Скринінг, профілактика та рання діагностика раку грудної залози
Смоланка І.І., Скляр С.Ю., Головко Т.С., Ганіч О.В.
Резюме. Скринінг, профілактика та рання діагностика раку грудної залозиУ статті наведено дані, призначені для забезпечення працівників охорони здоров’я практичними нормами щодо скринінгу, профілактичних обстежень і оцінки патологічних утворень грудної залози. Викладена методологія профілактики і ранньої діагностики раку грудної залози дозволяє застосовувати її на всіх ланках практичної охорони здоров’я, починаючи з оглядових кабінетів загальнолікарняної мережі.

Збереження репродуктивного здоров’я нації є невід’ємною частиною демографічної політики України, тому організація заходів, спрямованих на поліпшення профілактики, діагностики та лікування жінок, хворих на рак репродуктивних органів, залишається актуальною проблемою, яка потребує вирішення на державному рівні. За висновком Всесвітньої організації охорони здоров’я (ВООЗ), виникнення й розвиток злоякісних новоутворень жіночої репродуктивної сфери значною мірою зумовлені особливостями довкілля, про що свідчить великий діапазон коливань показників захворюваності в різних країнах світу, особливо виражений при раку грудної залози (РГЗ), тіла та шийки матки.
Однією з найбільш характерних особливостей збільшення кількості випадків розвитку злоякісних пухлин у жінок в економічно розвинених країнах є значне підвищення частоти РГЗ, який займає провідне місце в структурі онкологічної захворюваності та смертності.
У структурі онкологічної захворюваності жінок в Україні РГЗ займає перше місце [1]. На обліку онкологічних закладів на початок 2011 р. перебувало більше 140 тис. пацієнток із РГЗ. Щорічно в Україні реєструють понад 16,5 тис. нових випадків РГЗ, серед яких 25% — жінки репродуктивного віку. Щороку помирають понад 7,8 тис. хворих, з них понад 20% — у репродуктивному віці. Рівень захворюваності на РГЗ за останні 20 років зріс у 2,5 раза, а щорічний приріст становить при цьому більше 2%. Пікових значень рівень захворюваності на РГЗ досягає у віці 50–75 років [1].
У зв’язку з такою статистикою стають особливо актуальними питання скринінгу, профілактики, діагностики та лікування хворих на РГЗ, в організації яких ще існують суттєві недоліки. Незважаючи на те що злоякісні новоутворення грудної залози (ГЗ) належать до пухлин візуальної локалізації, занедбані випадки становили у 2012 р. 20,5%, а в окремих областях цей показник сягав більше 30%. На профілактичних оглядах в 2011 р. було виявлено 47,6% хворих на РГЗ, проте значення цього показника в окремих областях не перевищує 25%. Спеціальним лікуванням охоплено 83,4% хворих із вперше виявленими пухлинами (від 70,6 до 97,4% в окремих регіонах) [1].
Недоліки в організації лікувально-діагностичного процесу призводять до смерті від цієї патології протягом першого року 10,8% пацієнток (для порівняння — в США цей показник не перевищує 2%). При лікуванні хворих на генералізовані форми РГЗ характерним є підвищення витрат у 25–30 разів, порівняно з терапією пацієнтів із пухлинами, виявленими в ранній або доклінічній стадії. Саме тому великої актуальності набуває рання діагностика, котра покращує 5-річну виживаність хворих на РГЗ та зменшує витрати на протипухлинне лікування [2–4].
Дієвим шляхом поліпшення стану виявлення злоякісних новоутворень ГЗ може стати впровадження ефективних програм скринінгу, профілактики та ранньої діагностики. Відомо, що за рахунок впровадження державних програм скринінгу в розвинутих країнах світу за останні 15 років показники смертності від РГЗ знизилися на 25–30%.
У Резолюції Європейського Парламенту боротьба з РГЗ визначена як пріоритетне завдання, яке можна ефективно вирішити в країнах Європи [4].
Рання діагностика РГЗ можлива за умов виконання програм:
- самообстеження;
- лікарських профілактичних оглядів, спостереження і лікування передпухлинної патології;
- скринінгових обстежень і мамографічних досліджень (зараз у країнах Європи та США повсюдне застосування скринінгової мамографії рекомендовано у жінок у віці 50–69 років).
Відомо, що у 80–90% випадків захворювання виявляють самі хворі, у 15–18% — лікар при профілактичному огляді, під час мамографічного скринінгу — у 4–6% обстежених [5–7]. При проведенні скринінгу необхідно враховувати епідеміологічний, статистичний, технічний, кадровий стан у регіоні проведення скринінгу, а також фінансову забезпеченість запланованого дослідження.
Етапи організації масового скринінгу пухлин ГЗ можна поділити на:
- збір повної інформації про наявність факторів, які сприяють виникненню РГЗ;
- проведення огляду та пальпації ГЗ у жінок з метою попереднього розподілу оглянутих на групи за ступенем ризику для подальшого поглибленого їх обстеження;
- мамографію.
Для правильного планування організаційних заходів з метою активного виявлення хворих на РГЗ необхідне чітке визначення понять «скринінг», «профілактичний огляд», «диспансеризація».
Скринінг (англ. screening у прямому значенні — просіювання) — система організаційних заходів для масового періодичного обстеження здорового населення з метою раннього (доклінічного) виявлення онкологічного захворювання, наприклад РГЗ. Скринінгові обстеження ГЗ проводять у жінок без наявності симптоматики РГЗ для того, щоб виявити хворобу якомога раніше. Основною метою усіх программ скринінгу є зниження показників смертності за рахунок ранньої діагностики РГЗ.
Профілактичний огляд — активне виявлення хвороби ГЗ з обов’язковою участю медичного працівника. Індивідуальний профілактичний огляд проводиться середнім медичним працівником долікарського кабінету, фельшерсько-акушерського пункту. Мета — виявлення візуальної форми раку. При підозрі на РГЗ хвору направляють до акушера-гінеколога, терапевта, хірурга, мамолога. Цільовий профілактичний огляд здійснюється мамологом з метою виявлення захворювання ГЗ. Комплексний профілактичний огляд проводить група лікарів з метою виявлення різних нозологічних форм онкопатології, зокрема РГЗ.
Диспансеризація — періодичний огляд жінок, яких було взято на облік мамологом у зв’язку з високим ризиком розвитку РГЗ, а також тих, які одержали лікування з приводу доброякісних та злоякісних новоутворень ГЗ.
У деяких випадках скринінг, профілактичний огляд і диспансеризація можуть поєднуватися або бути етапами діагностичного маршруту хворої. Наприклад, проведення скринінгу → формування «групи ризику» → профілактичний огляд у групі ризику → уточнення діагнозу захворювання ГЗ → лікування → диспансеризація.
Планування та проведення скринінгу не є фіксованим і залежить від конкретних демографічних, організаційних і економічних умов охорони здоров’я держави та навіть окремих регіонів однієї країни (наприклад, вплив щільності населення, вік, статева структура населення в регіоні скринінгу).
Існує пряма економічна залежність між витратами та ефективним виявленням доклінічного випадку РГЗ. В окремих випадках вартість діагностики РГЗ в десятки разів перевищує вартість лікування. Навіть економічно благополучні країни мають проблеми з фінансовими ресурсами в охороні здоров’я при проведенні скринінгу та профілактичної роботи. Слід пам’ятати, що при виборі між економічними витратами та ефективністю скринінгу для лікаря приоритетними мають бути інтереси хворої. Варто підкреслити, що правильне планування реалізації скринінгових програм дозволяє поліпшити 5-річну виживаність при РГЗ більш ніж на 30% [4]. Жоден із відомих методів лікування не забезпечує такої ефективності.
Аналізуючи результати рандомізованих досліджень з проведення скринінгу РГЗ, Міжнародне агентство з вивчення раку (МАВР) (International Agency for Research on Cancer — IARC), Ліон, Франція, та відділ раку ВООЗ рекомендують проведення скринінгу в усіх жінок, які входять у «таргетну» когорту 50–69-річного віку, за допомогою одного тесту — мамографії, яку повторюють через кожні 2 роки.
Програма профілактики та ранньої діагностики РГЗ має два основних напрями: первинна (етіопатогенетична) і вторинна профілактика, яка полягає в діагностиці й лікуванні передракових захворювань. Оскільки етіопатогенез РГЗ остаточно не з’ясований, можливості первинної профілактики РГЗ обмежені [2, 3]. Основні зусилля дослідників у цей час спрямовані на удосконалення системи вторинної профілактики РГЗ.
Профілактичне дослідження пацієнтки має розпочинатися з оцінки ступеня ризику. При цьому слід пам’ятати про те, що приблизно у 75% жінок, у яких вперше встановлено діагноз РГЗ, немає факторів ризику.
Після збору анамнестичних даних стосовно факторів ризику формують групи пацієнток, які підлягають обов’язковому направленню на мамографію.
Найочевиднішим фактором ризику є вік — частота захворюваності на РГЗ підвищується у міру збільшення віку. Сімейний анамнез має містити дані про найближчих родичів (мати, сестра, дочка), в яких був РГЗ, та про вік, у якому вони захворіли. Пацієнтка, у близької родички якої встановлено діагноз перименопаузального РГЗ, має значно вищий ризик (у 4–5 разів) захворіти, ніж інші. Якщо у найближчої родички обстежуваної наявний рак обох ГЗ або вона перенесла РГЗ, ризик для такої жінки може в 8–10 разів перевищувати ризик у загальній популяції. Дуже важливо, щоб лікар дізнався про результати усіх попередніх діагностичних біопсій та виявлені раніше захворювання ГЗ. Для жінки, яка хворіла на РГЗ, ризик розвитку нового первинного раку другої залози становить приблизно 0,5–1% на кожен рік її життя, який залишився.
Під час огляду лікар повинен отримати детальну інформацію про перебіг вагітності та пологів у жінки, зокрема про кількість пологів та вік, в якому жінка вперше народила дитину. Жінка, яка не мала дітей, або та, що народила дитину після 30 років, має значно вищий ризик захворіти.
Основні фактори ризику виникнення РГЗ, які виділяють на сьогодні, представлені в таблиці.
Таблиця. Фактори ризику розвитку РГЗ
| Фактор ризику | Відносний ризик |
| Мутація в генах BRCA1 або BRCA2* | 10,0–32,0 |
| Онкологічне захворювання в сімейному анамнезі (без відомих мутацій)* | |
| 1 найближчий родич (першого ступеня спорідненості) | 1,5–2,0 |
| 2 найближчі родичі | 3,0 |
| 3 або більше найближчих родичів | 4,0 |
| 1 родич другого ступеня спорідненості | 1,2–1,5 |
| Застосування променевої терапії в ділянці грудної клітки у віці7,0–17,0 | |
| Гормональні фактори | |
| Пізнє (у віці >30 років) народження першої дитини або нездатність до дітонародження | 1,2–1,7 |
| Раннє (у віці55 років) | 1,2–1,3 |
| Комбінована гормонозамісна терапія (наприклад, протягом 10 років чи тривалішого періоду) | 1,5 |
| Постменопаузальне ожиріння | 1,2–1,9 |
| Вживання алкоголю | 1,2 |
| Паління перед народженням першої дитини | 1,2 |
| Малорухомий спосіб життя | 1,1–1,8 |
| Приналежність до європеоїдної раси | 1,1–1,5 |
| Щільність грудної залози (дуже щільна порівняно з грудною залозою переважно з жировою тканиною) | 5,0 |
| Атипова протокова або лобулярна гіперплазія чи лобулярна карцинома in situ за результатами попередньої біопсії тканини грудної залози | 4,0 |
| *Генетичне консультування/тестування рекомендується в таких випадках: 1) за наявності даних в особистому чи сімейному анамнезі, що свідчать про генетичну схильність до розвитку злоякісних пухлин (сімейний анамнез стосується РГЗ або РЯ. Ризик варіює залежно від віку пацієнтки і віку родича (родичів) з онкологічним захворюванням. У жінок, що належать до групи дуже високого ризику, може бути необхідним проведення скринінгового обстеження на більш ранньому етапі чи додаткового скринінгового обстеження); 2) якщо результати тесту можуть бути належним чином інтерпретовані; 3) якщо результати сприятимуть встановленню діагнозу або вплинуть на лікарське чи хірургічне ведення пацієнтки або членів сім’ї, що схильні до спадкового ризику розвитку злоякісних пухлин. **У жінок у віці до 30 років, у яких застосовували променеву терапію в ділянці грудної клітки, є необхідним додатковий скринінг. |
|
Після опитування хворих розподіляють на зони ризику, їм надаються рекомендації.
І зона ризику. Обов’язковий огляд хірургом або терапевтом чи гінекологом. При виявленні патології — лікування і диспансеризація. Огляд мамологом не рідше 1 разу на 12 міс із використанням сонографії у жінок у віці> 40 років. Сонографія 1 раз на рік + мамографія 1 раз на 2 роки для жінок у віці >40 років. Навчання правилам самообстеження.
ІІ зона ризику. Щорічний обов’язковий огляд мамологом, акушером-гінекологом, терапевтом, хірургом чи районним онкологом 1 раз на 6 міс + сонографія для жінок у віці <40 років. Мамографія для жінок у віці >40 років 1 раз на рік. Навчання правилам самообстеження.
ІІІ зона ризику. Огляд акушером-гінекологом, терапевтом, хірургом чи районним онкологом 1 раз на рік, у віці <40 років — сонографія 1 раз на 6 міс, у віці >40 років — 1–2 рази на рік; у віці >40 років — мамографія 1 раз на рік. Навчання правилам самообстеження. Пояснення впливу факторів ризику, які підвищують ймовірність виникнення захворювання ГЗ, рекомендації стосовно їх усунення, а також лікування.
Далі наведено фактори ризику, у випадках наявності ≥3 з яких пацієнтку слід направити на мамографію.
1. РГЗ у найближчих родичів чи інше онкологічне захворювання у пацієнтки.
2. Вік ≥50 років (щорічне обстеження).
3. Дисгормональні гіперплазії ГЗ (локалізовані форми чи вузлові компоненти, виділення із соска, фіброзно-кістозна мастопатія).
4. Ендокринні порушення (патологія щитоподібної залози, цукровий діабет, гіпоталамо-гіпофізарно-надниркові захворювання, ожиріння ІІ та ІІІ ступеня — перевищення нормальної маси тіла на ≥20 кг).
5. Порушення репродуктивної функції: аборт після 35 років, перші пологи після 30 років, безпліддя, ранній чи пізній початок менструації.
6. Захворювання репродуктивних органів — пухлини матки та придатків, запальні хвороби, порушення менструальної функції.
7. Проліферативні захворювання після лікування (в анамнезі, за даними біопсії).
Низький відсоток виявлення пухлин ГЗ лікарем при профілактичних оглядах пов’язаний із практичною відсутністю спеціалістів-мамологів, які вміють грамотно оцінювати стан ГЗ, проводити відповідне лікування передракових захворювань і спостерігати за пацієнтами з груп ризику.
За своєю природою огляд ГЗ, що проводиться різними спеціалістами, суб’єктивний, і тому можливі різні інтерпретації одних і тих же факторів. Зазначимо основні вимоги до проведення фізикального обстеження ГЗ та послідовність його елементів:
- огляд слід проводити в спокійній обстановці, яка забезпечує конфіденційність;
- пацієнтку рекомендується оглянути у положенні стоячи і лежачи на спині;
- необхідно записати дані про розміри, локалізацію, мобільність та консистенцію будь-якого пухлиноподібного утворення. Клінічно підозрілим є малорухомі пухлиноподібні утворення, які можуть бути спаяними з навколишними тканинами. Однак відомо, що клінічні прояви пухлин ГЗ надзвичайно варіабельні. Слід також відмітити усі зміни шкірного покриву, такі як втягнення, еритеми чи лущення шкіри соска;
- кожний сосок треба легенько стиснути, щоб дослідити виділення;
- слід оглянути лімфатичні вузли у пахвовій ділянці. Мета їх дослідження — встановлення, чи є вони клінічно негативними (нормальний розмір, м’які, мобільні). Якщо вузли викликали підозру, потрібно оцінити їх консистенцію, визначити, є вони поодинокими чи множинними, рухливими чи фіксованими;
- результати огляду, навіть якщо патології не виявлено, мають бути повністю задокументовані.
Не існує переконливих наукових даних, за якими можна було б точно визначити оптимальний вік для проведення мамографії. Результати наукових досліджень підтверджують доцільність проведення мамографії у жінок у віці 50–70 років [4–7]. Ведуться дискусії стосовно частоти обстеження жінок у віці ≥75 років. Проведення рутинного мамографічного обстеження жінок, які не досягли 40 років, не має високої результативності [4–7].
Відомо, що періодичне скринінгове мамологічне обстеження жінок, які не мають скарг, знижує рівень смертності від РГЗ. Скринінгова мамографія є внеском радіологів у надання повної медичної допомоги пацієнтам. Критерії якості мамографії в основному не відрізняються від принципів, яких дотримуються стосовно інших радіологічних досліджень. Для якісної роботи рентгенологів необхідно складати графіки проведення контролю і сервісного обслуговування обладнання, забезпечувати стандарти якості зображення, виконувати стандартні процедури для оцінки зображення, ретельно вести документацію та періодично переглядати дані про результати роботи мамологічних кабінетів.
У регіонах, де є достатня кількість лікарів-мамологів, скринінгова мамографія є радіологічним методом дослідження для виявлення «прихованого» РГЗ у ранній стадії у жінок, які не мають виражених симптомів. Крім того, дослідження полягає в тому, щоб розділити обстежених жінок на дві групи — з низьким і високим ризиком захворювання. Результати можуть продемонструвати більшості жінкам, що жодних значних відхилень від норми у них не виявлено, тоді як іншим потрібно сказати про наявність відхилення від норми та необхідність подальшого обстеження. Зазвичай дослідження обмежуються кутовими проекціями краніокаудальної та медіолатеральної ділянки кожної ГЗ. Іноді для оптимальної візуалізації тканини ГЗ потрібні додаткові проекції, але їх не слід виконувати рутинно. У випадку, коли є підозра на патологію, можна запропонувати подальші візуалізаційні дослідження, діагностичну мамографію чи біопсію.
Мета усіх мамографічних досліджень полягає у тому, щоб сприяти виявленню доклінічних форм РГЗ. На відміну від скринінгової мамографії, мамографічне дослідження ГЗ для вирішення особливих проблем (діагностична мамографія та допоміжні процедури) спрямоване на забезпечення спеціального аналітичного обстеження пацієнток із відхиленнями від норми, які виявлено клінічно або під час скринінгу. Діагностичне дослідження ГЗ має привести лікаря до кінцевого висновку про клінічні знахідки, а також верифікації діагнозу, що дозволяє надати спеціальні рекомендації для лікування хворої.
При профілактичних оглядах жінок молодого віку (<40 років) мамографія може бути замінена на сонографічне дослідження. У результаті проведення ультразвукового дослідження (УЗД) встановлено абсолютне підвищення до 20% рівня виявлення інвазивного РГЗ у жінок зі щільними ГЗ, у яких чутливість мамографії знижується, а ризик розвитку РГЗ зростає [6]. Алгоритм обстеження хворих при цьому наведено на рис. 1.
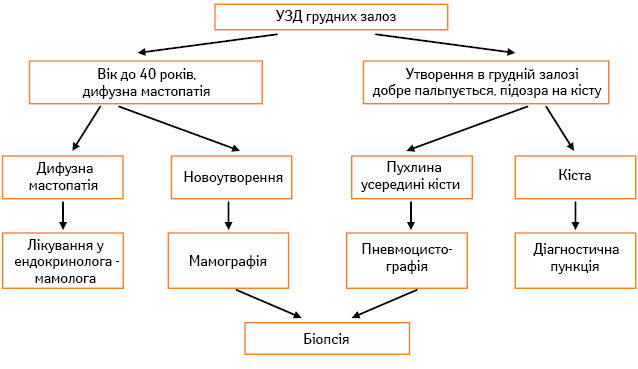
Якщо при УЗД ГЗ лікар не бачить будь-яких вузлових новоутворень, пацієнтку направляють до лікаря ендокринолога-мамолога (за наявності дифузної мастопатії) або рекомендують їй контрольні УЗД 1 раз на рік (за відсутності патології у ГЗ).
При виявленні вузлових новоутворень (фіброаденома, кіста та ін.) пацієнтка повинна бути обстежена за допомогою мамографічного чи пневмоцистографічного дослідження (рис. 2). При виявленні фіброаденоми рекомендоване хірургічне втручання з гістологічним дослідженням, за наявності кісти — пункційна аспірація з цитологічним дослідженням ексудату; при підозрі на проліферативні або малігнізаційні процеси необхідне хірургічне втручання з гістологічним дослідженням. Якщо кіста тільки пунктується, пацієнтку слід вторинно оглянути через 1–1,5 міс для того, щоб дізнатися, чи немає рецидиву кісти. Якщо кіста після аспірації швидко рецидивує, пацієнтку слід направити на операцію.
При підозрі на малігнізацію новоутворення необхідна термінова секторальна резекція ГЗ з гістологічним дослідженням (операцію слід виконувати в умовах онкологічного диспансеру або онкологічного інституту). При підтвердженні діагнозу РГЗ необхідно провести радикальну операцію з подальшим комбінованим лікуванням.
Якщо при сонографічному або мамографічному дослідженні у хворої діагностовано дифузні новоутворення (рис. 3) у ГЗ, лікування та спостереження здійснюють за амбулаторних умов. Серед дифузних форм виділяють фіброзні форми дисплазії з оваріальною недостатністю різного генезу і кістозні форми мастопатії з різними супутніми захворюваннями. Лікар має можливість за допомогою лабораторних методів визначити гормональний фон при дифузній формі гіперплазії ГЗ. Після цього формують медикаментозні комплекси, які призначають залежно від рівня естрогенів, прогестинів і клінічної форми дисгормональних гіперплазій. Оцінку ситуації необхідно проводити індивідуально. Так, наприклад, при низькому рівні естрогенів зазвичай має бути картина гіпоестрогенізації з розвитком мастопатії, але фактично виявляється, що супутній гіпертиреоз, порушення функції печінки та жовтого тіла призводять до клінічної гіперестрогенізації з розвитком кістозних компонентів фіброаденоматозу. Така ситуація спонукає шукати новий підхід до формування тактики лікування з урахуванням клінічних, рентгенологічних, цитогістологічних даних та результатів гормональних досліджень, які оцінюють за їх клінічною реалізацією. Це свідчить про можливість комплексного підходу до оцінки форми дисгормональних гіперплазій і призначення диференційованого лікування.
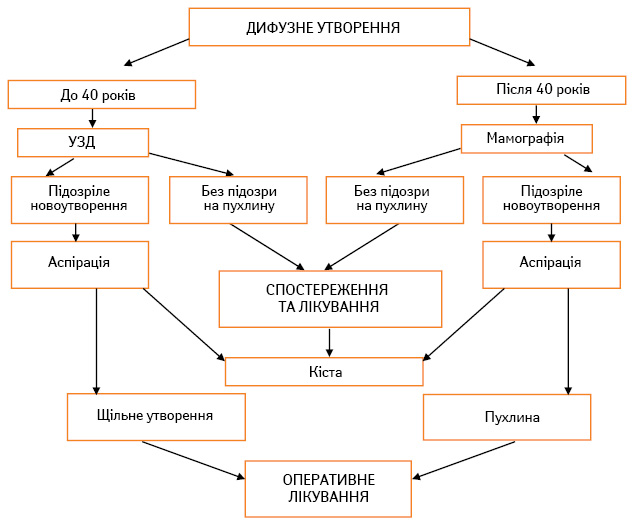
Розрізняють такі форми дисгормональних гіперплазій, які відображають одночасно ступінь їх розвитку та суттєво відрізняются за тактикою лікування:
- фіброзна;
- фіброзно-кістозна;
- аденозна;
- фіброзно-аденоматозна;
- інволютивно-фіброматозна;
- мастопатія з галактофоритом або галакторея;
- змішані дифузні форми;
- вузлові форми дисгормональних гіперплазій.
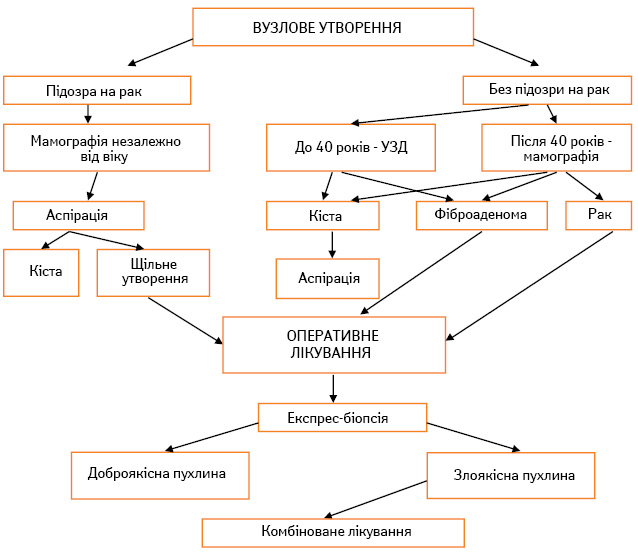
Лікування хворих із дисгормональними гіперплазіями вимагає індивідуального підходу з урахуванням патогенезу, супутніх захворювань, фенотипу жінки, характеру патології у ГЗ (клінічні, рентгенологічні дані), який супроводжується тими чи іншими змінами в гормональному гомеостазі. Алгоритми руху хворих при вузловій, дифузній мастопатії, новоутвореннях, що не пальпуються, та мікрокальцинатах у ГЗ наведено на рис. 2–5.
Біопсія є обов’язковою при солідному, домінуючому та персистуючому пухлинному процесі. Пацієнтку з солідним пухлинним новоутворенням слід направити до хірурга, навіть якщо результат мамографії є негативним. При новоутворенні, яке не пальпується (див. рис. 4), але виявлене при мамографії, варто зробити прицільні знімки та за можливості пункційну або трепан-біопсію під контролем УЗД. При одержанні висновку після біопсії, яка підтверджує доброякісний процес, пацієнтка підлягає спостереженню і лікуванню амбулаторно. При відповіді «підозра на злоякісний процес» або «злоякісний процес» необхідне хірургічне лікування.

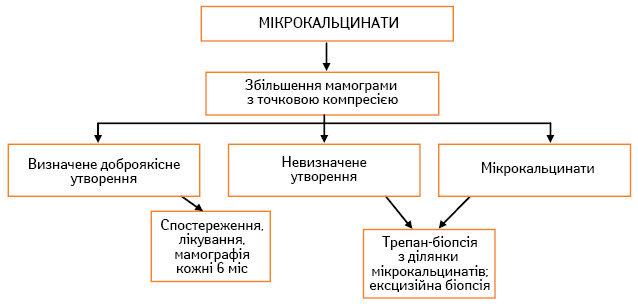
При виявленні на мамографічних знімках мікро- або макрокальцинатів обов’язковим є проведення прицільної мамографії зі збільшенням та компресією. Якщо при збільшенні процес розцінюється як доброякісний, необхідний рентген-контроль через 1 міс для визначення тактики подальшого лікування. За умови суперечливого результату слід обов’язково виконати секторальну резекцію з терміновим гістологічним дослідженням та проводити подальше лікування залежно від гістологічного висновку.
Усі вузлові форми дисгормональних гіперплазій підлягають цитологічній або гістологічній біопсії, при підозрі на проліферативні процеси — хірургічному лікуванню з терміновим гістологічним дослідженням в умовах онкологічної установи, оскільки лікування хворих на рак у загальнолікувальній мережі погіршує прогноз захворювання більше ніж у 3 рази. Оцінка ефективності отриманих результатів пов’язана з конкретними рекомендаціями щодо практичних дій стосовно хворих як на індивідуальному, так і на груповому та популяційному рівнях.
Список використаної літератури
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Бюл. Нац. канцер-реєстру України, 14: 120 с.
- Семиглазов В.Ф., Семиглазов В.В. (2010) Скрининг рака молочной железы. Практическая онкология, 11(2): 60–65.
- Харченко В.П., Рожкова Н.И. (2009) Маммология. Национальное руководство. ГЭОТАР-Медиа: 324 с.
- Warner E. (2011) Screening of breast cancer. N. Engl. J. Med., 365: 1025–1032.
- Bevers T.B. (2008) Ultrasound for the screening of breast cancer. Curr. Oncol. Rep., 10: 527–528.
- Armstrong K., Moye E., Williams S. et al. (2007) Screening mammography in women 40 to 49 years of age: a systematic review for the American College of Physicians. Ann. Intern. Med., 146: 516–526.
- Berg W.A., Blume J.D., Cormack J.B. et al. (2005) Combined screening with ultrasound and mammography vs mammography alone in women at elevated risk of breast cancer. J. Clin. Oncol., 23: 8469–8476.
Скрининг, профилактика и ранняя диагностика рака грудной железы
Резюме. В статье приведены данные, предназначенные для обеспечения работников здравоохранения практическими знаниями и нормами о скрининге, профилактических обследованиях и оценке патологических образований грудной железы. Изложенная методология профилактики и ранней диагностики рака грудной железы позволяет применять ее на всех звеньях практического здравоохранения, начиная со смотровых кабинетов общей лечебной сети.
рак грудной железы, скрининг, профилактические обследования, группы риска возникновения рака, ранняя диагностика рака.














Leave a comment