Можливість підвищення ефективності хіміопроменевої терапії хворих на рак грудної залози шляхом використання радіомодифікаторів
Резюме. У статті описано ефективні методи хіміопроменевої терапії (ХПТ) хворих на місцево-поширені форми раку грудної залози (МП РГЗ) з використанням радіомодифікуючих засобів (тегафур і комплекс мікроелементів — КМ). Проведено курс ХПТ за радикальною програмою у 106 хворих на МП РГЗ. Усі хворі на 1-му етапі лікування отримували по 4 курси поліхіміотерапії за схемою FAC. Пацієнткам 1-ї основної групи (34 хворі) курс променевої терапії (ПТ) проводили на тлі прийому цитостатичного препарату тегафур у радіомодифікуючій дозі 1200 мг/добу per os. Пацієнткам 2-ї основної групи (36 хворих) протягом курсу ПТ з метою радіомодифікації призначали КМ у дозі 1 крапля на 1 кг маси тіла в 3 прийоми per os(у середньому по 20 крапель 3 рази на добу) щоденно до сеансу опромінення: о 8; 11 та 14-й годині з подальшим проведенням сеансу ПТ з 15-ї до 19-ї години. Хворі контрольної групи (36 хворих) отримували курс ПТ згідно зі стандартами. Представлені дані свідчать про більшу ефективність ХПТ хворих на МП РГЗ в основних групах, у яких використовували радіомодифікатори (тегафур та КМ) під час ПТ.

Вступ
Проблема лікування хворих на рак грудної залози (РГЗ) на сьогодні залишається актуальною. В Україні РГЗ займає перше місце в структурі онкологічної захворюваності (19,9%) й смертності (20,7%) серед жіночого населення. Щороку реєструють підвищення цих показників серед жінок у віці 30–74 років. Із числа первинних хворих на РГЗ, охоплених спеціальним лікуванням (83,4%), лише хірургічне втручання одержують 12,2%, а комбіновану або комплексну терапію — 69,1% пацієнток [1]. За останні роки досягнуто певного поліпшення віддалених результатів терапії при ранніх стадіях РГЗ за рахунок застосування більш жорстких схем лікування з використанням нових цитостатичних і гормональних препаратів й методів (таксани, таргетне лікування, інтраопераційна або внутрішньотканинна променева терапія (ПТ) та ін.) [2]. Водночас для підвищення ефективності лікування при поширених формах цього захворювання необхідним є подальший пошук засобів і методів впливу на злоякісний процес, зважаючи на здатність клітин пухлини формувати резистентність до дії цитостатичної терапії [3, 4].
Згідно зі стандартами діагностики й лікування хворих онкологічного профілю, затверджених наказом МОЗ України від 17.09.2007 р. № 554, у пацієнток із неоперабельними місцево-поширеними формами РГЗ (МП РГЗ) слід проводити хіміопроменеву терапію (ХПТ) [5]. Це пояснюється тим, що при одночасному використанні хіміотерапії й ПТ підсилюється цитотоксична дія на пухлину [6, 7]. При поєднанні медикаментозного і променевого впливу досягається адитивність загального і місцевого ефектів, спрямованих як на первинне вогнище (пухлину), так і на мікрометастази.
ПТ є одним з основних компонентів лікування хворих на РГЗ — як самостійний метод і як важлива складова комбінованої й комплексної терапії. Проте можливості ПТ обмежені толерантністю неушкоджених тканин, що оточують пухлину, і зниженням радіочутливості (РЧ) клітин пухлини при збільшенні об’єму первинного вогнища [4]. На РЧ пухлини впливає багато факторів, у тому числі гетерогенність клітинного складу в морфологічному і біохімічному відношенні, яка зумовлена перебуванням клітин у різних фазах життєвого циклу (асинхронізація клітинної популяції), а також наявністю в загальній популяції декількох генетичних ліній — клітинних клонів з первинно високою РЧ або значною радіорезистентністю, порівняно з пухлиною в цілому [4, 8, 16]. Крім того, практично в кожній пухлині є зони найбільш резистентних гіпоксичних клітин, які повільно діляться або зовсім виходять із проліферативного пулу (фаза G0) і таким чином позбуваються чутливості до дії іонізуючого випромінювання [8–10]. РЧ клітини зумовлена вразливістю генетичних мішеней і у різні фази мітотичного циклу істотно відрізняється. Найвищою РЧ є на початку мітозу (М) — у фазі G2/M, а радіостійкість клітин є максимальною у ранню найтривалішу пресинтетичну фазу (G1) та в середині реплікативної фази (S) циклу [8, 10, 16]. Наявність у злоякісних пухлинах клітин, які резистентні до цитостатичного впливу, мають дуже тривалу G1-фазу або перебувають поза клітинним циклом у стані відносного спокою і не зазнають ні поділу, ні диференціації (фаза G0), значно ускладнює радіаційне пригнічення їх росту. Ці радіорезистентні клітини у відповідь на терапевтичну інактивацію злоякісних клітин, які активно проліферують, повертаються в цикл і забезпечують репопуляційне відновлення пухлинної тканини [7, 9, 10, 16]. Зазначені характерні біологічні особливості пухлини спонукають до пошуку методів і засобів, здатних підвищити чутливість злоякісних новоутворень до дії ПТ при мінімальному токсичному впливі на організм.
Застосування різних радіомодифікуючих факторів дозволяє розширити терапевтичний інтервал РЧ клітин пухлини й здорових тканин шляхом сенсибілізації злоякісних клітин і посилення деструктивних процесів у пухлині або захищення нормальних тканин організму [4]. Нині відомі декілька шляхів сенсибілізації клітин пухлини до цитостатичного впливу [4, 8, 10]: посилення радіаційного ураження ДНК, попередження репарації сублетальних і потенційно летальних променевих ушкоджень, запобігання репопуляційному відновленню клітинної популяції, синхронізація клітинного циклу на найбільш радіочутливі фази.
Регулювання розподілу клітин за фазами мітотичного циклу (синхронізація) — один із поширених методів впливу на РЧ тканини й клітинної популяції злоякісного новоутворення. У більшості досліджень, проведених in vitro та in vivo, доведено радіосенсибілізуючий вплив флуороурацилу (5-FU) — цитостатичного препарату фторпіримідинового ряду — за рахунок значно більшого поглинання урацилу пухлинними клітинами, на відміну від нормальних, шляхом непрямого пригнічення тимідинсинтетази. 5-FU проникає у клітини через систему транспорту урацилу з подальшою активацією шляхом реакції фосфорилювання за допомогою дигідропіримідиндегідрогенази, утворюючи неактивні й активні метаболіти. Протипухлинний ефект має один з активних метаболітів 5-FU — нуклеотид 5-фтордезоксиуридинмонофосфату (FdUMP), який сполучається з ферментом тимідинсинтетази, гальмуючи його. У зв’язку з тим, що протипухлинна активність 5-FU реалізується за допомогою його метаболітів, цей препарат належить до групи непрямих інгібіторів тимідинсинтетази. Протипухлинна дія препарату 5-FU на клітини проявляється у резистентній S-фазі їх життєвого циклу і призводить до переходу більшості злоякісних клітин у наступну, радіочутливу фазу циклу — мітоз.
Тегафур — сучасний препарат фторпіримідинового ряду, синтезований для перорального застосування, який дозволяє створювати і підтримувати таку концентрацію 5-FU у плазмі крові, як при внутрішньовенних пролонгованих інфузіях, запобігаючи розвитку гематологічних ускладнень, пов’язаних із тривалими внутрішньовенними введеннями. Максимальна концентрація препарату в крові досягається протягом 4–6 год після прийому. Особливістю тегафуру є активація його метаболітів безпосередньо в пухлинній тканині, яка має для цього фермент — тимідинфосфорилазу (ТФ). Цей процес відбувається за участю мікросомальних ферментів печінки, і на завершальному етапі трансформації тегафуру ТФ перетворює проміжний метаболіт 5-дезокси-5-фторуридин (5-DFUR) із цитостатичною дією на 5-FU, який за допомогою дигідропіримідиндегідрогенази пригнічує тимідинсинтетазу [11]. Таким чином, тегафур стає активним агентом тільки після ферментного каскаду перетворень in vivo і характеризується селективністю цитотоксичної дії шляхом вибіркової активації ферменту ТФ у злоякісних клітинах. Це дозволяє підтримувати постійний рівень 5-FU в пухлині, на відміну від інших тканин, що забезпечує мінімізацію загальних побічних ефектів і сприяє досягненню радіомодифікуючого ефекту шляхом синхронізації клітинного циклу на найбільш радіочутливі фази [12].
Згідно із законом Бергоньє — Трибондо, максимально чутливими до дії іонізуючого випромінювання є активно проліферуючі клітини [4, 10], тому цікавими є дослідження, присвячені вивченню можливостей управління РЧ за допомогою радіомодифікаторів, здатних змінювати біологічні особливості кінетики репопуляції клітин, залучати до проліферативного процесу клітини, що перебувають у стані спокою, тобто переводити їх у більш радіочутливу фазу життєвого циклу — фазу мітозу [10, 13]. Одним із таких радіомодифікаторів може бути комплекс мікроелементів (КМ) [7, 13], який являє собою водний розчин певного співвідношення неорганічних іонів, з’єднаних координаційними зв’язками з органічними молекулами-носіями, що підвищують всмоктування елементів і надходження їх до клітини (табл. 1). Результатами попередніх досліджень, а також експериментальними даними підтверджено імуностимулюючий і радіомодифікуючий вплив КМ, який підвищує ефективність ПТ в організмі пухлиноносія [7, 13].
Таблиця 1. Склад препарату на основі КМ
| Компоненти (мг/мл) | |||||
| Неорганічні | Органічні | ||||
| Fe | 2,0 | V | 0,12 | Гліцерин | 6,0 |
| Zn | 1,0 | Ni | 0,11 | Натрію едетат | 2,4 |
| Mg | 0,4 | B | 0,10 | Гліцин | 2,3 |
| Mn | 0,31 | F | 0,09 | L — (+) — Виннокам’яна кислота |
1,6 |
| Cu | 0,25 | Co | 0,025 | Бурштинова кислота | 0,5 |
| Mo | 0,19 | L — (+) — Аскорбінова кислота |
0,3 | ||
Зважаючи на те що проведення цитостатичної терапії, зокрема ХПТ, хворих на РГЗ негативно впливає на їх імунну систему (посилення стану існуючої імунодепресії, зумовленого основним процесом), важливою складовою сучасного лікування в онкології має бути імунореабілітація — відновлення кількісних характеристик і функціональної активності клітин імунної системи на рівні, достатньому для забезпечення протипухлинної стійкості організму та профілактики виникнення рецидивів і метастазів [14]. Відновлення функції імунної системи внаслідок підвищення протипухлинного імунітету шляхом стимуляції продукції та дії ряду цитокінів, які сприяють активності природних клітин-кілерів периферійної крові й лімфатичних вузлів, можливе при використанні КМ [13, 15]. У зв’язку з відсутністю прямої цитотоксичної дії мікроелементів, їх самостійне застосування в онкології неефективне. Доведено, що у фізіологічних концентраціях КМ здатний активувати різні метаболічні реакції та підвищувати проліферативний потенціал клітин у певному часовому інтервалі (через 26–28 год) [7, 13]. Тому, спираючись на практичний досвід, онкологи дійшли висновку, що такий КМ варто призначати хворим зі злоякісними новоутвореннями тільки під час проведення цитостатичної терапії для підвищення РЧ клітин пухлини і протипухлинної резистентності організму [7]. З огляду на радіобіологічний закон Бергоньє — Трибондо, при дії на пухлину адекватних доз іонізуючого випромінювання на тлі існуючих проліферативних процесів, які відбуваються під впливом КМ через 26–28 год, у тканинах реалізовуватиметься ефект радіосенсибілізації.
Мета роботи: вивчити можливості застосування препарату тегафур і КМ як радіомодифікаторів для підвищення ефективності ХПТ хворих на МП РГЗ.
МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕННЯ
Об’єктом дослідження були 106 хворих на РГЗ IIIА–IIIB стадії поширеності пухлинного процесу (табл. 2), які мали протипоказання до проведення хірургічного лікування і отримували ХПТ за радикальною програмою в Національному інституті раку в 2000–2013 рр.
Таблиця 2. Розподіл хворих на МП РГЗ в основних та контрольній групах за клінічними стадіями і TNM (ВООЗ)
| Стадія | TNM | Групи хворих | |||
| 1-ша група(тегафур + ХПТ) | 2-га група(КМ + ХПТ) | 3-тя група(ХПТ) | p | ||
| Кількість хворих, n (M±m, %) | Кількість хворих, n (M±m, %) | Кількість хворих, n (M±m, %) | |||
| IIIA | T2N2M0 | 2 (5,9±4,1) | 3 (8,3±4,7) | 1 (2,8±2,8) | р1–3>0,05 р2–3 >0,05 |
| T3N1M0 | 8 (23,5±7,4) | 9 (25,0±7,3) | 10 (27,8±7,5) | ||
| T3N2M0 | 3 (8,8±4,9) | 4 (11,1±5,3) | 6 (16,6±6,3) | ||
| Усього | 13 (38,2±8,4) | 16 (44,4±8,4) | 17 (47,2±8,4) | ||
| IIIB | T2N3M0 | — | — | — | р1–3>0,05 р2–3 >0,05 |
| T4N1M0 | 12 (35,3±8,3) | 12 (33,4±8,0) | 11 (30,6±7,8) | ||
| T4N2M0 | 9 (26,5±7,6) | 8 (22,2±7,0) | 8 (22,2±7,0) | ||
| T4N3M0 | — | — | — | ||
| Усього | 21 (61,8±8,4) | 20 (55,6±8,4) | 19 (52,8±8,4) | ||
| Усього | 34 (100) | 36 (100) | 36 (100) | ||
Першу основну групу (1-ша група — ХПТ + тегафур) становили 34 хворі на МП РГЗ (T2–4N1–2M0), які проходили лікування у 2008–2013 рр. і отримували 4 курси поліхіміотерапії (ПХТ) за схемою FAC (5-FU, доксорубіцин, циклофосфамід), курс дистанційної променевої терапії (ДПТ) за радикальною програмою на тлі цитостатичного препарату тегафур. З метою радіомодифікації тегафур призначали per os у дозі 1200 мг/добу (800 мг зранку і 400 мг увечері) щоденно, крім одного вихідного дня (субота). Сумарна доза препарату за курс променевого лікування становила 42000 мг. Протягом двотижневої перерви між етапами ДПТ пацієнтки тегафур не приймали. У другу основну групу (2-га група — ХПТ + КМ) включено 36 хворих на МП РГЗ (T2–4N1–2M0), які отримували лікування у 2000–2005 рр. (архівний матеріал інституту): 4 курси ПХТ за схемою FAC, курс ДПТ за радикальною програмою на тлі КМ. З метою радіомодифікації КМ призначали за 1 добу (24–28 год) до початку і протягом усього курсу ДПТ у дозі 1 крапля на 1 кг маси тіла в 3 прийоми per os (у середньому по 20 крапель 3 рази на добу), під час або відразу після прийому їжі щоденно, крім одного вихідного дня (субота). Для досягнення радіомодифікуючого ефекту КМ застосовували до сеансу опромінення: о 8-й, 11-й та о 14-й годині з подальшим проведенням сеансу ДПТ з 15-ї до 19-ї години, тобто дотримувалися експериментально визначеного терміну максимальної реалізації радіомодифікуючого ефекту КМ, який відзначали через 24–28 год після його введення. Саме в цей час, за даними експериментальних досліджень і літератури, пухлина під впливом введеного КМ була найбільш вразлива до дії іонізуючого випромінювання [7, 13]. Протягом двотижневої перерви між етапами ДПТ пацієнтки КМ не приймали. Сумарна доза препарату за курс променевого лікування становила 90–100 мл. Третю, контрольну групу (3-тя група — ХПТ), становили 36 хворих на МП РГЗ (T2–4N1–2M0), які проходили курс лікування відповідно до стандартів у 2008–2013 рр.: 4 курси ПХТ за схемою FAC, курс ДПТ за радикальною програмою.
Після закінчення курсу ХПТ хворим усіх груп залежно від менопаузального статусу призначено ендокринну терапію: жінки у пременопаузі отримували гозерелін у дозі 3,6 мг 1 раз на міс підшкірно і тамоксифен у дозі 20 мг/добу per os, а у постменопаузальний період — антиестрогени (тамоксифен 20 мг/добу або тореміфен 60 мг/добу per os).
Середній вік хворих 1-ї групи становив 62,6±1,7 року (49–72 роки), 2-ї — 63,4±1,5 (52–73 роки), 3-ї — 61,8±1,5 (50–71 рік). У всіх пацієнток цитологічно або гістологічно верифіковано аденокарциному різного ступеня диференціювання (переважно помірно диференційована).
Основні й контрольна групи між собою були тотожними за характеристиками, які впливають на прогноз хвороби. Не виявлено статистично вірогідних розбіжностей у хворих за критерієм «вік», розподілом за клінічними стадіями хвороби і за TNM (ВООЗ), локалізацією пухлини в грудній залозі (при вузловій формі — переважно у верхньо-зовнішніх квадрантах). Більшість пацієнток в усіх групах мали набряково-інфільтративну форму РГЗ. Найбільш поширеною супутньою патологією у хворих усіх груп були хвороби серцево-судинної системи (атерокардіосклероз, ішемічна хвороба, гіпертонічна хвороба, варикозне розширення вен нижніх кінцівок, цукровий діабет).
У разі відсутності протипоказань лікування хворих усіх груп починали з проведення 4 курсів ПХТ внутрішньовенно крапельно за схемою FAC (5-FU 600 мг/м в 1-шу добу, доксорубіцин 60 мг/м в 1-шу добу, циклофосфамід 600 мг/м в 1-шу добу). Інтервал між циклами становив 21 добу. ДПТ проводили згідно з радикальною програмою на гамма-терапевтичному апараті «Тератрон» за розщепленою методикою: сумарної вогнищевої дози (СВД) на грудну залозу досягали за два етапи з перервою 2 тиж. Разова вогнищева доза (РВД) на грудну залозу і шляхи регіонарного лімфовідтоку (аксилярні, над-, підключичні, а також парастернальні лімфатичні вузли, при локалізації пухлини у внутрішньому квадранті грудної залози) становила 2,0–2,2 Гр 5 разів на тиж; СВД на грудну залозу за 2 етапи — 60–64 Гр, що відповідало 96–102 од. фактора час-доза-фракція (ЧДФ); 40–44 Гр — на шляхи регіонарного лімфовідтоку (відповідно 72–76 од. ЧДФ). Променеве лікування грудної залози здійснювали з двох полів (латерального і медіального) при тангенціальному направленні пучка іонізуючого випромінювання, шляхів регіонарного лімфовідтоку — з одного поля на боці ураження.
Для оцінки ефективності лікування, окрім клінічних даних, використовували інструментальні методи: мамографічне і комплексне ультразвукове дослідження (УЗД) в режимах енергетичного та імпульсного допплерівського картування до лікування, перед початком II етапу опромінення, після курсу ХПТ. Регресію пухлини оцінювали згідно з критеріями ВООЗ з урахуванням динаміки розміру найбільшого діаметра утворення-мішені. Також вивчали розміри, структуру, васкуляризацію пухлини та регіонарних лімфатичних вузлів за даними УЗД і наявність кальцифікатів при проведенні мамографії. Крім того, ефективність запропонованих методів радіомодифікації при ХПТ хворих на МП РГЗ оцінювали за наявністю чи відсутністю токсичних проявів лікування, які негативно впливають на якість життя пацієнтів. У всіх хворих до і протягом лікування вивчали показники загальної та гематологічної токсичності ХПТ (ступінь мієлосупресії, зміни рівня печінкових ферментів, білірубіну, креатиніну й сечовини, показників згортання крові та вираженість нудоти й блювання). Токсичність лікування оцінювали за шкалою Загальних критеріїв токсичності Національного інституту раку (National Cancer Institute Common Toxicity Criteria — NCI СТС), США, і відповідно до рекомендацій EORTC/RTOG (European Organisation for Research and Treatment of Cancer та Radiotherapy Oncology Group). Статистичну обробку отриманих даних проведено за допомогою методів варіаційної статистики із застосуванням критерію Стьюдента та електронно-обчислювальної техніки.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
ХПТ хворі усіх груп переносили задовільно; її проведено у повному обсязі. Прояви загальної токсичності згідно зі шкалою EORTC/RTOG (нудота, слабкість, підвищена стомлюваність, вегетосудинна дистонія та погіршення показників гемодинаміки) під час проведення ДПТ частіше з’являлися у хворих 1-ї основної (тегафур + ХПТ) та 3-ї контрольної (ХПТ) груп і були більш виражені порівняно з 2-ю основною групою (ХПТ + КМ), проте не перевищували ІІ ступеня.
Гематологічна токсичність є одним із найчастіших ускладнень цитостатичної терапії. Впродовж курсу променевого лікування відзначали тенденцію до помірного зменшення кількості лейкоцитів у хворих усіх груп з мінімальним їх значенням (2,0•10/л) в 1-й основній та 3-й контрольній групах. Водночас короткочасне зниження рівня лейкоцитів у хворих цих груп під час проведення ДПТ не перевищувало II ступеня токсичності за критеріями СТС і не потребувало призначення колонієстимулюючих факторів. Лейкопенію ІІ ступеня у 1-й основній групі зареєстровано у 12 (35,3±8,3%) із 34 пацієнток, а в контрольній — у 7 (19,4±6,7%) із 36 хворих. Застосування КМ у пацієнток 2-ї основної групи запобігало розвитку значної лейкопенії, яка не перевищувала I ступеня токсичності. Окрім того, у хворих 2-ї основної групи, які приймали КМ протягом курсу променевого лікування, не спостерігали тромбоцитопенії та проявів анемії. Разом з тим проведення ПТ на тлі прийому тегафуру у хворих 1-ї групи спричиняло розвиток анемії I і II ступеня токсичності відповідно у 9 (26,5±7,6%) та 3 (8,8±4,9%) із 34 пацієнток, а в 3-й контрольній групі проведення ХПТ викликало анемію I ступеня у 6 (16,6±6,3%) із 36 пацієнток. Також у 9 (26,5±7,7%) жінок 1-ї основної групи і 4 (11,1±5,3%) хворих 3-ї контрольної наприкінці першого етапу ХПТ зареєстровано тромбоцитопенію I ступеня токсичності. Таким чином, застосування КМ під час проведення цитостатичної терапії дозволило уникнути проявів значущої мієлосупресії.
Таку саму тенденцію відзначено при вивченні біохімічних показників периферичної крові. У 10 (29,4±7,9%) хворих 1-ї основної та у 8 (22,2±7,0 %) пацієнток 3-ї контрольної груп наприкінці I етапу ХПТ виникли токсичні прояви з боку гепатобіліарної системи: підвищення за межі норми рівня загального білірубіну, печінкових ферментів — аланінамінотрансферази, аспартатамінотрансферази, а також лужної фосфатази. Проте ці зміни не перевищували ІІ ступеня гепатотоксичності за критеріями EORTC/RTOG. Призначення хворим гепатотропних препаратів сприяло відновленню рівня цих показників до верхньої межі норми. У пацієнток 2-ї основної групи застосування КМ ефективно запобігало розвитку токсичних проявів з боку гепатобіліарної системи.
Застосування радіомодифікаторів у хворих 1-ї та 2-ї основних груп не призвело до підвищення частоти і тяжкості променевих дерматитів, однак усім хворим призначали профілактичні місцеві заходи під час проведення ПТ, що сприяло розвитку лише катаральних дерматитів (I–II ступеня).
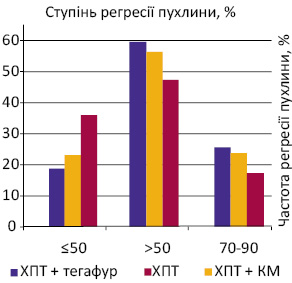
Безпосередній ефект ХПТ (регресія та зменшення васкуляризації в пухлині й лімфатичних вузлах, зменшення набряку шкіри), згідно з даними моніторингових досліджень, був більш вираженим у хворих основних груп, в яких під час променевого лікування застосовували радіомодифікатори (табл. 3). Майже повну регресію пухлини грудної залози (від 70 до 90%) зареєстровано у 8 (23,5±7,4%) із 34 хворих 1-ї основної групи і у 8 (22,2±7,0%) із 36 хворих 2-ї основної групи. У 3-й контрольній групі повну регресію відзначено у 6 (16,7±6,3%) із 36 пацієнток. Часткову регресію пухлини (>50%) також спостерігали частіше в основних групах (при зіставленні з контрольною), а саме: у 20 (58,8±8,5%) із 34 хворих 1-ї основної групи, у 20 (55,6±8,4%) із 36 хворих 2-ї основної групи та у 17 (47,2±8,4%) із 36 хворих 3-ї контрольної групи. Стабілізацію процесу (регресія пухлини ≤50%) в 1-й основній групі зареєстровано у 6 (17,6±6,4%) із 34 пацієнток, в 2-й основній групі — у 8 (22,2±7,0%) із 36, а в 3-й контрольній — у 13 (36,1±8,1%) із 36 (рисунок). Таким чином, сумарний позитивний ефект лікування (сума повної та часткової регресії пухлини) більш виражений в основних групах хворих, в яких застосовували тегафур і КМ в якості радіомодифікаторів під час проведення ПТ — у 28 (82,3±6,6%) із 34 хворих 1-ї основної групи і у 28 (77,8±7,0%) із 36 хворих 2-ї основної групи, а в 3-й контрольній групі сумарний позитивний ефект від ХПТ відзначено у 23 (63,9±8,1%) з 36 пацієнток. Випадків прогресування хвороби під час курсу ХПТ відзначено не було.
Таблиця 3. Реакція пухлини після проведення курсу ХПТ за традиційним методом і з застосуванням тегафуру й КМ як радіомодифікаторів у хворих на МП РГЗ
| СтадіяTNM | Групи хворих | |||
| 1-ша група(тегафур + ХПТ) | 2-га група (КМ + ХПТ) |
3-тя група (ХПТ) |
p | |
| Кількість хворих, n (M±m, %) | Кількість хворих, n (M±m, %) | Кількість хворих (M±m, %) |
||
| Повна регресія (70–90%) |
8 (23,5±7,4) |
8 (22,8±7,0) |
6 (16,7±6,3) |
р1–3> 0,05 р2–3 > 0,05 |
| Часткова регресія (>50%) |
20 (58,8±8,5) |
20 (55,6±8,4) |
17 (47,2±8,4) |
р1–3> 0,05 р2–3 > 0,05 |
| Стабілізація процесу (≤50%) | 6 (17,6±6,4) |
8 (22,8±7,0) |
13 (36,1±8,1) |
р1–3> 0,05 р2–3 > 0,05 |
| Прогресування | – | – | – | – |
| Усього | 34 (100) | 36 (100) | 36 (100) | |
| Сумарний позитивний ефект (повна регресія + часткова регресія) |
28 (82,3±6,6) |
28 (77,8±7,0) |
23 (63,9±8,1) |
р1–3> 0,05 р2–3 > 0,05 |
Отже, згідно з одержаними даними є підстави стверджувати, що застосування тегафуру і КМ як радіомодифікаторів посилює дію ПТ під час цитостатичного лікування хворих на МП РГЗ.
ВИСНОВКИ
Використання тегафуру як радіомодифікатора під час проведення променевого лікування у комплексній терапії хворих на МП РГЗ суттєво підвищує безпосередню ефективність ХПТ (повну й часткову регресію пухлин) і не збільшує її токсичність.
Застосування КМ як радіомодифікатора у хворих на МП РГЗ паралельно з променевим лікуванням дозволяє збільшити повну і часткову регресію карциноми грудної залози, порівняно із самостійним впливом ХПТ. Крім того, токсичність цього радіомодифікатора відсутня, а прийом КМ хворими дозволяє знизити негативний вплив цитостатичної терапії на клітини організму, відновлюючи порушений гомеостаз (нормалізація і підтримка фізіологічного рівня біохімічних показників сироватки крові хворих), що сприяє зменшенню періоду реабілітації пацієнток після цитостатичного лікування, поліпшенню якості життя хворих.
Список використаної літератури
- Федоренко З.П. , Гайсенко А.В. , Гулак Л.О. та ін. (2012) Рак в Україні, 2010 – 2011. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. національного канцер-реєстру, 13: 124 с.
- Семиглазов В.Ф., Манихас А.Г., Семиглазова Т.Ю. и др. (2012) Неоадъювантная системная терапия рака молочной железы. Руководство для врачей. Аграф, 112 с.
- Шомансурова Н.С., Нигманова Н.А., Гильдиева М.С. (2012) Изучение апоптоза и пролиферации в опухолевых клетках молочной железы больных после проведенной полихимиотерапии. Материалы IX Международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы», г. Санкт-Петербург, 18–20 июня 2012 г.: 63–64.
- Іванкова В.С., Дьоміна Е.А. (2012) Проблеми резистентності пухлин у радіаційній онкології (клінічні та радіобіологічні аспекти). Наукове видання, 192 с.
- Стандарти діагностики і лікування онкологічних хворих: затверджено Наказом Міністерства охорони здоров’я України «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія» від 17.09.2007 № 554. — Київ, 2007. 200 с.
- Семиглазов В.Ф., Манихас А.Г., Семиглазова Т.Ю. и др. (2013) Клинические рекомендации по диагностике и лечению рака молочной железы. Научное издание, 234 с.
- Барановська Л.М. (2006) Роль комплексу мікроелементів у підвищенні ефективності променевої терапії місцевопоширених форм раку молочної залози (експериментальне та клінічне дослідження): Дис…. канд. мед. наук: 14.01.23. Київ, 179 с.
- Голдобенко Г.В., Костылев В.А. (2000) Проблемы радиационной онкологии. АМФ-Пресс: 32–33.
- Семеняк О.Ю., Серебряков И.Г., Календо Г.С. (1988) Реакция непролиферирующих опухолевых клеток на облучение. Радиобиология, 28(2): 184–186.
- Гродзинський Д.М. (2000) Радіобіологія. Либідь, Київ, 447 с.
- Манзюк Л.В., Преводчикова Н.И., Горбунова В.А. и др. (2001) Фторафур — первый пероральный фторпиримидин в терапии метастатического колоректального рака. Современная онкология, 3(4): 1–5.
- Семикоз Н.Г., Ладур А.И., Колосов И.В. (2011) Фторафур — эффективность, проверенная временем (итоги новых исследований). Клиническая онкология, 3(3): 21–23.
- Зінченко В.А., Гриневич Ю.Я., Береш Й. (1998) Можливості підвищення чутливості злоякісних новоутворень до променевої терапії застосуванням концентрату мікроелементів. Укр. радіол. журн., 6(1): 59–62.
- Гриневич Ю.А. (2003) Иммунотерапия в противоопухолевом и противорецидивном лечении онкологических больных. Doctor, 4: 32–34.
- Кудрин А.В., Скальный А.В. (2001) Микроэлементы в онкологии. Ч. 2. Микроэлементы и противоопухолевый иммунитет. Микроэлементы в медицине, 2(2): 31–39.
- Hall E.J. (2000) Radiobiology for the radiologist. 4 Еd. Philadelphia, PA: Lippincott Williams & Wilkins: 136–141.
Возможность повышения эффективности химиолучевой терапии больных раком грудной железы путем использования радиомодификаторов
Резюме. В статье представлены эффективные методы химиолучевой терапии (ХЛТ) у больных с местно-распространенными формами рака грудной железы (МР РГЖ) с применением радиомодифицирующих средств (тегафур и комплекс микроэлементов — КМ). Проведен курс ХЛТ по радикальной программе у 106 пациенток с МР РГЖ. Все пациентки на 1-м этапе лечения получали 4 курса полихимиотерапии по схеме FAC. Пациенткам 1-й основной группы (34 больные) курс лучевой терапии (ЛТ) проводили на фоне приема цитостатического препарата тегафур в радиомодифицирующей дозе 1200 мг/сут per os. Пациенткам 2-й основной группы (36 больных) в течение курса ЛТ с целью радиомодификации назначали КМ в дозе 1 капля на 1 кг массы тела в 3 приема per os (в среднем по 20 капель 3 раза в сутки) ежедневно до сеанса облучения: в 8; 11 и 14-м часу с последующим проведением сеанса ЛТ с 15-го до 19-го часа. Больным контрольной группы (36 женщин) курс ЛТ проводили согласно стандартам. Представленные результаты свидетельствуют о большей эффективности ХЛТ больных МР РГЖ в основных группах, в которых использовали радиомодификаторы (тегафур и КМ) во время ЛТ.
рак грудной железы, химиолучевая терапия, радиомодификация, тегафур, комплекс микроэлементов.














Leave a comment