Ефективність застосування алгоритмів терапії супроводу з урахуванням факторів прогнозу токсичності хіміотерапії у хворих зі злоякісними пухлинами грудної залози
Сивак Л.А., Губарева Г.О., Лялькін С.А., Майданевич Н.М., Кліманов М.Ю., Алексик О.М., Аскольський А.В.
Резюме. Хіміотерапія є обов’язковим компонентом комплексного лікування хворих на місцево-поширений та метастатичний рак грудної залози. Токсичність хіміотерапії необхідно брати до уваги з метою її попередження та адекватної терапії, оскільки вона несприятливо впливає на якість життя хворих як під час лікування, так і при подальшому спостереженні; призводить до необхідності зниження доз цитостатиків, збільшення інтервалів між курсами та припинення протипухлинного лікування; може загрожувати життю хворого; значно збільшує вартість лікування. Застосування розробленого алгоритму терапії супроводу хіміотерапії за стандартними схемами у пацієнток зі злоякісними пухлинами грудної залози з високим ризиком розвитку ускладнень дозволило провести лікування в повному обсязі без зниження доз цитотоксичних препаратів, у заплановані терміни та зменшити прояви гастроінтестинальної токсичності у вигляді еметичного синдрому на 30,0%, ранньої печінкової токсичності — на 8,2% та ранньої кардіоваскулярної токсичності — на 25,1%, чим поліпшено результати лікування та якість життя пацієнток.

Злоякісні пухлини грудної залози (ЗПГЗ) — найбільш поширене онкологічне захворювання серед жіночого населення. У структурі онкологічної захворюваності розвинутих країн серед жінок ЗПГЗ займають 1-ше місце (20–25% усіх випадків раку). За даними Національного канцер-реєстру України, щорічний приріст цієї онкопатології перевищує 2%. Так, у 2010 р. в Україні зареєстровано 16 165 нових випадків захворювання, а загальна кількість летальних випадків внаслідок ЗПГЗ становила 7662. Серед причин смерті жінок питома вага ЗПГЗ найбільша і становить 20% [1].
Більшість хворих із ЗПГЗ отримують комбіноване лікування, яке включає проведення хіміотерапії (ХТ) після радикальної операції — ад’ювантної ХТ, а при поширених стадіях та несприятливих прогностичних факторах (розмір первинної пухлини >2 см, молодий вік до 35 років, рецепторнегативні та низькодиференційовані пухлини) — неоад’ювантної ХТ. За наявності метастатичного ураження лімфатичних вузлів і/або інших органів — обов’язкове проведення паліативної ХТ, яка у цих випадках є основним методом лікування [4, 5]. Таким чином, ХТ отримують понад 80% хворих із ЗПГЗ.
Проте частота побічних явищ, викликаних ХТ, нерідко таких, що загрожують життю пацієнтки, залишається досить високою. Фактори, що впливають на токсичність ХТ, досі до кінця не вивчені. За даними деяких авторів, до факторів ризику належать: молодий вік, жіноча стать, нудота та блювання під час вагітності, наявність супутньої патології, попереднє хіміотерапевтичне лікування, променева терапія, вживання алкоголю, еметогенні ускладнення під час попередньої ХТ [2, 6, 7].
Розрахунки показали, що близько 95% індивідуальних відмінностей в ефективності та токсичності ХТ можуть бути генетично зумовленими. Відомо, що однією з груп генів, які асоціюються з розвитком різних захворювань, є гени ферментів детоксикації ксенобіотиків [3]. Визначення наявності нуль-алелів GSTM1 та GSTT1 у пацієнтів, які отримують ХТ, може стати допоміжним молекулярно-генетичним діагностичним критерієм у виявленні хворих групи високого ризику розвитку ускладнень хіміотерапевтичного лікування, оцінці індивідуального ризику та своєчасному призначенні профілактичних заходів, спрямованих на мінімізацію шкідливих впливів ХТ [3, 9].
Проведення терапії супроводу в групі пацієнтів високого ризику токсичності ХТ дозволить попередити ускладнення протипухлинної терапії, зменшити їх прояви та продовжити лікування хворих із ЗПГЗ у повному обсязі та у встановлені терміни.
Нині в Україні не існує стандартів усунення ускладнень ХТ, тому розробка та впровадження в клінічну практику алгоритму терапії супроводу у пацієнтів із ЗПГЗ має велике значення для поліпшення як результатів лікування, так і якості життя цієї категорії хворих.
Об’єкт і методи дослідження
У дослідження включено 146 хворих із ЗПГЗ, яких розподілено на основну і контрольну групи. Основну групу становили 74 (50,7%) хворих із ЗПГЗ — це пацієнтки з високим ступенем ризику розвитку хіміотерапевтичних ускладнень, визначеним внаслідок застосування діагностичного клініко-інструментально-лабораторного комплексу досліджень. У хворих основної групи застосовано розроблений алгоритм терапії супроводу з метою попередження токсичних проявів ХТ.
У контрольну групу ввійшли 72 (49,3%) хворих, у яких застосували аналогічний діагностичний комплекс досліджень, проте терапію супроводу призначали при виникненні ускладнень.
Вік обстежуваних пацієнток на момент включення в дослідження коливався в межах від 24 до 78 років (середній — 49,0±7,5 року).
За стадіями ЗПГЗ пацієнток розподіляли згідно з класифікацією TNM (6-те видання, 2002 р.) після певного комплексного обстеження відповідно до стандартів діагностики та лікування хворих онкологічного профілю (наказ МОЗ України «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія» від 17.09.2007 № 554). Розподіл хворих із ЗПГЗ за стадіями захворювання представлено в табл. 1.
Таблиця 1. Розподіл хворих із ЗПГЗ за стадіями захворювання згідно з класифікацією TNM (n=146)
| Стадія | Кількість хворих | |
| Основна група,n (%) | Контрольна група,n (%) | |
| І (T1N0M0) | 3 (4,1) | 1 (1,4) |
| ІІа (T0–1N0M0, T2N0M0) | 12 (16,1) | 15 (20,8) |
| ІІb (T2N1M0, T3N0M0) | 26 (35,1) | 20 (27,8) |
| ІІІа (T0–3N2M0, T3N1–2M0) | 15 (20,3) | 12 (16,7) |
| ІІІb(T4N0–3M0, T0–4N3M0) | 3 (4,1) | 15 (20,8) |
| IV (T0–4N1–3M1) | 15 (20,3) | 9 (12,5) |
| Усього | 74 (100,0) | 72 (100,0) |
Дані табл. 1 свідчать про те, що у більшості пацієнток із ЗПГЗ (117 осіб; 80,1%) як основної (59 осіб; 79,7%), так і контрольної (58 осіб; 80,6%) групи захворювання було у стадії, за якої необхідним було хіміотерапевтичне лікування. Окремо потрібно звернути увагу на той факт, що у 4 хворих із ЗПГЗ у І стадії на момент включення в дослідження відзначали прогресування захворювання, що також потребувало проведення поліхіміотерапії (ПХТ): 3 (4,1%) хворих в основній та 1 (1,4%) — у контрольній групі.
Розподіл пацієнток за ступенем диференціації пухлини та молекулярно-генетичним типом [8] наведено у табл. 2.
Таблиця 2. Характеристика хворих із ЗПГЗ за ступенем диференціювання пухлини, молекулярно-генетичним типом (n=146)
| Імуногістохімічнідані | Кількість хворих | |
| Основна група,n (%) | Контрольна група,n (%) | |
| Ступінь диференціювання | ||
| G2 | 46 (62,2) | 46 (63,9) |
| G3 | 28 (37,8) | 26 (36,1) |
| Усього | 74 (100) | 72 (100) |
| Люмінальний тип | ||
| А | 52 (70,3) | 51 (70,8) |
| B | 12 (16,2) | 12 (16,7) |
| Усього | 64 (86,5) | 63 (77,5) |
| Експресія HER-2/neu | ||
| HER-2/neu– | 55 (74,3) | 61 (84,7) |
| HER-2/neu+++ | 19 (25,7) | 11 (15,3) |
| Усього | 74 (100,0) | 72 (100,0) |
Як свідчать дані табл. 2, у хворих із ЗПГЗ в обох групах переважав ІІ ступінь диференціювання пухлини (92 випадки; 63,0%). III ступінь диференціювання діагностовано у 54 (36,9%) пацієнток із ЗПГЗ. І ступінь диференціювання (G1) не зареєстровано в жодної хворої.
При вивченні рецепторного статусу пухлини у хворих із ЗПГЗ виявлено, що до люмінального A типу належало 103 (70,5%) пацієнтки, до люмінального B — 24 (16,4%). Статистично достовірні відмінності між групами визначені для HER-2/neu-позитивних хворих, яких було більше в основній групі (25,7% проти 15,3%). При аналізі за рештою типів (люмінальний A, B та тричі негативний) статистично достовірних відмінностей між групами не виявлено.
Усім хворим із ЗПГЗ як основної, так і контрольної групи після проведення певного діагностичного клініко-інструментально-лабораторного комплексу досліджень призначали хіміотерапевтичне лікування. Розподіл пацієнток із ЗПГЗ за кількістю курсів (режимами) та різновидом схеми призначеної ПХТ представлено в табл. 3.
Таблиця 3. Розподіл хворих із ЗПГЗ за режимами та схемами проведеної ПХТ (n=146)
| Режим та схема ХТ | Кількість хворих | |
| Основна група,n (%) | Контрольна група,n (%) | |
| Нео- та/або ад’ювантна ХТ | ||
| 4 курси FAC | 14 (18,9) | 15 (20,8) |
| 6 курсів FAC | 31 (41,9) | 36 (50,0) |
| 4–6 курсів АТ, РТ | 6 (8,1) | 4 (5,6) |
| Усього | 51 (68,9) | 55 (76,4) |
| Паліативна ХТ | ||
| 4 курси FAC | 1 (1,4) | 0 |
| 6 курсів FAC | 9 (12,1) | 7 (9,7) |
| 4–6 курсів АТ, РТ | 10 (13,5) | 9 (12,5) |
| 4 курси VР | 3 (4,1) | 1 (1,4) |
| Усього | 23 (31,1) | 17 (23,6) |
| Загалом | 74 (100,0) | 72 (100,0) |
Примітки: FAC — флуороурацил, доксорубіцин, циклофосфамід; АТ — доксорубіцин, паклітаксел; РТ — паклітаксел, цисплатин; VР — вінорельбін, цисплатин.
За даними табл. 3, первинним хворим із ЗПГЗ (106 жінок; 72,6%), в яких попередньо було виконано хірургічне лікування, проводили ад’ювантну ПХТ: 4 курси ПХТ за схемою FAC — 29 (27,4%) пацієнток, 6 курсів ПХТ за схемою FAC — 67 (63,2%) або 4−6 курсів ПХТ за таксановмісними схемами (АТ, РТ) — 10 (9,4%) хворих. Далі переходили на етап динамічного спостереження, який включав контрольне обстеження кожні 3 міс.
У випадку прогресування захворювання пацієнткам із ЗПГЗ (40; 27,4%) проводили паліативну ХТ ІІ лінії: 4−6 курсів ПХТ за схемою FAC — 17 (42,5%) хворих, 4−6 курсів ПХТ за таксановмісними схемами (АТ, РТ) — 19 (47,5%) або 4 курси ПХТ за схемою VР — 4 (10,0%) пацієнтки.
Усього проведено 778 курсів ПХТ. Перед включенням у дослідження у жодної хворої із ЗПГЗ ознак токсичності, зумовленої пухлиною, не відзначали. Усі 146 пацієнток із ЗПГЗ, які взяли участь у дослідженні, належали до групи високого ризику розвитку токсичності ХТ.
Усі зареєстровані побічні ефекти ХТ оцінено за шкалою токсичності NCI CTC (National Cancer Institute Common Toxicity Criteria), версія 3. Також було проаналізовано ступінь проявів, час виникнення та тривалість ускладнень, що розвинулися у хворих із ЗПГЗ внаслідок проведення ПХТ.
Результати та їх обговорення
У процесі хіміотерапевтичного лікування виявлено токсичні прояви ПХТ у 146 хворих із ЗПГЗ (основна група — 74 випадки, контрольна — 72), які представлено в табл. 4.
Таблиця 4. Розподіл хворих із ЗПГЗ за видом токсичних проявів ХТ (згідно зі шкалою токсичності NCI CTC) (n=146)
| Видтоксичності | Кількість випадків | p | |
| Основна група,n (%) | Контрольна група,n (%) | ||
| Гастроінтестинальна | 55 (74,3) | 58 (80,5) | p>0,05 |
| Печінкова | 29 (39,2) | 54 (75,0) | p |
| Кардіоваскулярна | 34 (45,9) | 68 (94,4) | p |
| Гематологічна | 27 (36,5) | 34 (47,2) | p |
| Інша | 12 (16,2) | 15 (20,8) | p>0,05 |
Примітка: відсоток перевищує 100,0, тому що у деяких хворих проявлялися декілька видів токсичності.
Дані табл. 4 свідчать про те, що найчастішими ускладненнями ХТ у хворих із ЗПГЗ були гастроінтестинальна токсичність (113; 77,3%), дещо рідше — кардіоваскулярна (102; 69,9%), печінкова (83; 56,8%) та гематологічна (61; 68,4%), іноді — неврологічна токсичність (26; 17,8%), в одному випадку зареєстровано алергічну реакцію у вигляді грипоподібного синдрому.
При аналізі результатів дослідження виявлено, що серед ускладнень лікування хворих із ЗПГЗ за стандартними схемами ПХТ ускладнення з боку травного тракту (гастроінтестинальна токсичність) становили 77,4%, тобто розвинулися у 113 досліджуваних пацієнток.
Згідно із загальноприйнятими критеріями токсичності ХТ за шкалою NCI СТС гастроінтестинальна токсичність розподіляється на різновиди. Різновиди гастроінтестинальної токсичності у хворих із ЗПГЗ, які отримували ПХТ за стандартними схемами, представлено на рис. 1.
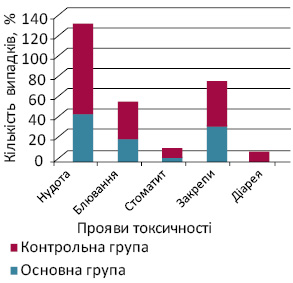
За допомогою клініко-лабораторних, інструментальних і молекулярно-генетичних методів дослідження виділено прогностичні фактори ризику розвитку гастроінтестинальної токсичності ХТ у хворих із ЗПГЗ. Кореляційний аналіз показав пряму залежність гастроінтестинальної токсичності від супутніх захворювань з боку травного тракту (r=0,42; р<0,05), віку до 45 років (r=0,58; p<0,05), проведення понад 3 курсів ХТ (r=0,37; p<0,05).
Результати дослідження генотипу GSTP1 продемонстрували, що в групі пацієнток, які мали гастроінтестинальні ускладнення ХТ ІІ–ІІІ ступеня проявів, переважав гомозиготний тип успадкування (G/G). Ризик розвитку гастроінтестинальної токсичності ХТ в 10 разів вищий у хворих із ЗПГЗ з генотипом G/G гена GSTP1, порівняно з хворими з генотипом А/А чи А/G.
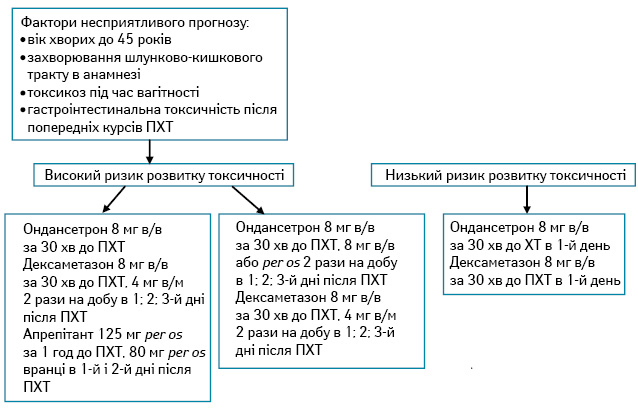
На підставі отриманих даних виділено групу пацієнток із ЗПГЗ з високим ризиком розвитку гастроінтестинальної токсичності — 55 (48,6%) осіб, для яких розроблено та застосовано алгоритм терапії супроводу з метою попередження гастроінтестинальної токсичності ПХТ за стандартними схемами.
Алгоритм антиеметичної терапії супроводу стандартних схем ХТ, який застосовували при лікуванні хворих із ЗПГЗ основної групи, представлено на рис. 2.
Нами проведено порівняльний аналіз частоти, термінів виникнення та ступеня проявів того чи іншого різновиду гастроінтестинальної токсичності, що розвинулася внаслідок застосування 4–6 курсів ХТ за стандартними схемами у хворих із ЗПГЗ, які отримали терапію супроводу за розробленим алгоритмом залежно від приналежності до групи ризику розвитку токсичності. Результати проведених досліджень представлено в табл. 5.
Таблиця 5. Розподіл епізодів гастроінтестинальної токсичності ХТ у хворих із ЗПГЗ за різновидом та ступенем проявів (згідно зі шкалою токсичності NCI CTC) (n=113)
|
Різновид та ступінь токсичності |
Кількість епізодів | p | |
| Основна група,n (%) | Контрольна група,n (%) | ||
| Нудота | |||
| І | 122 (221,8) | 137 (236,2) | >0,05 |
| II | 63 (114,5) | 98 (168,9) | |
| ІІI | 0 | 57 (98,2) | |
| ІV | 0 | 0 | >0,05 |
| Блювання | |||
| І | 37 (67,2) | 55 (94,8) | >0,05 |
| II | 23 (41,8) | 37 (63,7) | >0,05 |
| ІІI | 0 | 24 (41,3) | |
| ІV | 0 | 0 | >0,05 |
| Стоматит | |||
| І | 5 (9,0) | 7 (12,0) | >0,05 |
| II | 0 | 0 | >0,05 |
| ІІI | 0 | 0 | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Закреп | |||
| І | 57 (103,6) | 61 (105,1) | >0,05 |
| II | 0 | 0 | >0,05 |
| ІІI | 0 | 0 | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Усього | 307 (557,9%) | 476 (820,2) | |
Примітка: відсоток перевищує 100,0, тому що у хворих могли проявлятися декілька різновидів токсичності, які могли розвиватися неодноразово.
Дані табл. 5 свідчать про те, що прояви еметичного синдрому гастроінтестинальної токсичності І ступеня спостерігали однаково часто в обох групах хворих із ЗПГЗ. Еметичний синдром ІІ–ІІІ ступеня токсичності достовірно частіше розвивався у пацієнток із ЗПГЗ контрольної групи.
Отже, проведення терапії супроводу ХТ за розробленим алгоритмом у хворих із
ЗПГЗ значно знизило як частоту виникнення, так і ступінь проявів гастроінтестинальної токсичності. Так, прояви еметичного синдрому у пацієнток із ЗПГЗ, які отримували ХТ із застосуванням розробленого алгоритму терапії супроводу, зменшилися на 30,0% (з 60,1% у контрольній групі до 30,1% — в основній).
Симптомів блювання у хворих із ЗПГЗ в основній групі в жодному випадку не відмічено. Тобто пацієнтки із ЗПГЗ отримали від 4 до 6 курсів ХТ із мінімальними ускладненнями, що значно покращило якість їх життя.
Частота інших проявів гастроінтестинальної токсичності ХТ у хворих із ЗПГЗ основної та контрольної груп не відрізнялася.
При аналізі результатів дослідження виявлено, що після лікування хворих із ЗПГЗ за стандартними схемами ПХТ ускладнення з боку серцево-судинної системи (кардіоваскулярна токсичність) становили 69,9%, тобто розвинулися у 102 пацієнток.
Прояви кардіоваскулярної токсичності оцінювалися згідно із загальноприйнятими критеріями токсичності ХТ за шкалою NCI СТС з урахуванням таких показників, як частота серцевих скорочень (ЧСС), артеріальний тиск (АТ), ритм серця, довжина інтервалу Q–T на електрокардіограмі (ЕКГ)та фракція викиду на ехокардіограмі (ехоКГ). Розподіл показників кардіоваскулярної токсичності у хворих із ЗПГЗ, які отримували ПХТ за стандартними схемами, представлено на рис. 3.
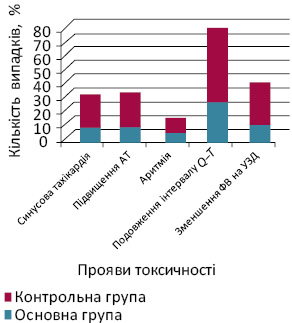
На підставі проведеного кореляційного аналізу визначено, що на розвиток кардіоваскулярної токсичності стандартних схем ХТ у пацієнток із ЗПГЗ впливають вік ≥50 років (r=0,36; р<0,05), хронічні захворювання серцево-судинної системи (r=0,39; р<0,05), попередня променева терапія на ліву грудну залозу та/або середостіння (r=0,41; р<0,05). Ризик розвитку серцево-судинних ускладнень ХТ у 2,68 раза вищий у хворих із ЗПГЗ із генотипом С/Т або Т/Т гена MTHFR, на відміну від пацієнток із генотипом C/C.
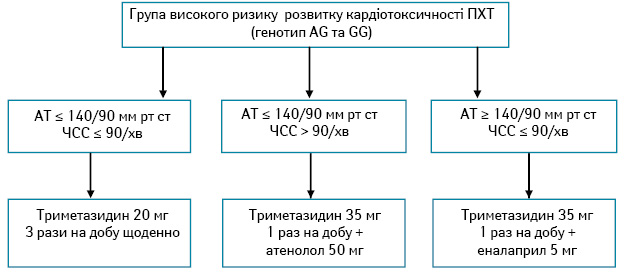
На основі визначених факторів нами виділено групу високого ризику розвитку кардіотоксичності, до якої віднесли 34 (33,3%) хворих із ЗПГЗ з наявністю хоча б одного фактора ризику.
Розроблений нами алгоритм кардіопротекторної терапії супроводу стандартних схем ХТ, який застосовували при лікуванні хворих із ЗПГЗ основної групи з високим ризиком розвитку кардіоваскулярної токсичності, представлено на рис. 4.
Нами проведено порівняльний аналіз частоти, термінів виникнення та ступеня проявів кардіоваскулярної токсичності ХТ у пацієнток із ЗПГЗ. Результати проведених досліджень представлено в табл. 6. Її дані свідчать про те, що своєчасне застосування терапії супроводу ХТ у хворих із ЗПГЗ значно знижує як частоту виникнення, так і ступінь проявів кардіоваскулярної токсичності.
Таблиця 6. Розподіл проявів кардіоваскулярної токсичності ХТ у хворих із ЗПГЗ залежно від ступеня (згідно зі шкалою токсичності NCI CTC) (n=102)
|
Різновид та ступінь токсичності |
Кількість епізодів | р | |
| Основна група,n (%) | Контрольна група, n (%) | ||
| Синусова тахікардія (ЧСС >90 уд./хв) | |||
| І | 5 (14,7) | 9 (13,2) | |
| II | 0 | 2 (2,9) | |
| ІІI | 0 | 1 (1,4) | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Підвищення АТ (>140/90 мм рт. ст.) | |||
| І | 6 (17,6) | 14 (20,6) | >0,05 |
| II | 1 (2,9) | 2 (2,9) | >0,05 |
| ІІI | 0 | 1 (1,4) | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Аритмія | |||
| І | 2 (5,9) | 4 (5,9) | >0,05 |
| II | 0 | 2 (2,9) | >0,05 |
| ІІI | 0 | 1 (1,4) | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Подовження Q–Tc на ЕКГ | |||
| І | 14 (41,2) | 25 (36,8) | |
| II | 4 (11,8) | 5 (7,4) | >0,05 |
| ІІI | 0 | 1 (1,4) | >0,05 |
| ІV | 0 | 0 | >0,05 |
| Зменшення фракції викиду на ехоКГ | |||
| І | 8 (23,5) | 14 (20,6) | >0,05 |
| II | 1 (2,9) | 6 (8,8) | |
| ІІI | 0 | 1 (1,4) | >0,05 |
| ІV | 0 | 0 | >0,05 |
Примітка: відсоток перевищує 100,0, тому що у хворих могли виникати відхилення декількох показників токсичності.
Аналіз результатів дослідження показав, що при лікуванні хворих із ЗПГЗ стандартними схемами ПХТ ускладнення з боку системи гемопоезу (гематологічна токсичність) становили 41,7%, тобто розвинулися у 61 досліджуваної пацієнтки.
Відповідно до загальноприйнятих критеріїв токсичності ХТ за шкалою NCI СТС та залежно від того, який із паростків кровотворення пригнічується, гематологічну токсичність розподіляють на підвиди (лейкопенія, нейтропенія, анемія, тромбоцитопенія, панцитопенія). Розподіл її підвидів у хворих із ЗПГЗ, які отримували ПХТ за стандартними схемами, представлено на рис. 5. За його даними, серед усіх випадків виникнення проявів гематологічної токсичності у хворих із ЗПГЗ найбільш часто відзначали анемію (основна група — 98 пацієнток; 36,7%; контрольна група — 46; 36,8%), лейкопенію (основна група — 79 пацієнток; 29,5%; контрольна група — 36; 28,8%), нейтропенію (основна група — 81; 30,3%; контрольна група — 41; 32,8%). Тромбоцитопенія розвивалася в поодиноких випадках: основна група — у 9 (3,4%) пацієнток, контрольна — у 2 (1,6%).
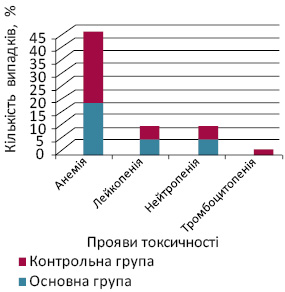
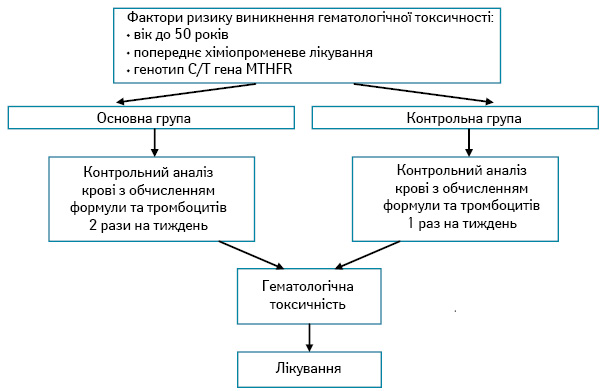
На підставі отриманих клініко-лабораторних даних виділено групу хворих із ЗПГЗ високого ризику розвитку гематологічної токсичності — 27 (44,2%) пацієнток, для яких розроблено та застосовано алгоритм спостереження з метою ранньої діагностики та лікування гематологічної токсичності ПХТ за стандартними схемами.
Алгоритм спостереження за хворими із ЗПГЗ основної групи з високим ризиком розвитку гематологічної токсичності представлено на рис. 6.
Алгоритм усунення гематологічних ускладнень хворих із ЗПГЗ основної групи з високим ризиком розвитку гематологічної токсичності залежно від її підвиду представлено в табл. 7.
Таким чином, визначення клініко-лабораторних факторів ризику гематологічної токсичності в комплексі з молекулярно-генетичними маркерами дало можливість виділити групу хворих із ЗПГЗ із високим ризиком розвитку гематологічної токсичності. Ретельніше спостереження за цією категорією пацієнток із метою ранньої діагностики розвитку токсичності та своєчасного її усунення дозволяє попередити виникнення більш тяжких ускладнень, поліпшити ефективність лікування, своєчасно провести ПХТ у повному обсязі та в оптимальні терміни і таким чином підвищити якість життя хворих.
Висновки
1. Встановлено, що факторами прогнозу високого ризику розвитку гастроінтестинальної токсичності ХТ у хворих із ЗПГЗ є вік до 45 років (r=0,58; p<0,05), токсикоз вагітних та супутні хронічні захворювання з боку травного тракту (r=0,42; р<0,05), обсяг попереднього лікування (≥3 курсів ХТ) (r=0,37; p<0,05), генотип G/G гена GSTP1 (OR=10,0; 95% CI 1,2–94,6; p<0,04).
2. Факторами прогнозу високого ризику розвитку кардіоваскулярної токсичності ХТ у хворих із ЗПГЗ є вік ≥50 років (r=0,36; р<0,05), хронічні захворювання серцево-судинної системи (r=0,39; р<0,05), попередня променева терапія на ліву грудну залозу та/або середостіння (r=0,41; р<0,05), генотип С/Т або Т/Т гена MTHFR (OR=2,7; 95% CI 1,2–94,6; p<0,04).
3. Виділено групи хворих із високим ризиком розвитку гастроінтестинальної, гематологічної та кардіоваскулярної токсичності ХТ з урахуванням комплексу клініко-лабораторних факторів прогнозу виникнення токсичних проявів та розроблено алгоритми терапії супроводу стандартних схем ХТ.
4. Застосування розроблених алгоритмів терапії супроводу стандартних схем ХТ у хворих із ЗПГЗ із високим ризиком розвитку токсичності дозволило зменшити прояви гастроінтестинальної токсичності на 30,0%, ранньої кардіоваскулярної токсичності — на 25,1%.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2012) Рак в Україні, 2010–2011. Захворюваність, смертність, виживаність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 13: 46–47.
2. Казюлин А.Н., Козлов С.В., Королева И.А., Кучерявый Ю.А. (2007) Частота поражения желудочно-кишечного тракта при проведении противоопухолевой химиотерапии рака молочной железы. Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 5: 173–176.
3. Abraham J. (2006) Pharmacogenetics of cancer chemotherapy. Biochim. Biophys. Acta, 1766(2): 168–183.
4. Andre F., Zielinski C. (2013) Optimal strategies for metastatic triple negative breast cancer with currently approved agents. Ann. Oncol., 24(4): 46–51.
5. Carey L. (2011) Directed therapy subtypes of triple negative breast cancer. Oncologist, 25(2): 141–151.
6. Hesketh P. (2004) Understanding the pathobiology of chemotherapy-induced nausea and vomiting. Providing a basis for therapeutic progress. Oncology (Williston Park), 18: 9.
7. Herrstedt J., Roila F. (2010) Guideline update for MASCC and ESMO in the prevention of chemotherapy and radiotherapy-induced nausea and vomiting: results of the Perugia consensus conference. Ann. Oncol., 21(5): 232–243.
8. Perou C.M. (2000) Molecular portraits of human breast tumors. Nature, 406: 747–752.
9. Ye E.T. (2009) Cardiovascular complications of cancer therapy. JACC, 53: 2231–2247.
Эффективность применения алгоритмов терапии сопровождения с учетом факторов прогноза токсичности химиотерапии у больных со злокачественными опухолями грудной железы
Резюме. Химиотерапия является обязательным компонентом комплексного лечения больных с местно-распространенным и метастатическим раком грудной железы. Токсичность химиотерапии необходимо учитывать с целью ее предупреждения и адекватной терапии, поскольку она неблагоприятно влияет на качество жизни больных как во время лечения, так и при последующем наблюдении; приводит к необходимости снижения доз цитостатиков, увеличению интервалов между курсами и остановке противоопухолевого лечения; может угрожать жизни пациентки; значительно увеличивает стоимость лечения. Применение разработанного алгоритма терапии сопроводжения химиотерапии по стандартным схемам у больных со злокачественными опухолями грудной железы с высоким риском развития осложений позволило провести лечение в полном объеме без снижения доз цитотоксических препаратов, в запланированные сроки и уменьшить проявления гастроинтестинальной токсичности в виде эметического синдрома на 30,0%, ранней печеночной токсичности — на 8,2% и ранней кардиоваскулярной токсичности — на 25,1%, вследствие чего были улучшены результаты лечения и качество жизни пациенток.
рак грудной железы, химиотерапия, токсичность химиотерапии, терапия сопровождения.














Leave a comment