Хірургічне лікування метастатичного раку прямої кишки із синхронним ураженням печінки
Щепотин И.Б., Колесник Е.А., Лукашенко А.В., Бурлака А.А., Приймак В.В.
Резюме. Проведено порівняльний аналіз результатів лікування 41 хворого на синхронний метастатичний рак прямої кишки із синхронним ураженням печінки (сМ-РПК), яким за період із листопада 2008 р. по вересень 2013 р. у клініці Національного інституту раку виконали оперативні втручання. Пацієнти рандомізовані в групи комбінованого (група І — видалення первинної пухлини та віддалених метастазів одночасно) та етапного (група ІІ — видалення первинної пухлини та віддалених метастазів двома етапами) хірургічного лікування. Аналіз отриманих даних не показав статистично значущої різниці за рівнем ранніх післяопераційних ускладнень у групах порівняння згідно зі шкалою Clavien — Dindo (Grade II; IIIa; IIIb; IVa), які становили 4,7; 14,3; 9,5; 4,7 та 10; 10; 5; 0% відповідно в групах І та ІІ. Не було зареєстровано післяопераційної летальності. Найбільш серйозні ускладнення (Clavien — Dindo Grades IIIb, IVa) були відмічені у пацієнтів групи І, у яких було видалено >40% паренхіми печінки (гемігепатектомія + сегмент/секція). У 3 (14,3%) хворих групи І діагностували часткову недостатність товстокишкового анастомозу в ранній післяопераційний період, чого не зареєстровано в групі ІІ (р=0,21). У групі етапних резекцій (група ІІ) загальна кумулятивна 3-річна виживаність становила 40,0%, при комбінованому хірургічному підході (група І) цей показник був достовірно вищий — 61,9% (р
Резюме. Проведен сравнительный анализ результатов лечения 41 больного метастатическим раком прямой кишки с синхронным поражением печени (сМ-РПК), которым за период с ноября 2008 г. по сентябрь 2013 г. в клинике Национального института рака выполнены оперативные вмешательства. Пациенты рандомизированы в группы комбинированного (группа І — удаление первичной опухоли и отдаленных метастазов одномоментно) и этапного (группа ІІ — удаление первичной опухоли и отдаленных метастазов двумя этапами) хирургического лечения. Анализ полученных данных не показал статистически значимого различия по уровню ранних послеоперационных осложнений в группах сравнения согласно шкале Clavien — Dindo (Grade II; IIIa; IIIb; IVa), которые составили 4,7; 14,3; 9,5; 4,7 и 10; 10; 5; 0% соответственно в группах I и II. Не зарегистрировано послеоперационной летальности. Наиболее серьезные осложнения (Clavien Grades IIIb, IVa) отмечали у пациентов группы I, у которых было удалено более 40% паренхимы печени (гемигепатэктомия + сегмент/секция). У 3 (14,3%) больных группы I развилась частичная несостоятельность толстокишечного анастомоза в ранний послеоперационный период, чего не было зарегистрировано в группе II (р=0,21). В группе этапных резекций (группа II) общая кумулятивная 3-летняя выживаемость составила 40,0%, при комбинированном хирургическом подходе (группа I) этот показатель был достоверно выше — 61,9% (р<0,001). Таким образом, комбинированные (одноэтапные) резекции у больных сМ-РПК позволяют достичь лучших результатов общей 3-летней выживаемости по сравнению с двухэтапными резекциями. Проведение радикального лечения путем одноэтапной операции улучшает качество жизни пациентов, уменьшает сроки стационарного лечения. Комбинированные резекции, включающих удаление первичной опухоли и резекцию печени (≤4 сегментов), — безопасная современная хирургическая тактика при сМ-РПК.

Введение
Колоректальный рак (КРР) занимает одно из ведущих мест в структуре онкологической заболеваемости и смертности в мире. В США заболеваемость КРР находится на третьем месте среди наиболее часто диагностируемых злокачественных новообразований и занимает вторую позицию в структуре смертности населения от онкологических заболеваний [15]. В 2012 г. в Украине зарегистрировано 10 796 и 9458 новых случаев заболеваемости раком ободочной и прямой кишки (РПК) соответственно [2]. У 20% больных на момент первичной диагностики РПК выявляют отдаленные (синхронные) метастазы, треть из которых поражает печень [15, 24]. Согласно опубликованным данным, у 50% пациентов с впервые выявленным РПК метастазы в печень будут диагностированы в течение их дальнейшей жизни [9].
Продолжительность жизни больных с синхронным метастатическим РПК (М-РПК) без лечения составляет 6–12 мес с момента установления диагноза; паллиативное хирургическое лечение обеспечивает общую 5-летнюю выживаемость в пределах 10% [21]. Резекция печени остается единственным методом, который позволяет достоверно улучшить отдаленные результаты лечения больных М-РПК. Общая 5-летняя выживаемость пациентов с М-РПК с синхронно диагностированными метастазами (сМ-РПК) в печени после комбинированных резекций (удаление первичной опухоли и метастатических очагов в печени) составляет, по разным данным литературы, 26–51% [18]. При этом показатель резектабельности у пациентов с сМ-РПК не превышает 10–30% [12]. Однако за последние годы отмечен значительный прогресс в лечении при данной патологии за счет более качественного предоперационного стадирования, совершенствования хирургической техники, технологий, а также применения высокоэффективных лекарственных средств [7].
По данным многочисленных исследований, современные режимы неоадъювантной полихимиотерапии (НПХТ) при нерезектабельных формах сМ-РПК позволяют повысить резектабельность до 60% [10]. В то же время существует риск утраты возможности хирургического лечения при прогрессировании заболевания на фоне НПХТ у больных с исходно резектабельными метастазами в печени и при появлении новых нерезектабельных внепеченочных очагов (21–26% случаев) [14, 19]. Также следует помнить о возможности развития патологических изменений печени вследствие токсического действия химиопрепаратов, что значительно снижает функциональный резерв остаточной печеночной паренхимы после резекции и, по некоторым данным, повышает уровень ранних послеоперационных осложнений [13].
Отсутствие достаточного мирового опыта в реализации алгоритма радикального лечения пациентов со сМ-РПК подняло вопросы относительно выбора оптимальной комбинации существующих методов лечения. Одним из основных предметов дискуссии является выполнение одномоментного комбинированного хирургического вмешательства либо разделение операции на два этапа. Следует отметить отсутствие консенсуса относительно оптимального временного промежутка для выполнения резекции печени и первичной опухоли прямой кишки, выбора наилучшей комбинации химио- и лучевой терапии [2, 9, 12, 18, 21, 24]. Дискутабельными остаются режимы проведения лучевой терапии на область первичной опухоли при синхронном метастазировании в печень.
Целью нашего исследования является оптимизация хирургической тактики в мультимодальном подходе к лечению пациентов с сМ-РПК для улучшения непосредственных и отдаленных результатов.
Объект и методы исследования
Проведен сравнительный анализ результатов лечения 41 пациента с сМ-РПК, которым за период с ноября 2008 г. по сентябрь 2013 г. в клинике Национального института рака выполнены оперативные вмешательства. Пациенты рандомизированы в группы комбинированного (группа І — удаление первичной опухоли и отдаленных метастазов одномоментно) и этапного (группа ІІ — удаление первичной опухоли и отдаленных метастазов двумя этапами) хирургического лечения.
Критерии включения:
- наличие резектабельной опухоли прямой кишки T1–3N0–2;
- наличие резектабельных синхронных метастазов в печени M1;
- общее состояние пациента по шкале ECOG 0–2.
Критерии исключения:
- наличие нерезектабельных внепеченочных метастазов;
- осложнения первичной опухоли (кишечная непроходимость, кровотечение, абсцесс и др.);
- наличие другого онкологического заболевания, а также резекции или абляция печени в анамнезе;
- наличие сопутствующей патологии в стадии декомпенсации.
В группах сравнения все пациенты получали суммарно 6 курсов полихимиотерапии (ПХТ) в режиме FOLFOX-6 и предоперационную лучевую терапию на область первичной опухоли прямой кишки (2,0 Гр × 15). В случае прогрессирования заболевания на фоне проведенной химиотерапии резекцию печени пациентам группы этапного лечения не выполняли.
Предоперационную диагностику проводили согласно утвержденным стандартам и клиническим протоколам [1]. Применены ультразвуковое исследование (УЗИ) органов брюшной полости, фиброгастроскопия, фиброколоноскопия, ирригоскопия, трансанальное УЗИ, спиральная компьютерная томография (СКТ) с внутривенным усилением, магнитно-резонансная томография (МРТ), электрокардиография, эхокардиография, а также вирусологическое исследование маркеров вирусных гепатитов (А, В, С), комплекс онкомаркеров (РЕА, СА-19-9, СА-242), пункционная биопсия с целью цитологической верификации диагноза. Вариативную сосудистую анатомию печени изучали по данным ангиореконструкции СКТ с использованием классификации Michel. Функциональные резервы печени оценивали в соответствии со шкалой Чайлд-Туркот-Пью и MELD. Проявления токсичности химиотерапии регистрировали согласно критериям CTCAE 4.03.
Протокол хирургического лечения на прямой кишке включал стандартные оперативные вмешательства с выполнением тотальной мезоректумэктомии и сохранением вегетативных тазовых нервов.
При планировании объема оперативного вмешательства на печени использовали классификацию Brisbane 2000, а также руководствовались результатами программной и ручной волюметрии [6]. Ответ очагов опухоли на НПХТ, а также первичной опухоли на лучевую терапию оценивали согласно критериям RECIST 1.1.
Протокол хирургического вмешательство на печени включал:
- интраоперационное УЗИ печени;
- анатомичность резекции печени;
- атипические резекции в случае наличия единичных субкапсульных очагов
- обработку воротных структур раздельным методом либо методом Глиссона;
- рассечение паренхимы печени с использованием ультразвукового кавитатора-аспиратора;
- методику управляемой гипотензии при рассечении паренхимы печени;
- неприменение маневра Прингла во время резекций печени;
- показанием к радиочастотной абляции (РЧА) являлось наличие единичного очага размером ≤1 см, локализованного интапаренхиматозно;
- дополнение геми- либо расширенных гемигепатэктомий РЧА при наличии вышеуказанного очага в остающейся доле/секции печени.
Статистический анализ проводили с помощью программного обеспечения STATISTICA 8.0. Непараметрические величины представлены медианой и межквартильным диапазоном, для сравнения использовали тест Манна — Уитни. Категориальные величины сравнивали, используя χ-тест. Значения (Мean±SЕМ) считали статистически достоверными при р
Результаты
Проведено хирургическое лечение 41 пациента с сМ-РПК. Общая характеристика больных представлена в табл. 1. В группах сравнения не выявлено значимых различий в демографических показателях. Средний возраст больных составил 60±8,1 и 57,5±11,3 года соответственно в группах I и II (р=0,45). В группе комбинированных резекций мужчин было 52,4%, в группе этапного лечения — 35% (р=0,21).
Таблица 1. Клинико-морфологическая характеристика групп пациентов с сМ-РПК
| Показатели | Всего пациентов(n=41) | Группа I(n=21) | Группа II(n=20) | Значение р |
| Средний возраст Мean±SЕМ, лет | 60,0±9,6 | 60,0±8,1 | 57,5±11,3 | 0,47 |
| Пол (мужчины), n (%) | 18 (43,9) | 11 (52,4) | 7 (35) | 0,21 |
| Стадия (TNM, 6-е изд.), n (%) | ||||
| pT1 | 0 | 0 | 0 | 0 |
| pT2 | 3 (7,3) | 2 (9,5) | 1 (5) | 0,80 |
| pT3 | 33 (80,5) | 15 (71,4) | 18 (90) | 0,18 |
| pT4 | 5 (12,2) | 4 (19,1) | 1 (5) | 0,17 |
| pN0 | 12 (29,4) | 7 (33,3) | 5 (25) | 0,65 |
| pN1 | 27 (65,8) | 12 (57,2) | 15 (75) | 0,23 |
| pN2 | 2 (4,8) | 2 (9,5) | 0 | 0,14 |
| Билобарное поражение печени, n (%) | 13 (31,7) | 8 (38,1) | 5 (25) | 0,38 |
| Синхронное метастатическое поражение легких, n (%) | 1 (2,4) | 1 (4,7) | 0 | 0,34 |
| Количество метастатических очагов в печени: | ||||
| по данным предоперационной СКТ, Мean±SЕМ, n | 3,00±1,38 | 3,00±1,67 | 3,00±1,6 | 0,90 |
| по данным интраоперационного УЗИ, Мean±SЕМ, n | 4,00±1,55 | 4,00±1,33 | 4,00±1,79 | 0,80 |
| по данным морфологического исследования макропрепарата, Мean±SЕМ, n |
4,00±1,64 | 4,00±1,33 | 4,00±1,95 | 0,90 |
| Наличие >2 метастазов в печени, n (%) | 24 (58,5) | 13 (61,9) | 11 (55) | 0,66 |
| Максимальный диаметр метастазов в печени, Мean±SЕМ, мм | 50±22,2 | 45±23,1 | 58±20,3 | 0,17 |
| Инвазия метастазов в смежные органы и структуры, n | 2 (4,8) | 1 (4,7) | 1 (5,0) | 0,97 |
| Виды резекций печени: | ||||
| только резекция, n (%) | 40 (97,5) | 20 (95,2) | 20 (100,0) | 0,34 |
| резекция + РЧА, n (%) | 1 (2,4) | 1 (4,7) | 0 | 0,34 |
| повторные резекции, n (%) | 3 (7,3) | 2 (9,5) | 1 (5,0) | 0,58 |
| повторные РЧА, n (%) | 1 (2,4) | 1 (4,7) | 0 | 0,34 |
| резекция ≥2 сегментов, n (%) | 12 (29,3) | 5 (23,8) | 7 (35,0) | 0,44 |
| гемигепатэктомия (4 сегмента), n (%) | 20 (48,7) | 12 (57,2) | 8 (40,0) | 0,28 |
| расширенная гемигепатэктомия (>4 сегментов), n (%) | 8 (19,5) | 3 (14,3) | 5 (25,0) | 0,39 |
| анатомические резекции печени, n (%) | 37 (90,3) | 18 (85,7) | 19 (95,0) | 0,33 |
| анатомические/атипические резекции печени, n (%) | 4 (9,7) | 3 (14,3) | 1 (5,0) | 0,33 |
| Виды резекции прямой кишки: | ||||
| передняя резекция, n (%) | 22 (53,6) | 12 (57,2) | 10 (50,0) | 0,70 |
| низкая передняя резекция, n (%) | 5 (12,2) | 3 (14,3) | 2 (10,0) | 0,82 |
| низкая передняя резекция с илеостомией, n (%) | 13 (31,7) | 5 (23,8) | 8 (40,0) | 0,38 |
| операция Кеню — Майлса, n (%) | 1 (2,4) | 1 (4,7) | 0 | 0,80 |
| Резекции легкого, n (%) | 1 (2,4) | 1 (4,7) | 0 | 0,34 |
| Продолжительность оперативного вмешательства, Мean±SЕМ, мин* | 393,5±111,4 | 647,8±125,8 | ||
| Сроки стационарного лечения, Мean±SЕМ, сут** | 12,3±1,6 | 21,8±2,2 | 0,02 |
* В группе II учитывали продолжительность двух хирургических этапов; ** в группе II учитывали суммарные сроки пребывания пациентов в стационаре после двух хирургических этапов.
Билобарное поражение печени зарегистрировано в 13 (31,7%) случаях; из них в группах I и ІІ — соответственно 38,1 и 25,0% (р=0,38). Максимальный диаметр метастазов составил 45±23,1 мм в группе I и 58±20,3 в группе II. Зарегистрировано метастатическое поражение легкого у 1 (2,4%) больного группы І.
У больных обеих групп выявлены сопоставимые данные о количестве метастатических очагов в печени согласно предоперационным СКТ и МРТ. Так, более 2 метастазов в печени зарегистрировано у 13 (61,9%) больных группы I и у 11 (55%) группы ІІ (р=0,66). Интраоперационное УЗД позволило повысить точность диагностики. В группе комбинированных резекций по данным интраоперационного УЗИ и СКТ количество метастатических очагов составляло 4,0±1,33 и 3,0±1,67 соответственно (р=0,04), в группе этапных резекций — 4,0±1,79 и 3,0±1,6 (р
Инвазия метастатических очагов печени в смежные органы и структуры выявлена у 2 (4,8%) пациентов (по 1 случаю в группах I и ІІ; р=0,97). Анализ хирургических вмешательств на печени показал, что у 40 (97,5%) больных выполнены резекции без использования РЧА. Только в 1 (2,4%) случае в группе I анатомическая гемигепатэктомия была дополнена РЧА, что было обусловлено центральной локализацией очага
На момент проведения анализа повторные резекции печени при прогрессировании заболевания были выполнены у 2 (9,5%) и 1 (5%) пациента после комбинированного и этапного хирургического похода соответственно (р=0,58). Прогрессирование заболевания у этих больных зарегистрировано в течение 7 мес в группе I и через 1,5 года — в группе II. Все повторные резекции печени были выполнены по анатомическим принципам. В I группе 1 пациентке резецировали Sg IV после ранее выполненной правосторонней гемигепатэктомии (Sg V–VIII); в группе II в одном клиническом случае резецировали левую латеральную секцию Sg II, III после ранее проведенной резекции Sg VI, в другом — Sg VIIId после удаления задней секции печени (Sg VI, VII). Кроме того, пациентке из I группы провели РЧА метастатического очага в Sg IVa печени через 5,5 мес после первого оперативного вмешательства.
Анализ не выявил различия в группах сравнения по виду и объему резекций печени, в частности расширенные гемигепатэктомии (резекция >4 сегментов) были выполнены в 3 (14,3%) и 5 (25%) случаях в группах комбинированного и этапного подхода соответственно (р=0,39). Большинство резекций в группах были анатомическими (90,3%), и только в 9,7% случаев использовали комбинацию анатомической и атипической резекции. У 1 (4,7%) пациента применена комбинированная атипическая резекция левого легкого.
Во II группе 3 (15%) пациентам резекция печени не произведена из-за прогрессирования заболевания на фоне проведения НПХТ (р=0,06). Срок наблюдения больных составил от 5 до 42 мес. За период проведения ПХТ в группах не отмечено проявлений токсичности выше III степени.
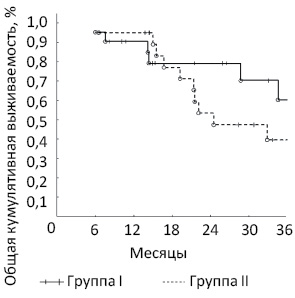
Зарегистрированный общий уровень рецидивов заболевания был выше в группе I (50,0%) по сравнению с группой II (38,1%) (р=0,63). Медиана общей выживаемости пациентов после этапных резекций составила 32 мес, тогда как в группе I не достигнута. При анализе непосредственных результатов хирургического лечения в 12 (29,3%) случаях зафиксированы ранние осложнения разной степени выраженности; их частота в обеих группах не имела статистически значимого различия (р=0,56) (табл. 2). В группах I и II этот показатель составил соответственно 33,3 и 25% (р=0,56). Анализ полученных данных не показал статистически значимого различия по уровню ранних послеоперационных осложнений в группах сравнения согласно шкале Clavien — Dindo (Grade II; IIIa; IIIb; IVa), которые составили 4,7; 14,3; 9,5; 4,7 и 10; 10; 5; 0% соответственно в группах I и II. В группах не зарегистрировано послеоперационной летальности.
Таблица 2. Результаты хирургического лечения пациентов с сМ-РПК в группах I и II
| Показатели | Всего пациентов(n=41) | Группа I(n=21) | Группа II(n=20) | Значение р | |||
| n | % | n | % | n | % | ||
| Края резекции печени: | |||||||
| R0 | 39 | 95,2 | 20 | 95,3 | 19 | 95 | 0,98 |
| R1 | 2 | 4,8 | 1 | 4,7 | 1 | 5 | 0,98 |
| R2 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Все зарегистрированные послеоперационные осложнения | 12 | 29,3 | 7 | 33,3 | 5 | 25 | 0,56 |
| Абсцесс брюшной полости/малого таза | 2 | 4,8 | 1 | 4,7 | 1 | 5 | 0,98 |
| Недостаточность толстокишечного анастомоза | 3 | 7,3 | 3 | 14,3 | 0 | 0 | 0,21 |
| Острая печеночная недостаточность | 4 | 9,7 | 2 | 9,5 | 2 | 10 | 0,90 |
| Жидкостные осумкования брюшной полости/малого таза | 2 | 4,8 | 1 | 4,7 | 1 | 5 | 0,98 |
| Другие | 1 | 2,4 | 0 | 0 | 1 | 5 | 0,33 |
| Уровни послеоперационных осложнений в течение 30 сут, согласно шкале Calvien — Dindo: | |||||||
| Grade II | 3 | 7,3 | 1 | 4,7 | 2 | 10 | 0,53 |
| Grade IIIa | 5 | 12,2 | 3 | 14,3 | 2 | 10 | 0,68 |
| Grade IIIb | 3 | 7,3 | 2 | 9,5 | 1 | 5 | 0,58 |
| Grade IVa | 1 | 2,4 | 1 | 4,7 | 0 | 0 | 0,34 |
Наиболее серьезные осложнения (Clavien — Dindo Grades IIIb, IVa) отмечали у пациентов группы I, у которых было удалено более 40% паренхимы печени (гемигепатэктомия + сегмент/секция). Следует отметить, что у 3 (14,3%) больных группы I развилась частичная несостоятельность толстокишечного анастомоза в раннем послеоперационном периоде, чего не зарегистрировано в группе II (р=0,21) (рис. 1).
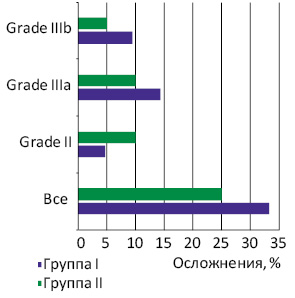
Согласно данным патогистологического исследования R0-резекция печени была достигнута у 39 (95,2%) больных, R1 — у 2 (4,8%). По данным заключительного патогистологического исследования, у всех пациентов, у которых подтверждена R0-резекция, соблюдена граница резекции не менее 10 мм.
Время пребывания в стационаре больных после этапных резекций было более длительным — суммарно 21,8±2,2 койко-дня, тогда как при комбинированных резекциях — 12,3±1,6 койко-дня (р=0,02). Длительность оперативного вмешательства в группе комбинированного хирургического подхода составила 316,3±10,3 мин и была значимо меньше по сравнению с группой II — 497,7±19,2 мин (р
При обработке полученных результатов с применением непараметрического анализа выявлено достоверное различие в общей кумулятивной 3-летней выживаемости пациентов с сМ-РПК. В группе этапных резекций (группа II) этот показатель составил 40,0%, при комбинированном хирургическом подходе (группа I) он был достоверно выше — 61,9% (р
Обсуждение
Лечение больных с сМ-РПК является сложным и высокотехнологичным процессом. Ключевыми в терапии таких больных должны быть использование мультидисциплинарного подхода, а также индивидуализации алгоритмов лечения [15]. Несмотря на актуальность представленной проблемы, анализ литературных данных свидетельствует о дефиците доказуемой базы, в особенности рандомизированных исследований, посвященных хирургическому лечению при этой патологии.
Основным критерием успешного лечения сМ-РПК является возможность выполнения R0-резекции как первичной опухоли, так и синхронных метастазов в печени, что обусловливает лучшую выживаемость такой категории больных. С этой целью следует осуществлять максимально точную оценку распространенности и резектабельности опухолевого процесса на этапе обследования пациента. В проведенном нами исследовании патоморфологический анализ показал, что у 40 (97,5%) пациентов выполнены R0-резекции печени. Показанием для проведения резекции у таких больных является наличие технической возможности сохранения 25–30% здоровой паренхимы печени.
В ранних исследованиях некоторые авторы проявляли определенный пессимизм относительно комбинированных резекций при метастатическом КРР. Последний был связан с вероятностью повышения риска ранних послеоперационных осложнений. Однако совершенствование хирургических и анестезиологических подходов, а также накопление опыта комбинированных вмешательств позволило нивелировать разницу в развитии осложнений при этапном и комбинированном подходе [21]. Считается, что этапные хирургические вмешательства при синхронном метастатическом РПК показаны в случае необходимости выполнения расширенных гемигепатэктомий, мультивисцеральных резекций при удалении первичной опухоли прямой кишки, а также при наличии у больных признаков повреждения ткани печени вследствие токсического воздействия неоадъювантной химиотерапии [22]. С другой стороны, основным преимуществом комбинированных хирургических вмешательств у больных с сМ-КРР является возможность удаления всех опухолевых очагов одномоментно, что снижает риск развития диссеминации заболевания, дает возможность избежать повторной послеоперационной иммуносупрессии. Кроме того, комбинированная операция улучшает качество жизни больного и обеспечивает лучшие условия для системной ПХТ [11, 12, 18].
В ряде работ не продемонстрировано статистически достоверного различия в отдаленных результатах между группами этапных и комбинированных резекций [4, 5, 16]. Однако следует отметить, что в этих исследованиях не дифференцировались результаты в группах согласно локализации первичной опухоли. Радикальные хирургические вмешательства по поводу РПК технически более сложны, чем при раке ободочной кишки, и сопровождаются большим риском развития ранних послеоперационных осложнений [15, 22]. В проведенном исследовании мы не выявили достоверных различий в количестве серьезных осложнений в группе больных, которым была выполнена комбинированная резекция прямой кишки и метастазов в печени по сравнению с группой этапного хирургического подхода. Установлено, что из 41 пациента только у 12 (29,3%) были выявлены ранние послеоперационные осложнения различной степени тяжести. Анализ полученных данных не показал статистически значимого различия по уровню ранних послеоперационных осложнений в группах сравнения согласно шкале Clavien — Dindo.
Частота возникновения острой печеночной недостаточности, абсцессов или жидкостных осумкований брюшной полости и малого таза в группах была сравнима. Причиной большей части зарегистрированных осложнений в группе I была зона резекции прямой кишки с первичной опухолью. Недостаточность толстокишечного анастомоза составила 14,3 и 0% соответственно в группах комбинированных и этапных резекций, однако из-за небольшого количества пациентов в группах сравнения этот показатель не имел значимых различий (р=0,21). Важно отметить, что все пациенты группы I с диагностированной несостоятельностью швов толстокишечного анастомоза перенесли комбинированные расширенные (>4 сегментов) резекции печени. Следует предположить, что развитию несостоятельности толстокишечного анастомоза способствует острая печеночно-клеточная недостаточность той или иной степени выраженности в раннем послеоперационном периоде. Последняя способствует нарушению эндотелиального механизма регуляции сосудистого русла культи прямой кишки [3].
Важным фактором, существенно влияющим на риск развития осложнений, является функциональный резерв остаточной печеночной паренхимы, при уменьшении которого существенно усугубляется тяжесть послеоперационных осложнений. Анализируя целый ряд прогностических факторов (онкомаркеры, количество очагов, врастание в сосуды и протоки, возраст, наличие первичной опухоли), следует констатировать, что только «малый» объем (≤3 сегментов) остающейся паренхимы может ограничить показания к радикальному лечению метастазов в печени.
Многие авторы указывают, что недостатками этапного хирургического лечения при сМ-РПК являются высокий уровень послеоперационных осложнений и смертности, более длительное пребывание больного в стационаре, а также негативное влияние на психосоматический статус пациента [8, 23]. На наш взгляд, основной проблемой этапного хирургического лечения пациентов с сМ-РПК является прогрессирование опухоли в период подготовки пациента ко второму этапу лечения — резекции печени, что может исключить возможность хирургического вмешательства и тем самым значительно ухудшить общий прогноз. В наших исследованиях в группе II было зарегистрировано прогрессирование заболевания и переход в нерезектабельную форму метастатического поражения печени у 3 (15%) пациентов, поэтому у них был проведен только первый этап хирургического лечения — удаление первичной опухоли.
Продолжительность оперативного вмешательства, экономическую эффективность и послеоперационную смертность редко анализируют в научной литературе. Согласно полученным нами результатам, этапные резекции достоверно увеличивали (р
Рассматривая возможные пути осуществления лечения пациентов с сМ-РПК, следует отметить целый ряд новых направлений, в основном касающихся возможности хирургического лечения при билобарном поражении печени. К ним относятся методы искусственной гипертрофии остаточной паренхимы печени (situ-split-резеции, эмболизация портальной вены), которые также применяются в нашей клинике, однако требуют дальнейшего подробного изучения. Перспективным направлением в повышении эффективности лечения является применение современных лекарственных средств в неоадъювантном режиме с целью повышения резектабельности метастазов в печени.
Важной проблемой в проведении НПХТ у больных с резектабельными формами сМ-РПК является ее безопасность. В малочисленных опубликованных работах по изучению этого вопроса выдвигается гипотеза, что обоснованием для проведения НПХТ у пациентов с резектабельными формами сМ-РПК может служить оценка «биологического поведения» опухоли и ее отдаленных метастазов у каждого конкретного больного с целью определения эффективности режима ПХТ после выполнения резекции [15, 25]. Аргументами противников назначения НПХТ таким пациентам является вероятность прогрессирования заболевания и переход в нерезектабельную форму на фоне проводимого лечения. Последнее подтверждается результатами и нашего исследования. В группе II нам удалось выполнить резекцию прямой кишки с первичной опухолью и печени с отдаленными метастазами только в 85% случаев. Причиной этого стало прогрессирование метастазов в печени на фоне НПХТ после первого этапа хирургического лечения. Кроме того, существует вероятность развития патологии здоровой ткани печени из-за токсичности химиопрепаратов, что может повышать риски развития печеночной недостаточности в послеоперационный период. Rubbia-Brandt и соавторы опубликовали клинические данные о синдроме синусоидальной обструкции, индуцированном НПХТ в ткани печени у больных с КРР [20]. Nakano и соавторы утверждают, что у больных, получивших ≥6 циклов химиотерапии на основе оксалиплатина, выявлена выраженная корреляция с развитием синдрома синусоидальной обструкции [17].
Непараметрический анализ не выявил значимого различия в группах сравнения по уровню ранних послеоперационных осложнений, однако очевидным становится факт наличия повышенного риска развития несостоятельности толстокишечного анастомоза у пациентов после расширенных резекций печени (>4 сегментов) в группе І. Поэтому при планировании подобных вмешательств следует проводить крайне тщательный отбор пациентов. Выполнение комбинированных хирургических вмешательств при М-РПК должно основываться на мультидисциплинарном подходе, включающем прецизионную диагностику как распространенности первичной опухоли, так и степени метастатического поражения печени, что в первом случае позволит выполнить сфинктеросохраняющие операции, а во втором даст возможность провести радикальное лечение больных с IV стадией РПК.
Выводы
Лечение пациентов сМ-РПК следует проводить в специализированных центрах, где возможно осуществить мультидисциплинарный подход.
Комбинированные (одноэтапные) резекции у больных с сМ-РПК позволяют достичь лучших результатов общей 3-летней выживаемости по сравнению с двухэтапными резекциями. Проведение радикального лечения путем одноэтапной операции улучшает качество жизни пациентов, уменьшает сроки стационарного лечения.
Комбинированные резекции, включающих удаление первичной опухоли и резекцию печени (
Расширенные резекции печени (>4 сегментов) могут выполняться с биологически допустимыми уровнями послеоперационных осложнений как при комбинированном, так и при этапном хирургическом подходе с условием соблюдения индивидуализации лечения.
Список использованной литературы
1. Стандарти діагностики та лікування онкологічних хворих. Накази МОЗ України № 544 від 17.09.07; № 645 від 30.07.10; № 247 від 29.04.11. (http://www.unci.org.ua/standarts1.html).
2. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011-2012. Захворюваність, смертність, виживаність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 14. 124 с.
3. Шатрова Н.А. (2012) Прогнозирование, профилактика и лечение несостоятельности толстокишечных анастомозов. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. 20 с.
4. Benoist S. (2007) Recommendations for clinical practice. Therapeutic choices for rectal cancer. How should rectal cancers with synchronous metastases be managed? Gastroenterol. Clin. Biol., 31: 1S75–1S80.
5. Boostrom S.Y., Vassiliki L.T., Nagorney D.M. et al. (2011) Synchronous rectal and hepatic resection of rectal metastatic disease. J. Gastrointest. Surg., 15(9): 1583–1588.
6. Catalano O.A., Singh A.H., Uppot R.N. et al. (2008) Vascular and Biliary Variants in the Liver: Implications for Liver Surgery. RadioGraphics, 28(2): 359–378.
7. Chiappa A., Bertani E., Makuuchi M. et al. (2009) Neoadjuvant chemotherapy followed by hepatectomy for primarily resectable colorectal cancer liver metastases. Hepatogastroenterology, 56: 829–834.
8. Dimitroulis D., Nikiteas N., Troupis T. et al. (2010) Role of surgery in colorectal liver metastases: too early or too late? World J. Gastroenterol., 16(28): 3484–3490.
9. Dupré A., Gagnière J., Chen Y., Rivoire M. (2013) Management of synchronous colorectal liver metastases. Bull. Cancer, 100(4): 363–371.
10. Folprecht G., Grothey A., Alberts S. et al. (2005) Neoadjuvant treatment of unresectable colorectal liver metastases: correlation between tumour response and resection rates. Ann. Oncol., 16(8): 1311–1319.
11. González H.D., Figueras J. (2007) Practical questions in liver metastases of colorectal cancer: general principles of treatment. HPB (Oxford), 9(4): 251–258.
12. Herman J., Messersmith W., Suh W.W. et al. (2010) ACR appropriateness criteria: rectal cancer-metastatic disease at presentation. Curr. Probl. Cancer, 34: 201–210.
13. Jones R.P., Jackson R., Dunne D.F.J. et al. (2012) Systematic review and meta-analysis of follow-up after hepatectomy for colorectal liver metastases. Br. J. Surg., 99(4): 477–486.
14. Jones R.P., Malik H.Z., Fenwick S.W., Poston G.J. (2013) Perioperative chemotherapy for resectable colorectal liver metastases: Where now? EJSO; 39(8): 807–811.
15. McKenzie S.P., Vargas H.D., Evers B.M., Davenport D.L. (2014) Selection criteria for combined resection of synchronous colorectal cancer hepatic metastases: a cautionary note. Int. J. Colorectal. Dis. [Epub ahead of print]. (http://www.ncbi.nlm.nih.gov/pubmed/24414017).
16. Minagawa M., Yamamoto J., Miwa S. et al. (2006) Selection criteria for simultaneous resection in patients with synchronous liver metastasis. Arch. Surg., 141(10): 1006–1012.
17. Nakano H., Oussoultzoglou E., Rosso E. et al. (2008) Sinusoidal injury increases morbidity after major hepatectomy in patients with colorectal liver metastases receiving preoperative chemotherapy. Ann. Surg., 247(1): 118–124.
18. Pavlidis T., Symeonidis N., Psarras K. et al. (2011) Current surgical management of colorectal cancer liver metastases. Hepatobiliary Pancreat Dis. Int.; 10: 243–247.
19. Adam R., Pascal G., Castaing D. et al. (2004) Tumor Progression While on Chemotherapy. A Contraindication to Liver Resection for Multiple Colorectal Metastases? Ann. Surg., 240(6): 1052–1064.
20. Rubbia-Brandt L., Audard V., Sartorelli P. et al. (2004) Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer. Ann. Oncol., 15(3): 460–466.
21. Sarah Y., Haddad R., Al-Sukhni W. et al. (2011) Synchronous rectal and hepatic resection of rectal metastatic disease. J. Gastrointest. Surg., 15: 1583–1588.
22. Slupski M., Wlodarczyk Z., Jasinski M. et al. (2009) Outcomes of simultaneous and delayed resections of synchronous colorectal liver metastases. Can. J. Surg., 52(6): E241–E244.
23. Vassiliou I., Arkadopoulos N., Theodosopoulos T. et al. (2007) Surgical approaches of resectable synchronous colorectal liver metastases: timing considerations. World J. Gastroenterol., 13(9): 1431–1434.
24. Viganò L., Karoui M., Ferrero A. et al. (2011) Locally advanced mid/low rectal cancer with synchronous liver metastases. World J. Surg., 35: 2788–2795.
25. Yoo P.S., Lopez-Soler R.I., Longo W.E., Cha C.H. (2006) Liver resection for metastatic colorectal cancer in the age of neoadjuvant chemotherapy and bevacizumab. Clin. Colorectal. Cancer, 6(3): 202–207.














Leave a comment