Аналіз цитогенетичних характеристик у хворих на платинорефрактерний рак яєчника
Дубініна В.Г., А.І. Рибін, Лисенко М.А., Кузнецова О.В.
Резюме. У статті розглянуто актуальне питання сучасної онкогінекології — прогнозування чутливості раку яєчника (РЯ) до платинової хіміотерапії. Автори провели порівняльний аналіз чутливості пацієнток із РЯ IIIA-IIIC стадії до ад’ювантної хіміотерапії препаратами платини залежно від наявності або відсутності цитогенетичних порушень. Для цього було проведено порівняльний аналіз 110 клінічних випадків РЯ IIIA-IIIC стадії. Пацієнткам виконано оптимальну або субоптимальну циторедуктивну операцію з подальшою ад’ювантною хіміотерапією препаратами платини. Виявлено різні варіанти фрагільних сайтів хромосом у хворих на РЯ. У групі хворих із платиночутливим РЯ відзначено такі фрагільні сайти хромосом: FRA(6)(q2.3–2.4), FRA(3)(p14–15), FRA(3)(q21), FRA (11)(q2.2–2.3), FRA (12)(q2.3–2.4). У групі хворих із платинорефрактерним РЯ спектр фрагільних сайтів був таким: (1)(p3.3–3.4), FRA(3)(q2.3–2.4), FRA(4)(q3.1–3.2), FRA(8)(q24), FRA(5)(q2.3–3.1), FRA(7)(q31–32), FRA(17)(q12–13). У досліджуваних групах не виявлено достовірної кореляції між стадією захворювання, клініко-анамнестичними характеристиками хворих на РЯ і чутливістю пухлини до препаратів платини. Також авторами відзначено достовірну позитивну кореляцію між наявністю цитогенетичних порушень у хворих на РЯ і чутливістю злоякісних пухлин яєчника до хіміотерапії препаратами платини. Цитогенетичні порушення трапляються достовірно частіше у хворих на платинорефрактерний РЯ.
 За даними Міжнародного агентства з вивчення раку (International Agency for Research on Cancer), щорічно у світі реєструють більше 165 тис. нових випадків раку яєчника (РЯ), і більше 100 тис. жінок гинуть від злоякісних новоутворень цієї локалізації. За рівнем смертності РЯ випереджає рак тіла та шийки матки, посідаючи 5-те місце серед причин смерті від усіх пухлин у жінок. Летальність хворих на РЯ на першому році після встановлення діагнозу становить 35%.
За даними Міжнародного агентства з вивчення раку (International Agency for Research on Cancer), щорічно у світі реєструють більше 165 тис. нових випадків раку яєчника (РЯ), і більше 100 тис. жінок гинуть від злоякісних новоутворень цієї локалізації. За рівнем смертності РЯ випереджає рак тіла та шийки матки, посідаючи 5-те місце серед причин смерті від усіх пухлин у жінок. Летальність хворих на РЯ на першому році після встановлення діагнозу становить 35%.
Проблема РЯ має величезне медико-соціальне значення. За зведеними даними популяційних ракових реєстрів країн Європи, 1-річна виживаність хворих на РЯ становить 63%, 3-річна — 41%, 5-річна — 35%.
На сьогодні золотим стандартом лікування РЯ IB–IIIC стадії є оперативне втручання з подальшим курсом післяопераційної хіміотерапії. При цьому препаратом вибору наразі (а на думку більшості вчених, і в найближчі 30–40 років) є препарати платини.
Незважаючи на те що РЯ належить до найбільш чутливих до хіміотерапії пухлин, у близько 40% пацієнток це захворювання є первинно-резистентним до платинової хіміотерапії. Навіть при виконанні оптимальної циторедуктивної операції й подальшому призначенні хіміотерапії препаратами платини (хіміотерапія першої лінії) з досягненням ефекту повної регресії й нормалізації рівнів пухлинних маркерів 5-річна виживаність хворих на РЯ III стадії становить 20–25%, а IV стадії — не перевищує 10%. Це означає, що, незважаючи на відсутність клінічних ознак захворювання, у більшості пацієнток у перші 2–3 роки після закінчення хіміотерапії першої лінії слід очікувати прогресування захворювання. Частота об’єктивного ефекту коливається в межах 10–25%, а медіана тривалості життя становить 7–18 міс [1, 3, 6, 8–10, 14].
Залежно від термінів прогресування хвороби прийнято розрізняти такі типи пухлин: платинорефрактерні (пухлини, що прогресують під час хіміотерапії першої лінії із включенням препарату платини), платинорезистентні (пухлини, що прогресують протягом 6 міс після закінчення хіміотерапії першої лінії із включенням препарату платини) і платиночутливі (пухлини, що прогресують більше ніж через 6 міс після закінчення хіміотерапії першої лінії) [1, 2, 4, 6, 11].
На сьогодні низка авторів показали вірогідну кореляцію між хромосомною нестабільністю та чутливістю аденокарциноми яєчника до хіміотерапіїї препаратами платини. При цьому хромосомна нестабільність характеризується значними генетичними змінами, зокрема вставками і втратами плечей хромосом та цілих хромосом [16, 21].
Мета цієї роботи — провести порівняльний аналіз чутливості РЯ IIIA–IIIC стадії до ад’ювантної хіміотерапії препаратами платини залежно від наявності або відсутності цитогенетичних порушень.
Об’єкт і методи дослідження
Із 2007 р. на базі відділення онкогінекології Одеського обласного онкологічного диспансеру та Університетської клініки Одеського національного медичного університету проведено порівняльний аналіз 110 клінічних випадків РЯ IIIA–IIIC стадії. У пацієнток виконано оптимальну або субоптимальну циторедуктивну операцію в обсязі пангістеректомії I типу, оментектомію з подальшою ад’ювантною хіміотерапією препаратами платини. У всіх випадках гістологічним варіантом РЯ була аденокарцинома.
Відбір хворих для дослідження здійснювали за принципом «випадок-контроль». Перед початком спеціального лікування всі пацієнтки пройшли анкетування з метою визначення клініко-анамнестичних характеристик захворювання та аналізу цитогенетичних характеристик. Критерієм розподілу хворих на групи обрано чутливість РЯ до препаратів платини.
Першу (основну) групу сформовано з 73 хворих із прогресуванням РЯ під час лікування препаратами платини. Другу (контрольну) групу — із 37 пацієнток із відсутністю прогресування або рецидиву захворювання під час лікування та протягом 6 міс після закінчення терапії препаратами платини. Дослідження проводили за схемою «випадок-контроль». Критерієм резистентності до препаратів платини була реєстрація рецидиву РЯ шляхом виконання комп’ютерної томографії органів малого таза, а також визначення рівнів СА-125 і НЕ4 у крові.
Забір крові для цитогенетичних досліджень проводили до оперативних втручань і терапії. Для культивування лімфоцитів периферичної крові використовували напівмікрометод [5]. Вирощування лімфоцитів виконували на середовищі 199, яке не містить фолатів і фолієвої кислоти, що є важливим при виявленні фрагільних сайтів хромосом. Рідкісні фрагільні сайти є фолатчутливими й можуть бути виявлені на середовищі, збідненому фолатами. Забарвлення препаратів здійснювали за методиками GTG та GAG.
Хромосомний аналіз проводили на системі каріотипування MetaSystems (Німеччина) із використанням програми Ikaros. Проаналізовано не менше 100 метафазних пластинок для кожної пацієнтки. Аналіз хромосом проводили згідно з критеріями ISCN [17], враховували хроматидні та хромосомні аберації, каріотипічно аномальні клітини, а також фрагільні сайти хромосом. Цитогенетично фрагільний сайт проявлявся як пробіл або неоднорідність у структурі хромосоми.
Отриманий цифровий матеріал піддавали статистичній обробці. Достовірними вважали розбіжності при р<0,05.
Результати дослідження та їх обговорення
Середній вік пацієнток становив 48±7,3 року й суттєво не різнився між групами (табл. 1).
Таблиця 1. Клінічна характеристика груп хворих
| Критерій | I група (основна) n=73 |
II група (контрольна) n=37 |
p | ||
| n | % | n | % | ||
| Професійні шкідливості | 50 | 68,5 | 21 | 63,6 | >0,05 |
| Порушення індексу маси тіла | 34 | 46,6 | 15 | 45,5 | >0,05 |
| Порушення менструального циклу | 40 | 54,8 | 16 | 48,9 | >0,05 |
| Обтяжений репродуктивний анамнез | 19 | 26,0 | 7 | 21,2 | >0,05 |
| Обтяжений генеалогічний анамнез | 11 | 15,1 | 29 | 78,4 | <0,05 |
| Супутня ендокринна патологія | 19 | 26,0 | 7 | 21,2 | >0,05 |
| Супутня патологія грудних залоз | 10 | 13,7 | 23 | 62,2 | <0,05 |
| Супутня патологія органів шлунково-кишкового тракту | 29 | 39,7 | 11 | 33,3 | >0,05 |
Аналіз клініко-анамнестичних характеристик пацієнток обох груп показав достовірну відсутність відмінностей за всіма досліджуваними показниками, окрім обтяженого генеалогічного анамнезу та наявності супутньої патології грудних залоз. Достовірно нижчі показники зазначених факторів в основній групі свідчать про взаємозв’язок спадкової схильності до виникнення й розвитку РЯ та чутливості пухлини до препаратів платини.
Таким чином, отримані дані є свідченням того, що досліджувані групи були сформовані рандомізовано й можуть бути порівнянними.
При цитогенетичному дослідженні метафазних пластинок лімфоцитів периферичної крові хворих обох груп відзначали збільшення кількості аберантних клітин у групі пацієнток із платинорефрактерним РЯ (31,2±2,2) порівняно з групою хворих із платиночутливим РЯ (15,1±5,0) (табл. 2).
Таблиця 2. Хромосомні зміни в лімфоцитах периферичної крові у хворих на РЯ
| Група(кількість обстежених) | Кількість метафаз | Аберантні клітини, % | Частота аберацій хромосомного типу, % | Частота аберацій хроматидного типу, % | Частота анеуплоїдії (гіпердиплоїдії), % |
| Основна група (73) | 7300 | 31,2±8,2 | 8,1±1,8 | 2,6±0,8 | 20,5±6,9 |
| Контрольна група (37) | 3700 | 15,1±5,0 | 4,2±1,3 | 1,5±0,6 | 9,4±2,5 |
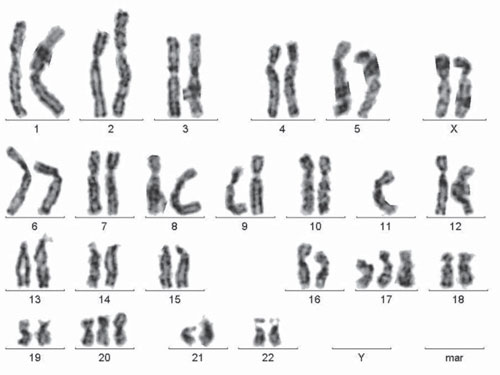
Рис. 1. Каріотип пацієнтки з платиночутливим РЯ: 47,ХХ; −11,+17,+20
Збільшення кількості аберантних клітин у групі жінок із платинорефрактерним РЯ відбувається за рахунок аберацій хромосомного типу й анеуплоїдії (рис. 1). Серед аберацій хромосомного типу переважають делеції ділянок хромосом, а також дицентрики. Анеуплоїдні клітини часто мають додаткові хромосоми невідомого походження. При злоякісних новоутвореннях нерідко відзначають хромосомну нестабільність не тільки в пухлинних клітинах, а й у лімфоцитах периферичної крові. Досліджуючи це явище, автори дійшли висновку, що, найімовірніше, відбувається трансформація геному лімфоцитів фрагментами пухлинної ДНК [7]. При дослідженні вільної циркулюючої пухлинної ДНК у крові пацієнток із РЯ виявлено, що у третини з них у крові наявна пухлинна ДНК, з чим пов’язане зниження виживаності хворих. Виявлено пухлиноспецифічну мутацію гена р53 у крові таких пацієнток [22].
Нарівні з мутаціями гена р53 мутації гена цикліну D1 також відіграють ключову роль у генетичній нестабільності пухлинних клітин. Зміна регуляції генів при переході з фази G1 у фазу S клітинного циклу є характерною для патогенезу більшості видів раку, зокрема РЯ. Циклін D1 є домінуючим регуляторним білком при проходженні клітинного циклу й клінічним провісником ризику розвитку РЯ. Активація протоонкогенів проходить унаслідок ампліфікацій, точкових мутацій генів, хромосомних мутацій (делеція, дуплікація, інверсія, транслокація) та геномних мутацій (анеуплоїдія, поліплоїдія). Цитогенетичними маркерами ступеня злоякісності новоутворень є плоїдність пухлинних клітин. Ступінь анеуплоїдії пухлинних клітин залежить від стадії пухлинного процесу. Із плоїдністю пухлини корелюють довготривалість безрецидивного періоду й загальна виживаність хворих.
Цитогенетичні зміни при РЯ різноманітні; найбільш часто трапляється делеція короткого плеча хромосоми 8(8р22–23), також делеції в регіонах 3р14, 17q21, 18q23, 6q25–27, 11q22–25, 7q31, 12p12, 12q23ter, 11p15, 7p, 5q13–21, 19q13, Xq11–12, 7q31, 8p22, 9p21, 9q34, 11p15, 17p13(p53), 17q12 (BRCA) [9].
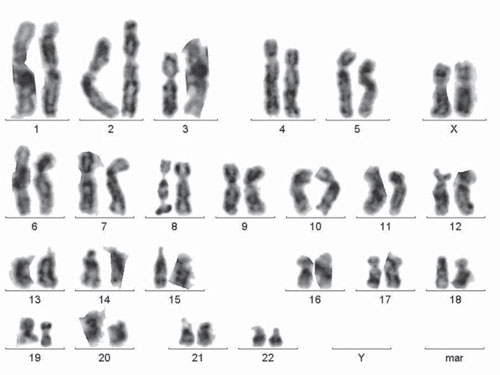
Рис. 2. Каріотип лімфоцитів периферичної крові хворої із платинорефрактерним РЯ: 46,ХХ; FRA(8)(q24)
У групі хворих із платиночутливим РЯ виявлено такі фрагільні сайти хромосом: FRA(6)(q2.3–2.4), FRA(3)(p14–15), FRA(3)(q21), FRA (11)(q2.2–2.3), FRA(12)(q2.3–2.4) (рис. 2). У групі хворих із платинорефрактерним РЯ спектр фрагільних сайтів був таким: FRA(1)(p3.3–3.4), FRA(3)(q2.3–2.4), FRA(4)(q3.1–3.2), FRA(8)(q24), FRA (5)(q2.3–3.1), FRA(7)(q31–32), FRA(17)(q12–13) (табл. 3).
Таблиця 3. Наявність фрагільних сайтів у групах пацієнток із РЯ
| Хромосомний фрагільний регіон | Класифікований фрагільний сайт | Локуси втрати гетерозиготності в пухлинах РЯ [15, 19] | Характеристика РЯ |
| 1p3.3–3.4 | – | – | ПР |
| 3p1.4–15 | FRA3B | 3p, 3p1.4 FHIT | ПЧ |
| 3q2.1 | FRA3F | – | ПЧ |
| 3q2.3–2.4 | – | ПР | |
| 4q3.1–3.2 | FRA4C | – | ПР |
| 5q3.1 | FRA5C | – | ПР |
| 6q2.3–2.4 | FRA6E | 6q2.4–2.7 | ПЧ |
| 7q3.1–3.2 | FRA7G | 7q3.1 | ПP |
| 8q2.4 | FRA8C | 8q2.2–2.3 | ПР |
| 11q2.2–2.3 | – | 11q22–23 | ПЧ |
| 12q2.3–2.4 | – | 12q23ter | ПЧ |
| 17q1.2–1.3 | – | 17q12–21 BRCA1 | ПР |
ПЧ – платиночутливі, ПР – платинорефрактерні.
Усі вищезазначені фрагільні сайти є загальними, такими, які виявляють в присутності мутагенних речовин (афідиколін тощо); рідкісних фрагільних сайтів у пацієнток із РЯ не знайдено. Сім виявлених нами фрагільних сайтів збігаються із класифікованими сайтами. Багато фрагільних сайтів збігаються за локалізацією з перебудовами хромосом у пухлинах яєчника, зокрема в пацієнток із РЯ у хромосомних регіонах 6q25–27, 3р14, 7q31, 12q23ter, 11q22–25, 17q12 виявлено фрагільні сайти.
Більшість фрагільних сайтів може бути індукована зовнішньосередовищними хімічними речовинами, включаючи кофеїн, алкоголь і компоненти сигаретного диму. Різноманітні поломки в регіонах фрагільних сайтів, асоційовані з виникненням раку, виявлені в людей, які зазнали впливу зазначених речовин. Багато генів локалізовані всередині або поблизу цих сайтів і є пухлинними супресорами чи онкогенами, причому фрагільні сайти є кращими мішенями для зовнішньосередовищних мутагенів і канцерогенів. Фактори спадкової схильності можуть змінювати силу впливу канцерогенів на організм і модулювати його відповідь на шкідливі фактори зовнішнього середовища. Взаємодія «ген-середовище» може виявитися критичним моментом у розвитку нестабільності геному й малігнізації, оскільки канцерогени сприяють індукції мутацій і викликають більше мутацій у тих клітинах, у яких така нестабільність уже існує.
Так, у регіоні 17q12 міститься ген BRCA. Цей регіон активно включається в хромосомні перебудови в пухлинах при РЯ, також у нього вбудовуються віруси. 90% генетичних порушень при РЯ становлять мутації генів BRCA1 та BRCA2 [10, 14]. У клітинах зі зниженою функцією BRCA підвищується частота анеуплоїдії, ампліфікації центросом та хромосомних аномалій, що підвищує їх чутливість до подальших мутацій [13].
Цитогенетично фрагільні сайти ідентифікують як пробіли або хромосомні розриви у певній частині метафазних пластинок. Фрагільні (ламкі) сайти являють собою ділянки ДНК із тандемними ди-, три-, тетра- і пентануклеотидними повторами (STRs), які формують незвичайні структури ДНК; такі експансії нуклеотидних повторів виникають у регіонах експресованих генів і викликають динамічні мутації, метилювання.
Загальні фрагільні сайти привертають велику увагу як такі, що сприяють ампліфікації. Збільшення копій генів при ампліфікації слугує однією з ознак генетичної нестабільності, яка демонструє селективні переваги пухлинної клітини. Розриви в регіонах фрагільних сайтів можуть ініціювати механізм, який відповідає за накопичення внутрішньохромосомних ампліконів у пухлинній клітині. Розриви у фрагільних сайтах можуть слугувати індикаторами для зупинки реплікації у пухлинних клітинах через мутації чи порушення в клітинному циклі.
Дослідження останніх років дозволяють зробити висновок про ключову роль генів, що містяться в регіонах фрагільних сайтів; більшість із них є генами — пухлинними супресорами, які є мішенями при ураженні геному й кодують білки, що захищають ДНК від пошкоджень. Загальні фрагільні сайти мають високий вміст АТ-повторів. Це протяжні регіони ДНК, в яких макромолекула може набувати форми структур із високою гнучкістю й низькою стабільністю. Тандемні повтори містять як мікросателіти, так і різні типи мінісателітів. АТ-острівці повторюваних послідовностей загальних фрагільних сайтів, крім усього іншого, відіграють роль матрикс-прикріплювальних регіонів (MARs). Хроматин здійснює заякорювання (прикріплення) ДНК до ядерного матриксу. АТ-острівці є пріоритетною мішенню для сильнодійних ДНК-алкілуючих протипухлинних препаратів. АТ-регіони можуть зв’язувати препарати, такі як бізелезин, талімустин та інші АТ-специфічні речовини.
Такі особливості фрагільних сайтів хромосом відкривають нові можливості в діагностиці й цільовій хіміотерапії онкологічних захворювань, зокрема РЯ. Незважаючи на те що фрагільні сайти безпосередньо не є мішенями для препаратів платини, їх використовують як маркери чутливості до цих препаратів [18, 20].
Дослідження генетичних маркерів платиночутливості при РЯ нечисленні, але дозволяють стверджувати про кореляцію окремих хромосомних перебудов у пухлинах з платиночутливістю при РЯ. Локалізація деяких із них збігається з виявленими нами фрагільними сайтами в лімфоцитах периферичної крові (3q2.3–2.4, 4q3.1–3.2, 8q2.4 та ін.). Відомо, що фрагільні сайти нестабільні в пухлинних клітинах, але в інших соматичних клітинах за наявності фрагільних сайтів такої нестабільності не відзначають. Загальні фрагільні сайти виявляються під впливом мутагенів в усіх соматичних клітинах, але саме в пухлинних клітинах найчастіше в цих регіонах локалізуються різноманітні хромосомні перебудови.
Виявлення деяких фрагільних сайтів хромосом у лімфоцитах периферичної крові з високою ймовірністю може бути прогностичним критерієм чутливості пухлин яєчника до препаратів платини.
При злоякісних новоутвореннях часто відзначають хромосомну нестабільність не тільки в пухлинних клітинах, а й у лімфоцитах периферичної крові. Найімовірніше, відбувається трансформація геному лімфоцитів фрагментами пухлинної ДНК.
Схильність до розвитку раку залежить від особливостей метаболізму канцерогенних речовин і здатності репарувати викликані ними ушкодження ДНК. Хромосомна нестабільність лімфоцитів периферичної крові у хворих на РЯ сигналізує про великі проблеми в організмі пацієнта, зокрема в імунній та/або репаративній системах. Кількість виявлених аберантних клітин в лімфоцитах периферичної крові в групі пацієнток із платинорефрактерним РЯ (31,2±8,2%) більш ніж удвоє перевищила цей показник у групі хворих на платиночутливий РЯ (15,1±5,0%).
Високий рівень хромосомної нестабільності в лімфоцитах периферичної крові в групі пацієнток із платинорефрактерним РЯ може свідчити про дуже серйозні порушення в імунній і репаративній системах та про несприятливий прогноз.
Висновки
Нами виявлено різні варіанти фрагільних сайтів хромосом у хворих на РЯ. У групі хворих із платиночутливим РЯ відзначено такі фрагільні сайти хромосом: FRA(6)(q2.3–2.4), FRA(3)(p14–15), FRA(3)(q21), FRA (11)(q2.2–2.3), FRA (12)(q2.3–2.4). У групі хворих із платинорефрактерним РЯ спектр фрагільних сайтів був таким: (1)(p3.3–3.4), FRA(3)(q2.3–2.4), FRA(4)(q3.1–3.2), FRA(8)(q24), FRA(5)(q2.3–3.1), FRA(7)(q31–32), FRA(17)(q12–13).
У досліджуваних групах не виявлено достовірної кореляції між стадією захворювання, клініко-анамнестичними характеристиками хворих на РЯ і чутливістю пухлини до препаратів платини.
Також відзначено достовірну позитивну кореляцію між наявністю цитогенетичних порушень у хворих на РЯ і чутливістю злоякісних пухлин яєчника до хіміотерапії препаратами платини. Цитогенетичні порушення трапляються достовірно частіше у хворих на платинорефрактерний РЯ.
Усі виявлені фрагільні сайти є загальними, 7 з них збігаються з класифікованими сайтами. Багато зі знайдених фрагільних сайтів збігаються за локалізацією з перебудовами хромосом у пухлинах яєчника.
Список використаної літератури
- Бохман Я.В. (2007) Лекции по онкогинекологии. МИА, Москва, 304 с.
- Важенин А.В., Жаров А.В., Шимоткина И.Г. (2010) Актуальные вопросы клинической онкогинекологии. СТРОМ, Москва, 128 с.
- Винокуров В.Л. (2009) Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. Фолиант, СПб., 333 с.
- Давыдов М.И., Ганцев Ш.Х. (2010) Онкология: учебник. ГЭОТАР-Медиа, Москва, 912 с.
- Захаров А.Ф., Бенюш В.А., Кулешов Н.П., Барановская Л.И. (1982) Хромосомы человека. Атлас. Медицина, Москва, 263 с.
- Козаченко В.П. (2005) Клиническая онкогинекология. Медицина, Москва, 376 с.
- Лихтенштейн А.В., Потапова Г.И. (2003) Генетические дефекты как маркеры опухолевого роста. Молекулярная биология, 37(2): 181–193.
- Онкология: национальное руководство (2008) Под ред.: В.И. Чиссова, М.И. Давыдова. ГЭОТАР-Медиа, Москва, 1072 с.
- Полищук Л.З., Несина И.П., Новак Е.Е. (2002) Рак яичника: генетические изменения и их связь с клиническими особенностями опухолевого процесса. Онкология, 4 (1): 9–14.
- Свінціцький В.С. (2010) Комплексне лікування хворих на злоякісні пухлини яєчника: автореф. дис. … д-ра мед. наук. Київ, 40 с.
- Урманчеева А.Ф., Тюляндина С.А., Моисеенко В.М. (2008) Практическая онкогинекология: избранные лекции. ТОММ, СПб., 400 с.
- Химиотерапия злокачественных новообразований (2008) Под ред.: Э.Чу и В.Т. де Вита (пер. с англ.). Практика, 447 с.
- Boulton S.J. (2006) Cellular function of the BRCA tumour-supressor proteins. Biochem. Soc. Trans., 34: 633–645.
- Fleming J.S., Beaugie C.R., Haviv I. (2006) Incescant ovulation, inflammation and epithelial ovarian cancerogenesis: Revisiting old hypothesis. Mol. Cell. Endocrinol., 247: 4–21.
- Lalwani N., Prasad S.R., Vikram R. et al. (2011) Histologic, molecular, and cytogenetic features of ovarian cancers: implications for diagnosis and treatment. Radiographics, 31(3): 625–646.
- Österberg L., Levan K., Partheen K. et al. (2009) Potential predictive markers of chemotherapy resistance in stage III ovarian serous carcinomas. BMC Cancer, 9: 368–374.
- Mitelman F. (2005) ISCN. An International System for Human Cytogenetic Nomenclature. Karger, Basel, 1–115.
- Nelson S.M., Ferguson L.R., Denny W.A. (2004) DNA and the chromosome — varied targets for chemotherapy. Cell & Chromosome, 3(2): 138–152.
- Osterberg L., Levan K., Partheen K. et al. (2010) Specific copy number alterations associated with docetaxel/carboplatin response in ovarian carcinomas. Anticancer Res., 30(11): 4451–4458.
- Prasad M., Bernardini M., Tsalenko A. et al. (2008) High definition cytogenetics and oligonucleotide aCGH analyses of cisplatin-resistant ovarian cancer cells. Genes Chromosomes Cancer, 47(5): 427–436.
- Soslow R.A. (2008) Histologic subtypes of ovarian carcinoma: an overview. Intern. J. Gynecol. Pathol., 27: 161–174.
- Swisher E.M., Wollan M., Mahtani S.M. et al. (2005) Tumor-specific p53 sequences in blood and peritoneal fluid of woman with epithelial ovarian cancer. Am. J. Obstet. Gynecol., 193: 662–667.
Анализ цитогенетических характеристик у больных платинорефрактерным раком яичника
Одесский национальный медицинский университет
Резюме. В статье рассмотрен актуальный вопрос современной онкогинекологии — прогнозирование чувствительности рака яичника (РЯ) к платиновой химиотерапии. Авторы провели сравнительный анализ чувствительности пациенток с РЯ IIIA–IIIC стадии к адъювантной химиотерапии препаратами платины в зависимости от наличия или отсутствия цитогенетических нарушений. Для этого было изучено 110 клинических случаев РЯ IIIA–IIIC стадии. Пациенткам выполнена оптимальная или субоптимальная циторедуктивная операция с последующей адъювантной химиотерапией препаратами платины. Выявлены различные варианты фрагильных сайтов хромосом у больных РЯ. В группе больных с платиночувствительным РЯ отмечены следующие фрагильные сайты хромосом: FRA(6)(q2.3–2.4), FRA(3)(p14–15), FRA(3)(q21), FRA(11)(q2.2–2.3), FRA(12)(q2.3–2.4). В группе больных с платинорефрактерным РЯ спектр фрагильных сайтов был таким: (1)(p3.3–3.4), FRA(3)(q2.3–2.4), FRA(4)(q3.1–3.2), FRA(8)(q24), FRA(5)(q2.3–3.1), FRA(7)(q31–32), FRA(17)(q12–13). В исследуемых группах не выявлено достоверной корреляции между стадией заболевания, клинико-анамнестическими характеристиками больных РЯ и чувствительностью опухоли к препаратам платины. Также авторами обнаружена достоверная положительная корреляция между наличием
цитогенетических нарушений у больных РЯ и чувствительностью злокачественных опухолей яичника к химиотерапии препаратами платины. Цитогенетические нарушения встречались достоверно чаще у больных платинорефрактерним РЯ.
рак яичника, лечение, платина, цитогенетические нарушения, фрагильные сайты.
Адреса:
Рибін Андрій Ігорович
65023, Одеса, Валіховський пров., 2
Одеський національний медичний університет
Тел.: (048) 720-26-17
E-mail: Andriy.Rybin@gmail.com














Leave a comment