Доцільність застосування доопераційної хіміопроменевої терапії в лікуванні хворих на резектабельний рак ободової кишки
Бондар Г.В.1, Башеєв В.Х.1, Костінський І.Ю.2, Семикоз Н.Г.3, Терен Т.І.4, Романчук В.Р.2
- 1Донецький національний медичний університет ім. М. Горького, Донецьк
- 2Івано-Франківський обласний онкологічний диспансер, Івано-Франківськ
- 3Донецький обласний протипухлинний центр, Донецьк
- 4Івано-Франківський національний медичний університет, Івано-Франківськ
За даними клінічного кооперованого дослідження за участю 90 хворих на резектабельний рак ободової кишки пропонується нове вирішення наукового завдання в онкології — розробка способу лікування раку ободової кишки І-ІІІ стадії, який передбачає застосування на доопераційному етапі хіміопроменевої терапії. Використання розробленого методу комплексного лікування резектабельного раку ободової кишки у разі поширення пухлинного процесу Т3-4N0M0 підвищує 5-річну виживаність на 13,33%, а також дозволяє уникнути місцевих рецидивів пухлини. Апробована комбінація застосування флуороурацилу й інтенсивно-концентраційного гамма-опромінення в неоад’ювантному режимі мала пряму девіталізуючу дію, забезпечивши IV і V ступінь лікувального патоморфозу у 46%, а ІІІ ступінь — у 25,58% випадків. Застосування неоад’ювантної хіміопроменевої терапії може бути рекомендоване для включення її до стандартів лікування хворих на рак ободової кишки.
Вступ
У лікуванні злоякісних пухлин ободової кишки за хірургічним методом зберігається провідна роль. Однак після радикального видалення пухлини протягом перших 3–5 років не менше 50% пацієнтів помирають внаслідок віддалених метастазів і рецидиву захворювання [3, 8]. Цей факт може свідчити про те, що на момент виявлення первинної пухлини у багатьох хворих уже були мікрометастази. Відомо, що можливість метастазування з’являється з початком ангіогенезу пухлини. Встановлено, що в регіонарній та периферичній крові хворих на рак ободової кишки (РОК) циркулюють ракові клітини, кількість яких зростає під час хірургічного втручання.
Виходячи із зазначеного пошук шляхів оптимізації лікування хворих на резектабельний РОК є актуальним. За мету роботи було покладено вивчення ефективності доопераційної хіміопроменевої терапії з використанням 5-денного курсу флуороурацилу з одночасною дистанційною гамма-променевою терапією.
Невелика кількість спостережень, а також відсутність чітких критеріїв відбору із застосуванням методу рандомізації не дозволили авторам зробити коректні висновки. Застосування хіміотерапії в ад’ювантному режимі має місце у клінічній практиці [7]. Проте узагальнених рекомендацій щодо необхідності застосування хіміотерапії в неоад’ювантному режимі не було прийнято [1, 4, 5 ].
За стандарт прийнято застосування при метастатичному ураженні регіонарних лімфатичних вузлів та поширення захворювання Т3-4, післяопераційної хіміотерапії [2]. Найбільш перспективним щодо підвищення ефективності лікування хворих на РОК ІІ–ІІІ стадії є застосування спеціальних антибластомних методів на доопераційному етапі. Цей висновок узгоджується із загальноприйнятими у світовій практиці реалізації головного онкологічного підходу до лікування — дотримання принципів абластики.
Мета дослідження — довести ефективність неоад’ювантної хіміопроменевої терапії (НХПТ) з використанням флуороурацилу та дистанційної променевої терапії для покращання віддалених результатів лікування у хворих на резектабельний РОК.
Матеріали і методи дослідження
Коопероване дослідження хворих на резектабельний РОК виконане на базах КЛПЗ «Донецький обласний протипухлинний центр» та Івано-Франківського обласного онкологічного диспансеру впродовж 7 років (2001–2008).
Діагностику та лікування хворих проводили відповідно до клінічного протоколу надання медичної допомоги хворим на РОК — наказу МОЗ України від 17.09.2007 р. № 554. Діагноз РОК встановлювали на підставі гістологічного дослідження біопсійного матеріалу пухлини, поширення об’ємного процесу за системою ТNM (2002) за 6-ю класифікацією Міжнародного протиракового товариства.
Проведено скринінг і рандомізацію хворих на РОК залежно від призначеного лікування: 1-ша група: хворі на резектабельний РОК, які отримували курс НХПТ з подальшим хірургічним лікуванням та ад’ювантною хіміотерапією (АХТ) за показаннями — 43 пацієнти; 2-га група: хворі на резектабельний РОК, яким проведено хірургічне лікування та АХТ за показаннями — 47 пацієнтів.
Критеріями включення у дослідження були первинно нелікований РОК з гістологічно підтвердженим діагнозом, І–ІІІ стадія захворювання; обов’язковою була письмова згода пацієнта у визначеному порядку на проведення апробованих методів лікування; вік старше 65 років, первинно множинне ураження товстої кишки; ускладнений перебіг РОК; супутня патологія, що суттєво впливає на стан хворого; віддалене проживання, що утруднює регулярне обстеження хворого. НХПТ хворих на РОК включала внутрішньовенне введення флуороурацилу (500 мг/м поверхні тіла) краплинно з тривалістю інфузії 2 год; через 4 год — сеанс передопераційного дистанційного гамма-опромінення пухлини дозами по 5 Гр. Блоки НХПТ виконувались щоденно 5 днів поспіль. При цьому хворий отримував до 5 г флуороурацилу та променеву терапію до сумарної дози 25 Гр. Оперативне втручання проводилося на 6-й день від початку НХПТ.
Потреба в АХТ оцінювалась після дослідження лімфатичних вузлів, отриманих під час оперативного втручання та інтраопераційного аналізу поширення первинного пухлинного процесу. Величина Т3-Т4 була показаннями до АХТ. Для АХТ застосовували флуороурацил та кальцію фолінат у режимі Mayo: 4 цикли стандартної хіміотерапії першої лінії — флуороурацил (450 мг/м) з 1-го по 5-й день у поєднанні з кальцію фолінатом (20 мг/м) внутрішньовенно струменево з 1-го по 5-й день з інтервалами між введеннями 3 тиж.
Результати дослідження та їх обговорення
Усього обстежено 90 хворих на РОК, середній вік становив 53,21±0,96 року.
Аденокарцинома була найпоширенішою серед злоякісних епітеліальних пухлин товстої кишки (88,89±3,45%) усіх ракових пухлин кишки. Найчастіше діагностували високо та помірно диференційовані форми аденокарциноми відповідно у 54,44±5,25 і в 24,44±4,53% пацієнтів 1-ї та 2-ї груп. Муцинозний рак визначався у 8,89±3,00% пацієнтів, а перснеподібноклітинний рак — у 2,22±1,55% хворих, зазвичай у осіб молодого віку. За гістологічною характеристикою пухлин вибірка пацієнтів обох груп є рівномірною.
Переважна локалізація пухлини у хворих 1-ї групи — це сигмоподібна кишка (65,12±7,27%), що достовірно частіше, ніж у 2-й групі (27,66±6,52%; р<0,001). У 16,28±5,63% хворих 1-ї групи об’ємний процес визначався у сліпій кишці проти 10,64%±4,50% пацієнтів 2-ї групи (р<0,05). Натомість у поперечній ободовій кишці та селезінковому куті пухлини діагностовано з майже однаковою частотою (6,98±3,89 і 6,38±3,56%) та (6,98±3,89 і 8,51±4,07%). Загалом у пацієнтів обох груп частіше діагностували пухлини сигмоподібної кишки (45,55±5,25%), сліпої кишки (13,33±3,58%) та висхідного відділу ободової кишки (12,22±3,45%). Пухлини інших відділів ободової кишки діагностовано достовірно рідше.
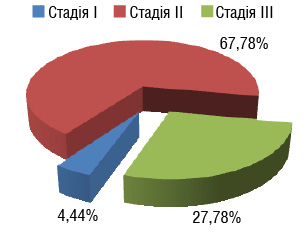
Питома вага пухлин, які проростали всі шари стінки кишки та поширювалася на вісцеральну очеревину, становила відповідно у 1-й групі 86,05±5,29 та 68,08±6,80% випадків. Поширення первинної пухлини в межах м’язової та субсерозної оболонок відзначали достовірно частіше у пацієнтів 2-ї групи (27,66±6,52% проти 9,30±3,21%; р<0,05). У переважної більшості пацієнтів обох груп на момент госпіталізації даних щодо ураження регіонарних лімфатичних вузлів (N0) не було (рис. 1): 1-ша група — 67,44±7,15% та 2-га група — 72,24±6,52% (р>0,05). У четвертини пацієнтів, які отримували НХПТ, виявили ураження лімфатичних вузлів уздовж регіонарних судин (23,26±6,44%), однак вірогідної відмінності від пацієнтів, оперованих без НХПТ, нами не встановлено.
Обсяг і характер хірургічного втручання з приводу РОК залежав від локалізації, стадії, наявності чи відсутності ускладнень хвороби, а також загального стану хворого.
Майже з однаковою частотою (таблиця) проводили правобічну геміколонектомію (36,67±5,08%) та резекцію сигмоподібної кишки (33,33±4,97%). У пацієнтів 1-ї групи частіше виконувалася резекція сигмоподібної кишки (у 51,17±7,62% випадків), а майже в половини пацієнтів 2-ї групи — правобічна геміколонектомія (46,81±7,28%). Лівобічна геміколонектомія була виконана у 16,67±3,93% хворих, у тому числі у 1-й групі — 6,97±3,86% і в 2-й групі — 25,53±6,36%. Майже з однаковою частотою виконана резекція поперечно-ободової кишки у пацієнтів обох груп: відповідно у 16,28±5,53% (1-ша група) та 10,64±4,50% випадків (2-га група).
| Вид операції | 1-ша група (n=43) |
2-га група (n=47) |
Усього(n=90) | |||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| Геміколонектомія зліва | 3 | 6,97±3,86 | 12 | 25,53±6,36 | 15 | 16,67±3,93 |
| Геміколонектомія справа | 11 | 25,58±6,65 | 22 | 46,81±7,28 | 33 | 36,67±5,08 |
| Резекція сигмовидної кишки | 22 | 51,17±7,62 | 8 | 17,02±5,48 | 30 | 33,33±4,97 |
| Резекція поперечно-ободової кишки | 7 | 16,28±5,53 | 5 | 10,64±4,50 | 12 | 13,33±3,58 |
| Усього | 43 | 100,00 | 47 | 100,00 | 90 | 100,00 |
Результати дослідження свідчать, що НХПТ не викликала суттєвого погіршення показників периферичної крові та функціонального стану печінки і нирок. Пацієнти 1-ї групи отримали стандартне радикальне лікування в такому ж обсязі та в терміни, як і пацієнти 2-ї групи, тобто компоненти запропонованої антибластичної терапії не ускладнили передопераційної підготовки. Отже, НХПТ була безпечною.
Ранній післяопераційний період у пацієнтів обох груп не мав достовірних клінічних та лабораторних відмінностей після операції.
За показаннями, враховуючи поширення пухлини, 41 хворому 1-ї групи та 45 хворим 2-ї групи проведено стандартну АХТ. За показниками гемограми суттєвих відмінностей у пацієнтів не виявлено. Після повного курсу АХТ незначно зростали показники цитолізу гепатоцитів, однак зміни мали тимчасовий характер, не потребували спеціальної медикаментозної корекції і не впливали на віддалені результати лікування.
Таким чином, НХПТ не лише забезпечувала принципи антибластики як компонента радикального лікування, але й була малотоксичною та безпечною, тобто її застосування не впливало на термін та обсяг оперативного лікування резектабельного РОК і перебіг раннього післяопераційного періоду.
Серед пацієнтів із резектабельним РОК обох груп спостерігалися ускладнення в ранній післяопераційний період. У пацієнтів 1-ї групи, які перед операцією отримували НХПТ, інтраопераційних ускладнень не було. В 1 пацієнта 2-ї групи перебіг операції ускладнився розривом капсули селезінки. Таке ускладнення зумовлене технічними труднощами, оскільки пухлина локалізувалась у ділянці селезінкового кута ободової кишки. Виявлено у 2 (4,65%) пацієнтів 1-ї групи та у 1 (2,13%) хворого 2-ї групи формування параколічного інфільтрату в ранній післяопераційний період. У 1 пацієнта 2-ї групи діагностували анастомозит через 8 днів після оперативного втручання, в подальшому накладено трансверзостому. Таке ускладнення, як неспроможність швів анастомозу, відзначалося відповідно у 2 випадках у 2-й групі хворих. В цілому у 95,35±3,21% пацієнтів 1-ї групи та у 89,36±4,50% пацієнтів 2-ї групи післяопераційний період минув без ускладнень.
Шляхом морфологічного дослідження РОК після застосування НХПТ виявлено виражені деструктивні зміни практично в усіх зонах пухлини при G1-G2, що в подальшому призводило до дифузного склерозу. Привертав увагу факт прогресивного зменшення об’ємної долі резидуальних ділянок пухлинної паренхіми, що мали морфологічні ознаки життєздатності в досліджуваному масиві диференційованих карцином [6].
За умови морфологічної структури пухлинної тканини за типом муцинозного, перснеподібноклітинного раку та недиференційованої аденокарциноми лікувальний ефект був мінімальним (поганим або несуттєвим) у кожному випадку.
Отже, за якісними і кількісними показниками лікувального патоморфозу, індукованого НХПТ, можна стверджувати, що при високо- та помірнодиференційованих аденокарциномах ободової кишки створюються реальні умови для абластики хірургічного втручання. Аналіз віддалених результатів лікування у хворих на резектабельний РОК після застосування різних способів радикального лікування продемонстрував задовільний рівень виживаності пацієнтів, включених у дослідження, порівняно з існуючими сучасними даними літератури.
Ретроспективна оцінка віддалених результатів у обстежених хворих свідчила, що 3 роки мали можливість прожити 80,40±6,24% хворих 1-ї групи та 78,20±6,11% хворих 2-ї групи; 5 років — відповідно 74,50±7,03% хворих 1-ї групи та 69,00±7,37% — 2-ї групи .
Аналіз показників віддаленої виживаності за групами демонструє практично повну їх ідентичність. З одного боку, це дозволяє стверджувати про відсутність негативних чинників для віддаленої виживаності при використанні НХПТ, з іншого боку, робить очевидним той факт, що доповнення оперативного втручання методами неоад’ювантного й ад’ювантного лікування не погіршує радикалізм втручання.
Серед 90 осіб із резектабельним РОК, залучених у дослідження, на момент аналізу матеріалу померли 25 (27,78%) пацієнтів. Залежно від виду застосованого лікування серед 43 пацієнтів, які отримували НХПТ, хірургічне лікування та, за потребою, АХТ, померли 10 (23,26%) хворих та серед пацієнтів 2-ї групи, пролікованих за схемою: хірургічне лікування та за потребою АХТ — померли 15 (31,91%) осіб.
У пацієнтів, які отримували доопераційний курс опромінення з одночасним введенням флуороурацилу, летальність мала пряму залежність від поширення первинної пухлини (Т) та наявності ураження регіонарних лімфатичних вузлів (N). Упродовж 1-го року помер 1 пацієнт 1-ї групи з характеристикою пухлинного процесу Т3-4N3M0. У 2-й групі впродовж 1-го року померли 2 хворих з пухлинним процесом (Т3-4) та ураженням регіонарних лімфатичних вузлів N3 відповідно. Смертність хворих прогресивно зростала з поширеністю первинного процесу, досягала максимуму при Т4, особливо на 2-му та 3-му році захворювання. Така ж залежність нами простежена при збільшенні метастатичного ураження регіонарних колекторів (критерій N).
Найвища виживаність спостерігалася при I стадії (T1-2N0M0), незалежно від отриманого лікування. За умов ІІА стадії при застосуванні НХПТ впродовж 5 років летальних випадків не спостерігалось, а при ІІВ стадії за цей період померли 5 хворих. У пацієнтів 2-ї групи, лікованих за схемою «радикальне хірургічне втручання + АХТ» при стадії ІІА виживаність становила 57,14±18,70%. Найнижча виживаність спостерігається при III стадії пухлинного процесу, однак слід відзначити, що цей показник не відрізняється від аналогічних даних літератури.
Простеживши залежність виживаності хворих на резектабельний РОК від гістологічної будови та ступеня диференціації, ми встановили, що у пацієнтів 1-ї групи при диференціації аденокарциноми помірного та високого ступеня виживаність становила 85,71±5,92%; слизоутворюючому раку — 20,00±17,89%; низько- і недиференційовані форми були представлені в 1 випадку, пацієнт помер до 2 років. У пацієнтів 2-ї групи відповідно при помірному та високому ступені диференціації аденокарциноми показник виживаності становив 72,22±7,47%; низько- і недиференційованих формах — 66,67±19,24% та при слизоутворюючому раку із 3 хворих 1 помер до 2 років, 2 пацієнти померли до 3 років. Одержані результати зайвий раз аргументують доцільність та безпеку НХПТ у хворих на резектабельний РОК молодого віку, з поширенням пухлинного процесу І–ІІВ стадії за умови виявлення диференційованої аденокарциноми. Цей метод дійсно підвищує абластичність лікування і шанс виживання хворих.
Дослідження показників безрецидивного періоду засвідчило, що у хворих зі ступенем поширення пухлинного процесу Т3-4N0M0 у 1-й групі в період спостереження до 1 року виживаність вища, ніж у 2-й групі на Δ 2,13%, через 2 роки — на Δ 6,22%, через 3 роки — на Δ 8,45% та через 5років — на Δ 13,33% (рис. 2).
Висновки
1. Запропонований новий метод лікування хворих на резектабельний РОК, який ґрунтується на застосуванні у ролі неоад’ювантних засобів введення флуороурацилу та променевої терапії з подальшим хірургічним лікуванням та за показаннями — проведення АХТ.
2. З’ясовано, що у пацієнтів, які отримали НХПТ, не виявлено суттєвого погіршення показників периферичної крові та функціонального стану печінки і нирок; радикальне лікування проведене в такому ж обсязі й термінах, як і пацієнтам, які отримали стандартне хірургічне лікування. Ранній післяопераційний період у пацієнтів обох груп не мав достовірних клінічних та лабораторних відмінностей. Усе це доводить безпеку застосування НХПТ у комплексному лікуванні хворих на резектабельний РОК.
3. Апробована комбінація флуороурацилу й гамма-терапії в неоад’ювантному режимі мала пряму девіталізуючу дію (IV–V ступінь лікувального патоморфозу) та спричинила при цьому незворотні зміни у тканинах, представлених високо- та помірнодиференційованою аденокарциномою (IV ступінь — у 34,87±7,27% та V ступінь — у 11,63±4,89%); у 25,58±6,65% хворих із високодиференційованою формою аденокарциноми встановлений ІІІ ступінь хіміопроменевого впливу. Шляхом патоморфологічного дослідження злоякісних пухлин ободової кишки та аналізу лікувального патоморфозу доведено ефективність неоад’ювантних методів терапії хворих на резектабельний РОК.
4. Виживаність хворих, які отримували НХПТ у разі диференціації аденокарциноми помірного та високого ступеня, становила 85,71±5,92%. У пацієнтів, у яких не було доопераційного лікування, відповідно при помірному та високому ступені диференціації аденокарциноми виживаність становила 72,22±7,47%. Передопераційне застосування НХПТ, радикального хірургічного і за показаннями — АХТ у хворих на резектабельний РОК зі ступенем поширення Т3-4N0M0 підвищує 5-річну виживаність (Δ 13,33%; р<0,05) порівняно із групою хворих аналогічного поширення, у яких проводили тільки хірургічне лікування та АХТ за показаннями.
ЛІТЕРАТУРА
1. Бердов Б.А., Евдокимов Л.В. (2003) Возможности лучевой терапии в комбинированом лечении рака ободочной кишки. VII Российская онкологическая конференция, Москва, 25–27 ноября 2003 г. Москва, с. 95–96.
2. Бондарь Г.В., Антипова С.В. (2009) Лекции по клинической онкологии. Луганская областная типография, Луганск, 585 с.
3. Бутенко З.А. (2000) Современные подходы к терапии рака. Онкология, 2(1): 141–143.
4. Федоренко З.П., Гулак Л.О., Горох Є.Л. та ін. (2009) Бюлетень національного канцер-реестру України. Київ, № 11, 123 с.
5. Вінник Ю.О., Чибісов Л.П. (2001) Безпосередні результати лікування хворих на рак прямої кишки з застосуванням неоад’ювантної хіміотерапії та променевої терапії. Клiн. хiрургiя, 1: 31–33.
6. Галахін К.О., Курик О.Г. (2000) Лікувальний патоморфоз злоякісних пухлин травного тракту. Книга-плюс, Київ, 176 с.
7. Колесник Е.А. (2009) Адъювантное лечение рака толстой кишки. Здоровье Украины, 1/2, с. 3–4.
8. Donald W. Kufe, Raphael E. Pollock, Ralph R. Weichselbaum et al. (2003) Holland-Frei Cancer Medicine, 6 ed. BC Decker, Hamilton – London, 2683 р.
Целесообразность применения дооперационной химиолучевой терапии в лечении больных резектабельным раком ободочной кишки
Донецкий национальный медицинский университет им. Максима Горького, Донецк
Ивано-Франковский национальный медицинский университет, Ивано-Франковск
Ивано-Франковский областной онкологический диспансер, Ивано-Франковск
Резюме. Согласно даным клинического кооперированого исследования с участием 90 больных резектабельным раком ободочной кишки представлено новое решение научной задачи в онкологи — разработка способа лечения рака ободочной кишки І–ІІІ стадии, который предусматривает применение на дооперационном этапе химиолучевой терапии. Использование разработанного метода комплексного лечения резектабельного рака ободочной кишки при распространении опухолевого процесса Т3-4N0M0 повышает 5-летнюю выживаемость на 13,33%, а также позволяет избежать возникновения местных рецидивов опухоли. Апробированная комбинация применения флуороурацила и интенсивно-концентрационного гамма-излучения в неоадъювантном режиме имела прямое девитализирующее действие, обеспечив IV и V степень лечебного патоморфоза в 46%, а III степень — в 25,58% случаев. Применение неоадъювантной химиолучевой терапии может быть рекомендовано для включения ее в стандарты лечения больных раком ободочной кишки.
рак ободочной кишки, неоадъювантная химиолучевая терапия.














Leave a comment