Хірургічне лікування хілярної холангіокарциноми: від часів Джеральда Клацкіна до нової ери комбінованих резекційних втручань
Тищенко А.М. 1, Скорый Д.И. 1, Смачило Р.М.1, Козлова Т.В. 1, Писецкая М.Э.1, Волченко И.В.1, Мангов А.В.2, Кульпина Е.А.2
- 1ГУ «Институт общей и неотложной хирургии НАМН Украины», Харьков
- 2Европейский радиологический центр, Харьков
Резюме. Холангіокарцинома (ХК) — первинна пухлина печінки, що розвивається з епітелію жовчних ходів. Займає друге місце у світі серед первинних злоякісних утворень печінки. Особливості локалізації та характер росту пухлини Клацкіна пояснюють низьку резектабельність (20–50%) і складність радикального хірургічного лікування. Мета роботи — детально висвітлити особливості патологічної анатомії та хірургічної тактики при лікуванні хворих на ХК, розповісти про власний досвід радикального лікування пацієнтів із пухлиною Клацкіна. За період 2011–2013 рр. у відділенні хірургії печінки, позапечінкових жовчних шляхів та підшлункової залози клініки ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» виконано 7 радикальних оперативних втручань з приводу пухлини Клацкіна. Резектабельність становила 58%. Усім пацієнтам виконано великі резекції печінки (4 та більше сегментів) в обов’язковому поєднанні з тотальною каудальною лобектомією. Летальність становила 14,2%. Загальна віддалена актуріальна виживаність: 1-річна — 85,8%, 3-річна — 42,8%. Агресивна хірургічна тактика в лікуванні ХК, що включає виконання розширених резекцій печінки в поєднанні з тотальною каудальною лобектомією, видаленням гепатикохоледоха, лімфодисекцією та, за необхідності, резекцією ворітних судинних структур, забезпечує найкращі результати терапії. Однак такі втручання слід виконувати лише в умовах спеціалізованих гепатобіліарних центрів із залученням мультидисциплінарної команди фахівців (хірургів-гепатологів, трансплантологів, онкологів, хіміотерапевтів, радіологів).
Резюме. Холангиокарцинома (ХК) — первичная опухоль печени, развивающаяся из эпителия желчных протоков. Занимает второе место в мире среди первичных злокачественных образований печени. Особенности локализации и характер роста опухоли Клацкина объясняют низкий процент резектабельности (20-50%) и сложность радикального хирургического лечения. Цель работы — подробно осветить особенности патологической анатомии и хирургической тактики при лечении больных с ХК, представить собственный опыт радикального лечения пациентов с опухолью Клацкина. За период 2011-2013 гг. в отделении хирургии печени, внепеченочных желчных протоков и поджелудочной железы клиники ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины» выполнено 7 радикальных оперативных вмешательств по поводу опухоли Клацкина. Резектабельность составила 58%. Всем пациентам выполнены обширные резекции печени (4 и больше сегментов) в обязательном сочетании с тотальной каудальной лобэктомией. Летальность составила 14,2%. Общая отдаленная актуриальная выживаемость: 1-летняя — 85,8%, 3-летняя — 42,8%. Агрессивный хирургический подход к лечению ХК, включающий выполнение расширенных резекций печени в сочетании с тотальной каудальной лобэктомией, удалением гепатикохоледоха, лимфодиссекцией и, при необходимости, резекцией воротных сосудистых структур, обеспечивает наилучшие результаты терапии. Тем не менее эти вмешательства следует применять лишь в условиях специализированных гепатобилиарных центров с привлечением мультидисциплинарной команды специалистов (хирургов-гепатологов, трансплантологов, онкологов, химиотерапевтов, радиологов).

Холангиокарцинома (ХК) — первичная опухоль печени, развивающаяся из эпителия желчных протоков. Данная патология занимает второе место в мире среди первичных опухолей печени. В западных странах основной причиной развития ХК является первичный склерозирующий холангит.
Японская группа по изучению рака печени выделила три основных типа ХК: нодулярный (массформирующий), инфильтративный и внутрипротоковый (папиллярный внутрипротоковый рост с формированием внутрипротоковых опухолевых тромбов) [1]. Кроме того, в зависимости от локализации ХК последнюю подразделяют на внутрипеченочную, дистальную (локализуется ниже пузырного протока) и хилярную, или воротную (локализуется в области конфлюэнса желчных протоков), которая получила название опухоли Клацкина.
Джеральд Клацкин (1910–1986 гг.) родился в Нью-Йорке в русской семье (рис. 1). Во время обучения в Университете Корнела (Cornell University) он проявлял большой интерес к изучению гистологии. В 1933 г. получил диплом врача, будучи лучшим студентом на своем курсе. В 1946 г. Д. Клацкин основал лабораторию, которая со временем стала известна как отделение по изучению гепатобилиарной системы. В 1965 г. он описал уникальные особенности ХК, поражающей бифуркацию правого и левого печеночного протоков, которая с тех пор и носит его имя.
В зависимости от региона заболеваемость холангиоцеллюлярным раком варьирует от 1 до 7 случаев на 100 000 населения [2, 3], из которых опухоль Клацкина является наиболее частым типом и составляет около 40–60% [4].
Гистологически опухоль Клацкина в большинстве случаев является высоко- или умеренно дифференцированной аденокарциномой с характерными для данного типа образований особенностями: медленным ростом, преимущественным лимфогенным и периневральным метастазированием, относительно поздним гематогенным метастазированием, лонгитудинальным и радиальным распространением вдоль протока и в глубину его стенки соответственно [5]. В связи с субэпителиальным ростом опухоли вдоль протока под внешне неизмененной слизистой оболочкой реальная распространенность опухолевых клеток может превышать макроскопически видимую на 5–10 мм, что значительно осложняет возможность получения «чистого» хирургического края [5, 6].
Единственным эффективным методом лечения пациентов с опухолью Клацкина является хирургический, а единственный способ достижения продолжительной выживаемости — обеспечение R0-резекции. С учетом особенности анатомического строения ворот печени хирургическое пособие представляет собой крайне сложную задачу, которая может быть решена лишь путем выполнения расширенной резекции печени с тотальной каудальной лобэктомией в одном блоке с гепатикохоледохом, широкой лимфодиссекцией и зачастую — резекцией воротной вены, печеночной артерии или проведения трансплантации печени (ТП).

Рис. 1. Джеральд Клацкин (1910–1986 гг.).
Фото из «The Yale Journal of Biology and Medicine»
1979; 52: 1–3
Ввиду сохраняющихся «по-старинке» взглядов многих врачей на бесперспективность данной категории пациентов и инертное развитие хирургической гепатологии в странах постсоветского пространства, высокой технической сложности диагностики, планирования и выполнения радикального оперативного вмешательства мы посчитали важным представить первый опыт радикального лечения пациентов с опухолью Клацкина в отделении хирургии печени, внепеченочных желчных протоков и поджелудочной железы клиники ГУ «Институт общей и неотложной хирургии (ИОНХ) им. В.Т. Зайцева НАМН Украины» и подробно осветить дискуссионные вопросы по данным мировой литературы.
Объект и методы исследования
За период 2011–2013 гг. в указанном выше отделении выполнено 7 радикальных оперативных вмешательств по поводу опухоли Клацкина. Мужчин было 2 (28,6%), женщин — 5 (71,4%); средний возраст больных составил 62,7±2,5 года.
Диагностическая и лечебная тактика. Все пациенты были обследованы в соответствии с алгоритмом, представленным на рис. 2. Пациентам проводили общеклинические, биохимические анализы, коагулограмму, применяли инструментальные методы исследования. В обязательном порядке для определения планируемого объема оперативного вмешательства выполняли магнитно-резонансную (МРТ) или спиральную компьютерную томографию (СКТ) с внутривенным контрастированием, холангиографию. Изучали характер поражения и его распространенность, признаки опухолевой инвазии в сосуды гепатодуоденальной связки, особенности артериальной, воротной и билиарной анатомии. У всех пациентов, независимо от объема и характера поражения, использовали методы билиарной декомпрессии — чрескожной чреспеченочной или назобилиарной. С целью профилактики печеночной недостаточности допустимым уровнем гипербилирубинемии в предоперационный период считали ≤50 мкмоль/л.
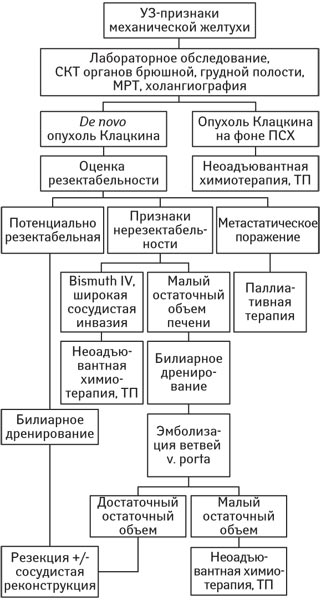
Рис. 2. Алгоритм диагностики и лечебной тактики. ПСХ — первичный склерозирующий холангит
В случае развития хилярной ХК на фоне первичного склерозирующего холангита мультидисциплинарная комиссия оценивала возможность выполнения неоадъювантной химиотерапии с последующей ТП.
Остальным пациентам по данным СКТ и МРТ выполняли планирование резекции. При потенциально резектабельных поражениях (объем планируемой резекции не более 60%) проводили оперативное вмешательство в плановом порядке. При планировании резекции в большем объеме, например трисекциоэктомии, в одном случае была выполнена эмболизация воротной вены с последующей оценкой остающегося объема печеночной паренхимы по данным компьютерной волюметрии. При достижении необходимых показателей проводили оперативное вмешательство, в противном случае оценивали возможность назначения неоадъювантной химиотерапии с последующей ТП.
При метастатическом распространении опухолевого процесса проводили паллиативную химиотерапию после билиарной декомпрессии.
Хирургическая техника. Для выполнения оперативных вмешательств использовали доступ типа «Mercedes». Холедох пересекали над верхним краем поджелудочной железы. В ходе удаления лимфоузлов (ЛУ) 12-й группы (ЛУ гепатодуоденальной связки) выделяли ствол и ветви печеночной артерии и воротной вены. Желчный проток остающейся части печени пересекали как минимум в 5 мм от видимого края опухоли. В обязательном порядке выполняли тотальную каудальную лобэктомию. После удаления препарата и достижения гемостаза формировали необходимое количество билиодигестивных анастомозов с петлей тонкой кишки, выключенной по Ру на транспеченочных дренажах.
Резекцию печени выполняли по стандартной методике с предварительной селективной деваскуляризацией. Для диссекции печеночной паренхимы применяли методы «Clamp crush» и ультразвуковой («Sonoca 300; Soring, Германия). Вне зависимости от используемых аппаратов в плоскости резекции разрушалась паренхима печени, при этом сосуды и протоки диаметром >1 мм оставались неповрежденными. Это давало возможность их дополнительно обрабатывать, для чего трубчатые структуры диаметром <1 мм коагулировали, 1–3 мм — клипировали и >3 мм — прошивали атравматической нитью, размер которой выбирали в зависимости от их диаметра.
Все резекции печени выполнены с учетом принципов малообъемной инфузионной терапии при низких значениях центрального венозного давления (0–50 мм водн.ст.). Методики диссекции сочетали с афферентной васкулярной эксклюзией печени в режиме 5–10–15 [7].
Все операции проводила одна команда хирургов, все члены которой, включая анестезиолога, прошли неоднократные стажировки в ведущих мировых центрах хирургии и ТП.
Статистическую обработку полученных результатов проводили методом вариационной статистики с помощью компьютерной программы Stat Plus 2009. Достоверность полученных данных составляла ≥0,95. Отдаленную актуариальную выживаемость вычисляли по методу Каплана — Мейера.
Результаты
За период 2011–2013 гг. в отделении хирургии печени, внепеченочных желчных протоков и поджелудочной железы клиники ГУ «ИОНХ им. В.Т. Зайцева НАМН Украины» выполнено 12 открытых оперативных вмешательств по поводу хилярной ХК, из них 7 — радикальных. Резектабельность составила 58%. Причинами эксплорации были канцероматоз, отдаленные метастазы. Согласно классификации Bismuth — Corlette IIIA тип зарегистрирован у 2 пациентов, IIIВ — у 4 и IV — у 1.
Объем выполненных оперативных вмешательств представлен в таблице. У всех пациентов проведены обширные резекции печени (4 и больше сегментов) в обязательном сочетании с тотальной каудальной лобэктомией.
Таблица. Характер оперативных вмешательств
| Объем резекции |
Количество пациентов | |
| n | % | |
| S1, 9, 2, 3, 4 | 4 | 57,1 |
| S1, 9, 5, 6, 7, 8 | 2 | 28,6 |
| S1, 9, 2, 3, 4, 5, 8 | 1 | 14,3 |
| Всего | 7 | 100,0 |
Средний объем интраоперационной кровопотери составил 697±152,7 мл, при этом трансфузия эритроцитарной массы в послеоперационный период проведена у 4 (57,1%) больных.
В ближайший послеоперационный период диагностированы следующие осложнения. Печеночная недостаточность (синдром малой печени) развилась у 3 (42,8%) больных. Причем в 2 случаях класса А и в одном — В, в соответствии с International Study Group of Liver Surgery. Желчеистечение по дренажу происходило у 2 (28,5%) пациентов, что не требовало ни в одном из случаев дополнительных вмешательств. Реактивный правосторонний плеврит мы расценивали не как осложнение, а как неотъемлемую реакцию на мобилизацию печени в послеоперационный период, которая возникла у 6 (85,7%) пациентов. В 4 случаях потребовалась плевральная пункция. Один пациент умер в результате прогрессирующей полиорганной недостаточности. Летальность составила 14,2%. Общая отдаленная актуриальная выживаемость: 1-летняя — 85,8%, 3-летняя — 42,8%.
В качестве наглядного примера мы решили представить клинический случай радикального лечения хилярной ХК.
Пациентка Т., 55 лет, госпитализирована в плановом порядке 21.10.2013 г. с жалобами на желтушность кожных покровов. Заболела за 20 сут до поступления, когда появилась желтушность. При амбулаторном ультразвуковом обследовании выявлено объемное образование в области портальных ворот печени, обтурирующее долевые протоки, в связи с чем пациентка направлена в клинику института.
Проведено обследование. Из особенностей лабораторных методов отмечено повышение уровня общего билирубина до 320 мкмоль/л преимущественно за счет прямой фракции, уровня АсАТ, АлАТ — в 2 раза и щелочной фосфатазы — в 10 раз. Уровень альбумина — в пределах нижней границы нормы. Остальные показатели — без существенных отклонений. По данным СКТ с контрастированием выявлена опухоль общего печеночного протока размером <1,5 см с распространением на левый долевой проток (рис. 3). Проток правой задней секции печени впадает в левый долевой проток на расстоянии >1,5 см от видимого края опухоли. Проток правой передней секции образует ствол правого долевого протока.
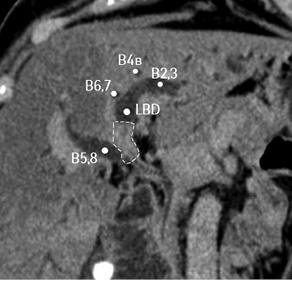
Рис. 3. СКТ печени пациентки с хилярной ХК IIIB типа по Bismuth — Corlette. В5,8 — проток правой передней секции; В6,7 — проток правой задней секции; В2,3 — проток левой латеральной секции; В4B — проток сегмента Sg4b; LBD — левый долевой проток. Пунктиром обозначена опухоль
Регионарные ЛУ не увеличены. Резко расширены внутрипеченочные желчные протоки. Данных об инвазии опухоли в воротную вену и печеночные артерии нет. Индивидуальные анатомические особенности: III тип артериальной анатомии по Michels (рис. 4), правая печеночная артерия отходит собственным стволом от верхнебрыжеечной артерии. I тип анатомии воротной вены по Covey. Вены II и III сегментов печени впадают изолированными стволами в нижнюю полую вену (рис. 5).
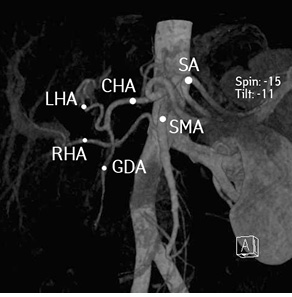
Рис. 4. Артериальная реконстукция сосудов гепатопанкреатобилиарной зоны. CHA — общая печеночная артерия; GDA — гастродуоденальная артерия; LHA — левая печеночная артерия; RHA — правая печеночная артерия; SA — селезеночная артерия; SMA — верхнебрыжеечная артерия
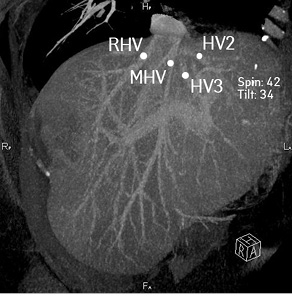
Рис. 5. Реконструкция эфферентных вен печени. HV2 — вена II сегмента печени; HV3 — вена III сегмента печени; MHV — срединная печеночная вена; RHV — правая печеночная вена
23.10.2013 г. выполнено наружное чрескожное чреспеченочное холангиодренирование правой доли печени (рис. 6, 7). Суточный дебит желчи по дренажу составлял 450–600 мл. В дооперационный период пациентка получала антибактериальную терапию. На фоне проводимого лечения отмечено регрессию гипербилирубинемии лишь до 102 мкмоль/л.
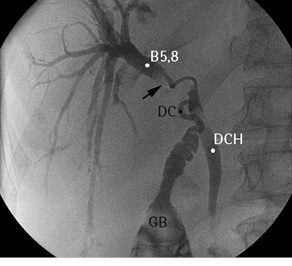
Рис. 6. Холангиограмма пациентки с хилярной ХК. B5,8 — проток правой передней секции печени; DC — общий печеночный проток; DCH — холедох; GB — желчный пузырь. Черной стрелкой обозначен дефект контрастирования (опухоль)
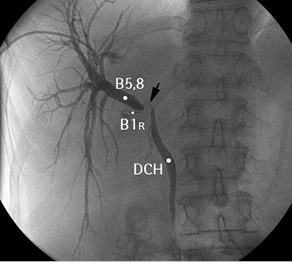
Рис. 7. Холангиограмма пациентки с хилярной ХК. B5,8 — проток правой передней секции печени; B1R — правый желчный проток хвостатой доли печени; DCH — холедох. Черной стрелкой обозначен дефект контрастирования (опухоль)
13.11.2013 г. проведено оперативное вмешательство: лапаротомия по типу «Mercedes», левосторонняя гемигепатэктомия, тотальная каудальная лобэктомия с удалением гепатикохоледоха и резекцией правого долевого протока, холецистэктомия, лимфодиссекция D2, бигепатикоеюностомия на выключенной по Ру петле, дренирование брюшной полости.
Ход оперативного вмешательства. Под эндотрахеальным наркозом произведена лапаротомия по типу «Mercedes». При ревизии брюшной полости опухолевых поражений печени и смежных органов не выявлено. Регионарные ЛУ не увеличены. Пальпаторно со стороны портальных ворот определяется опухоль рубцовой плотности, без четких границ, «замещающая» начальные отделы общего печеночного протока с распространением на долевые, преимущественно левые желчные протоки. Одиночный крупный конкремент желчного пузыря.
Желчный пузырь выделен из ложа, перевязана пузырная артерия, берущая начало от правой печеночной артерии. Дистально, над головкой поджелудочной железы пересечен холедох, прошит, перевязан. После дополнительной мобилизации гепатикохоледоха с перевязкой и пересечением нескольких коротких артериальных веточек, отходящих преимущественно от левой печеночной артерии, его культя вместе с желчным пузырем, клетчаткой и ЛУ отведена в сторону удаляемой левой доли печени (рис. 8). Левая печеночная артерия пересечена после отхождения a. gastroduodenalis (рис. 9). Выделены, прошиты и перевязаны левая долевая воротная вена и левая воротная вена хвостатой доли печени (рис. 10).
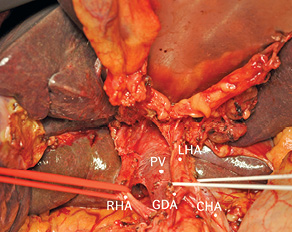
Рис. 8. Холедох пересечен у головки поджелудочной железы и вместе с клетчаткой, ЛВ и желчным пузырем отведен в сторону удаляемой части печени. CHA — общая печеночная артерия; GDA — гастродуоденальная артерия; LHA — левая печеночная артерия; PV — воротная вена; RHA — правая печеночная артерия
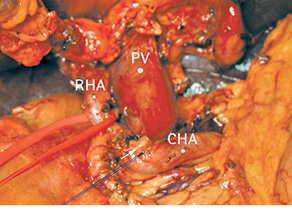
Рис. 9. Пересечена левая печеночная артерия (культя указана белой стрелкой). CHA — общая печеночная артерия; PV — воротная вена; RHA — правая печеночная артерия

Рис. 10. Пересечена левая долевая воротная вена (указана белой стрелкой) и левый стволик хвостатой доли (указан черной стрелкой). CHA — общая печеночная артерия; GDA — гастродуоденальная артерия; PV — основной ствол воротной вены; RHA — правая печеночная артерия; RPV — правая долевая воротная вена
Проток правой задней секции пересечен с максимально возможным отступлением от края опухоли (≈1 см). Для мобилизации левой доли печени рассечены печеночно-желудочная, серповидная, левая венечная и треугольная связки. Последовательно выделены, прошиты и пересечены вены II и III сегментов печени (рис. 11).
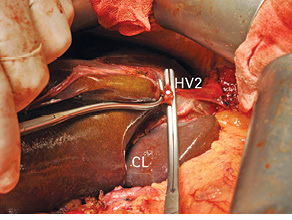
Рис. 11. Взята на зажимы вена II сегмента печени (HV2). CL — хвостатая доля
Выполнена диссекция паренхимы печени методом «Clamp crush» с последовательными «завариванием», перевязкой, клипированием, прошиванием и пересечением сосудисто-трубчатых структур в плоскости резекции. Для сваривания тканей использовали аппарат «Ligasure». В ходе диссекции отмечено вскрытие расширенных («блокированных») желчных протоков удаляемой левой половины печени с опорожнением застойной желчи. Окончательный устойчивый гемостаз раневой поверхности достигнут применением аргон-плазменного коагулятора. В 40 см от связки Трейца мобилизована петля тощей кишки по Ру, которая проведена через окно в брыжейке поперечно-ободочной кишки к устью правого печеночного протока. Сформирован однорядный (PDS 4/0) бигепатикоеюноанастомоз (проток правой передней секции печени B5,8 и правой задней В6,7) диаметром до 10 мм с сохранением транспеченочного билиарного дренажа, ранее установленного в желчных протоках правой передней секции печени. Этап формирования анастомоза и его окончательный вид представлены на рис. 12 и 13. В 50 см от билиодигестивного анастомоза наложен межкишечный анастомоз по типу бок в бок линейным сшивающим аппаратом. Ушиты дефекты в брыжейках. Дренированы околопеченочное (вдоль раневой поверхности), подпеченочное пространства и малый таз тремя силиконовыми трубками. Проведено послойное ушивание лапаротомной раны. Наложена асептическая повязка. Окончательный вид удаленного препарата представлен на рис. 14 и 15.
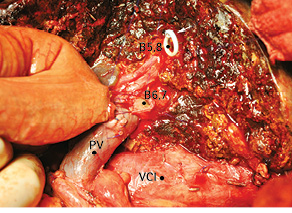
Рис. 12. Этап наложения гепатикоеюноанастомоза. B5.8 — проток правой передней секции печени; B6.7 — проток правой задней секции печени; PV — основной ствол воротной вены; VCI — нижняя полая вена
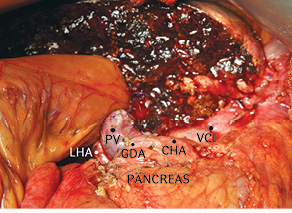
Рис. 13. Окончательный вид после операции. CHA — общая печеночная артерия; GDA — гастродуоденальная артерия; LHA — левая печеночная артерия; PV — основной ствол воротной вены; VCI — нижняя полая вена
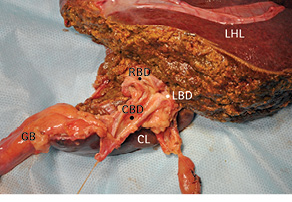
Рис. 14. Удаленный препарат. GB — желчный пузырь; CBD — общий печеночный проток; CL — хвостатая доля печени; LBD — левый и RBD — правый печеночный проток
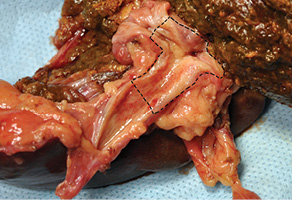
Рис. 15. Удаленный препарат. Опухоль обозначена пунктиром
Послеоперационный диагноз: хилярная ХК рT2bN0M0. Стадия II. Bismuth — Corlette IIIB. Острая механическая желтуха.
Обсуждение
Особенности локализации и характер роста опухоли Клацкина объясняют низкую резектабельность (20–50%) и сложность радикального хирургического лечения. Тем не менее в ведущих хирургических клиниках мира в течение последнего десятилетия отмечают существенный прогресс в ее лечении. Это обусловлено концепцией агрессивной хирургической тактики, выполнением обширных резекций печени, тотальной каудальной лобэктомии, широкой лимфаденэктомии и зачастую — резекции сосудов гепатодуоденальной связки и даже гепатопанкреатодуоденальной резекции. Сложившийся стойкий снобизм в хирургической общественности стран постсоветского пространства, предпочтения, основанные лишь на личном многолетнем опыте наших врачей, продиктовали необходимость осветить вопросы выбора оптимального объема хирургического лечения пациентов с хилярной ХК.
Резекция желчных протоков с опухолью. Впервые локальная резекция печеночных протоков с опухолью и наложением билатерального гепатикоеюноанастомоза успешно выполнена G. Brown в 1954 г. Как показали дальнейшие исследования, данная операция в чистом виде приводит к ранним рецидивам заболевания и развитию механической желтухи [9, 10]. По данным литературы, радикальности при локальной резекции желчных протоков удается добиться лишь в 25–27% случаев, а 1-годичная выживаемость составляет 5–10% [11, 12].
Тотальная каудальная лобэктомия. Современные анатомические исследования показали, что протоки хвостатой доли печени впадают непосредственно в область конфлюэнса, в связи с чем оказываются вовлеченными в опухолевый процесс практически в 100% случаев. Именно этот факт и объясняет причину локальных рецидивов при изолированной резекции желчных протоков с опухолью и диктует необходимость тотальной каудальной лобэктомии как неотъемлемого этапа радикального хирургического лечения.
Уникальная анатомия хвостатой доли предполагает применение определенных технических особенностей и подходов к ее удалению, которые являются часто несоизмеримыми с резекциями других печеночных сегментов. Крайняя скудность публикаций в отечественной литературе по данной теме побудила нас к освещению особенностей хирургической анатомии хвостатой доли печени.
Хвостатая доля печени является автономной анатомической структурой, которая классифицирована С. Couinaud (1981) как I сегмент печени. М. Kumon (1985) считается первым автором, который выделил субсегментарные участки в хвостатой доле: спигелиеву долю, которая соответствует I сегменту по классификации Couinaud, и собственно хвостатую долю, состоящую из паракавальной части и хвостатого отростка. Впоследствии С. Couinaud представил деление хвостатой доли на два субсегмента: левый (Il) и правый дорсальный (Ir), причем последний соответствовал паракавальной части по М. Kumon и был назван IX сегментом печени. При этом в представленных классификациях четкие границы между субсегментарными образованиями не выделены.
Анатомическим ориентиром, разделяющим спигелиеву долю (SgI) и паракавальную порцию (SgIX), является Аранциев канал. Он представляет собой венозную связку (ligamentum venosum Arantii), соответствующую облитерированной зародышевой вене, которая соединяет левую воротную вену с левой печеночной веной.
Выполнение каудальной лобэктомии возможно как в изолированном виде (тотальная каудальная лобэктомия), так и в сочетании с другими сегментами печени, наиболее часто с право- или левосторонней гемигепатэктомией.
На сегодня предложено четыре основных доступа к хвостатой доле. Левосторонний доступ (left-sided approach) применяют при небольших образованиях, расположенных в спигелиевой доле, или при выполнении тотальной каудальной лобэктомии в едином блоке с левой долей печени. Правосторонний доступ (right-sided approach) используют при локализации образований в хвостатом отростке или при выполнении тотальной каудальной лобэктомии в сочетании с правосторонней гемигепатэктомией. Билатеральный доступ (bilateral approach) — сочетание право- и левостороннего доступов — может быть применен как при изолированной тотальной каудальной лобэктомии, так и в сочетании с мезогепатэктомией. Передний транспеченочный доступ (аnterior transhepatic approach) выполняют в случаях, когда образование тесно прилегает к основным стволам печеночных вен, когда опухоль имеет большие размеры и находится в непосредственной близости от воротных структур и нижней полой вены. Данный метод предполагает разделение печени на левую и правую доли по линии Rex — Cantlie, что открывает доступ к верхним отделам хвостатой доли, особенно паракавальной порции, и обеспечивает необходимые условия для обработки ее афферентных трубчатых структур и безопасного отхождения от портальных и кавальных ворот печени.
Первое описание резекции I сегмента печени с расширенной левосторонней гемигепатэктомией по поводу хилярной ХК осуществлено L.H. Blumgart и соавторами в 1979 г. [13]. Y. Nimura в 1990 г. сообщил о 46 радикальных резекциях хвостатой доли печени, при этом в 44 случаях микроскопически выявлено вовлечение в опухолевый процесс желчных протоков или паренхимы хвостатой доли [14].
Комбинированная резекция печени +S1,9 в одном блоке с желчными протоками. Впервые левостороннюю гемигепатэктомию выполнили S. Mistilis и L. Schiff в 1962 г. по поводу хилярной ХК с распространением на левые желчные протоки. Уже через 3 года T. Kajitani и соавторы сообщили о проведении правосторонней гемигепатэктомии с резекцией воротной вены. Реконструктивный этап операции состоял в формировании гепатикоеюноанастомоза и проксимального портокавального шунта методом конец в бок. Пациент прожил 3 года 11 мес с нормальной функцией печени без печеночной энцефалопатии и умер от рецидива заболевания.
В 1995 г. M. Nagino и Y. Nimura разработали и успешно применили еще один вид операции при раке внепеченочного желчного протока — центральную бисегментэктомию (резекция IV, V и VIII сегментов) в сочетании с тотальной каудальной лобэктомией печени [15]. Для пожилых и ослабленных больных Y. Kawarada и B. Chandra (2000) предложили щадящий вид резекции печени при раке данной локализации — резекцию IVа, V и I сегментов (типа «Тадж Махал») с хорошими ближайшими результатами на момент публикации [16].
В настоящее время тактику комбинированной резекции внепеченочных желчных протоков в сочетании с резекцией печени и тотальной каудальной лобэктомией используют большинство ведущих мировых центров хирургии и ТП [17–19]. Применение обширных резекций печени позволило расширить показания к радикальным операциям и улучшить отдаленные результаты выживаемости. По данным ведущих центров, такой подход к лечению хилярной ХК позволяет достичь 70% резектабельности, а 5-летняя выживаемость составляет 20–40%
Факторами плохого прогноза хирургического удаления опухоли является ее низкая дифференцировка, метастазирование в паренхиму печени и регионарные ЛУ, а также R1-резекция. Инвазия опухолью воротной вены и печеночной артерии не является противопоказанием к выполнению резекции, более того, операция на воротной вене зачастую является стандартной процедурой для достижения безопухолевых границ резекции, поскольку инвазия воротной вены не ухудшает прогноз. Вовлечение же печеночной артерии ухудшает отдаленные результаты лечения, что обусловлено периневральным распространением опухоли.
Заключение
Агрессивный хирургический подход к лечению хилярной ХК, включающий выполнение расширенных резекций печени в сочетании с тотальной каудальной лобэктомией, удалением гепатикохоледоха, лимфодиссекцией и, при необходимости, резекцией воротных сосудистых структур, обеспечивает наилучшие результаты лечения. Тем не менее эти вмешательства следует применять лишь в условиях специализированных гепатобилиарных центров с привлечением мультидисциплинарной команды специалистов (хирургов-гепатологов, трансплантологов, онкологов, химиотерапевтов, радиологов).
Список использованной литературы
1. Nimura Y., Kamiya J., Kondo S. et al. (2000) Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience. J. Hepatobiliary Pancreat. Surg., 7: 155–62.
2. Shaib Y., El-Serag H.B. (2004) The epidemiology of cholangiocarcinoma. Semin. Liver Dis., 24: 115–125.
3. Nathan H., Pawlik T.M., Wolfgang C.L. et al. (2007) Trends in survival after surgery for cholangiocarcinoma: a 30-year population-based SEER database analysis. J. Gastrointest. Surg., 11: 1488–1496.
4. Groen P.C., Gores G.J., La Russo N.F. et al. (1999) Biliary tract cancers. N. Engl. J. Med., 341: 1368–1378.
5. Childs T., Hart M. (1993) Aggressive surgical therapy for Klatskin tumors. Am. J. Surg., 165 (5): 554–557.
6. Belina F. (2013) Hilar cholangiocarcinoma (Klatskin tumor) — current treatment options. Rozhl. Chir., 92(1): 4–15.
7. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 13: 124 с.
8. Бойко В.В., Писецкая М.Э., Тищенко А.М. и др. (2013) Роль предварительной ишемической подготовки в возникновении ишемически-реперфузионного повреждения печени в эксперименте. Клінічна хірургія, 5: 72–76.
9. Nimura Y., Nagino M., Kamiya I. et al. (1998) Aggressive surgical treatment of hilar cholangiocarcinoma. Hep. Bil. Pancr. Surg., 5: 52–61.
10. Iwasaki Y., Okamura T., Ozaki A. et al. (1986) Surgical treatment for carcinoma at the confluence of the majorhepaticducts. Surg. Gynecol. Obstet., 162: 457–464.
11. Timm S., Gassel H.J., Thiede A. (2007) Surgical therapy of proximal extrahepatic bile duct tumors (Klatskin tumors). Zentralbl. Chir., 132(4): 328–335.
12. Ewing H., Sali A., Kune G.A. (1989) Klatskin tumours: a 20 year experience. Aust. N. Z. J. Surg., 59(1): 25–30.
13. Blumgart L.H., Drury J.K., Wood C.B. (1979) Hepatic resection for trauma, tumour and biliary obstruction. Brit. J. Surg., 66: 762–769.
14. Nimura Y., Hayakawa N., Kamiya J. et al. (1990) Hepatic segmentectomy with caudate lobe resection for bile duct carcinoma of the hepatic hilus. World J. Surg., 14: 535–544.
15. Nagino M., Nimura Y., Kamiya I. et al. (1995) А cholangiocellular carcinoma radically resected by hepatic bisegmentectomy with en block resection caudate lobe extrahepatic bile duct. Hep. Bil. Pancr. Surg., 2: 72–76.
16. Kawarada Y., Chandra B. (2001) Less invasive hepatectomy for hilar bile duct carcinoma. Анн. Хир. Гепатол.. 6(1): 14–18.
17. Lee S.G., Song G.W., Hwang S. et al. (2010) Surgical treatment of hilar cholangiocarcinoma in the new era: the Asan experience. J. Hepatobiliary Pancreat. Sci., 17: 476–489.
18. Igami T., Nishio H., Ebata T. et al. (2010) Surgical treatment of hilar cholangiocarcinomain the «new era»: the Nagoya University experience. Hepatobiliary Pancreat. Sci., 17: 449–454.
19. Neuhaus P. et al. (2012) Oncological superiority of hilar en bloc resection for the treatment of hilar cholangiocarcinoma. Ann. Surg. Oncol.; 19 (5): 1602-1608.
Адрес:
Скорый Денис Игоревич
61166, Харьков, ул. Академика Ляпунова, 26А
ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины»
Тел.: (057) 702-09-71 (дом.);
(057) 349-41-20 (раб.);
050-343-90-26; 096-424-38-37 (моб.)
E-mail: sden16@mail.ru














Leave a comment