Фармакоекономічні особливості застосування протипухлинних лікарських засобів при раку передміхурової залози
Зіменковський А.Б.1, Заяць М.М.1, Зайцев В.І.2
- 1Львівський національний медичний університет імені Данила Галицького
- 2Буковинський державний медичний університет, Чернівці
Резюме. Проведено фармакоекономічний аналіз застосування протипухлинних лікарських засобів — агоністів лютеїнізуючого гормону — рилізинг-гормону у хворих на рак передміхурової залози, виконано оцінку економічних витрат. Фармакоекономічний аналіз «Сost — Еffectiveness Аnalysis» (СЕА) дав можливість оцінити одночасно як ефективність, так і вартість фармакотерапії, а також визначити економічні переваги у грошовому еквіваленті того чи іншого препарату за допомогою показника CER (Сost — Еffectiveness Ratio), вираженого в однакових одиницях для всіх досліджуваних об’єктів та вимірюваного у грошовому еквіваленті (у нашому випадку — в гривнях).

Вступ
Рак передміхурової залози (РПЗ) був і залишається однією з найгостріших проблем сучасної урології, незважаючи на революційні зміни в його діагностиці та лікуванні за останні десятиліття. Цю пухлину й досі найчастіше діагностують у дорослих чоловіків в Європі — у 2012 р. РПЗ становив 30% (417 000 хворих) від усіх нових випадків. Його розповсюдженість значно варіює (у десятки разів!) в різних країнах і на різних континентах, сягаючи максимуму на півночі Європи та Америки, мінімуму — в Азійсько-Тихоокеанському регіоні. Так, найвищий рівень захворюваності на 100 тис. населення в 2008 р. відзначали у США (118,2), Новій Зеландії (104,4), Швеції (97,0), Канаді (96,6), Фінляндії (95,2), а найнижчий — в Індії та Таїланді (4,4), Кореї (9,6), Китаї (12,0), Японії (15,1). В Україні в 2012 р. діагностовано 7512 нових випадків РПЗ, тоді як у 2001 р. цей показник був приблизно вдвічі меншим і становив 4837 осіб. Захворюваність на РПЗ у 2012 р. сягала 16,5 на 100 тис. населення [1–3].
Останнім часом досягнуто суттєвого прогресу в лікуванні онкологічних захворювань, а з 1971 р. арсенал лікарських засобів (ЛЗ) для боротьби з цими хворобами потроївся. Завдяки новим препаратам, порівняно з 1975 р., 1- і 5-річна виживаність при раку підвищилася на 50–60% (дослідження д-ра Френка Ліхтенберга, Колумбійський університет США, 2004 р.). У США в 1992–1999 рр. реєстрували 44% зростання 5-річної виживаності хворих онкологічного профілю завдяки застосуванню препаратів, «молодших» 1990 р., а у 20 країнах Європи та Північної Америки в 1995–2003 рр. застосування нових препаратів призвело до 30% зниження смертності від раку [4].
Зараз при локалізованих формах РПЗ радикальна простатектомія та дистанційна променева терапія чи брахітерапія є тими методами, які продемонстрували перевагу у виживаності порівняно з консервативним лікуванням. Водночас паліативна гормональна терапія (ГТ) є стандартним лікуванням першої лінії для пацієнтів із місцево-розповсюдженим, розповсюдженим та метастатичним, рецидивним або прогресуючим РПЗ і включає хірургічну чи медикаментозну кастрацію, протиандрогенну терапію чи поєднання обох методів [5].
Основою для ГТ РПЗ стало відкриття у 40-х роках минулого століття залежності росту пухлини від андрогенів: вони не ініціюють злоякісне переродження тканини передміхурової залози, але їхня наявність є необхідною умовою прогресування утворення на стадії гормонально залежного росту (автори отримали Нобелівську премію) [6]. Історично золотим стандартом ГТ була та залишається орхідектомія, яка призводить до швидкого, глибокого, тривалого і незворотного пригнічення вироблення тестостерону. На основі доступних у 70-х роках методів визначення кастраційного рівня сироваткового тестостерону значення 50 нг/дл вважали стандартним, його використовували в реєстраційних дослідженнях [7]. З появою більш чутливих методик стало відомо, що після хірургічної кастрації досягається рівень тестостерону <20 нг/дл [8].
Принциповим моментом при визначенні ефективності ГТ РПЗ є адекватне пригнічення виділення тестостерону, докази клінічної значущості якого продемонстровано в дослідженні J. Morote та співавторів [9]. Так, виживаність у середньому становила 106 міс у пацієнтів з рівнем тестостерону <20 нг/дл, 90 міс — з рівнем 20–50 нг/дл та 72 міс — з рівнем >50 нг/дл (р=0,0207). Одночасно виявлено, що середня виживаність без прогресування була значно вищою у пацієнтів із несподіваним зростанням рівня тестостерону, але <32 нг/дл, і становила 137 міс, тоді як у хворих, в яких непередбачуване підвищення рівня тестостерону >32 нг/дл, — 88 міс (р<0,03) [9].
Найбільш розповсюдженою альтернативою орхідектомії є застосування аналогів лютеїнізуючого гормону — рилізинг-гормону (ЛГ-РГ) гіпофіза. Усе більше хворих (75–80%) вибирають саме цей варіант лікування [10]. На його користь свідчать і недавно опубліковані дані про те, що якість життя та психосоціальний статус (за даними опитувальника Functional Living Index: Cancer) пацієнтів після медикаментозної кастрації (агоністи ЛГ-РГ) достовірно вищі, ніж після хірургічної, вже після 6 міс терапії [11].
Враховуючи те, що таке лікування проводиться пожиттєво, важливим аспектом комплаєнтності пацієнта (а значить, і ефективності лікування), особливо в Україні, є вартість препарату. Незважаючи на існування державної програми забезпечення ЛЗ для лікування онкологічних захворювань, на практиці її фінансування не відповідає сучасним потребам. Крім того, слід зауважити, що відсоток пацієнтів, які підлягають ГТ, в Україні значно вищий, ніж у розвинених країнах, за рахунок більшої кількості занедбаних випадків, при яких і показано в першу чергу використання ГТ. Так, в Україні у менше ніж половини пацієнтів РПЗ діагностують на ранніх стадіях, тому важко переоцінити важливість фармакоекономічної складової, що є елементом вибору оптимальної схеми лікування як для лікаря, так і для пацієнта, а також визначення критеріїв для прийняття рішень щодо підходів до терапії РПЗ на національному рівні.
Загалом, жодна країна у світі не забезпечує 100% потреб системи охорони здоров’я (ВООЗ, 2009–2013). Аналіз економічної ефективності є допоміжним інструментом у прийнятті рішень, який ідентифікує економічно найбільш ефективну медичну технологію чи ЛЗ для досягнення очікуваного результату при їх застосуванні (фармакотерапія — ФТ) [12]. Одним з ефективних інструментів, який дозволяє визначити вартість різних медичних технологій та забезпечити їх раціональний вибір, є фармакоекономічний аналіз. При цьому проводять порівняння прямих і непрямих витрат. До перших належать видатки, пов’язані з наданням медичної допомоги (у тому числі витрати на ліки), кошти, витрачені на оплату роботи персоналу тощо. Непрямі витрати — це соціальна допомога пацієнтам, витрати у сфері виробництва в результаті непрацездатності, інвалідності тощо [13]. Згідно з умовами фармакоекономічного аналізу, якщо визначити непрямі витрати неможливо, то слід враховувати лише прямі або тільки їх частину (кошти, витрачені на ліки).
Як критерії ефективності можна використовувати різні показники: прямі клінічні ефекти (зміна фізіологічних і біохімічних параметрів — показників артеріального тиску, гемоглобіну та ін., на які спрямована дія ЛЗ; усунення симптомів і синдромів захворювання; втрата або відновлення функцій органів та систем); опосередковані клінічні ефекти (зниження частоти ускладнень, скорочення кількості повторних госпіталізацій тощо); зміну показників здоров’я в групі, на яку спрямована дія медичного втручання (смертність, виживаність, тривалість життя, інвалідизація, кількість збережених років без інвалідності тощо); зміну якості життя, зумовленої здоров’ям (наприклад, кількість збережених років якісного життя — QALY) [14].
Поняття фармакоекономіки не стосується лише власне вартості ЛЗ. До уваги слід брати всі головні питання, пов’язані з лікуванням. Це перш за все загальна ефективність ЛЗ, наявність та інтенсивність побічних ефектів (ПЕ), а при тривалому лікуванні — і ризик виникнення поступового зниження ефекту терапії (звикання) та ін. Усі ці аспекти також безпосередньо впливають на комплаєнс пацієнта і на загальний результат терапії.
І, нарешті, ще одним важливим моментом є частота ПЕ, які, з одного боку, вимагають додаткового лікування, а з іншого — призводять до припинення прийому ЛЗ та зниження ефективності його дії. Таким чином, виділені пункти є головними для фармакоекономічного дослідження застосування цієї групи препаратів у пацієнтів із РПЗ.
Основним аспектом ефективності агоніста ЛГ-РГ, безумовно, є здатність ЛЗ адекватно та надійно знижувати рівень тестостерону. Як зазначено вище, кастраційний рівень тестостерону має становити <20 нг/дл і не має підвищуватися під час лікування. У зв’язку з підтвердженням доцільності застосування ЛГ-РГ при терапії хворих на РПЗ з’явилися такі синтетичні агоністи, як бусерелін, гозерелін, лейпрорелін, трипторелін, з часом було удосконалено форми випуску та винайдено депо-форми ЛЗ, які здатні виділяти контрольовану дозу діючої речовини протягом певного проміжку часу (1-, 3-, 6-, 12-місячні депо-форми). Аналіз існуючих даних свідчить, що при застосуванні більш ранніх представників ЛГ-РГ у 2–12,5% пацієнтів не вдається досягнути навіть рівня тестостерону 50 нг/дл, у 13–46% — рівня 20 нг/дл, а у 4–12,5% пацієнтів повторні ін’єкції призводять до відстроченого підвищення вмісту тестостерону, що спричиняє зниження ефективності лікування.
Загалом питанням фармакоекономіки останнім часом приділяють все більше уваги. На жаль, публікацій стосовно цього варіанта лікування у вітчизняній літературі ми не знайшли, але за кордоном фармакоекономіку застосування ЛГ-РГ при РПЗ висвітлюють у багатьох роботах. Російські автори [15] брали до уваги вартість ЛЗ, витрати на візити до лікаря та необхідність прийому додаткового препарату для лікування приливів, які є типовим ПЕ для цієї групи агоністів ЛГ-РГ (табл. 1).
Таблиця 1. Середня вартість річного курсу лікування різними агоністами ЛГ-РГ у Росії
| Препарати |
Річна вартість лікування (лише препарати), руб. |
Річна загальна вартість лікування (у тому числі УПЕ*+ візити), руб. |
| Елігард (6-місячний) | 57 184 | 61 883 |
| Елігард (3-місячний) | 76 861 | 85 910 |
| Гозерелін (3-місячний) | 90 690 | 99 860 |
| Бусерелін (1-місячний) | 97 378 | 110 399 |
| Елігард (1-місячний) | 100 583 | 126 625 |
| Лейпрорелін (1-місячний) | 103 058 | 129 101 |
| Гозерелін (1-місячний) | 109 805 | 135 848 |
| Трипторелін (1-місячний) | 123 813 | 149 863 |
*УПЕ — усунення ПЕ.
Автори зробили такі висновки: Елігард у дозі 7,5; 22,5 і 45 мг ефективно знижує рівень тестостерону <50 нг/дл практично у всіх пацієнтів (98–100%), гозерелін протягом 12 міс — у 88%, бусерелін протягом 12 міс — у 85%, лейпрорелін у різних формах через 28 днів — у 85,2%. Приливи відзначають у 0–8% пацієнтів, і тільки 50% з них потребують лікування (венлафаксин 75 мг). Отже, для терапії хворих на РПЗ оптимальним варіантом серед агоністів ЛГ-РГ є Елігард у вигляді 6-місячних ін’єкцій; економія коштів при цьому сягає близько 50 552 руб. на одного пацієнта на рік.
Інше дослідження проведено в Італії на основі детального аналізу 129 пацієнтів із метастатичним РПЗ [16]. Автори використовували спеціально створену математичну модель, в якій враховувалася низка факторів, перш за все ефективність та виживаність. У роботі порівняли основні представники ЛГ-РГ (лейпрорелін 11,25 та 22,5 мг, трипторелін 11,25 мг та гозерелін 10,8 мг). Середня тривалість життя пацієнтів становила близько 5 років з різницею 2 міс залежно від варіанта лікування. Найбільш вартісним було застосування гозереліну, найменш — лейпрореліну 22,5 мг. Практично за всіма проаналізованими критеріями лейпрорелін 22,5 мг був на першому місці з економією близько 2500 євро протягом життя.
В огляді J. Wex та співавторів (2013) проведено аналіз доступних публікацій стосовно різних форм лейпроліду в 9 європейських країнах з погляду преференцій пацієнтів та економіки [17]. Відзначено, що лейпролід із сучасною системою доставки на основі полімерів у вигляді гелю (Atrigel®) дозволяє контролювати рівномірне вивільнення діючої речовини протягом тривалого часу, що позитивно позначається на комплаєнтності пацієнтів та ефективності лікування порівняно з існуючими формами з короткостроковим інтервалом між ін’єкціями. Тому на сьогодні саме Елігард (лейпролід з системою Atrigel®) можна вважати стандартом аногістів ЛГ-РГ. Досліджували різні форми Елігарду — 1-, 3- та 6-місячну. Вірогідних відмінностей в ефективності та переносимості не виявлено, тому різниця полягала тільки у вартості препаратів і візитів у клініку. Економічно найбільш вигідним був прийом 6-місячним курсом, 3-місячний — дорожчий на 3–38%, а вартість 1-місячного була вищою від 3-місячного на 15–152% залежно від країни.
Схожі дані отримано при аналізі 10 клінічних досліджень в європейських країнах із різними формами Елігарду (1-, 3- та 6-місячна) [18]. Продемонстровано, що всі форми препарату ефективно знижують рівень тестостерону в крові <50 нг/дл (відповідно у 100; 100 та 99% пацієнтів). З погляду фармакоекономіки, оптимальним було використання 6-місячної форми ЛЗ, дешевшої на 3–38% від 1-місячної.
Арсенал доступних нині в Україні агоністів ЛГ-РГ широкий, механізм їхньої дії однаковий, та при визначенні схеми терапії вирішальне значення може мати не діюча речовина, а насамперед форма випуску препарату, оскільки саме вона визначає потенціал агоніста ЛГ-РГ знижувати рівень тестостерону протягом часу дії. Різниця між агоністами ЛГ-РГ, які найчастіше застосовують в Україні, представлено в табл. 2.
Таблиця 2. Дози діючих речовин у різних агоністів ЛГ-РГ, найчастіше застосовуваних в Україні
| Період введення | Лейпрорелін у лікарській формі Atrigel (Елігард), мг |
Інші лейпрореліни, мг |
Гозерелін, мг |
Трипторелін, мг |
Бусерелін, мг |
| 1 раз на місяць | 7,5 | 3,75 | 3,6 | 3,75 | 3,75 |
| 1 раз на 3 міс | 22,5 | 11,25 | 10,8 | 11,5 | 11,25 |
| 1 раз на 6 міс | 45,0 | − | − | − | − |
Незважаючи на широке застосування різних агоністів ЛГ-РГ, в Україні досі немає робіт з їх фармакоекономічного аналізу, тому метою дослідження було проведення фармакоекономічного аналізу використання протипухлинних ЛЗ — агоністів ЛГ-РГ у пацієнтів із РПЗ. Оскільки вартість ФТ досліджуваними ЛЗ є порівняно високою, важливо провести оцінку економічних витрат при їх застосуванні. Саме фармакоекономічний аналіз СЕА (Сost — Еffectiveness Аnalysis) дає можливість оцінити як ефективність, так і вартість ФТ одночасно, а також визначити економічні переваги у грошовому еквіваленті того чи іншого ЛЗ. Варто відзначити, що, згідно з вимогами фармакоекономічного аналізу, препаратом вибору вважається той, який має найнижчий показник CER (Сost — Еffectiveness Ratio).
Об’єкт і методи дослідження
Для оцінки економічної вигоди при застосуванні досліджуваних ЛЗ використано методику фармакоекономічного аналізу «Вартість — ефективність». Для більшої об’єктивності ми провели низку таких аналізів, врахувавши дані про ефективність різних років та авторів. Показник CER визначають як співвідношення вартості ФТ та її ефективності, виражених у однакових одиницях для всіх досліджуваних об’єктів, та вимірюють у грошовому еквіваленті (у нашому випадку — в гривнях). Для більшої об’єктивності в дослідження включено лікарські препарати зі схожим способом введення.
Результати
Оскільки ми дослідили декілька показників ефективності ЛЗ, то й показників CER було декілька. А саме:
1) CER1: одиницею ефективності (Ef 1) обрано кількість пацієнтів, що досягли рівня тестостерону ≤20 нг/дл (табл. 3). Цей коефіцієнт обчислювали на основі даних літератури [19–29, 45, 46].
Таблиця 3. Вихідні дані та результати фармакоекономічного аналізу (СЕА1)
| Назва ЛЗ та дозування | Інтервали між введеннями ЛЗ, міс | Вартість упаковки, грн. | Витрати за 1 міс ФТ, грн. | Ef 1 (частка пацієнтів, у яких досягли рівня тестостерону ≤20 нг/дл) | CER1 (витрати за 1 міс ефективного лікування), грн. |
| Лейпрорелін 45 мг(Елігард 6-місячний) | 6 | 7979,30 | 1329,90 | 0,87 | 1533,03* |
| Лейпрорелін 22,5 мг (Елігард 3-місячний) | 3 | 5284,52 | 1761,50 | 0,89 | 1982,00 |
| Лейпрорелін 7,5 мг (Елігард 1-місячний) |
1 | 1981,70 | 1981,70 | 0,90 | 2193,97 |
| Гозерелін 3,6 мг(1-місячний) | 1 | 1829,40 | 2105,14 | 0,67 | 3123,35 |
| Гозерелін 10,8 мг(3-місячний) | 3 | 4491,56 | 2105,14 | 0,65 | 3256,21** |
| Трипторелін 3,75 мг (1-місячний) | 1 | 1730,63 | 1730,60 | 0,62 | 2791,29 |
| Трипторелін 11,5 мг(3-місячний) | 3 | 5033,62 | 1677,87 | 0,60 | 2796,45 |
| Лейпрорелін 3,75 мг(1-місячний) | 1 | 1173,94 | 1173,90 | 0,59 | 1982,94 |
| Лейпрорелін 11,5 мг(3-місячний) | 3 | 3601,69 | 1200,60 | 0,55 | 2196,22 |
Місяць ефективного лікування — це місяць лікування, при якому досягається цільовий рівень тестостерону. Тут і в табл. 4, 5: *ЛЗ, який є препаратом вибору серед досліджуваних, тобто його застосування є економічно найбільш обґрунтованим; **ЛЗ, застосування якого є економічно найменш обґрунтованим.
2) CER2: одиницею ефективності (Ef 2) обрано кількість пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону на фоні ФТ (табл. 4). Цей коефіцієнт визначали на основі літературних джерел [19, 20, 29, 30–36, 45, 46].
Таблиця 4. Вихідні дані та результати фармакоекономічного аналізу (СЕА2)
|
Назва ЛЗ та дозування |
Інтервали між введеннями ЛЗ, міс |
Вартість упаковки, грн. | Витрати за 1 міс ФТ, грн. | Ef 2 | CER2, грн. |
| Лейпрорелін 7,5 мг (Елігард) | 1 | 1981,7 | 1981,70 | 0,99 | 2001,72 |
| Лейпрорелін 22,5 мг (Елігард) | 3 | 5284,52 | 1761,50 | 0,99 | 1779,29 |
| Лейпрорелін 45 мг (Елігард) | 6 | 7979,3 | 1329,90 | 0,99 | 1343,33* |
| Гозерелін 3,6 мг | 1 | 2105,14 | 2105,14 | 0,875 | 2405,87 |
| Гозерелін 10,8 мг | 3 | 2105,14 | 2105,14 | 0,87 | 2419,70** |
| Трипторелін 3,75 мг | 1 | 1730,63 | 1730,60 | 0,801 | 2160,55 |
| Трипторелін 11,5 мг | 3 | 5033,62 | 1677,87 | 0,801 | 2094,72 |
| Лейпрорелін 3,75 мг | 1 | 1173,94 | 1173,90 | 0,8 | 1467,38 |
| Лейпрорелін 11,5 мг | 3 | 3601,69 | 1200,60 | 0,785 | 1529,43 |
3) CER3: одиницею ефективності (Ef 3) обрано кількість пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону одразу після введення ЛЗ (табл. 5). Цей коефіцієнт обчислювали на основі даних літератури [4, 19, 29, 37–46].
Таблиця 5. Вихідні дані та результати фармакоекономічного аналізу (СЕА3)
|
Назва ЛЗ та дозування |
Інтервали між введеннями ЛЗ, міс | Вартість упаковки, грн. | Витрати за 1 міс. ФТ, грн. | Ef 3 | CER3, грн. |
| Лейпрорелін 7,5 мг (Елігард) | 1 | 1981,7 | 1981,70 | 1 | 1981,70 |
| Лейпрорелін 22,5 мг (Елігард) | 3 | 5284,52 | 1761,50 | 1 | 1761,50 |
| Лейпрорелін 45 мг (Елігард) | 6 | 7979,3 | 1329,90 | 1 | 1329,90* |
| Гозерелін 3,6 мг | 1 | 1829,4 | 2105,14 | 0,9 | 2339,04** |
| Гозерелін 10,8 мг | 3 | 4491,56 | 2105,14 | 0,9 | 2339,04** |
| Трипторелін 3,75 мг | 1 | 1730,63 | 1730,60 | 0,9 | 1922,89 |
| Трипторелін 11,5 мг | 3 | 5033,62 | 1677,87 | 0,9 | 1864,30 |
| Лейпрорелін 3,75 мг | 1 | 1173,94 | 1173,90 | 0,9 | 1399,33 |
| Лейпрорелін 11,5 мг | 3 | 3601,69 | 1200,60 | 0,9 | 1387,00 |
Вибір саме цих показників ефективності продиктований їх наявністю у доступних інформаційних джерелах для всіх досліджуваних ЛЗ. Вартість препаратів визначена відповідно до Реєстру оптово-відпускних цін на ЛЗ (станом на 29.04.2014 р. та 26.05.2014 р. — для гозереліну).
Встановлено, що показник «Витрати — ефективність» (CER1) суттєво відрізняється у досліджуваних ЛЗ та становить для Елігарду від 1533,03 до 2193,97 грн. Для інших ЛЗ — від 1982,94 до 3256,21 грн. відповідно. Такий результат дозволяє зробити висновок, що терапія Елігардом дозволить зекономити від 449,91 до 1062,24 грн./міс з урахуванням ефективності проведеної ФТ, а саме кількості пацієнтів, у яких досягнуто рівня тестостерону ≤20 нг/дл.
Переваги Елігарду більш наочні при графічному зображенні результатів (рисунок).
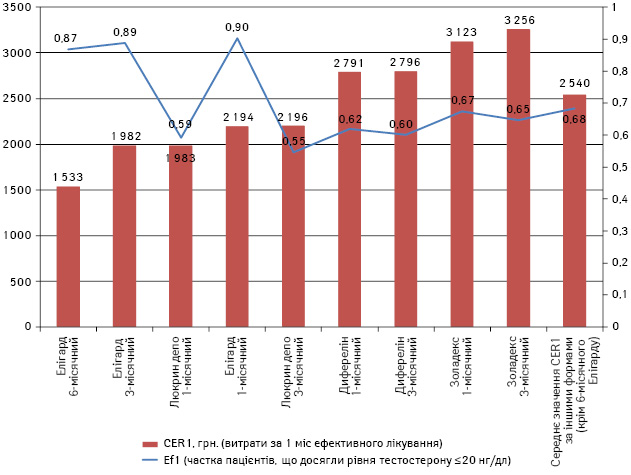
Рисунок. Результати фармакоекономічного аналізу за показником Ef 1 на CER1
Показник CER1, тобто витрати за 1 міс ефективного лікування, найнижчий для 6-місячного Елігарду і становить 1533,03 грн., тоді як середня вартість для решти форм агоністів ЛГ-РГ досягає 2540 грн. Різниця становить у середньому 1007 грн. (від 449 до 1723 грн./міс). Якщо перерахувати цю різницю, наприклад, на одного пацієнта на рік, стає очевидним, що порівняно з іншими агоністами ЛГ-РГ Елігарду 6-місячна форма економить в середньому більше 12 тис. грн. на одного ефективно пролікованого пацієнта на рік. Наступним за оптимальністю використання є 3-місячна форма Елігарду.
Цікава ситуація складається при порівнянні 1-місячного Елігарду із Люкрином депо. За даними рисунка, при практично однакових витратах за 1 міс ефективного лікування для обох препаратів кількість ефективно пролікованих пацієнтів буде значно більшою при застосуванні 1-місячного Елігарду, ніж при використанні препарату порівняння.
Що стосується показника «Витрати — ефективність» CER2, було встановлено, що він суттєво відрізняється у досліджуваних препаратів та становить для Елігарду від 1343,33 до 2001,72 грн. Для інших — від 1467,38 до 2419,70 грн. відповідно. Такий результат дозволяє зробити висновок, що терапія Елігардом дозволить зекономити від 89,02 до 417,98 грн./міс з урахуванням ефективності проведеного лікування (кількість пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону протягом терапії).
З’ясовано, що показник «Витрати — ефективність» (CER3) значно різниться у досліджуваних ЛЗ та становить для препарату Елігард від 1329,90 до 1981,70 грн. Для інших ЛЗ — від 1387,00 до 2339,04 грн. відповідно. Отже, ФТ препаратом Елігард дасть можливість зекономити від 50,97 до 357,34 грн./міс з урахуванням ефективності проведеної ФТ, а саме кількості пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону на фоні ФТ досліджуваними ЛЗ.
Таким чином, формуємо остаточну таблицю (табл. 6) зі зведеними результатами фармакоекономічних аналізів.
Висновки
Головними вимогами до агоністів ЛГ-РГ при лікуванні РПЗ є оптимальний контроль над рівнем тестостерону (зниження його концентрації <20 нг/дл), а також його підтримка на максимально низькому рівні протягом усього періоду лікування.
Таблиця 6. Економічна перевага застосування Елігарду порівняно з іншими аналогами ЛГ-РГ
| Показник ефективності ФТ |
Економічна перевага Елігарду за 1 міс ФТ, грн. |
| Кількість пацієнтів, у яких досягнуто рівня тестостерону ≤20 нг/дл | від 449,91 до 1062,24 |
| Кількість пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону на фоні ФТ | від 89,02 до 417,98 |
| Кількість пацієнтів, у яких не відмічено неочікуваного підвищення рівня тестостерону одразу після введення ЛЗ | від 50,97 до 357,34 |
Багатовекторний аналіз «Вартість — ефективність» чітко засвідчив значну економічну перевагу застосування препарату Елігард, яка не залежить від вибору показників його ефективності.
Загальна економія коштів при застосуванні препарату Елігард становить від 50,97 до 1062,24 грн./міс на одного пацієнта залежно від форми випуску та кратності його прийому, при цьому економічно найбільш обґрунтованим є використання 6-місячної форми препарату.
Водночас варто відзначити, що дані проведеного фармакоекономічного аналізу можуть варіювати залежно від змін вихідних параметрів (вартості, ефективності ЛЗ) у майбутньому.
Список використаної літератури
1. Jemal A., Siegel R., Ward E. et al. (2008) Cancer statistics, 2008. CA Cancer J. Clin., 58(2): 71–96.
2. Quinn M., Babb P. (2002) Patterns and trends in prostate cancer incidence, survival, prevalence and mortality. Part I: international comparisons. BJU Int., 90(2): 162–73.
3. Рак в Україні, 2001–2012 рр. Захворюваність, смертність, показники діяльності онкологічної служби. (2013) Бюл. Нац. канцер-реєстру, 14. Київ, 76.
4. Sharifi N., Gulley J.L., Dahut W.L. (2010) An update on androgen deprivation therapy for prostate cancer. Endocr. Relat. Cancer, 17: R305–R315.
5. Heidenreich A., Bastian P.J., Bellmunt J. et al. (2013) Guidelines on Prostate Cancer. European Association of Urology Guidelines. EAU: 1–154.
6. Huggins C., Stevens Jr. R.E., Hodges C.V. (1941) The effect of castration on advanced carcinoma of the prostate gland. Arch. Surg., 43: 209.
7. Shearer R.J., Hendry W.F., Sommerville I.F., Fergusson J.D. (1973) Plasma testosterone: an accurate monitor of hormone treatment in prostatic cancer. Br. J. Urol., 45: 668–677.
8. Oefelein M.G., Feng A., Scolieri M.J. et al. (2000) Reassessment of the definition of castrate levels of testosterone: implications for clinical decision making. Urology, 56: 1021–1024
9. Morote J., Orsola A., Planas J. et al. (2007) Redefining clinically significant castration levels in patients with prostate cancer receiving continuous androgen deprivation therapy. J. Urol., 178: 1290–1295.
10. Cassileth B.R., Soloway M.S., Vogelzang N.J. et al. (1989) Patients’ choice of treatment in stage D prostate cancer. Urology, 33 (Suppl): 57–62.
11. Cassileth B.R., Soloway M.S., Vogelzang N.J. et al. (1992) Quality of life and psychosocial status in stage D prostate cancer. Zoladex Prostate Cancer Study Group. Qual. Life Res., 1(5): 323–329.
12. Siegel J.E., Weinstein M.C., Russell L.B., Gold M.R. (1996) Recommendations for reporting cost-effectiveness analyses. JAMA, 276: 1339–41.
13. Cameron D. (2004) Patient management issues in metastatic bone disease. Semin. Oncol., 31(5, suppl. 10): 79–82.
14. Зинчук И.Ю. (2013) Актуальные вопросы фармакоэкономики в онкологии. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология, 3.
15. Аполихин О.И., Сивков А.В., Жернов А.А., Кешишев И.Г. (2010) Фармакоэкономическая оценка применения аналогов ЛГРГ при лечении рака предстательной железы в России: обоснование для льготного обеспечения. Эксп. клин. урол., 3: 76–78.
16. Iannazzo S., Pradelli L., Carsi M., Perachino M. (2011) Cost-effectiveness analysis of LHRH agonists in the treatment of metastatic prostate cancer in Italy. Value in health, 14: 80–89.
17. Wex J., Sidhu M., Odeyemi I. et al. (2013) Leuprolide acetate 1-, 3- and 6-monthly depot formulations in androgen deprivation therapy for prostate cancer in nine European countries: evidence review and economic evaluation. Clinicoecon. Outcomes Res., 5: 257–269.
18. Retsa P., Sidhu M., Odeyemi I. et al. (2011) Leuprolide acetate with Atrigel®, an androgen deprivation therapy for advanced prostate cancer: Economic evaluation of three formulations in nine European countries. EMUC 2011 3 Multidisciplinary Meeting on Urological Cancers (EAU, ESMO, ESTRO), November 4–6, 2011, Barcelona, Spain.
19. Bhasin S., Berman N., Swerdloff R.S. (1994) Follicle-stimulating hormone (FSH) escape during chronic gonadotropin-releasing hormone (GnRH) agonist and testosterone treatment. J. Androl., 15: 386–391.
20. Cassileth B.R., Soloway M.S., Vogelzang N.J. et al. (1989) Patients’ choice of treatment in stage D prostate cancer. Urology, 33 (Suppl): 57–62.
21. Crawford E.D., Sartor O., Chu F. et al. (2006) A 12-month clinical study of LA-2585 (45.0 mg): a new 6-month subcutaneous delivery system for leuprolide acetate for the treatment of prostate cancer. J. Urol., 175: 533–6.
22. Oefelein M.G., Cornum R. (2000) Failure to achieve castrate levels of testosterone during luteinizing hormone releasing hormone agonist therapy: the case for monitoring serum testosterone and a treatment decision algorithm. J. Urol., 164: 726–9.
23. Vogelzang N.J., Chodak G.W., Soloway M.S. et al. (1995) Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a radomised trial. Urology, 46(2): 220–226.
24. Heyns C.F., Simonin M.P., Grosgurin P. et al. (2003) Comparative efficacy of triptorelin pamoat and leuprolide acetate in men with advance prostate cancer. BJU Int., 92 (3): 226–231.
25. Kawakami J., Morales A. (2002) A comprehensive hormonal evaluation in patients with cancer of the prostate on androgen suppression with LHRH agonist. J. Urol., 167 (Suppl. 4): 288, Abstract 1135.
26. Perez-Marreno R., Chu F.M., Gleason D. et al. (2002) A six-month, open-label study assessing a new formulation of leuprolide 7.5 mg for suppression of testosterone in patients with prostate cancer. Clin. Ther., 24: 1902–14.
27. Tombal B., Berges R. (2005) How good do current LHRH Agonists Control Testosterone? Can this be Improved with Eligard? European Urology Supplements, 4(8): 30–36.
28. Fujii Y., Yonese J., Kawakami S. et al. (2008) Equivalent and sufficient effects of leuprolide acetate and goserelin acetate to suppress serum testosterone levels in patients with prostate cancer. BJU Int., 101(9): 1096–100.
29. Стаховский Э.А., Витрук Ю.В. (2013) Современные аспекты использования агонистов лютеинизирующего гормона — рилизинг-гормона в лечении рака предстательной железы (обзор литературы). Клин. онкол., 1(9): 94–100.
30. Debruyne F.M., Dijkman G.A., Lee D.C. et al. (1996) A new long acting formulation of the luteinizing hormone-releasing hormone analogue goserelin: results of studies in prostate cancer. J. Urol., 155: 1352–4.
31. Gittelman M., Pommerville P.J., Persson B.E. et al. (2008) A 1-year, open-label, randomized phase II dose-finding study of degarelix, a novel gonadotropin-releasing hormone (GnRH) receptor blocker, in the treatment of prostate cancer in North America. J. Urol., 180: 1986–1992.
32. Imamura T., Yasunaga H. (2008) Economic evaluation of prostate cancer screening with prostate-specific antigen. Int. J. Urol., 15(4): 285–288.
33. Mongiat-Artus P., Teillac P. (2004) Abarelix: the first gonadotrophin-releasing hormone antagonist for the treatment of prostate cancer. Expert. Opin. Pharmacother., 5: 2171–2179.
34. Oefelein M.G. (1998) Time to normalization of serum testosterone after 3-month luteinizing hormone-releasing hormone agonist administered in the neoadjuvant setting: implications for dosing schedule and neoadjuvant study consideration. J. Urol., 160: 1685–8.
35. Payne H.A., Edwards S.J. (2008) Efficacy of leuprorelin 3.75 mg compared to 7.5 mg in the treatment of prostate cancer: systematic review and meta-analysis [abstract]. Value Health., 11(6): A459.
36. Sarosdy M.F., Schellhammer P.F., Soloway M.S. et al. (1999) Endocrine effects, efficacy and tolerability of a 10.8-mg depot formulation of goserelin acetate administered every 13 weeks to patients with advanced prostate cancer. BJU Int., 83: 801–06.
37. Fuldeore M.J., Brook R.A., Smeeding J., Dabbous O.H. (2008) Leuprolide acetate persistence varies by age in patients with prostate cancer [abstract]. Value Health., 11(3): A73.
38. Herbst K.L., Coviello A.D., Page S.T. et al. (2004) Acyline, a gonadotropin releasing-hormone antagonist suppresses gonadotropins and testosterone for 15 days after a single dose. J. Clin. Endocrinol. Metab., 89: 5959–5965.
39. Mottet N., Bellmunt J., Bolla M. et al. (2014) EAU Guidelines on Prostate Cancer. Part II: Treatment of Advanced, Relapsing, and Castration-Resistant Prostate Cancer. Eur. Urol., 65: 467–479.
40. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology™. Prostate Cancer. National Comprehensive Cancer Network: Fort Washington, PA, Version 2.2014.
41. NICE. Prostate Cancer: Diagnosis and Treatment 2008.
42. Shahinian V.B., Kuo Y.F., Freeman J.L. et al. (2005) Increasing use of gonadotropin-releasing hormone agonists for the treatment of localized prostate carcinoma.
43. Tombal B., Berges R. (2008) Optimal control of testosterone: a clinical case-based approach of modern androgen-deprivation therapy. Eur. Urol. Suppl., 7: 15–21.
44. Tombal B., Miller K., Boccon-Gibod L. et al. (2010) Additional analysis of the secondary end point of biochemical recurrence rate in a phase 3 trial (CS21) comparing degarelix 80 mg versus leuprolide in prostate cancer patients segmented by baseline characteristics. Eur. Urol., 57: 836–842.
45. Abbou C.C., Lucas C., Leblanc V. (1997) Tolerance and clinical and biological responses during the first 6 months of treatment with 1-month sustained release LHRH agonists leuprolerin and triptolerin in patients with metastatic prostate cancer. Prog. Urol., 7(6): 984–95.
46. Chu F.M., Jayson M., Dineen M.K. et al. (2002) A clinical study of 22.5mg. La-2550: a new subcutaneous depot delivery system for leuprolide acetate for the treatment of prostate cancer. J. Urol., 168(3): 1199–1203.
Фармакоэкономические особенности применения противоопухолевых лекарственных средств при раке предстательной железы
Львовский национальный медицинский университет имени Данила Галицкого
Буковинский государственный медицинский университет, Черновцы
Резюме. Проведен фармакоэкономический анализ применения противоопухолевых лекарственных средств — агонистов лютеинизирующего гормона — рилизинг-гормона у больных раком предстательной железы, оценены экономические утраты при их использовании. Фармакоэкономический анализ «Сost — Еffectiveness Аnalysis» (СЕА) дал возможность оценить одновременно как эффективность, так и стоимость фармакотерапии, а также определить экономическое превосходство в денежном эквиваленте того или иного препарата с помощью показателя Сost — Еffectiveness Ratio (CER), выраженного в одинаковых единицах для всех исследуемых объектов и измеряемого в денежном эквиваленте (в нашем случае — в гривнях).
рак предстательной железы, аналоги ЛГ-РГ, фармакоэкономика противоопухолевых средств.
Адреса:
Зіменковський Андрій Борисович
79010, Львів, вул. Пекарська, 69
Львівський національний медичний університет імені Данила Галицького
Тел.: +380 (32) 258-74-10
E-mail: azimenkovsky@ukr.net














Leave a comment