Діагностика та лікування лімфом під час вагітності
Новосад І.О., Пастушенко Я.В., Скрипець Т.В., Крячок І.А.
Резюме. Епідеміологічні дані останніх років свідчать про підвищення захворюваності на гемобластози. Сучасна специфічна терапія дає можливість вилікувати хворих на лімфоми, що зробило актуальною проблему реалізації у пацієнтів молодого віку репродуктивної функції. На підставі даних зарубіжних дослідників, а також власних спостережень представлено загальні принципи тактики ведення вагітності у жінок із лімфомами.

Вступ
Рак є другою за значимістю причиною смерті протягом репродуктивного періоду жінки і ускладнює приблизно 1:1000 вагітностей [1–2]. Лімфома є четвертою найбільш частою злоякісною хворобою під час вагітності та діагностується приблизно в 1 випадку на 6000 породіль [1–3]. Пік захворюваності на лімфому Ходжкіна (ЛХ) припадає на репродуктивний вік, що включає підлітків та осіб віком до 30 років. ЛХ — найбільш поширений тип лімфоми під час вагітності.
Захворюваність на неходжкінську злоякісну лімфому (НХЛ) не має вікової залежності, середній вік на момент встановлення діагнозу становить 42 роки [2]. За даними Національного канцер-реєстру України, у 2011–2012 рр. захворюваність на НХЛ становила 5,2 випадку, а ЛХ — 2,6 випадку на 100 тис. населення. Діагноз лімфоми під час вагітності створює проблеми для жінки, її родини та медиків. Питання збереження вагітності у таких хворих досі є дискусійним.
Симптоми та діагностика
Симптоми лімфом схожі з характерними ознаками вагітності (втомлюваність, нудота і блювання, зменшення маси тіла, біль у животі). Перелік діагностичних процедур є стандартним: проводиться пункція та/або подальша біопсія лімфатичного вузла з гістологічним дослідженням. Таку операцію проводять під місцевою анестезією, не шкідливою для плода. Коли немає поверхнево доступних лімфовузлів, можливе проведення загального знеболення для виконання ексцизійної біопсії. У цілому, завдяки сучасним хірургічним та знеболювальним методам планова операція у вагітної є безпечною навіть протягом I триместру. Рівень ризику спонтанного аборту, материнської смертності, народження дитини з дефектами чи пізнього розвитку нервової системи статистично не відрізняється при проведенні операцій у вагітних з лімфомами порівняно з хворими в популяції [4]. Розподіл гістологічних варіантів ЛХ, діагностованих під час вагітності, аналогічний таким у невагітних. Найчастіше виявляють варіант нодулярного склерозу. Щодо НХЛ, асоційованих із вагітністю, – найчастіше діагностують агресивні типи НХЛ, а саме дифузну В-великоклітинну та Т-клітинні лімфоми [5].
Доза радіації, одержана плодом під час радіологічних досліджень, що включають рентгенографію та комп’ютерну томографію (КТ) грудної порожнини, набагато нижча, ніж порогова доза для шкідливого впливу на плід (за умови використання спеціального свинцевого фартуха для захисту плода). КТ органів черевної порожнини та малого таза супроводжується більш високим рівнем опромінення плода (>0,02 Гр) і протипоказана під час вагітності [6]. У цих випадках перевагу необхідно надати безпечнішим методам дослідження: МРТ і УЗД, які можуть забезпечити потрібну діагностичну інформацію без помітного підвищення ризику виникнення у плода вад розвитку [7, 8].
Для встановлення діагнозу та оцінки відповіді на лікування у пацієнтів із лімфомою нині все частіше використовують позитронно-емісійну томографію (ПЕТ). Однак, оскільки F-ФДГ здатна проникати через плаценту і досягати плода, це може бути пов’язано з підвищенням рівня радіаційного опромінення, порівняно з регулярним КТ, а отже, використання ПЕТ не рекомендоване протягом вагітності [9]. ПЕТ можна виконувати у породіль для оцінки ефективності лікування. Грудне вигодовування має бути призупинене принаймні на 24 год під час виконання цієї процедури, оскільки радіоактивний F-ФДГ концентрується і в грудних залозах, і в грудному молоці [10].
Для виключення ураження кісткового мозку показана трепанобіопсія клубової кістки.
Лікування хворих на лімфому під час вагітності
Загальні принципи
Тактика ведення вагітності при лімфомі залежить від трьох основних факторів:
1) агресивності лімфоми;
2) часу виникнення (І, ІІ, ІІІ триместр);
3) бажання жінки.
Існує три найбільш поширених тактики ведення вагітних із лімфомою: переривання вагітності, «watch and wait» (спостереження та очікування), лікування.
Більшість цитотоксичних агентів проникають через плацентарний бар’єр і досягають плода завдяки їх відносно малій молекулярній масі [11]. При лікуванні вагітних із застосуванням хіміотерапії (ХТ) важливо враховувати фізіологічні зміни, які відбуваються під час вагітності, такі як збільшення обсягу плазми і ниркового кліренсу препаратів, а також простору, створеного амніотичною рідиною [12]. Ці зміни можуть знизити активну концентрацію препарату порівняно з тими жінками, які мають таку саму масу тіла, але не вагітні [12]. На сьогодні фармакокінетичних досліджень у вагітних, які отримують ХТ, не проводили, їх спрямовано на визначення необхідної модифікації доз цитостатичних препаратів. Тератогенна дія майже всіх хіміотерапевтичних агентів документально підтверджена на тваринах [12]. ХТ у I триместр може підвищити ризик спонтанного викидня, призвести до загибелі плода і суттєвих вад розвитку [13, 14]. На виникнення вад розвитку впливає гестаційний вік на момент опромінення: плід надзвичайно вразливий з 2-го по 8-й тиждень гестації, в який відбувається органогенез [12]. Під час цього періоду пошкодження будь-якого органа, що розвивається, може призвести до смерті або значних вад розвитку плода. Після завершення органогенезу залишаються вразливими для ХТ такі органи, як очі, геніталії, кровотворна та центральна нервова системи [14]. Цей ризик зберігається протягом всієї вагітності, проте між 14-м та 16-м тижнем вагітності ризик серйозних вад розвитку або розумової відсталості значно знижується [12]. У I триместр експозиція до ХТ асоціюється з 10–20% ризику виникнення серйозних вад розвитку. У цілому, ризик тератогенезу після лікування раку нижчий, ніж зазвичай очікується (дані підтверджено проведеним дослідженням на тваринах) [11].
II і III триместри вагітності не асоціюються з виникненням вад розвитку, однак може зростати ризик неонатальної загибелі плода, затримки внутрішньоутробного розвитку, дострокових пологів і малої маси тіла при народженні [11, 14]. Ці ускладнення можуть бути пов’язані з несприятливими віддаленими побічними явищами, такими як нервово-розумова відсталість [15], ризик захворювань або порушень з боку серцево-судинної [16] і ниркової систем [17] (як правило, мікроальбумінурія). Однак такі ускладнення не були пов’язані із ХТ, та їхній вплив на плід не встановлено.
Спірним залишається питання кардіотоксичного внутрішньоутробного впливу антрациклінів на плід. В одному дослідженні, в яке включено 81 дитину, матері яких лікувалися цитостатичними препаратами, в тому числі антрациклінами, не виявлено пошкодження міокарда ні в гестаційний період, ні на постнатальних ехокардіограмах [18]. Відсутні повідомлення щодо пошкодження легень плода або виникнення нейротоксичності, які пов’язані з використанням блеоміцину чи вінка-алкалоїдів відповідно. Рішення про використання ХТ під час вагітності приймають з урахуванням побічних ефектів лікування, які можуть вплинути на материнську виживаність. Якщо це можливо, ХТ слід відкласти до кінця I триместру. Якщо ж необхідно розпочати в I триместр вагітності, рішення щодо медичного аборту слід розглядати, враховуючи думку сім’ї пацієнтки. Сам діагноз лімфоми як в активній фазі, так і в ремісії захворювання не є показанням для розродження оперативним шляхом. Показаннями є або необхідність негайного початку протипухлинного лікування при непідготовлених пологових шляхах, або ускладнення, пов’язані зі спеціальною терапією (постпроменевий кардіофіброз, серцево-легенева недостатність II–III ступеня, асептичний некроз тазостегнового суглоба, переломи поперекового відділу хребта та ін.).
ЛХ та вагітність
Перший випадок поєднання ЛХ і вагітності зареєстровано у 1911 р. У середині 60-х років минулого сторіччя проведене в Меmorial Sloan-Kettering Cancer Center (США) вивчення виживаності 347 жінок із ЛХ віком від 18 до 40 років, з яких у 84 вагітність була збережена (період спостереження з 1910 по 1960 р.), похитнуло усталений погляд на необхідність переривання вагітності — у вагітних, хворих на лімфоми, медіана виживаності була такою самою. Встановлено, що в групі вагітних і в контрольній групі цей показник становив 90 міс [19]. У Данії з 1973 по 2002 р. було проведено національне когортне дослідження 292 випадків пологів у жінок із ЛХ. Продемонстровано, що частота передчасного розродження, затримки внутрішньоутробного розвитку, антенатальної загибелі плода не перевищує популяційних значень у жінок, які перенесли ЛХ до вагітності або протягом 2 років після пологів. У групі пацієнток, хворих на ЛХ під час вагітності, частота передчасного розродження була трохи вищою (53,3% порівняно з 50%) у зв’язку з необхідністю початку протипухлинного лікування [20].
A.B. Gelb та співавтори представили результати дослідження 17 випадків ЛХ під час вагітності (II–III триместр). Середній термін вагітності становив 22 тиж. 10 пацієнток отримали ХТ, а у 7 не проводили спеціального лікування. Більшість пацієнток одержали терапію під час вагітності та після пологів, зареєстровано 1 випадок смерті, не пов’язаної із захворюванням. Не встановлено вроджених аномалій плода під час пологів. 88% жінок досягли повної відповіді на лікування після завершення протипухлинної терапії [21].
У дослідженні A. Aviles, N. Neri (2001) обстежено 84 новонароджених, матері яких отримали поліхіміотерапію (ПХТ) (за схемою АВVD, ABD, EBVD або МОРР) під час вагітності, 10 із них — у I триместр [22]. Усі пацієнтки розродилися на термінах 36–40 тиж без розвитку аномалій у плода [20]. Однак у повідомленні D.C. Doll (1989) аномалії розвитку мали 4 із 7 дітей, матері яких отримували лікування за схемою МОРР [34]. В іншому дослідженні A. Aviles і співавторів [18] обстежили 43 дітей віком від 3 до 19 років, матері яких також одержували ХТ під час вагітності. У групу контролю увійшли 25 здорових дітей. Проведено аналіз крові, фізичного і розумового розвитку дітей, їх імунного статусу, а також цитогенетичні дослідження. Відмінностей між групами дітей, матері яких отримали ХТ, і групою контролю за вказаними параметрами не виявлено [22, 23].
Більшість дослідників показали, що вагітність не погіршує прогнозу захворювання. Проведено порівняння частоти повних ремісій, загальної та безрецидивної виживаності жінок із ЛХ у таких групах: 1-ша — при виявленні захворювання під час вагітності; 2-га — за наявності вагітності та пологів після закінчення лікування в ремісії захворювання; 3-тя — за відсутності вагітності як за кілька років до лікування, так і після лікування протягом усього спостереження [20, 21]. Не було відмінностей у частоті повних ремісій (93,0; 93,1 і 91,6% відповідно) і частоті рецидивів (24,6; 20,6 і 19,0% відповідно). При тривалості спостереження до 30 років 10-річна безрецидивна виживаність становила 71; 63 і 73% відповідно (статистично значущих відмінностей між кривими виживаності не виявлено). Загальна виживаність досягала 81; 93 і 91% відповідно [21, 22]. Таким чином, вагітність та її збереження на будь-якому етапі захворювання не впливають на ефективність лікування і тривалість життя хворих ЛХ [23].
НХЛ та вагітність
Для визначення тактики ведення та лікування пацієнток, НХЛ можна поділити на 3 групи: індолентні, агресивні та високоагресивні лімфоми (відповідно до класифікації ВОЗ).
Індолентні НХЛ. Ця група включає фолікулярну лімфому, хронічний лімфолейкоз/лімфому, лімфому маргінальної зони. Але ці типи лімфом дуже рідко виникають під час вагітності, характеризуються повільним клінічним перебігом, і початок лікування можна відкласти до перших проявів захворювання. Тому розпочинати ХТ протягом I триместру, як правило, немає необхідності. Монотерапія ритуксимабом протягом І триместру вагітності є суперечливою тактикою. У ІІ триместр можливе використання курсу ХТ CVP (циклофосфамід, вінкрістин, преднізолон). Останнім часом часто призначають флударабінвмісні режими для лікування пацієнтів молодого віку. Однак доказова база щодо застосування флударабіну під час вагітності відсутня. Для пацієнтів із І стадією та ураженням шийних або аксилярних лімфатичних вузлів можна використовувати променеву терапію.
Агресивні НХЛ. Ця група включає дифузну В-великоклітинну лімфому, лімфому з клітин мантії, Т- та NK-клітинні лімфоми. Цей вид лімфом найчастіше діагностують під час вагітності. Більшості пацієнтів необхідно оперативно надавати лікування з огляду на агресивний перебіг НХЛ. Виняток становлять пацієнти з локалізованою стадією захворювання. Як правило, пацієнти з дифузною В-великоклітинною лімфомою отримують ХТ за схемою СНОР/R-CHOP.
Дані про відсутність негативного впливу ХТ CHOP на плід під час вагітності обмежені. Результати не показали підвищення ризику виникнення внутрішньоутробних вад у тих небагатьох випадках, коли в І триместр лікування проводили за схемою CHOP [19, 20, 28]. Це свідчить про те, що ХТ у режимі CHOP можна застосовувати в ІІ і ІІІ триместр вагітності [20]. У пацієнток, у яких діагностовано лімфому наприкінці І триместру вагітності, можна проводити локальну променеву терапію на окремі ділянки ураження (вище діафрагми) чи застосовувати метод спостереження до кінця І триместру з подальшим проведенням адекватного лікування в повному обсязі [24, 25].
Не існує чітких даних стосовно використання ритуксимабу в лікуванні вагітних із НХЛ. Препарат проходить через плацентарний бар’єр і тому може впливати на В-клітинний пул плода.
На сьогодні ритуксимаб отримали тільки 7 пацієнток із лімфомами під час вагітності: 6 — у комбінації з ХТ та 1 — у вигляді монотерапії [26–31].
Останній випадок — це рецидив фолікулярної лімфоми, коли ритуксимаб було введено в І триместр вагітності, після чого терапію зупинили та продовжили спостереження за перебігом вагітності. Решта 6 пацієнток мали різні типи агресивних лімфом, тому лікування ритуксимабом було розпочато під час II триместру вагітності. Усі 7 хворих мали неускладнену вагітність. У 3 із 7 новонароджених CD19 В-клітини або неможливо було порахувати, або кількість їх різко зменшилася на момент народження чи невдовзі після [28, 30, 32]. Кількість В-клітин відновлювалася до норми протягом 3–6 міс. Не виявлено значних постнатальних інфекцій, а в подальшому — відхилень відповідних показників при стандартній імунізації у всіх 4 дітей.
Видимий ефект ритуксимабу на пригнічення В-клітинного пулу новонароджених дійсно може підвищити ризик виникнення неонатальних інфекцій [33]. Період напіввиведення цього препарату призводить до зазначеного побічного ефекту, навіть якщо препарат вводили на початку вагітності та протягом коротких періодів. Однак обмежені наявні дані свідчать про те, що цей ефект є зворотним і не становить загрози для життя новонароджених за умови здійснення ретельного моніторингу.
Високоагресивні НХЛ. Ця група включає В- або Т-лімфобластний лейкоз/лімфому та лімфому Беркітта. Зважаючи на швидкий перебіг і несприятливий прогноз агресивних лімфом, лікування в таких випадках має розпочинатися відразу після встановлення діагнозу, навіть у I триместр. Вагітну слід проінформувати про значний ризик тератогенного впливу на плід, а також про можливе переривання вагітності. Багато схем ХТ, які застосовують для лікування високоагресивних лімфом, включають метотрексат у високих дозах, який становить найбільшу небезпеку для плода при введені у I триместр вагітності. На основі дуже обмежених даних можна зробити висновок, що лікування метотрексатом у II або III триместр вагітності не спричинює тератогенного ефекту, але може викликати мієлосупресію плода [24]. Однак при виборі адекватної схеми ХТ у вагітних із НХЛ виживаність є аналогічною цьому показнику в групі невагітних хворих.
Алгоритми лікування вагітних пацієнток із ЛХ та НХЛ подано на рис.1 та 2 відповідно.
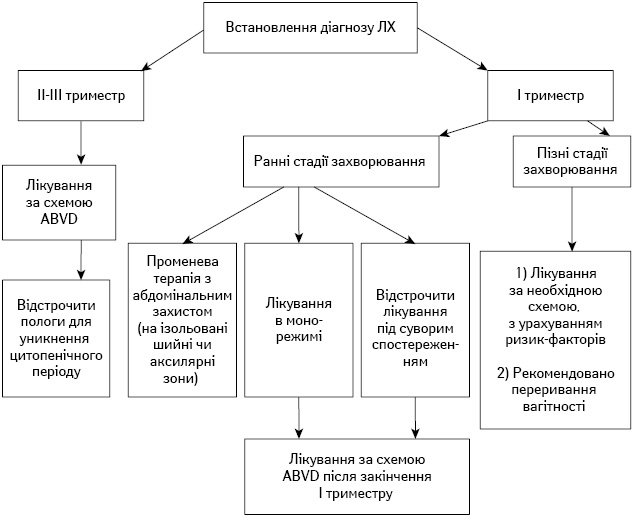
Рис. 1. Алгоритм лікування вагітних пацієнток з ЛХ

Рис. 2. Алгоритм лікування вагітних пацієнток з НХЛ у І триместр
Власний досвід
Клінічний випадок № 1
Пацієнтка К., 32 роки, медсестра районної лікарні, за 6 міс до госпіталізації в Національний інститут раку (НІР) звернулася до стоматолога з приводу болю у верхньому корінному зубі зліва. На фоні консервативного лікування відзначено погіршення стану, діагностовано норицю у верхній щелепі, яка була дренована. У подальшому з’явилася припухлість ясен у ділянці виникнення нориці. Проведено резекцію частини верхньощелепної кістки та трьох зубів. Висновок гістологічного дослідження: «псевдопухлина». Набряк збільшувався та поширювався на верхнє м’яке піднебіння.
Пацієнтку госпіталізували у відділення онкогематології НІР зі скаргами на біль у верхній щелепі та головний біль, ECOG1. Status localis: відмічали утворення розміром до 8 см на яснах верхньої щелепи (від крила носа) зліва, щільне, помірно чутливе до дотику. Лімфатичні вузли не збільшені. Вагітність 24 тиж. Виконано біопсію пухлинного утворення верхньої щелепи.
Імуногістохімічне дослідження: CD20, СD45, CD22, CD4neg, CD8 neg, CD5 neg, CD23 neg, PAX5, CyclinD1 neg, Ki-67 >75%: дифузна В-великоклітинна лімфома. Стадія ІЕА; ІРІ = 1.
Спостереження та лікування пацієнтки проводили спільно спеціалісти НІР та Інституту педіатрії, акушерства та гінекології НАМН України. Проведено 2 курси ПХТ за схемою СНОР, після 1-го курсу виконано оцінку стану плода, відхилень не виявлено. Вагітність розвивалася нормально.
Виконано кесарів розтин у строк 32 тиж (8 тиж після діагностування). Дитина (хлопчик) народилася здоровою, маса тіла 2800 г, перебувала під спостереженням педіатра, фізичний та інтелектуальний розвиток відповідав терміну розродження.
Після 3-го курсу досягнуто повної відповіді (критерії Cheson et al., 1998). З метою консолідації подальше лікування продовжено до 8 курсів ПХТ за схемою СНОР.
У зв’язку з ураженням верхньої щелепи, що є фактором ризику ураження центральної нервової системи — рецидиву, проведено профілактику: метотрексат 7000 мг внутрішньовенно 3-годинною інфузією.
Також проведено променеву терапію на ділянку пухлини в сумарній вогнищевій дозі 36 Гр (разова доза 2 Гр).
Наразі дитині виповнилося 4 роки, хлопчик не відстає у фізичному та інтелектуальному розвитку.
Клінічний випадок № 2
Пацієнтка Ч., 23 роки, бухгалтер, на профогляді проведено рентгенографію органів грудної порожнини, при якому виявлено розширення тіні середостіння (2009 р.). Від подальшого дообстеження (КТ органів грудної порожнини та консультації онколога) пацієнтка відмовилася в зв’язку з відсутністю скарг. Самолікуванням не займалася. На 4-му місяці вагітності (квітень 2011 р.) збільшилися надключичні лімфатичні вузли справа.
30.06.11 р. проведено біопсію шийного лімфатичного вузла. Результати гістологічного дослідження: морфологічні дані відповідають ЛХ, варіант нодулярного склерозу. У загальному аналізі крові: гемоглобін 97 г/л, швидкість осідання еритроцитів 63 мм/год, тромбоцити 200 тис.
Встановлено діагноз: ЛХ ІІА стадії з ураженням надключичних лімфовузлів справа та медіастинальних лімфовузлів. Вагітність 30 тиж.
Враховуючи індолентний перебіг захворювання, відсутність ознак інтоксикації та прогресування росту лімфовузлів, спеціальне лікування пацієнтці рекомендовано після своєчасного розродження.
Хвору направили до Інституту педіатрії, акушерства та гінекології НАМН України, де провели аналіз на наявність порушень розвитку, хромосомних порушень та внутрішньоутробного інфікування. Патологічних змін не виявлено.
При обстеженні в динаміці: розміри периферичних лімфовузлів не збільшувалися, лімфовузли середостіння становили 27×32 мм (за результатами КТ органів грудної порожнини від 05.07.11 р.), ознак інтоксикації не було.
Пацієнтка успішно самостійно в строк народила дитину (26.09.11 р.), після чого отримала 4 курси ПХТ ABVD та променеву терапію на ділянку середостіння.
Зараз дитині 3,5 року, вона не відстає у фізичному та інтелектуальному розвитку.
Висновки
Сучасне лікування лімфом дає пацієнтам шанс на повне одужання та повернення до повноцінного життя, у тому числі — народження дитини. Протипухлинну терапію не слід протиставляти вагітності та пологам, їх можна успішно поєднувати. Також можливий динамічний моніторинг пацієнтки до пологів при індолентному перебігу захворювання.
Список використаної літератури
1. Pentheroudakis G., Pavlidis N. (2006) Cancer and pregnancy: poena magna, not anymore. Eur. J. Cancer, 42: 126–40.
2. Koren G., Lishner M., Santiago S. (2005) The Motherisk Guide to Cancer in Pregnancy and Lactation (Second edition). Toronto, Canada. Motherisk program.
3. Pavlidis N. (2002). Coexistence of pregnancy and malignancy. Oncologist, 7: 279–87.
4. Cohen-Kerem R., Railton C., Oren D. et al. (2005). Pregnancy outcome following non-obstetric surgical intervention. Am. J. Surg., 190: 467–73.
5. Lishner M., Zemlickis D., Sutcliffe S., Koren G. (1994) Non-Hodgkin’s lymphoma and pregnancy. Leuk Lymphoma, 14: 411–3.
6. Cohen-Kerem R., Nulman I., Abramow-Newerly M. et al. (2006) Diagnostic radiation in pregnancy: perception versus true risks. J. Obstet. Gynaecol. Can., 28: 43–48.
7. Kawabata I., Takahashi Y., Iwagaki S., Tamaya T. (2003) MRI during pregnancy. J. Perinat. Med., 31: 449–58.
8. Levine D. (2006) Obstetric MRI. J. Magn. Reson. Imaging., 24: 1–15.
9. Hicks R., Binns D., Stabin M. (2001) Pattern of uptake and excretion of (18)F-FDG in the lactating breast. J. Nucl. Med., 42: 1238–42.
10. Benveniste H., Fowler J., Rooney W. et al. (2003) Maternal-fetal in vivo imaging: a combined PET and MR. J. Nucl. Med., 44 (9): 1522–30.
11. Weisz B., Meirow D., Schiff E., Lishner M. (2004) Impact and treatment of cancer during pregnancy. Exper. Rev. Anticancer. Ther., 4: 889–902.
12. Cardonick E., Iacobucci A. (2004) Use of chemotherapy during human pregnancy. Lancet Oncol., 5: 283–91.
13. Leslie K., Koil C., Rayburn W. (2005) Chemotherapeutic drugs in pregnancy. Obstet. Gynecol. Clin. North. Am., 32: 627–40.
14. Zemlickis D., Lishner M., Degendorfer P. et al. (1992) Fetal outcome after in utero exposure to cancer chemotherapy. Arch. Intern. Med., 152: 573–6.
15. Pallotto E., Kilbride H. (2006) Perinatal outcome and later implications of intrauterine growth restriction. Clin. Obstet. Gynecol., 49: 257–69.
16. Kistner A., Celsi G., Vanpee M., Jacobson S. (2000) Increased blood pressure but normal renal function in adult women born preterm. Pediatr. Nephrol., 15: 215–20.
17. Yudkin J., Martyn C., Phillips D., Gale C. (2001) Associations of micro-albuminuria with intra-uterine growth retardation. Nephron, 89: 309–14.
18. Aviles A., Neri N., Nambo M. (2006) Long-term evaluation of cardiac function in children who received anthracyclines during pregnancy. Ann. Oncol., 17: 286–8.
19. Демина Е.А. (2006) Современная терапия первичных больных лимфомой Ходжкина: Автореф. дис…. д.м.н., Москва, 230 с.
20. Шмаков Р.Г., Демина Е.А. (2009) Практическая онкология, 4(10): 231.
21. Gelb A.B., van de Rijn M., Warnke R.A. et al. (1996) Pregnancy-associated lymphomas. A clinical pathologic study. Cancer, 78: 204–210.
22. Aviles A., Neri N. (2001). Hematological malignancies and pregnancy: a final report of 84 children who received chemotherapy in utero. Clin. Lymphoma, 2: 173–7.
23. Lishner M., Zemlickis D., Degendorfer P. et al. (1992) Maternal and foetal outcome following Hodgkin’s disease in pregnancy. Br. J. Cancer, 65: 114–7.
24. Guven S., Ozcebe O., Tuncer Z. (2005) Non- Hodgkin’s lymphoma complicating pregnancy: a case report. Eur. J. Gynaecol. Oncol., 26: 457–8.
25. Lishner M., Zemlickis D., Sutcliffe S., Koren G. (1994) Non-Hodgkin’s lymphoma and pregnancy. Leuk. Lymphoma, 14: 411–3.
26. Cordeiro A., Machado A., Borges A. et al. (2009) Burkitt’s lymphoma related to Epstein – Barr virus infection during pregnancy. Arch. Gynecol. Obstet., 280(2), 297–300.
27. Rey J., Coso D., Roger V. et al. (2009) Rituximab combined with chemotherapy for lymphoma during pregnancy. Leukemia Res., 33(3): e8–e9.
28. Decker M., Rothermundt C., Hollander G. et al. (2006) Rituximab plus CHOP for treatment of diffuse large B-cell lymphoma during second trimester of pregnancy. Lancet Oncol., 7(8): 693–694.
29. Magloire L., Pettker C., Buhimschi C., Funai E. (2006) Burkitt’s lymphoma of the ovary in pregnancy. Obstet. Gynecol., 108(3 Pt 2): 743–745.
30. Friedrichs B., Tiemann M., Salwender H. et al. (2006) The effects of rituximab treatment during pregnancy on a neonate. Haematologica, 91(10): 1426–1427.
31. Herold M., Schnohr S., Bittrich H. (2001) Effycacy and safety of a combined rituximab chemotherapy during pregnancy. J. Clin. Oncol., 19(14): 3439.
32. Kimby E., Sverrisdottir A., Elinder G. (2004) Safety of rituximab therapy during the first trimester of pregnancy: a case history. Eur. J. Hematol., 72(4): 292–295.
33. Klink D., van Elburg R., Schreurs M., van Well G. (2008) Rituximab administration in third trimester of pregnancy suppresses neonatal B-cell development. Clin. Dev. Immunol., 2008: 271363.
34. Doll D.C., Ringenberg Q.S., Yarbo J.W. (1989) Antineoplastic agents and pregnancy. Semin. Oncol., 16: 337−346.
Диагностика и лечение лимфом во время беременности
Национальный институт рака, Киев
Резюме. Эпидемиологические данные последних лет свидетельствуют о повышении заболеваемости гемобластозами. Современная специфическая терапия дает возможность излечить больных лимфомами, что сделало актуальной проблему реализации у пациентов молодого возраста репродуктивной функции. На основании данных зарубежных исследователей, а также собственных наблюдений представлены общие принципы тактики ведения беременности у женщин с лимфомами.
лимфома, беременность, химиотерапия, плод, порок развития.
Адреса:
Новосад Ольга Ігорівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-10-90
E-mail: novosad.o.ua@gmail.com














Leave a comment