Актуальні питання діагностики захворювань сечостатевої системи
Спосіб лабораторної діагностики раку передміхурової залози
О.О. Михайлюта, І.М. Антонян, В.В. Россіхін, О.І. Зеленський, Т.А. Налбадян
Харківська медична академія післядипломної освіти,
Харків, Україна
Рак передміхурової залози (РПЗ) є одним із найпоширеніших злоякісних захворювань у чоловіків старшої вікової групи. У багатьох країнах світу РПЗ вийшов на друге місце в структурі онкологічної захворюваності чоловічого населення після раку легені. За даними Національного канцер-реєстру, в Україні в 2013 р. виявлено 7511 нових випадків РПЗ, а смертність протягом 1997–2012 рр. зросла з 10,8 до 16,8 на 100 тис. чоловічого населення (Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін. Рак в Україні, 2011–2012 // Бюлетень національного канцер-реєстру України, Київ. — 2013. — № 14 — С. 54–55). Актуальним є завдання ранньої діагностики цього захворювання, що дозволяє провести ефективне лікування.
У комплекс традиційних методів діагностики РПЗ входять: пальцеве ректальне дослідження, трансректальне ультразвукове дослідження передміхурової залози та визначення в сироватці крові рівнів простатичного специфічного антигену (ПСА).
Значну роль у скринінгу РПЗ, контролі за ефективністю лікування і ранній діагностиці рецидивів відіграє визначення в сироватці крові рівнів ПСА. Недоліком зазначеного способу діагностування є його інвазивність, що поряд із пасивністю чоловічого населення в питаннях ранньої діагностики та профілактики захворювань значно затримує темпи скринінгу РПЗ.
Метою дослідження є збільшення діагностичних можливостей наявного способу ранньої лабораторної діагностики РПЗ за рахунок зміни матеріалу дослідження і досягнення неінвазивності та більшої доступності.
Проведено обстеження 113 чоловіків віком від 54 до 84 років, що звернулися з приводу симптомів порушення сечовипускання. Усіх пацієнтів обстежили за загальноприйнятою методикою: загальноклінічні обстеження, пальцеве ректальне дослідження, трансректальне ультразвукове дослідження передміхурової залози та визначення в сироватці крові рівнів ПСА. Крім цього, проведено визначення рівня ПСА у сечі. При підозрі на РПЗ виконано поліфокальну біопсію передміхурової залози. Хворих із доброякісною гіперплазією передміхурової залози прооперовано з обов’язковим морфологічним дослідженням. За гістологічними результатами у 65 хворих виявлено РПЗ. У 46 пацієнтів діагностовано доброякісну гіперплазію передміхурової залози — вони увійшли до контрольної групи. Проведено математичну обробку отриманих результатів.
Здійснено порівняння рівнів ПСА у сироватці крові та сечі окремо у хворих на РПЗ і пацієнтів із доброякісною гіперплазією передміхурової залози. Cтатистичний варіаційний аналіз вказує, що у середньому показник ПСА в сечі для обох вибірок є вищим, ніж у сироватці крові.
З урахуванням аналізу рівняння регресії найбільш вірогідним видається висновок, що значення ПСА у сечі Р вищі за значення ПСА у сироватці крові Рid в 2 рази (при Рid → 0), причому ця різниця зменшується з підвищенням Рid. Похибка визначення Р вища за похибку Рid, проте величина похибки визначення Р-έ(Рid) також швидко зменшується зі зростанням Рid.
Дослідження рівня ПСА у сечі дозволяє збільшити діагностичні можливості цього способу ранньої лабораторної діагностики РПЗ за рахунок зміни матеріалу дослідження, досягнення неінвазивності та більшої доступності. Якщо показники ПСА у сечі вдвічі перевищують вікові норми для ПСА в сироватці крові, це є підставою для значної підозри наявності РПЗ.
Біофізичні технології діагностики онкологічної патології
К.А. Владиченко1, Д.І. Волошинський1, С.Б. Єрмоленко2
1Буковинський державний медичний університет,
Чернівці, Україна
2Чернівецький національний університет ім. Ю. Федьковича, Чернівці, Україна
Діагностика онкологічної патології на початкових стадіях розвитку є пріоритетним напрямом сучасної онкоурології. Незважаючи на високу діагностичну цінність сучасних методів обстеження, залишається високою частота діагностування інцидентальних непластичних процесів. Гістологічне дослідження також має певні недоліки, оскільки його результати залежать від адекватності та точності проведення біопсії, а правильність інтерпретації морфологічних змін — від досвіду лікаря, який виконує це дослідження. Тому не втрачає актуальності пошук та розробка нових методів діагностики.
Робота, яку ми виконуємо, спрямована на дослідження можливостей методу лазерної поляриметрії для вивчення розвитку та наявності неопластичних змін тканин в умовах багаторазового розсіювання. Встановлено, що прикладний пакет Matlab дозволяє визначати структурні та оптико-геометричні параметри досліджуваних у поляризаційних зображеннях гістологічних зрізів.
В основу аналітичного підходу до аналізу поляризаційно неоднорідних зображень тканини покладені головні модельні положення методу лазерної поляриметрії, згідно з якими біотканину розглядають як моношар, що містить набір оптично одновісних двопроменезаломлювальних фібрил. Як основний аналітичний інструмент для оцінювання сукупності випадкових величин z, що характеризують зображення біологічного об’єкта (інтенсивність I, азимут α та еліптичність β поляризації) та його оптико-геометричну структуру (напрями орієнтації протеїнових фібрил ρ та показник двопроменезаломлення їх речовин Δ n), використовували статистичні моменти першого М, другого σ, третього A і четвертого E порядків їх величин, які обчислювали шляхом усереднення відліків для кожного пікселя реєструвальної CCD-камери за алгоритмами.
Комп’ютерне моделювання показало прямий взаємозв’язок між ступенем самоподібності геометричних та оптико-анізотропних компонентів архітектоніки об’єкта та координатними розподілами інтенсивності його поляризаційного зображення I (0–0), I (0–90). При дослідженні біотканин відзначають поєднання як статистичної, так і фрактальної структури поляризаційних зображень, які характеризуються конкретною специфікою структури архітектоніки.
Використання методів параметричної та непараметричної статистики, вейвлет-аналізу продемонструвало ефективність статистичного аналізу для встановлення діагностичної різниці між нормальною та неопластично зміненою біотканиною.
Неинвазивные методы дифференциальной диагностики опухолевидных образований мочеточника
Е.М. Ухаль, О.И. Маломуж, М.И. Ухаль, Р.Б. Савчук
Одесский национальный медицинский университет,
Одесса, Украина
Первичные злокачественные опухоли мочеточника составляют лишь около 1% от всех опухолевых поражений верхних мочевых путей. Псевдоопухолевидные образования мочеточника (воспалительные инфильтраты, сосудистые конфликты, болезнь Ормонда, ятрогенные поражения, эндометриоз, глистная инвазия и др.) встречаются гораздо чаще, и их дифференциальная диагностика со злокачественными опухолями имеет важное значение для выбора метода лечения.
Целью исследования является улучшение неивазивной дифференциальной диагностики опухолевидных образований мочеточника и повышение эффективности выбора способа лечения больных с данной патологией путем углубленного анализа клинико-лабораторных показателей и применения современных лучевых методов исследования.
Диагностика проведена у 28 пациентов с признаками опухолевидного образования мочеточника в возрасте 38–71 года. Для анализа клинико-лабораторных показателей использовали такие критерии, как возраст, начало и симтомы заболевания, наличие болезней почек и других органов, предшествующие эндоскопические диагностические и лечебные процедуры на верхних мочевых путях, изменения в анализах крови и мочи. Из современных лучевых методов исследования применяли следующие протокольные методики: мультиспиральную компьютерную томографию с 3D сагиттальной и коронарной реконструкцией; сплит-болюс для оценки сосудистых конфликтов; полипозиционное сканирование на отсроченных сканах, в том числе с тугим наполнением мочевого пузыря и стимуляцией мочегонными препаратами почек для улучшения визуализации мочеточника; использование адекватного количества контраста (300–350 мг йода на 1 мл) из рассчета 1,5–2 мл на 1 кг массы тела больного для оценки тканевой составляющей; исследование в динамике, в том числе через непродолжительное время (от 1 нед до 1 мес).
Первичная злокачественная опухоль мочеточника выявлена и подтверждена при последующем гистологическом исследовании удаленных опухолей у 2 больных. Воспалительные инфильтраты и сосудистые конфликты выявлены и подтверждены при динамическом наблюдении у 10 и 5 пациентов соответственно; ятрогенные повреждения мочеточников выявлены у 6 больных; болезнь Ормонда и поражение мочеточников наружным эндометриозным процессом диагностированы и подтверждены при гистологическом исследовании удаленных тканей у 3 и 1 пациентов соответственно; поражение мочеточников глистной инвазией выявлено и подтверждено при гистологическом исследовании удаленных тканей у 1 пациента.
Использование углубленного анализа клинико-лабораторных показателей и применение современных лучевых методов исследования позволяют провести малоинвазивную дифференциальную диагностику опухолевидных образований мочеточника, требующих оперативного лечения, а также избежать такового у пациентов с динамическими изменениями мочеточников, обусловленными воспалительными инфильтратами и сосудистыми конфликтами.
Промежностная биопсия предстательной железы
И.М. Антонян, В.В. Россихин, А.И. Зеленский, А.А. Михайлюта, Т.А. Налбадян, Р.А. Зеленский
Харьковская медицинская академия последипломного образования, Харьков, Украина
Рак предстательной железы (РПЖ) является одним из самых распространенных злокачественных заболеваний у мужчин старшей возрастной группы. Во многих странах мира РПЖ вышел на второе место в структуре онкологической заболеваемости мужчин после рака легкого. По данным Национального канцер-регистра, в Украине в 2013 г. зарегистрировано 7786 новых случаев РПЖ, а смертность в течение 1997–2013 гг. возросла с 10,8 до 16,9 на 100 тыс. мужского населения. Высокая распространенность рака, трудности диагностики, особенно в начале развития патологии, нередко выявление на поздних стадиях, когда даже паллиативная терапия малоэффективна, — факторы, которые определяют актуальность проблемы и придают ей социальное значение.
Биопсия предстательной железы является основным диагностическим методом, благодаря которому злокачественное заболевание может быть выявлено на ранней стадии, когда возможно проведение радикальной терапии.
Показанием к проведению биопсии предстательной железы являются: повышение уровня простатического специфического антигена >4 нг/мл, патологические изменения, выявленные при пальцевом ректальном исследовании, наличие гипоэхогенных зон в предстательной железе при трансректальном ультразвуковом исследовании. В зависимости от доступа различают трансуретральную, трансректальную, промежностную, трансвезикальную, аспирационную и открытую биопсию предстательной железы. Наиболее распространенными осложнениями данного дигностического метода являются боль, лихорадка, гематурия, в том числе уретроррагия, гемоспермия, кровотечения из прямой кишки, острая задержка мочи, инфекционные осложнения. По данным литературы, осложнения биопсии предстательной железы возникают в 12–41% (Илюхин Ю.А. и др., 2002; Donzella J. et al., 2004).
За период 2004–2014 гг. нами обследовано 472 мужчин в возрасте от 45 до 83 лет с подозрением на РПЖ. Биопсию предстательной железы выполняли с помощью биопсийного автомата фирмы «Bard» промежностным доступом под местной инфильтрационной анестезией 40,0 мл 0,5% раствора прокаина с добавлением антибиотика группы цефалоспоринов II поколения в среднетерапевтической дозе. Экспозиция — 3–5 мин до начала манипуляции. Инфильтрация анестетиком парапростатического пространства, кроме исключения болевой импульсации, позволяет отодвинуть стенку прямой кишки от поверхности предстательной железы и семенных пузырьков. Биоптаты получают из 6 участков по латеральному краю предстательной железы (периферической, центральной зон и ее основы). РПЖ гистологически был подтвержден у 326 (69,07%) пациентов. У 13 (2,75%) отмечали кратковременную гематурию, при которой требовалась дополнительная терапия. Других ранних и/или поздних осложнений биопсии не зарегистрировано.
Биопсия предстательной железы промежностным доступом предпочтительнее наиболее распространенного трансректального доступа (Chiari R., Harzmarm R., 2009). Есть возможность взять больше ткани предстательной железы с периферической зоны, где РПЖ локализуется в 70% случаев (Emiliozzi P. et al., 2003). Этот доступ позволяет проводить манипуляцию в амбулаторных условиях, является практически безболезненным, проводится в стерильных условиях, не требует никакой подготовки пациента к манипуляции и последующих назначений после процедуры. Эта процедура может быть многократно выполнена без осложнений под местной анестезией у больных любого возраста и почти с любой сопутствующей патологией.
Пункционная биопсия инфильтративно-опухолевых образований забрюшинного пространства и периуретральной зоны под контролем компьютерной томографии
Е.М. Ухаль, М. Тахо, М.И. Ухаль, Р.Б. Савчук
Одесский национальный медицинский университет,
Одесса, Украина
Дооперационная морфологическая верификация инфильтративно-опухолевых образований забрюшинного пространства и периуретральной зоны является труднейшей задачей клинической онкологии. Это связано с анатомическими особенностями забрюшинного пространства и периуретральной зоны, разнообразием тканевых структур в этой области, наличием на близком расстоянии от периуретральной зоны крупных сосудов (аорты, нижней полой вены) и сложностью получения из патологических очагов тканевого материала путем перкутанной пункции под контролем ультрасонографии.
Цель исследования — повысить эффективность дооперационной морфологической верификации инфильтративно-опухолевых образований забрюшинного пространства и периуретральной зоны путем пункционной перкутанной биопсии под контролем компьютерной томографии.
В исследовании участвовали 9 пациентов в возрасте 48–72 лет. Пункцию проводили под контролем компьютерного томографа Сименс SOMA-TOM Definiton AS (64 среза)механической иглой диаметром 14 G режущего типа. Биопсию выполняли под смешанным обезболиванием методом «свободной руки». Больной находился в положении лежа на животе. Биопсию под КТ-контролем разделили на 4 этапа: 1-й — прицеливание в положении больного лежа на спине; 2-й — анестезия и выбор траектории прохождения пункционной иглы; 3-й — контроль положения биопсийной иглы в забрюшинном пространстве и мультипланарная реконструкция; 4-й — выполнение прицельной биопсии опухолево-инфильтративного образования.
При проведении биопсии по возможности выбирали кратчайший путь продвижения пункционной иглы. При этом расположение очагов инфильтративно-опухолевых образований было различным (параортально, паракавально, в проекции и ниже нижнего полюса правой и левой почки, в проекции тела и головки поджелудочной железы, в подвздошных или фланковых областях), что создавало определенные трудности для выбора начальной точки введения иглы и техники проведения биопсии. Несмотря на «флотирование» при дыхании и малые размеры (<50 мм) патологических инфильтративно-опухолевых образований у 5 пациентов, во всех случаях мы получили биопсийный материал из очагов, составляющих для нас интерес. При морфологическом исследовании биопсийных материалов гиперплазия лимфатического узла (болезнь Кастельмана) выявлена у 1 больного, метастазы рака — у 2 пациентов, фиброзная ткань с элементами воспаления — у 6 больных.
Пункционная биопсия под контролем компьютерной томографии является эффективным способом верификационной диагностики инфильтративно-опухолевых образований забрюшинного пространства и периуретральной зоны, особенно при малых размерах патологических образований.
Трудности диагностики и дифференциальной диагностики деструктивного туберкулеза и опухолей почки. Лечебная тактика
И.М. Русинко, Н.М. Русинко, О.Г. Коноплева
КУ «Днепропетровское 12-е территориальное медицинское объединение Днепропетровского областного совета»,
Днепропетровск, Украина
Среди органных внелегочных поражений туберкулез почек является наиболее распространенной формой заболевания и встречается в урологии в 30–40% наблюдений. Первоначально при туберкулезе почек происходит поражение коркового слоя органа. Дальнейшее прогрессирование инфекции сопровождается распадом тканей, образованием полостей и каверн в почечной паренхиме. В тяжелых случаях отмечают развитие туберкулезного пионефроза, вовлечение в инфекционный процесс лоханки, мочеточника, мочевого пузыря, половых органов.
Возбудителями туберкулеза почек являются микобактерии туберкулеза (M. tuberculosis). Как правило, туберкулез почек возникает у пациентов с запущенным легочным или костным туберкулезом через 3–10 лет после лечения первичного туберкулезного процесса. Проникновение инфекции в почку происходит преимущественно гематогенным путем. Попадая с током крови в клубочковый аппарат почки, микобактерии формируют множественные мельчайшие туберкулезные очаги. В дальнейшем инфекция распространяется в мозговое вещество почки, вызывая туберкулезный папиллит. По мере развития туберкулеза почек в процесс вовлекается вся толща паренхимы почки, происходит казеозный распад последней, что сопровождается образованием изолированных или сообщающихся с чашечками и лоханкой каверн. Прогрессирование туберкулеза почек может привести к формированию в почечной паренхиме множественных полостей (поликавернозная форма) и развитию пионефроза. Последующее заживление каверн протекает с обызвествлением казеозных очагов, в которых могут сохраняться жизнеспособные микобактерии туберкулеза.
В клинической урологии принята классификация, учитывающая клинико-рентгенологические особенности туберкулеза почек:
- туберкулез почечной паренхимы, сопровождающийся образованием множественных очагов в корковом и медулярном слое почки;
- туберкулезный папиллит, протекающий с поражением почечных сосочков;
- кавернозный туберкулез почек, характеризующийся слиянием деструктивных очагов с инкапсуляцией (полосная форма);
- фиброзно-кавернозный туберкулез почек, сопровождающийся облитерацией чашечек с формированием в них замкнутых деструктивно-гнойных полостей;
- омелотворение (обызвествление) почки, выражающееся в формировании ограниченных полостных очагов с большим количеством солей кальция (казеома, туберкулема).
С учетом того, что туберкулез почек может протекать бессимптомно или в виде различных клинических вариантов, в диагностике первостепенное значение приобретает проведение лабораторных и аппаратно-инструментальных исследований. При подозрении на туберкулез почек показана консультация фтизиоуролога. При сборе анамнеза выясняют факт наличия легочного туберкулеза у самого пациента и его родственников, контакты с больными туберкулезом. У худых пациентов в ряде случаев удается пропальпировать плотную, бугристую почку. Определяется ярко выраженный симптом Пастернацкого.
Характерными изменениями общего анализа мочи при туберкулезе почек служат стойкая резко кислая реакция, лейкоцитурия, протеинурия, эритроцитурия. Достоверно судить о наличии туберкулеза почек позволяет выявление микобактериурии при помощи бактериологического посева мочи или полимеразной цепной реакции. Проведение иммуноферментного анализа дает возможность определить антитела к туберкулезу.
В отдельных случаях необходимо выполнение провокационных тестов с туберкулином. После подкожного введения туберкулезного антигена происходит обострение туберкулеза почек, что сопровождается выраженной протеинурией, пиурией и микобактериурией.
Ультразвуковое исследование почек при их туберкулезном поражении позволяет выявлять каверны, обызвествленные очаги, оценить степень вовлечения почечной паренхимы и динамику регресса туберкулеза почек под действием проводимой терапии.
Рентгенологическое исследование почек (обзорная урография, экскреторная урография, ретроградная уретеропиелография и антеградная пиелография) помогают комплексно оценить состояние паренхимы и чашечно-лоханочного аппарата почек, мочеточников, мочевого пузыря. Выполнение почечной ангиографии позволяет определить внутриорганную ангиоархитектонику в случае необходимости резекции почки.
Широкими диагностическими возможностями в отношении выявления туберкулеза почек обладают компьютерная томография почек и магнитно-резонансная томография. Данные о функциональном состоянии почек при туберкулезе получают с помощью радиоизотопной нефросцинтиграфии.
Необходима дифференциальная диагностика туберкулеза почек с гидронефрозом, неспецифическим пиелонефритом, губчатой почкой, мегакаликозом, поликистозом почки, опухолями почек.
В литературе неоднократно сообщалось о трудностях дифференциальной диагностики между туберкулезом и опухолями почки. Эти трудности обусловлены сходством многих симптомов данных заболеваний — как клинических (гематурия, лихорадка, пальпируемая почка), так и рентгенологических (ампутация чашечки, деформация лоханки). Нефротуберкулез вызывает подозрение на опухоль почки в тех случаях, когда проявляет себя тотальной безболевой гематурией, а на урограммах визуализируется «опухолеподобная» деформация чашечно-лоханочной системы опухолеподобным инфильтратом или отключенной каверной. Последняя иногда заполняется на экскреторной урографии, что вносит ясность в диагноз. Окончательно решает вопрос выполнение компьютерной томографии и почечной артериографии.
В 10% случаев злокачественные опухоли почки, независимо от их размеров, содержат очаги кальцификации. Такие очаги широко варьируют в количестве и размере: от точечных кальцификатов до обызвествления всей опухолевой ткани; они обычно располагаются в старых гипернефроидных опухолях. Помимо теней неправильной формы, обусловленных очагами кальцификации, расположенными в центре опухоли, иногда бывают видны обызвествленные очаги по периферии опухоли в виде полумесяца.
При проведении дифференциальной диагностики между туберкулезом и опухолями почки следует различать два самостоятельных момента: дифференциальную диагностику туберкулеза почки и ее опухоли и диагностику сочетания туберкулеза и опухоли в одной и той же почке. В первом случае наличие общих клинико-рентгенологических симптомов при туберкулезе и опухоли почки является источником диагностических ошибок. Эти ошибки усугубляются иногда влиянием на заключение уролога о наличии у пациента в настоящем или прошлом туберкулеза других органов.
Под нашим наблюдением находились 23 пациента, поступивших с диагнозом туберкулеза почки, у которых при дообследовании и превентивном противотуберкулезном лечении в 18 случаях выявлена опухоль почки, а в 5 — сочетание деструктивного туберкулеза и опухоли почки. Во всех случаях выполнено оперативное лечение: резекция полюса почки или нефректомия.
На рис. 1 приведены данные сочетания деструктивного туберкулеза и опухоли почки у пациента М. (56 лет).
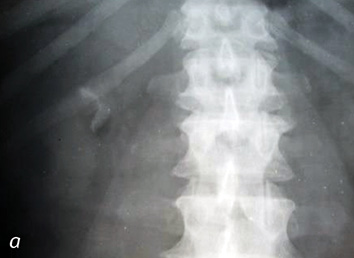
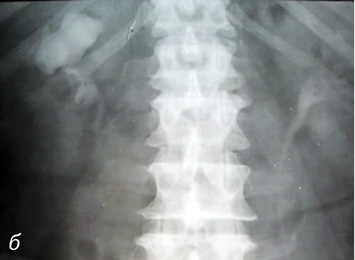
На рис. 2. представлен случай папиллярного рака и кавернозного туберкулеза почки у пациента С. (68 лет).
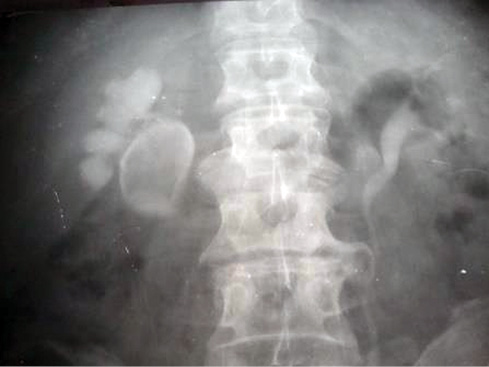
На рис. 3 представлен гипернефроидный рак центрального отдела левой почки у пациента К. (58 лет).

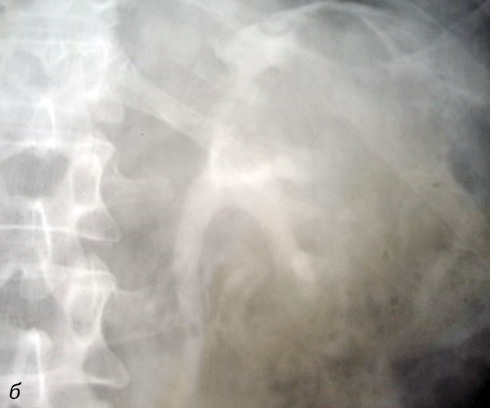
На рис. 4 проиллюстрирован случай ампутации чашечек верхнего полюса левой почки при гипернефроидном раке у пациентки К. (34 года).
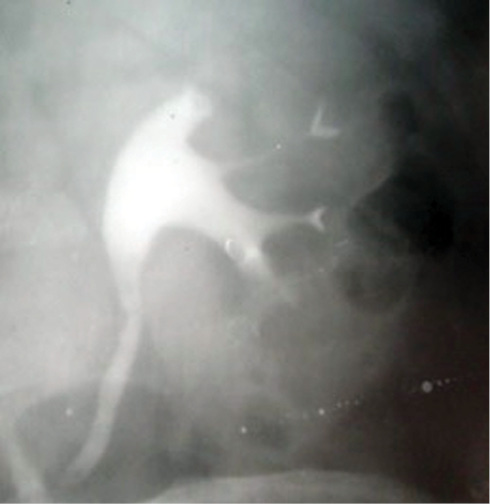
На рис. 5 представлено сочетание деструктивного туберкулеза правой почки и мочеточника и гипернефроидного рака левой почки с множественными очагами кальцификации у пациентки Ц. (48 лет).














Leave a comment