Радикальне хірургічне лікування злоякісних периампулярних новоутворень
Копчак В.М., Хомяк И.В., Копчак К.В., Дувалко А.В., Перерва Л.А., Симонов О.М., Сердюк В.П., Борисов Б.В.
Резюме. Нами проаналізовано досвід виконання 468 панкреатодуоденальних резекцій (ПДР) у пацієнтів зі злоякісними періампулярними новоутвореннями за період з 1998 по 2010 р. У 344 пацієнтів виконано стандартну ПДР, у 124 — з пухлинами великого сосочка дванадцятипалої кишки та дистального відділу холедоха-пилорус-зберігаючою методикою. Ми застосували індивідуальний підхід із використанням сучасних технологій ПДР. У 45 пацієнтів виконано ПДР із судинними резекціями. У 24 пацієнтів ми виконали no-touch ПДР. Окрім того, провели аналіз результатів виконання модифікованої розширеної лімфаденектомії у пацієнтів із ПДР. Ускладнення розвинулись у 29,9% пацієнтів, летальність становила 2,6%. Середня виживаність становила 24, 48, 72 міс у пацієнтів із пухлинами підшлункової залози, дистального відділу холедоха та великого сосочка дванадцятипалої кишки відповідно. Запровадження нових методик ПДР потенційно може покращити ранні та віддалені результати її виконання.
Резюме. Нами проанализирован опыт выполнения 468 панкреатодуоденальных резекций (ПДР) у пациентов со злокачественными периампулярными новообразованиями в период с 1998 по 2010 год. 344 пациентам выполнена стандартная ПДР, 124 больным с опухолями большого сосочка двенадцатиперстной кишки и дистального отдела холедоха-пилорус-сохраняющей методики. Мы применили индивидуальный подход с применением современных технологий ПДР. 45 пациентам выполнена ПДР с сосудистыми резекциями. 24 больным мы выполнили no-touch ПДР. Кроме того, мы провели анализ результатов модифицированной расширенной лимфаденэктомии у пациентов с ПДР. Осложнения возникли у 29,9% пациентов, летальность составила 2,6%. Медиана выживаемости составила 24, 48, 72 мес у пациентов с опухолями поджелудочной железы, дистального отдела холедоха и большого сосочка двенадцатиперстной кишки соответственно. Внедрение новых методик ПДР потенциально может улучшить ранние и отдаленные результаты их выполнения.
Вступление
Радикальная панкреатодуоденальная резекция (ПДР) является золотым стандартом хирургического этапа лечения злокачественных периампулярных новообразований. Соответственно, вполне логичным является стремление ведущих хирургических коллективов к улучшению как непосредственных, так и отдаленных результатов этой операции.
Материалы и методы
За период с 1998 по 2010 г. нами выполнено 468 ПДР у больных со злокачественными опухолями органов периампулярной зоны. Мужчин было 242 (51,7%), женщин 226 (48,3%), в возрасте от 27 до 87 лет, средний возраст больных составил 55,4+9,5 года. У 194 (41,4%) больных диагностирована протоковая аденокарцинома головки поджелудочной железы, у 15 (3,2%) больных – злокачественные нейроэндокринные опухоли, у 16 (3,4%) — злокачественные кистозные опухоли головки поджелудочной железы, у 182 (38,9%) — злокачественные опухоли большого сосочка (БС) двенадцатиперстной кишки (ДПК), у 49 (10,5%) — злокачественные опухоли дистального отдела холедоха, у 12 (2,6%) — злокачественные опухоли ДПК.
Стандартная методика ПДР по Whipple была выполнена у 344 больных. При опухолях БС ДПК и дистального отдела холедоха считали возможным выполнение пилорус-сохраняющей методики ПДР, выполненной у 124 больных.
Наличие инвазии опухоли в воротную или верхнюю брыжеечную вену было показанием к краевой резекции вены (28 больных) либо циркулярной резекции последней с последующей ее пластикой с использованием аутовены или анастомоза «конец в конец» (13 больных). У 4 больных была выполнена ПДР с резекцией пораженного участка общей печеночной артерии и восстановлением артериального кровотока путем артериального шва «конец в конец».
Результаты и обсуждение
Осложнения выявлены у 140 больных (29,9%), что привело к летальным исходам в 12 случаях (2,6%). Умерло 2 пациента с сопутствующими сосудистыми резекциями (1 после резекции воротной вены и 1 после резекции печеночной артерии). Летальность у больных с сосудистыми резекциями составила 4,4%.
Мы начали внедрять в практику некоторые хирургические приемы при выполнении ПДР.
С целью профилактики несостоятельности дуоденоеюноанастомоза вследствие ухудшения кровоснабжения культи ДПК мы внедрили в свою практику пилорус-сохраняющую ПДР с сохранением гастродуоденальной артерии. По данным литературы, применение этой методики приводит к значительному снижению частоты некроза стенки ДПК и позволяет сохранять культю ДПК значительно более длинную в сравнении со стандартной методикой, не сказываясь при этом негативно на степени радикальности резекции [1, 2]. При выполнении операции в этой модификации мобилизация комплекса достигается путем перевязки и пересечения не гастродуоденальной артерии, а передней и задней панкреатодуоденальных артерий (рис. 1). Подобная методика успешно применена нами у 5 больных.
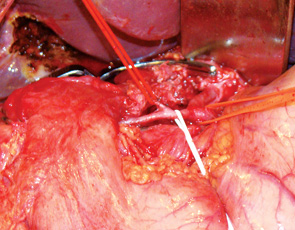
С целью профилактики послеоперационного панкреатита культи поджелудочной железы у 2 пациентов была применена разработанная нами методика ПДР с селективной перевязкой правой ветви дорзальной панкреатической артерии. Эта методика основана на том, что второй по величине артерией, кровоснабжающей тело и хвост поджелудочной железы, является поперечная панкреатическая артерия, чаще всего отходящая от дорзальной панкреатической артерии и проходящая по задней поверхности левого сегмента поджелудочной железы. Мы разработали метод ПДР с селективной перевязкой правой ветви дорзальной панкреатической артерии, который за счет сохранения левой ветви дорзальной панкреатической артерии позволяет избежать некроза культи поджелудочной железы и несостоятельности панкреатоеюноанастомоза вследствие ишемии культи железы (рис. 2).
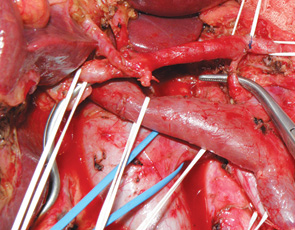
У 8 пациентов мы применили технологию ПДР резекции с селективной первичной перевязкой нижней панкреатодуоденальной артерии, позволяющей значительно уменьшить уровень интраоперационной кровопотери [3]. Эта технология реализуется путем последовательного выделения верхней брыжеечной артерии, панкреатодуоденоеюнального ствола (при его наличии), нижней панкреатодуоденальной артерии, а при ее отсутствии отдельно передней и задней панкреатодуоденальных артерий, верхней тонкокишечной артерии (рис. 3). Селективную перевязку нижней панкреатодуоденальной артерии выполняем после ее пробного временного пережатия атравматичной артериальной клипсой во избежание ошибочной перевязки верхней тонкокишечной артерии.
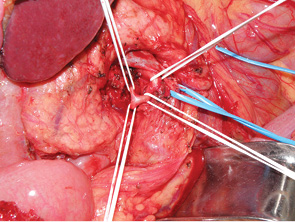
Применение селективной перевязки нижней панкреатодуоденальной артерии при выполнении ПДР сопровождалось средним уровнем интраоперационной кровопотери в размере 266,25+197,4 (от 80 до 750 мл), что было значительно ниже средних уровней кровопотери при выполнении ПДР. Следует отметить, что наши предварительные данные соотносятся с данными, полученными другими авторами [3].
При подозрении на наличие инвазии опухоли в верхней брыжеечной артериии, у 3 пациентов выполнен задний доступ (Posterior approach) к верхней брыжеечной артерии, который позволяет на ранних этапах операции выявлять нерезектабельность опухоли и избежать выполнения R2 резекции [4]. Posterior approach ПДР включает выполнение широкой мобилизации ДПК по Кохеру с последующей обработкой связки крючковидного отростка поджелудочной железы и отделением от удаляемого комплекса верхней брыжеечной артерии как первого этапа ПДР.
Важным и дискутабельным вопросом при выполнении ПДР является необходимый объем лимфаденэктомии и невродиссекции. Мы считаем необходимым и показанным выполнение модифицированной расширенной забрюшинной лимфаденэктомии с диссекцией 1-й и 2-й порции нервного сплетения головки поджелудочной железы и правого полулунного ганглия. В своей практике сначала мы выполняем регионарную лимфаденэктомию (рис. 4) и диссекцию частично первой и в полном объеме второй порции нервного сплетения поджелудочной железы (вокруг правой полуокружности верхней брыжеечной артерии с обязательным сохранением нервных стволов по ходу левой полуокружности верхней брыжеечной артерии) единым блоком с удаляемым панкреатодуоденальным комплексом. После чего при необходимости выполняем сосудистую реконструкцию. Далее по показаниям удаляем единым блоком забрюшинную клетчатку с лимфатическими узлами (группы №16a1 inter, 16a2 inter и latero, 16b1 inter и latero, 16b2 inter и latero, латерокавальные лимфоузлы). Границы диссекции в забрюшинном пространстве: верхняя — ножки диафрагмы, нижняя — бифуркация аорты, правая — ворота правой почки (рутинное удаление паранефральной клетчатки мы не выполняем), левая — ворота левой почки. В завершении резекционного этапа мы отдельным препаратом удаляем правый полулунный ганглий, завершая тем самым диссекцию первой порции нервного сплетения поджелудочной железы. При выполнении ретроперитонеальной лимфаденэктомии мы используем модифицированный транслатеральный подход (translateral retroperitoneal approach), который обеспечивает идеальный доступ к забрюшинному пространству, а также значительно облегчает диссекцию зоны верхних брыжеечных сосудов [5].
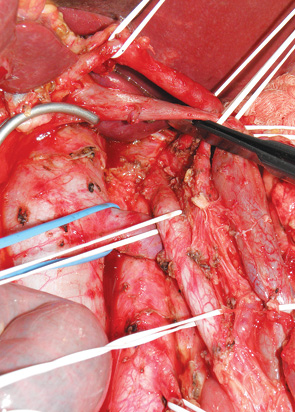
Исследованием М.Hirota [6] было доказано, что пальпация периампулярной опухоли с целью ревизии, мобилизация ДПК по Кохеру и осуществление тракции за головку поджелудочной железы по ходу мобилизации панкреатодуоденального комплекса повышает частоту появления метастазов в печени. Этот факт подтолкнул Hirota к разработке no-touch ПДР, главным отличием которой является выполнение мобилизации ДПК по Кохеру как завершающего этапа ПДР уже после полной перевязки всех артерий, вен, лимфатических протоков и пересечения связки крючковидного отростка. В своей практике мы чаще используем технику no-touch ПДР по Nagai, более широко известную в Японии как «Jichi method» [7]. Эта технология так же подразумевает отказ от мобилизации ДПК по Кохеру до полной перевязки всех артерий, вен, лимфатических протоков панкреатодуоденального комплекса и пересечения связки крючковидного отростка. Основным отличием «Jichi method» от методики, предложенной Hirota, является завершение операции не стандартной мобилизацией ДПК по Кохеру а, так называемой реверсированной кохеризацией — мобилизации комплекса в направлении от верхних брыжеечных сосудов (слева направо). Подобный подход позволяет безопасно и под полным визуальным контролем выполнить модифицированную расширенную лимфаденэктомию, удалив забрюшинную клетчатку единым блоком с панкреатодуоденальным комплексом, и снижает риск возникновения метастазов в печени (рис. 5). С 2008 г. у 24 пациентов ПДР выполнена по no-touch методике.
По данным литературы [6, 7], выполнение no-touch ПДР приводит к значительному и статистически достоверному увеличению продолжительности жизни пациентов и снижению риска развития гематогенного метастазирования в печени. Незначительное количество пациентов и короткие сроки послеоперационного наблюдения (максимально — 34 мес) не позволяют нам сделать собственные выводы об эффективности данных методик для повышения уровня 5-летнего выживания. На момент написания статьи 1 пациентка умерла через 6 мес. После оперативного вмешательства 1 пациентка жива с признаками метастатического поражения печени, обнаруженного через 6 мес после оперативного вмешательства, остальные пациенты живы без признаков рецидива опухоли, при этом 17 пациентов пережили годичный рубеж без признаков рецидива опухоли и отдаленных метастазов. Уровень годичной выживаемости без рецидива опухоли составил 89,5%.
Применение нами новых технологий выполнения ПДР не привело к повышению летальности пациентов. Большинство технологических приемов не приводят к увеличению длительности оперативного вмешательства. Основным технологическим приемом, занимающим длительное время (дополнительных 1,5–2 часа), являлось выполнение модифицированной расширенной лимфаденэктомии и невродиссекции в сравнении со стандартной. Данная методика у всех больных приводила к выраженной лимфорее, требующей коррекции консервативной интенсивной терапии в раннем послеоперационном периоде (высокие дозы октреотида и заместительная терапия альбумином и свежезамороженной плазмой) и увеличению длительности дренирования брюшной полости. В то же время частота опухолевого поражения лимфоузлов, дополнительно удаляемых при расширенной модифицированной лимфодиссекции по нашим данным составляла 27%. Расширенная лимфодиссекция у этих пациентов позволяет повысить статус резекции (R).
Сохранение гастродуоденальной артерии, селективная перевязка правой ветви дорзальной панкреатической артерии и no-touch ПДР в наших наблюдениях были технически выполнимыми, не сопровождались увеличением уровня интраоперационных осложнений и длительности оперативного вмешательства.
1-, 3-, и 5-летняя выживаемость у больных с протоковыми аденокарциномами головки поджелудочной железы составила 71, 43, 15% соответственно, медиана — 24 мес. 1-, 3-, и 5-летняя выживаемость у больных с аденокарциномами БС ДПК составила 88, 79 и 58% соответственно, медиана — 72 мес. 1-, 3-, и 5-летняя выживаемость у больных с опухолями дистального отдела холедоха составила 82, 54, 26% соответственно, медиана — 48 мес. У больных с резекциями пораженного венозного участка продолжительность жизни статистически не отличалась от таковой при ПДР без венозных резекций. Все пациенты после выполнения ПДР с резекцией пораженного участка общей печеночной артерии умерли в сроки от 1 до 3 лет.
Заключение
Таким образом, наиболее адекватным вариантом хирургического этапа лечения злокачественных периампулярных опухолей следует считать ПДР с модифицированной расширенной радикальной лимфаденэктомией. Инвазия опухоли в воротную/верхнюю брыжеечную вену является показанием к выполнению ПДР с резекцией и реконструкцией вены. Перспективным направлением, которое потенциально может улучшить отдаленные результаты лечения за счет снижения частоты появления метастазов в печени, является no-touch технология выполнения ПДР. Выполнение вариантов ПДР с сохранением гастродуоденальной и дорзальной панкреатической артерий позволяет достигнуть снижения количества послеоперационных осложнений.
Литература
1. Nagai H., Ohki J., Kondo Y., (1996) Pancreatoduodenectomy with Preservation of the Pylorus and Gastroduodenal Artery Ann Surg., 223(2):194–8.
2. Skandalakis J.E., Gray S.W., Rowe J.S. Jr., et al. (1979) Anatomical complications of pancreatic surgery. Contemp Surg., 15: 17–50.
3. Kawai M., Tani M., Ina S., et al. (2008) CLIP method (preoperative CT image-assessed ligation of inferior pancreaticoduodenal artery) reduces intraoperative bleeding during pancreaticoduodenectomy. World J Surg., 32(1):82–7.
4. Pessaux P., Varma D., Arnaud JP. et al. (2006) Pancreaticoduodenectomy: superior mesenteric artery first approach. J Gastrointest Surg., 10(4): 607–11.
5. Nagakawa T., Kurachi M., Konishi K., et al. (1982) Translateral retroperitoneal approach in radical surgery for pancreatic carcinoma. Jpn J Surg., 12(3): 229–33.
6. Hirota M., Shimada S., Yamamoto K., et al. (2005) Pancreatectomy using the no-touch isolation technique followed by extensive intraoperative peritoneal lavage to prevent cancer cell dissemination: a pilot study JOP, 6(2):143–51.
7. Nagai H. (2003) Configurational anatomy of the pancreas: its surgical relevance from ontogenetic and comparative-anatomical viewpoints. J. Hepatobiliary Pancreat Surg.,10(1): 48–56.














Leave a comment