Вивчення статусу сторожових лімфовузлів при хірургічному лікуванні раку шлунка
Щепотін І.Б.1, Розумій Д.О.1, Колеснік О.О.1, Лукашенко А.В.1, Жуков Ю.О.1, Енгел О.Т.2, Бурлака А.А.2, Махмудов Д.Е.1, Штанько О.І.3, Кульмінський В.І.3, Волк М.О.1
- 1Національний інститут раку, Київ
- 2Національний медичний університет ім. О.О. Богомольца, Київ
- 3Севастопольський міський онкологічний диспансер, Севастополь
Мета: вивчити можливості й точність методики визначення сторожового лімфатичного вузла (СЛВ) при хірургічному лікуванні раку шлунка (РШ). Матеріали і методи: 157 хворих на РШ T2-4N0-2M0, яким виконано радикальне оперативне лікування в обсязі радикальної гастректомії та лімфодисекції D2. Біопсію СЛВ проводили з використанням під час операції контрастування лімфовузлів введенням метиленового синього по периферії пухлини. Вивчалися технічні аспекти, визначалися точність, чутливість і специфічність методики. Результати: СЛВ виявлено у 116 зі 157 пацієнтів; загальна кількість видалених СЛВ становила 225, в середньому по 2 (від 1 до 3). У 55 хворих виявлено метастази у СЛВ. До першого рівня лімфатичного відтоку належали 205 із 225 визначених СЛВ (91%) , а лише 20 СЛВ (9%) — до другого рівня. Лише 10 випадків експрес-дослідження СЛВ виявилися помилковонегативними. Із 41 пацієнта з відсутністю контрастування СЛВ у 31 (75,6%) виявлено метастази у лімфатичних вузлах, і у 10 (24,4%) — pN0-статус. Встановлено здатність біопсії СЛВ прогнозувати стан регіонарного лімфатичного колектора з чутливістю методу 91% та специфічністю 100%. Висновки: результати проведеного нами дослідження свідчать, що методика визначення сторожового лімфатичного вузла при оперативному лікуванні раку шлунка технічно можлива, має високу чутливість і специфічність.
Вступ
Незважаючи на зниження захворюваності у більшості країн світу, рак шлунка все ще залишається однією із основних невирішених проблем охорони здоров’я та займає друге місце за статистикою онкологічної смертності. Прогнози виживаності хворих із місцево-поширеним раком шлунка є критично низькими в економічно розвинених країнах, оскільки загальна виживаність стновить ≤25%, незважаючи на розширені обсяги оперативних втручань. Визначення об’єму лімфодисекції конкретному хворому при раку шлунка все ще залишається у стадії поглибленого вивчення, а протоколи оперативного лікування не мають повної доказової бази. Тому нині актуальною для дослідження є розробка методів діагностування ступеня враження регіонарних лімфатичних вузлів (ЛВ) при раку шлунка.
Мета проведеного нами дослідження — вивчення і узагальнення даних літератури з цього питання і оцінка власних результатів вивчення статусу сторожових ЛВ у хворих на рак шлунка.
Хірургічне лікування раку шлунка
Основна мета хірургічного лікування раку шлунка полягає у досягненні повного видалення пухлини зі збереженням гістологічної чистоти країв резекції (R0). Згідно з даними літератури лише у 50% пацієнтів вдається досягти бажаних результатів.
Операції при раку шлунка класифікують за обсягом виконаної під час операції лімфодисекції. Японським товариством The Japanese Research Society for the Study of Gastric Cancer розроблено принципи проведення оцінки патогістологічної експертизи видаленого макропрепарату та оцінки ураження регіонарних ЛВ [1]. Відповідно до їхньої класифікації група перигастральних ЛВ вздовж малої кривизни шлунка (групи 1; 3 та 5) та великої кривизни (2; 4 та 6) становлять групу N1. ЛВ вздовж лівої шлункової артерії (група 7), загальної печінкової артерії (група 8), артерії celiac (група 9), селезінкової артерії (групи 10 та 11) становлять N2. Більш віддалені вузли, включаючи парааортальні (N3, N4), розцінюються як віддалені метастази. Обсяг лімфодисекції D0 включає неповну лімфодисекцію групи N1. Лімфодисекція по D1 включає виконання дистальної, проксимальної субтотальної резекції шлунка чи гастректомії, в тому числі ЛВ вздовж малої та великої кривизни шлунка. Видалення сальникової сумки з переднім листком очеревини mesocolon та очищенням відповідних артерій розцінюється як D2. Так, при проксимальних пухлинах шлунка лімфодисекція в обсязі D2 передбачає виконання спленектомії (з метою видалення груп ЛВ 10 та 11).
Проведено ректроспективний аналіз ефективності виконання розширених лімфодисекцій при поширених формах раку шлунка. У це дослідження було включено 1377 пацієнтів, яким встановлено діагноз поширеного раку шлунка, інформацію отримано із Surveillance Epidemiology та End Results (SEER). Результати дослідження свідчать, що у пацієнтів, кількість досліджених ЛВ яких становила >15 (N2) та >20 (N3), були кращі показники віддаленої виживаності [2].
Відомо, що гастректомія із лімфодисекцією D2 є стандартом лікування хворих із резектабельним раком шлунка у Східній Азії. У контрольному дослідженні (JCOG9501) японські дослідники порівнювали лімфодисекцію в обсязі D2 із D3, де виконували видалення парааортальних груп ЛВ; показано, що у пацієнтів, яким виконували гастректомії з приводу резектабельного раку шлунка (T2b, T3 чи Т4), результати післяопераційної смертності становили 0,8% у кожній групі [3]. Кінцеві результати цього дослідження показали, що розширена D3-лімфодисекція порівняно із D2-лімфодисекцією не покращує виживаності. Загальна 5-річна виживаність становила 70,3 та 69,2% відповідно. Не було також відмінностей у групах при оцінці безрецидивної виживаності [4]. Дослідники прийшли до висновку, що лімфодисекція парааортальної зони у хворих на резектабельний рак шлунка не має використовуватись .
Японські дослідники часто підкреслювали цінність розширених лімфодисекцій (D2 та більше). Однак західні колеги не підтвердили переваги розширених лімфодисекцій над D1 [5,6]. У дослідженні Dutch Gastric Cancer Group взяли участь 711 пацієнтів. Учасники були рандомізовані на групи, в одній з яких виконували лімфодисекцію D1, у другій — D2-лімфодисекції. В обох группах рівень післяопераційних ускладнень (25% проти 43%; р<0,001) та смертності (4% проти 10%; р=0,004) були вищими у пацієнтів, яким виконали лімфодисекцію D2 без різниці в показниках загальної виживаності (30% проти 35%; р=0,53). Відзначено, що пацієнти із N2 мали кращу виживаність при виконанні лімфодисекції D2 порівняно із D1. Однак показник N2 можна встановити лише після дослідження видаленого препарату.
Експертиза British Cooperative, яку провели Medical Research Council, також не змогла продемонструвати переваги D2- над D1-лімфодисекцією [7]. 5-річна загальна виживаність становила 35% при D1 та 33% — при D2. Крім того, D2 пов’язували з підвищеними показниками післяопераційної смертності та ускладнень. Висновками цих досліджень було також те, що виконання лімфодисекції D2 із спленектомією чи панкреатектомією значно підвищує післяопераційну смертність та частоту ускладнень.
Проте, незважаючи на отримані результати, інтерес до розширених лімфодисекцій не зник [8]. Дослідники стверджували, що при можливості знизити рівні післяопераційної смертності та ускладнень у ранній післяопераційний період лімфодисекція в обсязі D2 можлива для ряду відібраних пацієнтів. Хірургічним вибором, який здатний знизити захворюваність і смертність, є лімфодисекція в обсязі D2 без видалення селезінки та панкреатектомії [9, 10].
Дослідження ІІ фази, яке проводили Italian Gastric Cancer Study Group (IGCSG), встановило, що при виконанні лімфодисекції D2 зі збереженням підшлункової залози у онкологічному центрі відзначається покращанням виживаності [11]. Загальна 5-річна виживаність всіх пацієнтів становила 55%, а післяопераційна смертність — 3,1% [12]. Отримані результати подібні до результатів групи Dutch та United Kingdom trial. Панкреатектомія та спленектомія при D2 призводять до підвищення рівня післяопераційної смертності та ускладнень.
Інші дослідження у західних країнах також показали кращі результати виживаності пацієнтів після виконання лімфодисекцій D2 відповідно до рекомендацій Japanese Research Society of Gastіric cancer. В австрійському дослідженні 5- та 10-річна загальна виживаність становила 45,7 та 34,3% відповідно [13]. Згідно з результатами японських дослідників у пацієнтів, які перенесли радикальне оперативне лікування, 5- та 10-річна виживаність становила 57,7 та 44,3% відповідно, післяопераційна смертність при R0, R1 та R2 — 4,9; 9 та 13,4% відповідно.
Визначення сторожового ЛВ
Після піонерських праць Cabanas та Morton концепція сторожового ЛВ, який першим отримує лімфу від первинної пухлини, широко обговорюється у спільноті хірургічних онкологів. Відомо, що метастазування у лімфатичну систему є типовим для злоякісних пухлин епітеліального походження, зокрема раку шлунка. Наявність та кількість метастатично уражених ЛВ вважається важливим фактором прогнозу перебігу захворювання, критичним для стадіювання та призначення ад’ювантного лікування. Техніка визначення сторожового ЛВ при меланомі шкіри та раку молочної залози добре розроблена, однак можливість застосування концепції сторожового ЛВ при раку шлунка все ще активно досліджується. Інтраопераційна візуалізація сторожових ЛВ стала можливою лише у 90-ті роки ХХ ст., коли було розроблено два способи їх ідентифікації : фарбування хімічними речовинами та радіоізотопна індикація [14]. Суть методів полягає в можливості індивідуальної оцінки наявності метастатичного ураження регіонарного лімфатичного апарату під час операції, індивідуалізації показань до лімфодисекції та покращання віддалених результатів оперативного лікування [15]. Дані про можливість застосування методики визначення сторожового ЛВ у хворих на пухлини шлунково-кишкового тракту з’явились у літературі 10 років тому. G.J. Tsionlia та співавтори (2000) виконали інтраопераційне контрастування ЛВ введенням ізосульфату синього по периферії пухлин у 65 хворих на рак органів шлунково-кишкового тракту, в тому числі у 6 хворих на рак шлунка [16]. Як описано вище, хірургічне лікування раку шлунка, зокрема обсяг лімфодисекції, розрізняється у окремих хірургічних центрах. Згідно з міжнародними рекомендаціями лікування раку шлунка, оперативне втручання має супроводжуватися лімфодисекцію в обсязі D2. Однак розширені лімфодисекції пов’язані зі збільшенням кількості післяопераційних ускладнень та летальності, тому актуальним є вивчення способів прогнозування метастатичного ураження регіонарних ЛВ при раку шлунка. Отже, точних перед- та інтраопераційних методів визначення метастатичного ураження ЛВ при раку шлунка бракує, а виявлення сторожового ЛВ теоретично може прогнозувати статус інших ЛВ та служити показанням до обсягу лімфодисекції [17, 18]. На жаль, широкий лімфатичний відтік від шлунка призводить до частого виявлення scip-метастазів до другого рівня ЛВ, які, за даними літератури, відзначають у ≈17% випадків [19, 20]. Однак інша точка зору свідчить про винятковість цього явища, що виникає у 0,9–5,3%. За даними рандомізованого дослідження B. Huang та співавторів, проведеного у 2011 р. [21], в якому взяли участь 207 хворих на рак шлунка, ураження перигастральних сторожових ЛВ спостерігалося у 82,1% (N1-статус), однак у 17,9% відзначалось ураження віддалених груп ЛВ без ураження сторожових («мігруючі» метастази). Отже, контрастування та біопсія сторожового ЛВ є однією з сучасних концепцій, яка поєднала прагнення до оптимізації лікування, покращання виживаності та досягнення максимально високої якості життя хворих.
Одним із показників чутливості методу є наявність помилковонегативних результатів, тобто розбіжність між негативним результатом експрес-дослідження сторожових ЛВ та наявністю метастатичного ураження ЛВ при остаточному патогістологічному дослідженні. Помилковонегативні результати дослідження виникають при метастатичному ураженні клітковини, що оточує сторожовий ЛВ через блок відтоку лімфи у хворих на недиференційований рак. З метою більш точної ідентифікації сторожового ЛВ та зменшення кількості помилковонегативних результатів запропонована методика дисекції лімфатичного блоку, коли видалялись усі лімфатичні компоненти в зоні фарбування з подальшим виділенням контрастованого вузла з блоку тканин [22, 23].
Результати власних досліджень
Мета проведеної нами роботи — вивчити інформативність методики визначення сторожового ЛВ при хірургічному лікуванні раку шлунка. Підвищити ефективність хірургічного лікування при цій патології шляхом визначення оптимального обсягу лімфодисекції при застосуванні методики дослідження сторожового ЛВ.
За період 2008–2010 рр. на базі відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку вивчено безпосередні результати лікування 157 хворих на резектабельний рак шлунка з інтраопераційною діагностикою ступеня розповсюдженості пухлини шляхом термінового гістологічного дослідження сторожових ЛВ та виконання оментобурсектомії.
Так, хворим під час операції у стінку шлунка субсерозно по периферії пухлини вводили 1–2 мл водорозчинного барвника (метиленового синього), через 8–15 хв візуально визначали позитивне/негативне забарвлення сигнальних ЛВ. Зафарбовані ЛВ у кількості від 1 до 3, розташовані залежно від локалізації пухлини ретропілорично, у великому чи малому сальнику або вздовж лівої шлункової артерії, відправлялися на термінове гістологічне дослідження. Усім хворим виконували лімфодисекцію в обсязі D2. Класифікація видалених ЛВ проводилася згідно з класифікацією Japanese Gastric Cancer Association (JGCA, 1998), в якій детально описано 20 груп регіонарних ЛВ, що формують три послідовні етапи метастазування від різних відділів шлунка.
Точність методики виявлення сторожового ЛВ у прогнозуванні наявності або відсутності метастазів в інших ЛВ оцінювалася відповідно до таких критеріїв: чутливість: істиннопозитивні ЛВ/(істиннопозитивні ЛВ + помилковонегативні ЛВ) та специфічність: істиннонегативні ЛВ/(істиннонегативні + помилково негативні ЛВ).
Результати та їх обговорення
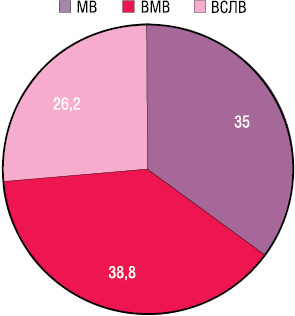
Проведено аналіз результатів лікування хворих на рак шлунка з дослідженням сторожових ЛВ. Хворих було розподілено на групи для визначення ролі кожного з компонентів лікування (рисунок):
Група із метастатичним ураженням сторожових ЛВ (МВ).
Група із відсутністю метастатичного ураження сторожових ЛВ (ВМВ).
Група хворих, у яких сторожовий ЛВ був відсутній (ВСЛВ).
Усім хворим виконувалася радикальна операція з лімфаденектомією в обсязі D2. Середній вік хворих становив 52,2±7,1 року. Характеристику груп хворих за класифікацією TNM і за типом росту пухлини наведено в табл. 1.
| Показник | ВМ | ВМВ | МСЛВ | |||
|---|---|---|---|---|---|---|
| n | % | n | % | n | % | |
| pT2 | 5 | 9,0 | 15 | 24,6 | 5 | 12,2 |
| pT3 | 40 | 73,0 | 40 | 65,6 | 31 | 75,6 |
| pT4 | 10 | 18,0 | 6 | 9,8 | 5 | 12,2 |
| pN0 | 61 | 100 | 10 | 24,4 | ||
| pN1-2 | 55 | 100 | 31 | 75,6 | ||
| Екзофітна пухлина | 15 | 27,3 | 20 | 32,8 | 15 | 36,6 |
| Ендофітна пухлина | 25 | 45,5 | 30 | 49,2 | 20 | 48,8 |
| Змішана форма пухлини | 15 | 27,3 | 11 | 18,0 | 6 | 14,6 |
| Усього | 55 | 100 | 61 | 100 | 41 | 100 |
Слід зазначити, що більшість у групах становили хворі з pT3, тобто інвазією пухлини в субсерозну сполучну тканину без проростання вісцеральної очеревини, переважали пухлини з ендофітним типом росту. Інтраопераційно виявлено 225 сторожових ЛВ у 116 хворих. Попередній аналіз результатів дослідження показав, що у 205 (91%) випадках сторожові ЛВ відносились до першої групи (N1), згідно з Японською класифікацією раку; у 20 (9%) випадках — до другої групи (N2). У 41 пацієнта фарбування сторожових ЛВ не відбулося. Відсутність фарбування ЛВ у більшості випадків свідчить про блок аферентних лімфатичних протоків. Локалізацію сторожових ЛВ залежно від локалізації пухлини наведено в табл. 2.
| Локалізація пухлини (група ЛВ) |
Верхнятретина(n=40) | Середня третина(n=55) | Нижнятретина(n=95) | Тотальнеураження(n=35) | Усього(n=225) |
|---|---|---|---|---|---|
| № 1 (праві паракардіальні) | 16 | 4 | – | – | 20 |
| № 2 (ліві паракардіальні) | 10 | – | – | – | 10 |
| № 3 (вздовж малої кривизни шлунка) | 14 | 31 | 35 | 16 | 96 |
| № 4 (вздовж великої кривизни шлунка) | – | 10 | 13 | 23 | |
| № 5 (надпілоричні) | – | 17 | 17 | ||
| № 6 (підпілоричні) | – | 11 | 14 | 4 | 29 |
| № 7 (вздовж лівої шлункової артерії) | – | – | 6 | 9 | 15 |
| № 8 (вздовж загальної печінкової артерії) |
– | – | 8 | 6 | 14 |
| № 12 (гепатодуоденальної зв’язки) | – | – | 2 | 4 | 6 |
Зв’язок між даними інтраопераційного фарбування сторожових ЛВ, їх терміновим гістологічним дослідженням та післяопераційним вивченням регіонарних ЛВ відображено в табл. 3.
| Інтраопераційне введення метиленового синього |
Експрес-дослідження СЛВ |
Паталогогістологічне післяопераційне дослідження ЛВ | ||
|---|---|---|---|---|
| Виявлено СЛВ (n=225 ) | СЛВ + | СЛВ – | рN + | рN – |
| 112 | 113 | 122 | 103 | |
| Відсутність СЛВ (n=41 ) | – | – | 31 | 10 |
Слід відзначити наявність у 10 випадках помилковонегативних результатів, що свідчить про можливість метастатичного ураження кількох лімфоколекторів. Чутливість методики визначення сторожових ЛВ становить: 112/122=91%, специфічність: 113/113=100%. Нами також виявлено прямий зв’язок між розповсюдженням первинної пухлини та частотою розвитку метастазів.
Проаналізовано безпосередні результати лікування хворих. Післяопераційної летальності не зафіксовано. Післяопераційні ускладнення виникли у 17% хворих. У структурі ускладнень гнійно-запальні знаходяться на першому місці, на другому — легеневі, на третьому — серцево-судинні.
До специфічних ускладнень після лімфодисекції належать післяопераційний панкреатит, піддіафрагмальний абсцес, лімфорея, парези кишечнику. До особливостей виконання операцій слід віднести: збільшення часу виконання на 15–20 хв, незначне збільшення крововтрати; з 2-ї до 9-ї доби у 15 хворих після стандартної радикальної операції (D2) спостерігалася лімфорея, яка не потребувала додаткового дренування черевної порожнини.
Висновки
Проведений огляд даних літератури свідчить про необхідність лімфодисекцій в обсязі D2 при виконанні субтотальних резекцій чи гастректомії у хворих на резектабельні форми раку шлунка. Візуалізація сторожового ЛВ за допомогою субсерозного введення метиленового синього — простий, високочутливий (91%) та високоспецифічний (100%) метод. Отримані результати свідчать про те, що існує прямий зв’язок між гістологічним статусом сторожових та регіонарних ЛВ. Отже, проведений аналіз даних літератури та отримані закономірності власних досліджень дають підґрунтя вважати методику вивчення сторожових ЛВ у хворих на рак шлунка перспективним напрямком досліджень.
Література
1. Kajitani T. (1981) The general rules for the gastric cancer study in surgery and pathology. Part I. Clinical classification. Jpn. J. Surg., 11: 127–139.
2. Schwarz R.E., Smith D.D. (2007) Clinical impact of lymphadenectomy extent in resectable gastric cancer of advanced stage. Ann. Surg. Oncol., 14: 317–328.
3. Sano T., Sasako M., Yamamoto S. et al. (2004) Gastric cancer surgery: morbidity and mortality results from a prospective randomized controlled trial comparing D2 and extended para-aortic lymphadenectomy-Japan Clinical Oncology Group study 9501. J. Clin. Oncol., 22: 2767–2773.
4. Sasako M., Sano T., Yamamoto S. et al. (2008) D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N. Engl. J. Med., 359: 453–462.
5. Hartgrink H.H., van de Velde C.J.H., Putter H. et al. (2004) Extended lymph node dissection for gastric cancer: who may benefit? Final results of the randomized Dutch gastric cancer group trial. J. Clin. Oncol., 22: 2069–2077.
6. McCulloch P., Nita M.E., Kazi H. et al. (2004) Extended versus limited lymph nodes dissection technique for adenocarcinoma of the stomach. Cochrane Database Syst. Rev.
7. Cuschieri A., Weeden S., Fielding J. et al. (1999) Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br. J. Cancer., 79: 1522–1530.
8. McCulloch P., Nita M.E., Kazi H. et al. (2004) Extended versus limited lymph nodes dissection technique for adenocarcinoma of the stomach. Cochrane Database Syst Rev.
9. Douglass H.O. Jr., Hundahl S.A., Macdonald J.S. et al. (2007) Gastric cancer: D2 dissection or low Maruyama Index-based surgery-a debate. Surg. Oncol. Clin. N. Am., 16: 133–155.
10. Jansen E.P.M., Boot H., Verheij M. et al. (2005) Optimal locoregional treatment in gastric cancer. J. Clin. Oncol., 23: 4509–4517.
11. Degiuli M., Sasako M., Calgaro M. et al. (2004) Morbidity and mortality after D1 and D2 gastrectomy for cancer: interim analysis of the Italian Gastric Cancer Study Group (IGCSG) randomised surgical trial. Eur. J. Surg. Oncol., 30: 303–308.
12. Degiuli M., Sasako M., Ponti A. et al. (2004) Survival results of a multicentre phase II study to evaluate D2 gastrectomy for gastric cancer. Br. J. Cancer., 90: 1727–1732.
13. Jatzko G.R., Lisborg P.H., Denk H. et al. (1995) A 10-year experience with Japanese-type radical lymph node dissection for gastric cancer outside of Japan. Cancer, 76: 1302–1312.
14. Давыдов М.И., Тер-Ованесов М.Д., Абдихакимов А.Н. и др. (2001) Рак желудка: что определяет стандарты хирургического лечения. Практ. онкология, 3(7): 18–24.
15. Karube T., Ochiai T., Shimada H. et al. (2004) Detection of sentinel lymph nodes in gastric cancers based on immunohistochemical analysis of micrometastases. J. Surg. Oncol., 87(1): 32–38.
16. Cheng L.Y., Zhong S.Z., Huang Z.H. (2004) Sentinel lymph node concept in gastric cancer with solitary lymph node metastasis. World J. Gastroenterol., 10: 3053–3055.
17. Cozzaglio L., Bottura R., Di Rocc et al. (2011) Doci Sentinel lymph node biopsy in gastric cancer: Possible applications and limits. EJSO, 37: 55–59.
18. Chang-Ming Huang, Jian-Xian Lin, Chao-Hui Zheng et al. (2009) Prognostic impact of dissected lymph node count on patients with node-negative gastric cancer World J. Gastroenterol., 15(31): 3926–3930.
19. Tsuburaya A., Noguchi Y., Yoshikawa T. et al. (2002) Solitary lymph node metastasis of gastric cancer as a basis for sentinel lymphnode biopsy. Hepatogastroenterology, 49: 1449–1452.
20. Li C., Kim S., Lai J.F. et al. (2008) Solitary lymph node metastasis in gastric cancer. J. Gastrointest. Surg., 12: 550–554.
21. Baojun Huang, Zhenning Wang, Zhe Sun et al. (2011) A novel insight of sentinel lymph node concept based on 1-3 positive nodes in patients with pT1-2 gastric cancer. BMC Cancer, 11: 18.
22. Cheng L.Y., Zhong S.Z., Huang Z.H. (2004) Sentinel lymph node concept in gastric cancer with solitary lymph node metastasis. World J. Gastroenterol., 10: 3053–3055.
23. Miwa K., Kinami S., Ajisaka H. et al. (2005) Lymphatic basin dissection and function-preserving limited gastrectomy for early-stage gastric carcinoma. Nippon Geka Gakkai Zasshi, 104(4): 280–285.
Изучение статуса сторожевых лимфоузлов при хирургическом лечении рака желудка
Национальный институт рака, Киев
Национальный медицинский университет им. А.А. Богомольца, Киев
Севастопольский городской онкологический диспансер, Севастополь
Резюме. Цель: изучить возможности и точность методики определения сторожевого лимфатического узла (СЛУ) при хирургическом лечении рака желудка. Материалы и методы: 157 больных раком желудка T2-4N0-2M0, которым выполнено радикальное оперативное лечение в объеме радикальной гастрэктомии и лимфодиссекции D2. Биопсию СЛУ проводили с применением во время операции контрастирования лимфоузлов введением метиленового синего по периферии опухоли. Изучали технические аспекты, определяли точность, чувствительность и специфичность методики. Результаты: СЛУ выявлены у 116 из 157 пациентов; общее количество удаленных СЛУ составляла 225, в среднем — по 2 (от 1 до 3). У 55 больных выявлены метастазы в СЛУ. К первому уровню лимфатического оттока принадлежали 205 (91%) из 225 определенных СЛУ, а только 20 (9%) СЛУ — ко второму уровню. Только 10 случаев экспресс-исследования СЛУ оказались ошибочноотрицательными. Из 41 пациента с отсутствием контрастирования СЛУ у 31 (75,6%) виявлены метастазы в лимфатических узлах, у 10 (24,4%) — pN0-статус. Установлена способность биопсии СЛУ прогнозировать состояние регионарного лимфатического коллектора с чувствительностью метода 91% и специфичностью 100%. Выводы: результаты проведенного нами исследования свидетельствуют, что методика определения СЛУ при оперативном лечении рака желудка технически возможна, имеет высокую чувствительность и специфичность.
рак желудка, определение сторожевого лимфатического узла, лимфодиссекция.














Leave a comment