Безпосередні результати застосування доопераційної хіміопроменевої терапії з внутрішньоартеріальним введенням цитостатиків
Фридель Р.І., Кіркілевський С.І., Супруненко О.О., Крахмальов П.С., Кондрацький Ю.М.
Резюме. Рак стравоходу — високозлоякісне захворювання, що супроводжується раннім лімфогенним метастазуванням. Найбільш ефективним у лікуванні пацієнтів з цією нозологічною формою вважають комплексний підхід. Для визначення ефективності доопераційного хіміопроменевого лікування при раку стравоходу розпочато рандомізоване дослідження, в якому порівняли стандартну хіміопроменеву терапію з внутрішньоартеріальною. У дослідження увійшли 54 хворих на рак внутрішньогрудного відділу стравоходу. У 26 пацієнтів застосовано доопераційну хіміопроменеву терапію з внутрішньоартеріальним введенням цитостатиків, а в 28 — стандартну хіміопроменеву терапію. Безпосередні результати не відрізнялися за частотою регресії, післяопераційних і токсичних ускладнень. Віддалені результати не вивчено у зв’язку з невеликим терміном від початку дослідження. Аналіз виживаності та віддалених результатів надасть можливість визначити доцільність застосування доопераційної хіміопроменевої терапії з внутрішньоартеріальним введенням цитостатиків у хворих на рак внутрішньогрудного відділу стравоходу.

Вступ
Рак стравоходу — злоякісне захворювання, що характеризується високою частотою раннього лімфогенного метастазування та розвитком дисфагії. Анатомія стравоходу сприяє швидкій інвазії пухлини в суміжні життєво важливі органи та структури. Основним методом лікування хворих на рак стравоходу є хірургічний. Існує думка, що хіміопроменева терапія дозволяє досягнути подібної виживаності без хірургічного втручання, проте частота місцевих рецидивів за такого підходу сягає 50%. При застосуванні хірургічного лікування і хіміопроменевої терапії в самостійному варіанті 5-річна виживаність становить близько 20%. Результативність ад’ювантної хіміотерапії у хворих на рак стравоходу не доведена. На основі проведених метааналізів рандомізованих досліджень попередніх років більшість вчених надає перевагу комплексному підходу до лікування пацієнтів із цією нозологічною формою, що передбачає застосування доопераційної хіміопроменевої терапії з подальшим хірургічним лікуванням. Зазначені дані обґрунтовують використання променевої терапії з одночасним застосуванням хіміотерапії на доопераційному етапі для девіталізації пухлини, регіонарних метастазів, зменшення вираженості симптомів дисфагії та підвищення резектабельності.
З метою створення максимальної концентрації хіміопрепарату в пухлині стравоходу у науково-дослідному відділенні пухлин органів грудної порожнини Національного інституту раку розроблено методику внутрішньоартеріальної хіміотерапії. Великий інтерес викликає ефективність застосування неоад’ювантної внутрішньоартеріальної хіміотерапії у поєднанні з променевою терапією.
Основною метою цього дослідження було порівняльне вивчення ефективності неоад’ювантної радіохіміотерапії з внутрішньоартеріальним і внутрішньовенним шляхами введення цитостатиків. Завданнями було вивчення післяопераційних ускладнень, протипухлинної відповіді, місцевого контролю над пухлиною, частоти віддаленого метастазування і виживаності без прогресування захворювання.
Об’єкт і методи дослідження
Критерії включення пацієнтів у дослідження і виключення з нього
У дослідження включали хворих з гістологічно підтвердженим діагнозом плоскоклітинного раку внутрішньогрудного відділу стравоходу ІІ–ІІІ стадії, які раніше не отримували специфічного лікування. Обов’язковою умовою була відсутність віддалених метастазів за даними анамнезу та фізикального дослідження. Хворим проводили езофагогастродуоденоскопію, комп’ютерну томографію (КТ) шиї, органів грудної клітки, черевної порожнини та заочеревинного простору, малого таза, рентгенографію стравоходу, дослідження функції зовнішнього дихання та електрокардіографію, фібробронхоскопію. Ще одним критерієм включення було отримання нормальних показників гемограми та біохімічного аналізу крові. У дослідження залучали хворих без хіміо- чи променевої терапії в анамнезі з приводу раку стравоходу або будь-якого іншого опромінення зон, що перекривають поля, які обов’язково включаються в зону опромінення при цій пухлині. Допускалася наявність в анамнезі іншої пухлини, якщо з моменту її виявлення пройшло більше 5 років й ознаки рецидиву відсутні. Необхідною умовою була також відсутність інших тяжких захворювань, які могли б призвести до смерті менш ніж через 2 роки, або психічних відхилень, які могли б завадити дотриманню режиму лікування чи наданню інформованої згоди. Критеріями виключення були неконтрольовані або тяжкі серцево-судинні захворювання, хвороби легень, активні інфекції, вагітність. Протокол схвалено Вченою радою Національного інституту раку, а також комісією з біоетики. У кожного хворого отримано інформовану згоду.
План лікування
Хворих рандомізували у дві групи. В основну групу увійшли пацієнти, яким на доопераційному етапі призначали променеву терапію в поєднанні з внутрішньоартеріальною хіміотерапією. Контрольну групу сформували хворі, у яких застосовували променеву терапію разом із системною хіміотерапією. Променеву та хіміотерапію проводили одночасно. Променеве лікування застосовували протягом 2 тиж у разовій вогнищевій дозі 2,4–2,6 Гр 5 днів на тиждень до сумарної вогнищевої дози 30 Гр на апараті «Тератрон». Межі полів опромінення пролягали на відстані 5 см від проксимального і дистального краю пухлини, латеральні границі — 2 см від видимих меж пухлини. Якщо верхній край пухлини розташовувався більш ніж на 2 см вище біфуркації трахеї, опромінювали надключичні лімфовузли. Якщо первинна пухлина знаходилася в нижній третині стравоходу або за даними КТ були збільшені паракардіальні лімфовузли, поля опромінення розширювали так, щоб захопити й ці мішені. Поля мали вигляд прямокутника і захоплювали первинну пухлину і 2 см навколишніх тканин. Для хіміотерапії застосовували цисплатин в дозі 75 мг/м у 1-й день та 5-флуороурацил 750–1000 мг/м у 1–4-й день у поєднанні зі стандартною гідратацією і протиблювотною терапією. У хворих основної групи цисплатин вводили внутрішньоартеріально, 5-флуороурацил — внутрішньовенно. Катетеризацію артерій, які кровопостачають пухлину стравоходу, проводили трансаксилярним доступом зліва під контролем ангіографії. Залежно від ангіоархітектоніки, яку визначали під час ангіографії, у хворих на рак верхньої третини стравоходу проводили катетеризацію нижньої щитоподібної артерії чи щитошийного стовбура. У пацієнтів із раком середньої третини стравоходу катетер ставили в ліву нижню діафрагмальну артерію, щитошийний стовбур або ліву внутрішню грудну артерію. У хворих на рак нижньої третини стравоходу внутрішньоартеріальну терапію проводили через ліву шлункову артерію чи ліву нижню діафрагмальну артерію. Слід зазначити, що катетеризацію нижньої діафрагмальної та лівої шлункової артерії можна провести і за допомогою трансфеморального доступу. Однак у хворих цієї категорії паралельно з внутрішньоартеріальним введенням цитостатиків застосовували променеву терапію. Тому перевага надається трансаксилярній методиці катетеризації аферентних судин пухлин стравоходу різної локалізації.
Цисплатин вводили за допомогою інфузомата протягом 4–5-годинної інфузії. Після завершення інфузії катетер видаляли.
Через 2–3 тиж після хіміопроменевого лікування у пацієнтів виконували загальноклінічні дослідження, ендоскопічні та рентгенологічні обстеження та проводили оперативне втручання. Оптимальним часом для виконання операції був термін між 2-м і 3-м тижнем після завершення хіміопроменевої терапії. При раку верхньої третини стравоходу виконували субтотальну езофагектомію. У хворих на рак середньої третини стравоходу виконували операцію типу Льюїса. У пацієнтів, у яких пухлина розміщувалася в нижній третині стравоходу, в основному виконували операцію типу Гарлока. Виконання езофагектомії трансхіатальним доступом не рекомендувалося. Необхідною умовою було видалення всіх доступних лімфовузлів. Cтан країв резекції оцінював хірург під час операції та патоморфолог при дослідженні видаленого макропрепарату. Оптимальною вважали відстань від проксимального і дистального краю до видимих меж пухлини не менше 4 см.
Оцінка відповіді пухлини
Як повну морфологічну відповідь розцінювали відсутність у видалених під час операції тканинах (ложе первинної пухлини і лімфовузли) макро- і мікроскопічної пухлини (за даними світлової мікроскопії, але не імуногістохімічного дослідження). Під частковою морфологічною відповіддю розуміли зменшення розміру пухлини порівняно з початковим, визначеним при езофагогастродуоденоскопії та рентгенографії стравоходу. Пухлини поділяли на макроскопічні (видимі під час операції) та мікроскопічні (виявлені тільки при морфологічному дослідженні). Прогресуванням вважали збільшення перпендикулярних діаметрів контрольного вогнища на ≥25% або появу нових вогнищ. До стабілізації захворювання відносили випадки, які не відповідали критеріям ні повної, ні часткової регресії, ні прогресуванню. Видалення пухлини розподіляли на повне (R0 — видима пухлина повністю видалена, пухлинні клітини в краях резекції відсутні) і неповне (R1 — визначається видима залишкова пухлина або пухлинні клітини в краях резекції).
Результати та їх обговорення
Аналізу піддавали дані всіх рандомізованих пацієнтів, які отримали заплановане лікування і відповідали критеріям для проведення оцінювання. Реєстрацію та рандомізацію хворих, а також збір даних здійснювали під керівництвом рандомізаційного центру Національного інституту раку. Реєстрацію пацієнтів проводили за телефоном методом простої фіксованої рандомізації.
Характеристика пацієнтів і захворювання
З листопада 2013 р. до лютого 2015 р. у дослідження включено 54 хворих на плоскоклітинний рак внутрішньогрудного відділу стравоходу, які перебували на стаціонарному лікуванні у відділенні пухлин органів грудної порожнини Національного інституту раку. У результаті рандомізації 26 пацієнтів потрапили в основну групу, 28 — в контрольну (рисунок). Усі пацієнти були віком від 39 до 71 року, середній вік становив 56,5 року. Жінок було 3, чоловіків — 51. Серед усіх пацієнтів хворих на рак верхньої третини стравоходу було 3, середньої — 38, нижньої — 13. Характеристика пацієнтів і проявів хвороби в обох групах була статистично однорідною (табл. 1).
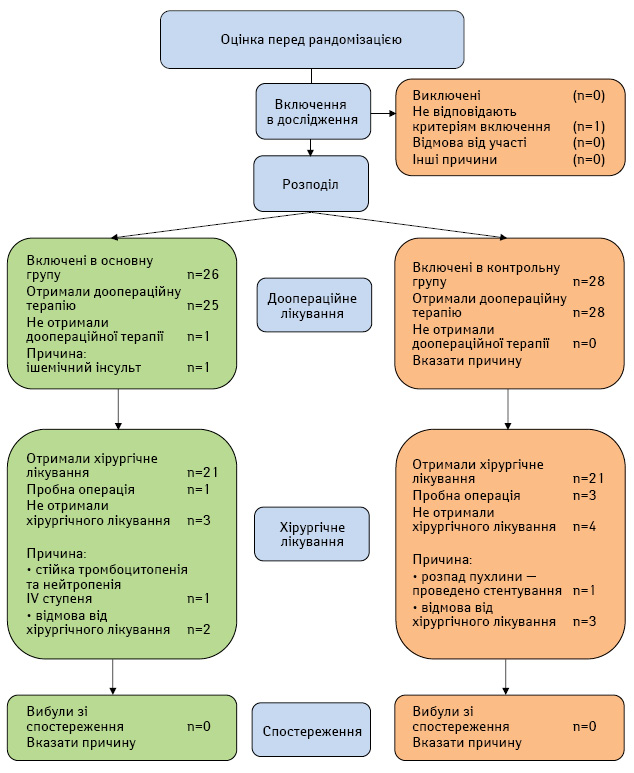 Рисунок. Характеристика пацієнтів та проведеного лікування
Рисунок. Характеристика пацієнтів та проведеного лікування
Таблиця 1. Характеристика хворих у дослідженні
| Показник | Група | p | |||
| Основна група | Контрольна група | ||||
| n | % | n | % | ||
| Стать | |||||
| Чоловіча | 25 | 96,15±3,85 | 26 | 92,86±4,96 | 0,53 |
| Жіноча | 1 | 3,85±3,85 | 2 | 7,14±4,96 | |
| Вік, років | |||||
| Середній | 54,5±1,52 | 58±1,4 | 0,09 | ||
| Діапазон | 39–67 | 39–71 | |||
| Гістологічний варіант пухлини | |||||
| Плоскоклітинний рак | 26 | 100,0 | 28 | 100,0 | |
| Аденокарцинома | 0 | 0 | 0 | 0 | |
| Локалізація пухлини у стравоході | |||||
| Верхня третина | 2 | 7,69±5,33 | 1 | 3,57±3,57 | 0,64 |
| Середня третина | 17 | 65,38±9,51 | 21 | 75,0±8,33 | 0,76 |
| Нижня третина | 7 | 26,92±8,87 | 6 | 21,43±7,90 | 0,46 |
Визначення стадії
Для визначення стадії до операції використовували ультрасонографію та КТ. У хворих на рак верхньої та середньої третини стравоходу виконували фібробронхоскопію для встановлення інвазії в трахею та бронхи. У пацієнтів із підозрою на метастатичне ураження скелета використовували остеосцинтиграфію. Інвазивні методи визначення стадії до операції не використовували. Стадіювання проводили з урахуванням усіх відомих для певного хворого результатів дослідження (табл. 2).
Таблиця 2. Розподіл хворих з досліджуваних груп залежно від показників T і N
| Стадія | Кількість хворих | |||||||
| Основна група | Контрольна група | p | ||||||
| Т | N | n | % | n | % | |||
| 2 | 0 | 1 | 3,85±3,85 | 1 | 3,57±3,57 | 0,05 | ||
| 2 | 1 | 2 | 7,69±5,33 | 1 | 3,57±3,57 | 0,64 | ||
| 3 | 0 | 6 | 23,08±8,43 | 6 | 21,43±7,90 | 0,14 | ||
| 3 | 1 | 17 | 65,38±9,51 | 19 | 67,86±8,99 | 0,19 | ||
| 4 | 1 | 0 | 0 | 1 | 3,57±3,57 | 1,00 | ||
| Невідомо | 0 | 0 | 0 | 0 | 0 | 0 | ||
| Усього | 26 | 100,0 | 28 | 100,0 | ||||
Побічні ефекти
Побічні ефекти ІІ–III ступеня і вище відзначено у 21 хворого, які отримали передопераційну хіміопроменеву терапію: у 13 пацієнтів основної групи та у 8 — контрольної (табл. 3). У 38% хворих, які отримали доопераційну хіміопроменеву терапію, зафіксовано мінімум по одному епізоду гематологічної токсичності II ступеня і вище. До негематологічної токсичності належали езофагіт/дисфагія (60% — в основній групі, 50,1% — у контрольній), інфекція (8% — в основній групі, 7,1% — у контрольній) і діарея. В однієї пацієнтки контрольної групи після хіміопроменевої терапії виник розпад пухлини, стравохідно-медіастинальна нориця. Хворій під контролем ендоскопії проведено стентування стравоходу. Через 1 міс вона померла від гнійно-септичної патології. У табл. 3 перелічено всі прояви токсичності II–ІІІ ступеня і вище, зареєстровані на фоні комплексного лікування як мінімум у 20% хворих.
Таблиця 3. Прояви токсичності II, IІІ, ІV ступеня, відзначені щонайменше у 20% хворих
| Показник | Основна група | Контрольна група | ||||||
| Ступінь | Загальнакількість | Ступінь | Загальнакількість | |||||
| ІІ | ІІІ | ІV | ІІ | ІІІ | ІV | |||
| Гематологічна токсичність | 6 | 5 | 1 | 12 | 5 | 4 | 0 | 9 |
| Нудота, блювання | 8 | 0 | 0 | 8 | 7 | 0 | 0 | 7 |
| Інфекція | 2 | 0 | 0 | 2 | 2 | 0 | 0 | 2 |
| Езофагіт/дисфагія | 6 | 7 | 2 | 15 | 5 | 8 | 1 | 14 |
| Зменшення маси тіла | 3 | 0 | 0 | 3 | 3 | 0 | 0 | 3 |
Хірургічне лікування
Хірургічні втручання виконано у 46 пацієнтів: 22 хворих основної групи та 24 — контрольної. У групі внутрішньоартеріальної хіміотерапії хірургічне лікування не проводили у 3 хворих. Операції не виконали з різних причин: у 1 пацієнта після курсу хіміопроменевої терапії була виражена тромбоцитопенія та лейкопенія ІV ступеня, які не піддавалися медикаментозній корекції; 2 пацієнтів відмовилися від операції. З 22 прооперованих хворих основної групи у 5 (22,73±9,14%) проведено операцію типу Гарлока, у 15 (68,18±10,16%) — типу Льюїса, в 1 (4,55±4,55%) хворого — субтотальну езофагектомію, ще в 1 (4,55±4,55%) — пробну торакотомію. В одному випадку операцію типу Льюїса комбінували з резекцією верхньої частки правої легені та спленектомією. З 28 пацієнтів контрольної групи 4 хворих не отримали хірургічного лікування: в 1 пацієнтки стався розпад пухлини, стравохідно-медіастинальна нориця, а 3 інших відмовилися від хірургічного втручання. У 3 (12,5±6,9%) пацієнтів виконано пробні торакотомії. Операцію типу Гарлока виконано в 4 (16,67±7,77%) пацієнтів, у 16 (66,67±9,83%) — типу Льюїса, в 1 (4,17±4,17%) хворого проведено субтотальну езофагектомію. В одному випадку виконано комбіновану операцію Льюїса з резекцією грудного лімфатичного протоку. Причиною пробних торакотомій у хворих основної та контрольної групи була місцева поширеність процесу.
Ускладнення зареєстровано у 16 хворих з 46, яким проведено хірургічне лікування. Ці ускладнення були пов’язані з операціями, тому вони наведені в табл. 4 і не включені в табл. 3. У контрольній групі 1 пацієнт помер від післяопераційних ускладнень, а саме — тромбоемболії легеневої артерії, через 17 днів після хірургічного втручання.
Таблиця 4. Операційні ускладнення залежно від досліджуваної групи
| Ускладнення | Основна група | Контрольна група | |||
| n | % | n | % | p | |
| Інфекція | 2 | 9,09±6,27 | 3 | 12,50±6,90 | 0,37 |
| Недостатність анастомозу, некроз трансплантата |
1 | 4,55±4,55 | 1 | 4,17±4,17 | 0,06 |
| Серцево-судинні ускладнення | 2 | 9,09±6,26 | 4 | 16,6±7,77 | 0,76 |
| Діарея | 1 | 4,55±4,55 | 2 | 8,33±5,76 | 0,52 |
| Усього | 6 | 27,27±9,72 | 10 | 41,67±10,28 | 1,02 |
Протипухлинна відповідь
Патоморфологічні дані про відповідь пухлини на проведене лікування одержано у 42 хворих (по 21 випадку у контрольній та основній групах), які отримали доопераційну хіміопроменеву терапію з подальшим хірургічним втручанням. Результати виявилися такими: повна регресія у 4 хворих (об’єм життєздатних пухлинних тканин становив 0%), з них у 3 (14,29±7,82%) пацієнтів контрольної групи та 1 (4,76±4,76%) — основної. Часткову регресію відзначили у 36 хворих, із них — у 19 (90,48±6,56%) основної та 17 (80,95±8,78%) контрольної групи. Стабілізація процесу виявлена у 3 пацієнтів, із них у 2 (9,52±6,56%) — контрольної та 1 (4,76±4,76%) — основної. Об’єм життєздатних пухлинних тканин у середньому становив 28,5±0,97% в основній групі та 28,7±0,85% — у контрольній. У 8 (38,10±10,86%) пацієнтів контрольної групи та у 6 (28,57±10,10%) основної після проведеного хіміопроменевого лікування порівняно з вихідними даними констатовано зниження стадії — з N1 до N0.
Віддалені результати
У зв’язку з невеликим проміжком часу з початку дослідження віддалені результати не вивчено. Є дані про рецидиви в анастомозі з метастазами в лімфовузлах середостіння в 2 пацієнтів основної групи та продовження хвороби також у 2 осіб контрольної групи: в одного хворого метастазування в лімфовузли середостіння, в іншого — метастази в заочеревинних лімфовузлах. В одного пацієнта основної групи рецидив виник через 7 міс після операції, в іншого — через 4. В одного хворого контрольної групи метастази розвинулися через 8 міс після операції, в іншого — через 5. За наявності продовження хвороби пацієнтам було запропоноване хіміопроменеве лікування, решта перебувають під динамічним контролем.
Висновки
На основі аналізу застосування хіміопроменевої терапії у хворих на рак внутрішньогрудного відділу стравоходу можна зробити висновок, що безпосередні результати проведення внутрішньоартеріальної хіміотерапії в поєднанні з променевим лікуванням не відрізняються за частотою післяопераційних і токсичних ускладнень від стандартного хіміопроменевого лікування; протипухлинна відповідь є вираженою в обох досліджуваних групах. Застосування внутрішньоартеріальної хіміотерапії дозволяє досягти максимальної концентрації хіміопрепарату в пухлині стравоходу, що забезпечує її регресію та можливість радикального видалення. Віддалені результати лікування визначать доцільність проведення доопераційної хіміопроменевої терапії з внутрішньоартеріальним введенням цитостатиків у хворих на рак внутрішньогрудного відділу стравоходу.
Непосредственные результаты применения предоперационной химиолучевой терапии с внутриартериальным введением цитостатиков
Национальный институт рака, Киев
Резюме. Рак пищевода — высокозлокачественное заболевание, сопровождающееся ранним лимфогенным метастазированием. Наиболее эффективным в лечении пациентов с данной нозологической формой считается комплексный подход. Для определения эффективности дооперационного химиолучевого лечения при раке пищевода проведено рандомизированное исследование, в котором осуществлен сравнительный анализ стандартной химиолучевой терапии с внутриартериальной. В исследование вошли 54 больных раком внутригрудного отдела пищевода. У 26 пациентов применена дооперационная химиолучевая терапия с внутриартериальным введением цитостатиков, а у 28 — стандартная химиолучевая терапия. Непосредственные результаты не отличались по частоте регрессии, послеоперационных и токсических осложнений. Отдаленные результаты не изучены в связи с небольшим сроком от начала исследования. Анализ выживаемости и отдаленных результатов дает возможность определить целесообразность применения предоперационной химиолучевой терапии с внутриартериальным введением цитостатиков у больных раком внутригрудного отдела пищевода.
рак пищевода, неоадъювантная химиолучевая терапия, внутриартериальная химиотерапия, хирургическое лечение.
Адреса:
Фридель Роман Ігорович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 259-01-68
E-mail: niraky@ukr.net














Leave a comment