Тезисы
Експресія Вcl-2 та вміст ДНК у клітинах аденокарцином товстої кишки
С.А. Антонюк, О.М. Грабовий
Національний інститут раку, Київ, Україна
Зміни кількості ДНК у ядрах клітин аденокарцином товстої кишки є типовим явищем, пов’язаним із хромосомною нестабільністю (порушенням механізмів мітозу), яка реалізується в полі- та анеуплоїдії. Разом з тим зміни вмісту ДНК у ядрі також асоціюються певною мірою з її синтезом під час мітозу, а також із порушенням апоптозу, коли виживає та збільшується частка у складі пухлини полі- та анеуплоїдних клітин.
Мета роботи — встановити особливості експресії Bcl-2 серед клітин епітеліальних пухлин товстої кишки з різним вмістом ДНК у ядрах.
Дослідження проведено на матеріалі від 88 пацієнтів з аденокарциномами та доброякісними новоутвореннями з використанням кількісного визначення ДНК у ядрах клітин та імуногістохімічним виявленням експресії Bcl-2.
Показано, що аденокарциноми товстої кишки мають широкий спектр частоти експресії Bcl-2, причому її рівень відрізняється і змінюється залежно від G та вмісту ДНК в ядрах клітин. Збільшення кількості ДНК у ядрах пухлинних клітин супроводжується зростанням рівня кореляції з експресією Bcl-2. Наявність експресії Bcl-2 призводить до певного збільшення середнього вмісту ДНК в ядрах клітин аденокарцином товстої кишки. Визначення експресії Bcl-2 як самостійної ознаки аденокарцином товстої кишки є малоінформативним, але значущим — як вторинного показника, тобто складової при багатофакторній оцінці стану ядер клітин пухлини, пов’язаного, відповідно, з їхнім проліферативним потенціалом і збільшенням вмісту ДНК у ядрах пухлинних клітин.
Оцінка експресії Bcl-2 в аденокарциномах товстої кишки може бути додатковим критерієм, що уточнює та підвищує достовірність прогнозу.
Частота нулевого варианта GSTМ1 при прогрессировании рака яичника
Т.В. Базаринская
Харьковская медицинская академия последипломного образования, Харьков, Украина
Канцерогенез в настоящее время рассматривают как многоступенчатый процесс накопления различных генетических и эпигенетических повреждений, которые приводят к появлению новообразования. Возникшие генетические нарушения в дальнейшем могут способствовать также прогрессированию заболевания. То есть опухоль не является абсолютно автономной, а представляет собой сложную биологическую систему, которая взаимодействует с организмом, нарушая его гемостаз.
Цель исследования — определить генотип GSTM1 0/0 в опухолевых клетках рака яичника (РЯ) на разных стадиях прогрессирования заболевания.
Обследовано 104 больных РЯ I–IV (Т1с–3сN0–1М0–1) стадии в возрасте от 32 до 79 лет. Всем пациентам проведено комбинированное лечение. Во всех исследуемых случаях диагноз был верифицирован морфологически. У больных методом полимеразной цепной реакции было изучено наличие нулевого генотипа GSTМ1 в опухолевых клетках.
При анализе нулевого генотипа GSTМ1 0/0 нами установлено, что частота нулевого варианта фермента у пациентов с РЯ I стадии по сравнению с доброкачественными опухолями яичника возросла более чем в 5 раз (с 8,0 до 44,0%; р<0,01). По мере увеличения распространенности опухолевого процесса частота нулевого генотипа GSTМ1 0/0 повышалась: при РЯ II стадии — до 50,0%, при РЯ III стадии — до 58,5% случаев. В то же время частота такого варианта полиморфизма фермента детоксикации у больных РЯ IV стадии снизилась в сравнении с показателем при III стадии и составила 52,9% случаев.
Анализ частоты нулевого генотипа GSTМ1 0/0 не выявил достоверного различия в группах больных в зависимости от наличия асцита. Так, частота нулевого генотипа GSTМ1 0/0 у больных с безасцитной формой РЯ (50,0%) и при наличии асцита (52,5%) практически не отличалась.
Выводы:
1. Нулевой генотип GSTМ1 достоверно чаще отмечали при РЯ по сравнению с доброкачественными опухолями яичника.
2. Не зафиксировано достоверных различий в частоте нулевого генотипа GSTМ1 у больных РЯ в зависимости от стадии заболевания и наличия асцита.
3. Полученные данные позволяют предположить, что нарушение функции данного гена играет значительную роль в возникновении РЯ и меньшую — в прогрессировании заболевания.
Реабілітація онкологічних хворих після ендопротезування тазостегнового суглоба
С.І. Бойчук, А.Г. Дєдков, П.А. Ковальчук
Національний інститут раку, Київ, Україна
Реабілітація після ендопротезування тазостегнового суглоба є найскладнішою порівняно з відновленням після операцій на інших великих суглобах. Період післяопераційної реабілітації в середньому становить 12 міс. За цей час при адекватному руховому режимі у пацієнтів практично повністю відновлюються порушені раніше статико-локомоторні функції.
Мета дослідження — систематизувати основні принципи реабілітації хворих після ендопротезування тазостегнового суглоба.
Ендопротезування тазостегнового суглоба виконано у 40 хворих. Чоловіків було 18 (45,0%), жінок — 22 (55,0%). Середній вік пацієнтів становив 44,35±2,68 року. Майже в третини (32,5%) хворих діагностовано метастази раку в проксимальному відділі стегнової кістки. Із первинних пухлин частіше за все (25,0%) відзначено хондросаркому. Для реконструкції використовували двополюсний тотальний ендопротез індивідуального виготовлення.
Ранні ускладнення виявлено у 12 (30,0%), пізні — у 8 (20,0%) хворих. Із ранніх ускладнень частіше (15,0%) траплялися вивихи головки ендопротеза внаслідок порушення основних принципів реабілітації в ранній післяопераційний період, рідше (10,0%) — інфекційні ускладнення. Пізнім ускладненням була нестабільність ендопротеза (12,5%), рідше — інфекційні ускладнення (7,5%). Функцію нижньої кінцівки після ендопротезування в різні строки спостереження оцінювали за шкалою MSTS. У перший рік спостереження показник функції кінцівки поступово зростав від 65,0±2,43 до 84,0±2,21%.
Ретельне дотримання основних принципів реабілітації сприяє швидкому відновленню функції прооперованої кінцівки, зниженню відсотка ускладнень у ранній післяопераційний період, поліпшенню якості життя та виживаності.
Становление метода цитологической диагностики в Украине
Л.С. Болгова, М.М. Оношко
Национальный институт рака, Киев, Украина
Применение метода цитологической диагностики берет свое начало с конца ХІХ столетия, когда в Харькове в 1899 г. врач С.Л. Эрлих открыл первый частный кабинет лабораторных исследований, который затем был преобразован в Институт лабораторной диагностики. Проведенные С.Л. Эрлихом множественные диагностические исследования легли в основу успешной защиты в 1920 г. диссертации «Обызвествленный распад и обызвествленные эластические волокна в мокроте при туберкулезе».
Дальнейшее развитие метода цитологической диагностики обязано исследованиям А.Я. Альтгаузена, достойного ученика С.Л. Эрлиха. Проведенная А.Я. Альтгаузеном огромная диагностическая работа позволила накопить большой опыт, который он представил в двух изданных монографиях: «Диагностика злокачественных новообразований при микроскопическом исследовании секретов и экскретов» (1948 г.) и «Морфологическое (цитологическое) исследование пунктатов из опухолей, опухолевидных образований и серозных полостей» (1962 г.).
В послевоенные 40–50-е годы прошлого столетия в Киевском рентгено-радиологическом и онкологическом институте (ныне — Национальный институт рака) патологоанатомы начали изучение возможности цитологической эксфолиативной диагностики рака шейки матки (А.В. Руденко «Морфогенез плоскоклеточного рака шейки матки», 1972 г.) и рака легкого (Л.К. Куница «Цитоморфологическая диагностика рака легкого», 1985 г.). Сопоставление результатов цитологического и гистологического исследования убедительно продемонстрировало высокую достоверность метода цитологической диагностики, что явилось основанием для проведения специальной проблемной конференции по цитологической диагностике рака (Киев, 1950 г.), в ходе которой патологоанатом Т.С. Шведкова-Роше дала теоретическое обоснование и обозначила главные принципы метода. Об этом было доложено на заседании Противоракового комитета Министерства здравоохранения Украины. Эффективность, достоверность и простота цитологического исследования были столь убедительными, что метод признали перспективным и приняли решение рекомендовать его для научной разработки и применения в онкологической практике в Украине.
Особенности цитологической диагностики опухолей поджелудочной железы
Л.С. Болгова, Т.Н. Туганова, М.Г. Махортова, О.И. Алексеенко
Национальный институт рака, Киев, Украина
Морфологическая диагностика опухолей поджелудочной железы (ОПЖ) до недавнего времени была возможна лишь на основе гистологического исследования операционного материала. Получение кусочка ОПЖ для гистологического исследования до начала лечения ввиду особенностей морфофункционального строения органа чревато серьезными осложнениями. При этом для цитологического исследования можно получить материал из участка опухоли специальной тонкой иглой под контролем ультразвукового исследования или компьютерной томографии на любом этапе обследования пациента.
Согласно Международной гистологической классификации (Лион, 2010) в поджелудочной железе (ПЖ) развивается более 40 нозологических форм опухолей. В нашей практике наиболее частой из них являлся железистый рак. Среди редко встречающихся ОПЖ мы диагностировали карциноиды и гигантоклеточную опухоль.
Особенности цитологической диагностики ОПЖ заключаются не только в трудностях интерпретации самих клеточных элементов в пункционном материале, но и в довольно частой малоинформативности большинства пунктатов, что обусловлено сложностью доступа к патологическому очагу. Поэтому в цитологических препаратах часто определяется небольшое количество клеток, в которых не выражены признаки атипии. В ряде случаев, когда с помощью клинико-рентгенологических методов выявляют ОПЖ, в ее пунктате находят некротические массы и гибнущие лейкоциты. В части наблюдений в цитологических препаратах выявляют отдельные клетки опухоли с явными признаками атипии, на основании которых можно установить диагноз рака ПЖ. Наиболее часто в пункционном материале определяется небольшое количество клеток железистого типа, часть из которых — с признаками атипии, что позволяет установить диагноз железистого рака.
Однако, невзирая на все сложности цитологической диагностики ОПЖ, сопоставление результатов цитологического и гистологического исследований свидетельствует о высокой точности первого в 93–100% наблюдений.
Результати лікування хворих на нейробластому групи високого ризику
М.В. Велимчаниця
Національний інститут раку, Київ, Україна
Нейробластома є однією з найпоширеніших солідних злоякісних пухлин у дітей. Частота виникнення цієї патології становить 0,85–1,1 на 100 тис. осіб дитячого віку.
Мета роботи — покращити результати лікування дітей із нейробластомою групи високого ризику.
До групи стандартного ризику включено 74 пацієнти з І–ІІІ стадією патологічного процесу. До групи високого ризику увійшли 69 хворих. Як критерії несприятливого прогнозу використали загальновідомі прогностичні характеристики: вік дитини, стадію процесу, ампліфікацію гена N-myc. В усіх хворих у 1-й лінії терапії застосовували комбіноване лікування за клінічними протоколами І та ІІ (протокол І — NB-2004, протокол ІІ — HR-NBL-1/ESIOP). Пацієнти групи стандартного ризику отримували терапію тільки за І протоколом. Загальна 5-річна виживаність хворих цієї групи становила 67,0%. Дітей групи високого ризику, які одержували лікування за І протоколом, включено до 1-ї групи, а тих, у яких проводили терапію за ІІ протоколом, — до 2-ї групи. Загальна виживаність хворих групи високого ризику сягала 30,4%. Залежно від використаної терапевтичної програми загальна виживаність у 1-й групі становила 22,7%, у другій — 38,9%. Також ми проаналізували виживаність пацієнтів групи високого ризику відповідно до наявності у хворого N-myc ампліфікації. Загальна виживаність N-myc-негативних хворих досягла 49,8%, N-myc-позитивних — 24,3%. У всіх випадках визначали досліджувані молекулярно-генетичні фактори несприятливого прогнозу, а саме — ампліфікацію N-myc та поліморфізм гена GSTP1.
У групу стандартного ризику увійшли 13 хворих на нейробластому І–ІІІ стадії без прогностично несприятливих молекулярно-генетичних маркерів. Як терапевтичну програму застосовували І протокол. Наразі всі діти групи стандартного ризику живі. До групи високого ризику включено 26 N-myc-позитивних пацієнтів з І–ІV стадією пухлинного процесу. Діти групи високого ризику отримували лікування за І та ІІ протоколом. У 13 хворих завершальним етапом терапії проведено високодозову хіміотерапію з аутотрансплантацією стовбурових клітин периферичної крові, із них у 9 —тандемну. 3 пацієнтів померли від прогресування хвороби.
Впровадження нових прогностичних критеріїв та інтенсифікація лікування згідно з розробленими методиками дозволили у 26 дітей із нейробластомою групи високого ризику досягти безпосередньої ефективності лікування (добра та дуже добра часткова відповідь) у 70,1% випадків. Нині загальна виживаність у групі хворих високого ризику, які отримували лікування за І протоколом, становить 70,0%, а у пацієнтів, пролікованих за ІІ протоколом, — 75,0%.
Таким чином, у нашому дослідженні доведено, що хворі групи високого ризику, у яких діагностовано позитивний N-myc онкоген, мають набагато гірший прогноз порівняно з пацієнтами, у яких цей маркер відсутній. Загальна виживаність N-myc-негативних хворих становить 49,8%, N-myc-позитивних — лише 24,3%. Також доведено, що ІІ протокол, запропонований для лікування пацієнтів із прогностично несприятливими нейробластомами групи високого ризику, в нашому дослідженні виявився ефективнішим за І протокол.
Иммунофенотип лимфоцитов, инфильтрирующих меланому кожи: связь с эффективностью интерферонотерапии
В.Н. Весельская
Национальный институт рака, Киев, Украина
Известно, что у больных меланомой кожи (МК) лимфоидно-клеточная инфильтрация опухоли и/или индукция транскрипционных факторов генов иммунного ответа свидетельствует об активации противоопухолевой иммунной защиты и коррелирует с благоприятным прогнозом. В настоящее время активно обсуждается возможность включения иммунологических критериев в параметры стадирования онкологических заболеваний и применения в ряде случаев иммунозависимых факторов (irRC) при оценке результатов иммунотерапии.
Цель исследования — изучение локализации лимфоцитов, их фенотипических характеристик и выраженности инфильтрации ткани первичной опухоли для уточнения прогностической ценности этих показателей при проведении адъювантной интерферонотерапии (ИФН-терапии) у больных первично-локализованной МК.
При помощи иммуногистохимического метода изучен иммунофенотип (CD3, CD8, CD4, CD20, CD56, CD45RA, CD45RO, CD95, CD25, HLA-DR) лимфоцитов, инфильтрирующих первичную опухоль, у 12 больных МК IB–IIC стадии.
Установлено, что клетки лимфоидного инфильтрата экспрессируют CD3−, CD8−, CD45RA−, CD45RO− и CD20−антигены. Во всех случаях в строме и паренхиме первичной опухоли представлены Т-лимфоциты (CD3+), и только в 3 из 12 случаев, помимо CD3+-клеток, выявлены В-лимфоциты (CD20+). Все Т-лимфоциты экспрессировали исключительно корецептор CD8, что позволило отнести их к субпопуляции цитотоксических Т-лимфоцитов. Большинство последних локализовались в строме опухоли и были представлены как наивными Т-клетками (CD45RA+), так и клетками иммунологической памяти (CD45RO+). При ретроспективном анализе на фоне ИФН-терапии установлено, что у пациентов с благоприятным течением заболевания, в отличие от больных с рецидивом МК, развившимся у 4 из 12 лиц в течение года после иссечения первичной опухоли, регистрируют более выраженную инфильтрацию стромы опухоли CD45RO+-клетками, а паренхимы — CD8+-лимфоцитами.
Полученные результаты открывают новые возможности в применении иммунологических параметров в прогнозировании ответа на ИФН-терапию у больных первично-локализованной МК.
Молекулярні механізми розвитку та резистентності плоскоклітинної карциноми легені за рахунок ракових стовбурових клітин
Є.А. Воробєй, О.М. Грабовий
Національний інститут раку, Київ, Україна
Рак легені (РЛ) із його різноманітними підтипами відомий як резистентний до лікування вид новоутворень, який займає перше місце за розповсюдженістю у світі. Припускають, що РЛ підтримується та поширюється за рахунок незначної популяції ракових стовбурових клітин (РСК), існування яких зумовлює резистентність пухлини до лікування.
Підтримання клітинного складу епітелію легень відбувається за рахунок діяльності трьох основних популяцій стовбурових клітин (СК): базальних клітин, клітин Клара, клітин альвеолярного типу ІІ. Спираючись на гіпотезу про РСК і дані, отримані з експериментальних робіт, перелічені вище популяції СК можна співвіднести з різними гістологічними підтипами РЛ.
Численні дослідження показали, що плоскоклітинна карцинома легень (ПКК) розвивається з базальних клітин, які містяться у проксимальних повітряних шляхах (трахея, бронхи), що мають фенотип CK5+/CK 14+/p63+. Ці базальні клітини, після пошкодження повітряних шляхів, мають здатність до самооновлення та дають початок клітинам із різним фенотипом (мультипотентні особливості).
РЛ — результат взаємодії впливу несприятливих факторів, індивідуального генетичного портрета та накопичення соматичних генетичних пошкоджень. Цей процес належить до багатокрокового канцерогенезу, що розпочинається з еволюційних змін ініціаторних легеневих клітин. Зокрема, за активацію та утилізацію канцерогенів відповідають гени родини цитохромів CYP 1A1 та глутатіонтрансферази GSTM1 відповідно, порушення функціонування яких підвищує ризик виникнення РЛ. За контроль клітинного циклу в ПКК відповідальними є 2 сигнальні шляхи: p16-cyclin D-pRb-E2F та p19ARF-Mdm2-p53, порушення в роботі яких призводять до неконтрольованого клітинного поділу. Окрім того, інактивація p53 спричинює пригнічення апоптозу та сприяє виникненню нових онкоасоційованих мутацій.
З урахуванням можливості РСК ініціювати та підтримувати клітинну популяцію пухлини дослідження мають бути спрямовані на вивчення шляхів патогенезу ПКК із базальних СК легень для подальшого застосування цих відомостей у лікувальній практиці.
Радіотермометрія як метод контролю ефективності хіміотерапевтичного етапу в комплексному лікуванні хворих зі злоякісними новоутвореннями порожнини рота, ротової та гортанної частини глотки в занедбаних стадіях
М.О. Воробйов, О.В. Шмикова
Запорізький державний медичний університет, Запоріжжя, Україна
В Україні у структурі захворюваності на рак слизової оболонки порожнини рота і глотки відносно всіх злоякісних пухлин частота цієї патології становить майже 3%, а смертність з її приводу — 3,65 на 100 тис. населення.
Мета роботи — порівняти ефективність використання неоад’ювантної системної поліхіміотерапії (ПХТ) у різних комбінаціях хіміопрепаратів і променевої терапії з радіотермометричним контролем при лікуванні хворих на місцево-розповсюджений рак слизової оболонки порожнини рота, ротової та гортанної частини глотки.
Дocлiджeння базується на результатах лікування 163 пацієнтів із місцево-розповсюдженим раком слизової оболонки порожнини рота, ротової та гортанної частини глотки стадії T2–4N0–3M0, які пройшли комплексне лікування з неоад’ювантною системною ПХТ з використанням цисплатину (когорта I; n=103) та поліплатиллену (когорта II; n=60), а також променевої терапії. У 121 хворого до та після кожного етапу лікування вимірювали температуру пухлини за допомогою радіотермометра РТМ-01-РЕС з метою визначення ефективності кожного етапу хіміотерапевтичного лікування.
Контроль змін температури у пухлині та метастазах дозволив оптимізувати кількість курсів ПХТ, яка в середньому становила 2,2 курса до початку променевої терапії. Так, у I групі від прогресування захворювання до року померли 24 (23,3%) хворі, у термін від 1 до 3 років — 21 (20,4%), продовжують перебувати під спостереженням 58 (56,3%) пацієнтів. У II групі: померли до року — 10 (16,7%) хворих, у термін від 1 до 3 років — 9 (15,0%), перебувають під спостереженням — 41 (68,3%) пацієнт.
Застосування індукційної системної ПХТ із поліплатилленом при лікуванні хворих із раковими пухлинами порожнини рота, ротової та гортанної частини глотки має переваги перед використанням системної хіміотерапії з цисплатином.
Радіотермометрія у лікуванні пацієнтів зі злоякісними новоутвореннями порожнини рота, ротової та гортанної частини глотки є ефективним методом контролю динаміки перебігу захворювання і дозволяє оптимізувати тактику комплексної терапії при злоякісних пухлинах цієї локалізації.
Магнітно-резонансна томографія у стадіюванні раку прямої кишки: сучасний стан проблеми. Огляд літератури
О.В. Ганіч, А.П. Безносенко
Національний інститут раку, Київ, Україна
МРТ-зображення високої якості демонструють значний відсоток збігів із гістологічними зрізами видаленого препарату, що надає, при правильній інтерпретації результатів, додаткові можливості для уточнення прогнозу захворювання за допомогою визначення стадії T та N. Завдяки такій техніці стає доступним визначення інтенсивності передопераційної терапії залежно від ризику рецидиву захворювання. Без МРТ-стадіювання виявлення з високим рівнем достовірності важливих прогностичних факторів можливе тільки при дослідженні видаленого препарату. Таким чином втрачається можливість потенційного зниження стадії захворювання, що впливає на прогноз останнього. Більшу ефективність передопераційної, ніж післяопераційної, терапії забезпечує виявлення прогностичних факторів у передопераційний період.
Мета роботи — огляд літератури, визначення сучасних можливостей МРТ у стадіюванні раку прямої кишки (РПК) та потенційних напрямів наукових досліджень у цій сфері.
Опрацьовано 3 монографії та 24 наукові статті, в яких розглянуто застосування МРТ у стадіюванні РПК.
Як показують результати багатоцентрового дослідження MERCURY на чолі з радіологом Джиною Браун, впровадження стандартизованої техніки сканування та стандартизованих форм опису дослідження дозволить зробити оцінку прогностичних факторів при РПК і подальше документування результатів достовірно точною процедурою, що забезпечить клініцистів незамінною інформацією для визначення тактики лікування. Разом з тим залишається відкритим питання можливостей дифузно-зважених зображень в оцінюванні ефекту хіміопроменевої терапії. Нині кількість робіт на цю тему нечисленна, дані досліджень суперечливі.
Магнітно-резонансна томографія у стадіюванні раку прямої кишки
О.В. Ганіч, А.П. Безносенко, А.С. Коровіна
Національний інститут раку, Київ, Україна
Стадіювання раку прямої кишки (РПК) дозволяє правильно визначити тактику лікування пацієнтів цієї категорії.
Мета дослідження — встановити діагностичну цінність магнітно-резонансної томографії (МРТ) у стадіюванні Т та N і визначенні залучення циркулярної границі резекції при РПК.
Ретроспективно у дослідження включено 49 пацієнтів із гістологічно верифікованим РПК, які проходили лікування у Національному інституті раку та яким у доопераційний період проводили МРТ і комп’ютерну томографію (КТ) органів малого таза, трансанальне ультразвукове дослідження (ТРУЗД) прямої кишки. Оцінювали точність методів у визначенні Т та N стадії пухлини та залучення циркулярного краю резекції (відстань до мезоректальної фасції). Контроль здійснювали за результатами патоморфологічного дослідження післяопераційних препаратів.
У визначенні стадії Т точність МРТ, КТ і ТРУЗД становила 90; 65 та 84% відповідно. У встановленні стадії N точність МРТ, КТ і ТРУЗД сягала відповідно 84; 70 та 75%. При визначенні ступеня залучення циркулярної границі резекції точність МРТ, КТ і ТРУЗД становила 88; 65 та 84% відповідно. Судячи з отриманих результатів, МРТ можна вважати методом вибору в стадіюванні РПК.
Застосування інноваційного методу еластографії в ультразвуковому дослідженні патології шийки матки
Т.С. Головко, О.О. Бакай, А.С. Крахмальова
Національний інститут раку, Київ, Україна
Метою роботи було дослідження можливостей нової методики соноеластографії в діагностиці новоутворень шийки матки.
Обстежено 87 пацієнток із патологією шийки матки (у 11 з них виявлено цервіцит, у 14 — дисплазію, у 62 — рак шийки матки). До контрольної групи увійшли 10 практично здорових осіб. Вік жінок становив від 29 до 70 років. Усім пацієнткам проводили комплексне ультразвукове обстеження із застосуванням еластографії. Ультразвукову семіотику зіставили з клінічним перебігом хвороби та даними морфологічного дослідження.
При доброякісній патології переважали еластичні типи еластограм, злоякісні пухлини забарвлювалися відповідно жорстким типам картування. Результати дослідження продемонстрували ефективність соноеластографії в оцінці поширеності неопроцесу: при виявленні інвазії пухлини в параметрій чутливість підвищилася з 77,1 до 91,4%, специфічність — з 85,1 до 96,2%, точність — з 80,6 до 93,5%; при інвазії пухлини у піхву ці показники зросли відповідно з 75 до 83,3%, з 76,9 до 88,4% та з 75,8 до 85,4%; у тіло матки — з 82,9 до 85,3%, з 85,7 до 95,2% та з 83,8 до 88,7% відповідно.
Застосування еластографії підвищує інформативність ультразвукового дослідження в оцінці поширеності раку шийки матки.
Магнітно-резонансна томографія в діагностиці колоректального раку
Т.С. Головко, М.С. Смакова, А.С. Коровіна
Національний інститут раку, Київ, Україна
Мета дослідження — підвищити ефективність променевої діагностики колоректального раку шляхом використання магнітно-резонансної томографії (МРТ) під час первинного обстеження та ведення пацієнтів.
Проведено МРТ із внутрішньовенним контрастним підсиленням у 45 пацієнтів із попереднім діагнозом утворення прямої (сигмоподібної ободової) кишки. Заздалегідь усім хворим виконано фіброколоноскопію з подальшою прицільною біопсією. 38 пацієнтам із гістологічно верифікованим діагнозом аденокарциноми прямої чи сигмоподібної ободової кишки попередньо проведено передопераційний курс променевої терапії та контрольну МРТ для моніторингу динаміки процесу. У 25 пацієнтів цієї групи виконано оперативне втручання, в післяопераційний період з метою виявлення продовження захворювання — МРТ.
При МРТ-дослідженні за участю 38 пацієнтів із гістологічно підтвердженою аденокарциномою прямої чи сигмоподібної ободової кишки виявлено: у 38 (100%) випадках — циркулярне нерівномірне потовщення стінок прямої кишки зі стенозом її просвіту; у 10 (26%) пацієнтів — відсутність ознак інвазії; у 18 (47%) хворих — пухлинну інвазію прилеглої жирової клітковини, з яких у 13 випадках інфільтрація поширювалася на органи, фасції та м’язи порожнини таза. Із 38 пацієнтів у 21 (55%) виявлено метастазування, з яких у 13 (34%) випадках — у регіонарні лімфовузли та у 8 (21%) — у кістки порожнини таза. Після курсу променевої терапії у 1 пацієнта зареєстровано повний регрес, у 15 — частковий (пухлина зменшилася більше ніж на 50%), у 32 хворих — стабілізацію процесу (регрес до 50%), у 5 — негативну динаміку (прогресування більше ніж на 25%).
У 28 (74%) пацієнтів можливо було провести оперативне втручання. При моніторингу перебігу захворювання останніх у 15 (39%) хворих виявлено рецидив.
МРТ — високоінформативний метод променевої діагностики колоректального раку, який допомагає визначити ступінь поширеності процесу, оцінити ефективність проведеного лікування і вчасно виявити рецидив.
Застосування низьких доз циклофосфаміду сумісно з вакциною на основі дендритних клітин для зниження пухлиноасоційованої імуносупресії
О.І. Горбач, Н.М. Храновська, О.В. Скачкова, Р.І. Сидор, Н.М. Свергун
Національний інститут раку, Київ, Україна
Значна частина хворих онкологічного профілю гине від рецидивів і метастазів, які розвиваються після видалення первинної пухлини та проведення променевої та хіміотерапії, що зумовлено неможливістю повного знищення пухлинних клітин в організмі за допомогою консервативних методів лікування. Застосування низьких доз хіміопрепаратів сприяє зменшенню кількості Т-регуляторних клітин з імуносупресорними властивостями.
Метою роботи було дослідити вплив дендритноклітинної вакцинотерапії та низьких доз циклофосфаміду (ЦФ) на ступінь вираженості пухлиноасоційованої імуносупресії у мишей лінії С57Bl/6 із перещепленою карциномою легені Льюїс (КЛЛ).
В експериментальних дослідженнях використано 80 мишей лінії С57Bl/6. Клітини КЛЛ вводили внутрішньом’язово в летальній дозі 1•106 клітин на тварину. ЦФ у дозі 2 мг/кг застосовували у тварин інтраперитонеально 10 або 4 рази щоденно. Вакцину вводили внутрішньовенно в орбітальний синус ока в концентрації 0,2•106 дендритних клітин на тварину, починаючи з 11-ї доби після перещеплення пухлини, 3 рази з інтервалом 3 доби.
Обидві схеми хіміоімунотерапії продемонстрували виражений протипухлинний ефект у мишей лінії C57Bl/6 із перещепленою КЛЛ. Встановлено, що застосування хіміоімунотерапії у групі комбінованого лікування з ЦФ у сумарній дозі 8 мг/кг значно посилює ступінь імунної відповіді, а саме: підвищується цитотоксична активність спленоцитів, зменшується кількість лімфоцитів у стані анергії у відповідь на фітогемаглютинін, підвищується індекс проліферативної активності спленоцитів. У групі тварин, що отримували ЦФ у сумарній дозі 8 мг/кг, відмічено зниження системної пухлиноасоційованої імуносупресії за рахунок зменшення рівня експресії мРНК TGF-β та IL-10 з можливим переключенням імунної відповіді з гуморальної на клітинну шляхом посилення експресії мРНК ІФН-γ та зниження — IL-4.
Застосування ЦФ у сумарній дозі 8 мг/кг знижує ступінь пухлиноасоційованої імуносупресії, таким чином підсилюючи протипухлинний ефект імунотерапії на основі дендритних клітин.
Радикальна простатектомія: аналіз віддалених онкологічних результатів
В.М. Григоренко, Р.О. Данилець, М.В. Вікарчук, С.М. Межерицький, С.С. Волков
ДУ «Інститут урології НАМН України», Київ, Україна
Радикальна простатектомія (РПЕ) — один із методів радикального лікування при локалізованому та місцево-розповсюдженому раку передміхурової залози (РПЗ). За даними світової літератури, рецидив після РПЕ виникає в 27–53% випадків.
Мета дослідження — визначити віддалені онкологічні результати РПЕ та оцінити фактори, що підвищують ризик виникнення біохімічного рецидиву РПЗ.
Ретроспективно вивчено дані 302 хворих, яким проведено відкриту РПЕ з приводу РПЗ. Середній період спостереження становив 47,2 (12–150) міс, середній вік на момент операції — 62±5,8 (40–78) року. 15,2% пацієнтів увійшли до групи низького ризику, 27,2% — проміжного, 57,6% — високого ризику за d’Amico.
На час спостереження живими залишаються 277 (91,7%) хворих, померли — 25 (8,3%), у тому числі від прогресування РПЗ — 17 (5,6%). Рецидив РПЗ виник у 92 (30,5%) пацієнтів. 3-, 5- та 7-річна безрецидивна виживаність становила відповідно 67,8; 64,7 та 59,7%; 3-, 5- та 7-річна канцерспецифічна виживаність — 98,1; 91,7 та 88,3% відповідно; 3-, 5- та 7-річна загальна виживаність — 95,8; 91,3 та 85,8% відповідно. Серед пацієнтів низького ризику рецидив розвинувся у 4,3%, проміжного — у 14,6%, високого — у 44,8% хворих. За наявності позитивного хірургічного краю рецидив констатовано у 74,5%, при периневральній інвазії пухлини — у 72,2% пацієнтів (р<0,05 у всіх випадках).
Пацієнти високого ризику з додатковими несприятливими факторами прогнозу (позитивний хірургічний край, периневральна інвазія) мають підвищений ризик виникнення біохімічного рецидиву та потребують проведення негайної післяопераційної гормональної та/або променевої терапії. Такий підхід до лікування хворих на РПЗ дозволяє досягнути високого рівня канцерспецифічної виживаності.
Антиандрогенна терапія раку передміхурової залози в стандартній та редукованій дозах
В.М. Григоренко, Р.О. Данилець, С.С. Волков, М.В. Вікарчук
ДУ «Інститут урології НАМН України», Київ, Україна
Антиандрогенна терапія — основний метод паліативного лікування при раку передміхурової залози (РПЗ). Високі вартість лікування та частота побічних явищ спонукають до перегляду загальноприйнятих доз і режимів прийому гормональних препаратів.
Мета дослідження — порівняти результати терапії при РПЗ нестероїдним антиандрогеном у редукованій та стандартній дозі з метою оптимізації лікування.
У дослідження увійшли 112 хворих на РПЗ ІІ–IV стадії. Досліджувану групу сформували 28 хворих, що отримували флутамід у редукованій дозі 125 мг 4 рази на добу, групу контролю — 84 пацієнти, у яких застосовували флутамід у стандартній дозі 250 мг 3 рази на добу. До лікування рівень простатичного специфічного антигену становив у середньому 46,6±5,9 в досліджуваній групі та 40,2±6,9 — у групі контролю. Усі хворі мали іритативну та обструктивну симптоматику різної інтенсивності, збільшення об’єму передміхурової залози (ПЗ) за даними ультразвукового дослідження. Ефективність лікування оцінювали 1 раз на 3 міс. Середній час спостереження становив 77,4±36,6 та 64,9±36,6 міс відповідно в першій і другій групах.
За час спостереження померли 65 (58,0%) із 112 хворих: 14 (50,0%) — у досліджуваній групі та 51 (60,7%) — у групі контролю. Медіана виживаності становила 96 та 78 міс відповідно. Вірогідної різниці в обох досліджуваних групах при порівнянні загальної та канцерспецифічної виживаності не виявлено (p>0,05). В обох групах пацієнтів відмічали зниження інтенсивності скарг, достовірне покращення урофлоуметричних показників, зменшення об’єму ПЗ. Достовірної різниці між групами у змінах зазначених показників у динаміці не відзначено. У хворих досліджуваної групи частота побічних реакцій була нижчою на 62%.
Клінічна ефективність лікування флутамідом у стандартній і редукованій дозі подібна. Редукція дози флутаміду не знижує показників загальної та канцерспецифічної виживаності та зменшує частоту побічних проявів лікування.
Оцінка факторів ризику та ускладнень після біопсії передміхурової залози
А.О. Губарь, Г.В. Бачурін, В.І. Бачурін, М.А. Довбиш, Хасан Ахмед Рафіа
Запорізький державний медичний університет, Запоріжжя, Україна
Біопсія передміхурової залози (ПЗ) з використанням трансректальної ультрасонографії (ТРУСГ) з метою діагностики раку цього органа є частою процедурою, яку застосовують у щоденній урологічній практиці. Цей метод характеризується низьким рівнем ускладнень та достатньою простотою проведення. Однак гостре запалення ПЗ або сепсис можуть стати серйозними ускладненнями процедури. Останні дослідження довели, що пацієнтів з уретральним катетером, цукровим діабетом або тих, у яких заплановано біопсію з більшою кількістю зразків, на відміну від стандартної методики, слід дуже прискіпливо спостерігати через ймовірний найвищий рівень ускладнень.
З січня 2005 по грудень 2014 р. під нашим спостереженням перебували 484 пацієнти, яким виконано біопсію ПЗ із використанням ТРУСГ. Стандартною процедурою підготовки було застосування очищувальної клізми та періопераційної антибіотикопрофілактики.
Із 484 пацієнтів у 24 (4,96%) виявили ускладнення, які включали гостре запалення ПЗ (18 хворих, 3,72%), гостру затримку сечі (2 хворих, 0,41%), гематурію (1 хворий, 0,21%), сепсис (3 хворих, 0,62%) впродовж тижня після біопсії.
Біопсія ПЗ без попередньої підготовки визнана єдиним фактором ризику для оцінки ускладнень. Загальна підготовка (використання очищувальної клізми та антибіотикопрофілактика) й асептичні умови проведення процедури слід вважати найбільш важливими профілактичними заходами.
Результати реконструктивних втручань при пухлинах дистального відділу променевої кістки
А.Г. Дєдков, В.Ю. Костюк, П.А. Ковальчук, С.І. Бойчук, М.М. Кукушкіна
Національний інститут раку, Київ, Україна
Хірургічне лікування пацієнтів із пухлинами дистального відділу променевої кістки (ПДВПК) є одним із найважливіших завдань онкоортопедії через складні анатомотопографічні особливості органа.
Мета дослідження — поліпшення якості життя хворих за рахунок виконання реконструктивних органозберігаючих операцій.
У дослідження включено 54 пацієнти із ПДВПК — зі злоякісними та умовно доброякісними (місцевоагресивними) утвореннями, — які отримали хірургічне лікування з 2000 по 2014 р. Серед пухлин: хондросаркома — у 2 (3,70%), остеосаркома — у 4 (7,41%), гігантоклітинна пухлина — у 48 (88,89%) хворих. Середній вік пацієнтів становив 34,15 року. Хірургічне лікування виконували за стандартною методикою. Реконструкцію дефекту променевої кістки проводили аутологічним проксимальним відділом малогомілкової кістки, при фіксації трансплантата кістку забезпечували серкляжним фіксатором. Функціональні результати оцінено за шкалою Enneking.
Ускладнення виявлено у 16 (29,63%) хворих: підвивих головки трансплантата — в 10 (18,52%), інфекційні ускладнення — у 1 (1,85%), рецидив захворювання — у 1 (1,85%), незрощення та лізис трансплантата — у 4 (7,41%). Максимального функціонального результату досягнуто через 12 міс після операції (84,6%).
Хірургічні втручання, виконані за даною методикою, у більшості випадків дозволили відновити функцію верхньої кінцівки в середньому у 82,17% випадків. Ускладнення у 29,63% хворих суттєво не вплинули на функцію верхньої кінцівки. Такі ускладнення, як підвивих головки, незрощення та лізис трансплантата можуть бути усунені за рахунок удосконалення методів фіксації трансплантат — кістка, що потребує подальшого вивчення.
Оценка показателей динамики функций мочеполовой системы путем усовершенствования методики хирургического лечения у больных инфильтративным раком шейки матки
Т.В. Дерменжи, В.С. Свинцицкий, С.В. Неспрядько, А.В. Кабанов
Национальный институт рака, Киев, Украина
Цель исследования — оценить показатели динамики функций мочеполовой системы путем усовершенствования методики хирургического лечения больных инфильтративным раком шейки матки (РШМ).
В 2012–2015 гг. в отделении онкогинекологии Национального института рака проведено исследование, в котором 63 больным инфильтративным РШМ (средний возраст 32,7±4,9 года) выполнена радикальная гистерэктомия (РГЭ): из них у 32 пациенток (I группа) вмешательство производили с сохранением тазового вегетативного нервного сплетения (ТВНС) и 31 больной — по стандартной методике, без сохранения ТВНС (II группа, контрольная). Цистоманометрию выполнили у 27 пациенток I группы и 30 больных II группы с целью оценки растяжимости стенки мочевого пузыря (РСМП). РСМП (комплаентность) рассматривали как изменение детрузорного давления при определенной вариации объема заполнения. Высчитывали по формуле:
К=∆V/∆Р,
где К — РСМП (в мл/см вод. ст.); ∆V — изменение объема; ∆Р — изменение давления детрузора в момент изменения объема.
При сохранении ТВНС РСМП составляла >10 мл/см вод. ст. при объеме <100 мл и >25 мл/см вод. ст. — при объеме <500 мл. Прогностические показатели были тождественны в исследуемых группах.
Проведя анализ К, ∆V, ∆Р у пациенток I группы, мы определили, что РСМП (ср. К) составляет 18,9 мл/см вод. ст. при разнице объема (ср. ∆V) 193 мл и разнице давления (ср. ∆Р) 7,85 мм рт. ст. Проанализировав показатели у пациенток II группы, мы установили, что РСМП (ср. К) достигает 13,5 мл/см вод. ст. при разнице объема (ср. ∆V) 151 мл и разнице давления (ср. ∆Р) 7,4 мм рт. ст.
На основании полученных результатов мы можем сделать вывод, что коэффициент РСМП у пациенток с сохранением ТВНС выше, чем у пациенток II группы, что свидетельствует о более редких нарушениях функции со стороны мочеполовой системы, таких как затруднение опорожнения мочевого пузыря, недержание мочи разной степени проявления, нарушение вагинальной секреции, болевой синдром, возникающих у пациенток I группы.
Частота виникнення ускладнень i неадекватного епідурального блоку при періопераційному знеболенні в онкохірургії
Х.А. Закальська, І.І. Лісний, С.В. Ушаков, В.Ф. Присяжнюк
Національний інститут раку, Київ, Україна
Показано, що попри високу ефективність і мінімізацію негативних наслідків певні ускладнення епідуральної анестезії на практиці все-таки виникають. Згідно з даними літератури їхня частота становить 0,1–4,1%.
Мета дослідження — встановити частоту розвитку ускладнень і неефективності епідурального блоку при періопераційному знеболенні в онкохірургії.
На базі відділення анестезіології та інтенсивної терапії Національного інституту раку з січня 2014 р. по нині проводять проспективне обсерваційне дослідження пацієнтів, у яких застосовували епідуральну анестезію. Пункцію та катетеризацію епідурального простору лікарі виконували, використовуючи набори «Perifix 401» та «Perifix One 401» (BBraun), а результати спостережень вносили в розроблену нами анкету.
У дослідження було включено 575 пацієнтів — 231 жінку та 344 чоловіки. 518 епідуральних пункцій виконано з використанням набору «Perifix 401». Перша спроба при цьому була вдалою в 73,75% випадків. Частота ускладнень становила: при пункції судини — 6,76%, пункції твердої мозкової оболонки — 1,16%, катетеризації епідуральної вени — 4,38%, а також технічні труднощі — 18,53%. Парестезії при введенні голки виникали у 3,86% пацієнтів, а при введенні катетера — у 12,93%. Гіпотензію зафіксували у 32,63% хворих, брадикардію — у 13,1%, головний біль — у 0,2%. У 14,3% випадків розвинувся неадекватний блок. 57 пункцій виконано з використанням набору «Perifix One 401». Перша спроба була вдалою в 75,44% випадків. Частота ускладнень становила: при пункції судини — 3,5%, пункції твердої мозкової оболонки — 1,75%, катетеризації епідуральної вени — 3,5%, а також технічні труднощі — 14,04%. Парестезії при введенні голки розвинулися у 8,77% пацієнтів, а при введенні катетера — у 10,53%. Гіпотензію відзначено у 14,04% хворих. У 17,54% випадків виник неадекватний блок.
Висновки:
1. Найпоширенішим ускладненням, що виникає при епідуральній анестезії, є гіпотензія.
2. Частота виникнення ускладнень епідуральної анестезії є нижчою при використанні набору «Perifix One 401».
Лазерні методи оцінки цитологічних мазків шийки матки при аденокарциномі
Н.В. Зелінська, О.П. Пересунько
Буковинський державний медичний університет, Чернівці, Україна
За останні роки відзначають підвищення захворюваності на аденокарциному шийки матки (АКШМ) порівняно з відповідним показником при плоскоклітинному раку шийки матки (ПКРШМ). Цитологічна діагностика АКШМ складніша і менш точна, ніж діагностика ПКРШМ.
Мета роботи — обґрунтувати спектрополяризаційне дослідження мазків шийки матки як додатковий метод діагностики АКШМ.
Використано мазки-відбитки із зіскрібка цервікального каналу та нативні мазки з екзоцервікса при АКШМ (n=50). Група порівняння — аналогічні мазки при ПКРШМ (n=56). Проведено оцінку оптично-анізотропних властивостей вищезазначених зразків за рівнем лінійного дихроїзму, який характеризує здатність до перетворення ортогональних лінійних станів поляризації в товщі біологічного зразка з використанням широкого спектра діапазону.
Параметри лінійного дихроїзму нативного мазка при АКШМ становлять 0,343±0,041, при ПКРШМ — 0,194±0,021; зіскрібка з цервікального каналу при АКШМ — 0,396±0,081, при ПКРШМ — 0,212±0,014 (таблиця, рисунок).
Таблиця. Значення лінійного дихроїзму для усіх досліджених груп зразків
| Нативний мазок у нормі | Нативний мазок при ПКРШМ | Нативний мазок з ектоцервікса при АКШМ | Мазок-відбиток у нормі | Мазок-відбиток при ПКРШМ | Мазок-відбиток при АКШМ | |
| λ, нм | n=30 | n=56 | n=50 | n=30 | n=56 | n=50 |
| 380 | 0,056±0,01 | 0,136±0,012 | 0,273±0,04 | 0,095±0,013 | 0,110±0,031 | 0,176±0,026 |
| 400 | 0,056±0,013 | 0,171±0,021 | 0,343±0,041 | 0,076±0,012 | 0,176±0,033 | 0,356±0,043 |
| 420 | 0,063±0,019 | 0,194±0,021 | 0,334±0,002 | 0,113±0,012 | 0,212±0,014 | 0,396±0,081 |
| 440 | 0,065±0,021 | 0,183±0,071 | 0,286±0,007 | 0,110±00,013 | 0,183±0,072 | 0,323±0,031 |
| 460 | 0,067±0,012 | 0,163±0,039 | 0,220±0,01 | 0,096±0,024 | 0,176±0,028 | 0,270±0,037 |
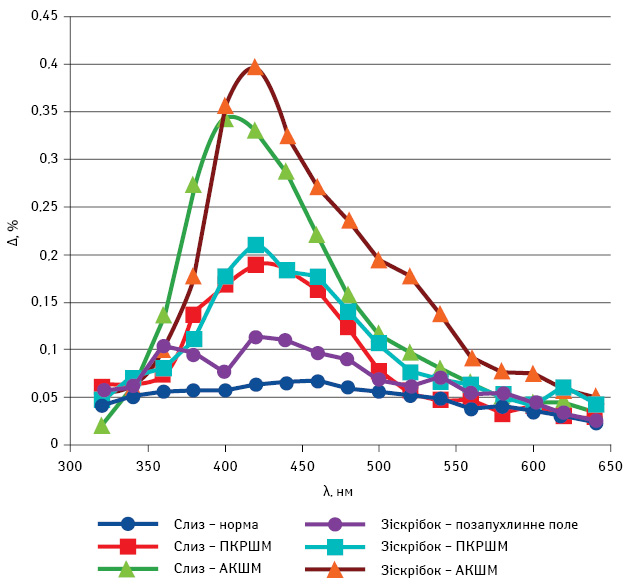 Рисунок. Спектральна залежність значення лінійного дихроїзму для усіх досліджуваних груп зразків
Рисунок. Спектральна залежність значення лінійного дихроїзму для усіх досліджуваних груп зразків
Параметри лінійного дихроїзму при РШМ дозволяють діагностувати АКШМ, на відміну від ПКРШМ та норми. Спектрополяризаційний метод дослідження нативного цитологічного мазка та зіскрібка з каналу шийки матки рекомендують як додатковий у комплексній діагностиці АКШМ.
Лучевые реакции слизистой оболочки полости рта при радиотерапии больных с опухолями орофарингеальной зоны
В.С. Иванкова, О.Ю. Столярова, Т.В. Скоморохова, В.А. Пыльнов
Национальный институт рака, Киев, Украина
Острые лучевые реакции со стороны слизистых оболочек (мукозиты) — это наиболее частые осложнения при проведении лучевой терапии (ЛТ) у больных орофарингеальной зоны (ОФЗ). Наличие и тяжесть лучевых реакций, вызванных ЛТ, являются одними из важнейших критериев эффективности и адекватности ЛТ. От степени выраженности лучевых реакций зависят условия и сроки проведения радиотерапии.
В Национальном институте рака за 2014 год пролечен 61 пациент с опухолями ОФЗ. Все больные были разделены на 2 группы: I группа — 37 пациентов, которые лечились на аппарате «Тератрон» с разовой очаговой дозой (РОД) 2,0 Гр до достижения суммарной очаговой дозы (СОД) 60 Гр. II группа — 24 пациента, получавшие лечение на линейном ускорителе электронов (ЛУЭ) с РОД 2,0 Гр до СОД 60 Гр без перерыва.
По данным ряда авторов, частота мукозитов после ЛТ составляет от 40 до 100% (Trotti A. et al., 2000; Vokes E. et al., 2007). У 30–60% пациентов, получающих только лучевое лечение, и почти у 100%, у которых применяют химиолучевую терапию по радикальной программе, развивается выраженный мукозит полости рта и глотки. В нашем исследовании у половины пациентов, пролеченных на аппарате «Тератрон» на протяжении 2014 г., зарегистрированы лучевые реакции со стороны слизистых оболочек II степени и выше, в результате чего понадобился перерыв в радиотерапии для медикаментозного лечения. При использовании ЛУЭ методом конформного облучения лучевые реакции появлялись по завершении лечения и достигали 90–100%, однако имели умеренную степень выраженности и не требовали активного медикаментозного купирования.
Современная ЛТ с использованием высокоэнергетических источников излучения — ЛУЭ — методом конформного облучения позволяет провести лечение без перерыва, снизить степень выраженности лучевых реакций полости рта, что повышает ее эффективность.
Проблеми радіорезистентності сарком м’яких тканин
В.С. Іванкова, О.Ю. Столярова, М.І. Палій, В.В. Остафійчук
Національний інститут раку, Київ, Україна
В онкологічній практиці прийнято вважати саркоми м’яких тканин (СМТ) резистентними до променевої терапії (ПТ). Але, враховуючи стрімкий розвиток радіологічного обладнання та методик опромінення, слід дослідити цю тезу.
Мета роботи — проаналізувати радіочутливість СМТ, враховуючи перед- та післяопераційну ПТ на лінійному прискорювачі електронів.
Довгий час СМТ сприймали як малочутливі до ПТ пухлини. Проте ще в 2001 р. Brian G. Fuller провів дослідження радіочутливості клітин пухлини. Під час роботи за фактор оцінки радіочутливості автор брав коефіцієнт SF2 (Surviving Fraction — кількість клітин, які вижили при разовій дозі опромінення 2 Гр). Результати дослідження показали, що чутливість СМТ схожа з чутливістю пухлин головного мозку та грудної залози, які вважають помірно радіочутливими. У ході дослідження автор підкреслив, що для досягнення локального контролю СМТ достатньо практично таких самих доз, як і для пухлин грудної залози. Враховуючи результати роботи, вчений акцентував увагу на можливості здійснення перед- та післяопераційного опромінення при СМТ. Нині існує єдине рандомізоване дослідження B. O’Sullivan (2002 р.), в якому порівнювали ускладнення у перед- та післяопераційних курсах ПТ у лікуванні хворих на СМТ. Зроблено висновки, що при проведенні передопераційного курсу ПТ ризик виникнення ускладнень вищий, проте вищою є й загальна виживаність.
Враховуючи дані описаних робіт, можна зробити висновок, що сталий принцип радіорезистентності СМТ є щонайменш недослідженим і потребує глибшого вивчення та подальшого рандомізованого дослідження.
Зміна експресії родини мікроРНК-34 при прогресуванні нейробластоми
М.В. Іномістова, Н.М. Свергун, Н.М. Храновська, О.В. Скачкова, Г.І. Климнюк
Національний інститут раку, Київ, Україна
Нейробластома (НБ) — пухлина симпатичної нервової системи, що становить 15% злоякісних новоутворень дитячого віку. Значна клінічна гетерогенність захворювання вказує на складність генетичних порушень, притаманних НБ. Незважаючи на рідкість мутацій гена TP53, порушення р53 шляху часто виникають при НБ. MDM2 — прямий антагоніст р53, який призводить до зниження його супресорної активності. Ампліфікація гена MYCN (MNA) є маркером агресивного перебігу НБ. Родина мікроРНК-34 (мікроРНК-34а,b,c) найчастіше індукується за допомогою p53 і є важливим медіатором пригнічення росту пухлини.
Метою роботи було визначити роль змін експресії мікроРНК-34а,b,c при прогресуванні НБ та асоціацію з клінічними характеристиками захворювання.
Досліджено зразки пухлинної тканини (ПТ) 75 пацієнтів із верифікованим діагнозом НБ (середній вік — 39,45±4,81 міс; рецидивні пухлини — 5,3%; метастатичні вогнища — 9,3%). Визначення експресії MDM2 та ампліфікації MYCN проводили з використанням специфічних TaqMan праймерів і зондів, а рівня експресії мікроРНК — за допомогою TaqMan MicroRNA Assay, Applied Biosystems (США) і полімеразної ланцюгової реакції з детекцією результатів у режимі реального часу з нормуванням щодо відповідних контролів.
MNA виявлено у 32,7% зразків ПТ. Найнижчі рівні експресії мікроРНК-34а відзначено в зразках ПТ пацієнтів із несприятливими клінічними ознаками (рецидиви, метастази, пізні стадії та MNA). Сильну кореляцію (r=0,95) встановлено між мікроРНК-34b і c, зниження їхньої експресії у пацієнтів із несприятливим перебігом захворювання було статистично незначущим, проте спостерігалося на рівні тенденції (р=0,06). Виявлено зворотну залежність між експресією родини мікроРНК-34 та MDM2 (p<0,05). Зниження рівня мікроРНК-34 асоціювалося зі значним скороченням 3-річної загальної виживаності у пацієнтів із гіперекспресією MDM2, незалежно від статусу гена MYCN. У зразках без MNA та з низьким рівнем експресії MDM2 3-річна загальна виживаність становила на 44% (p<0,05) менше у пацієнтів зі зниженим рівнем експресії мікроРНК-34а.
Залежність зміни експресії родини мікроРНК-34 та MDM2, антагоніста р53, вказує на їхній непрямий регуляторний зв’язок при НБ. Зниження рівня експресії родини мікроРНК-34 може бути використане як маркер несприятливого прогнозу при НБ.
Порівняння морфофункціональних ознак клітинних культур після впливу трастузумабу
О.О. Калмикова, О.І. Джус, Г.М. Світіна, Г.В. Островська, Л.В. Гарманчук
ННЦ «Інститут біології» Київського національного університету імені Тараса Шевченка, Київ, Україна
Трастузумаб — моноклональне гуманізоване антитіло до рецептора епідермального фактора росту — широко застосовують у лікуванні хворих на рак грудної залози (НЕR2-позитивний), проте детальні молекулярно-клітинні механізми його дії щодо інших типів пухлинних клітин з гіперекспресією рецептора EGF та шляхи виникнення резистентності потребують детальнішого вивчення.
Метою роботи було порівняння морфофункціональних характеристик трансформованих адгезивних клітинних культур гепатокарциноми (Нер G2), карциноми шийки матки (НеLа) і первинної культури мезенхімальних стовбурових клітин (МСК), виділених із кісткового мозку щура, після впливу трастузумабу.
Культури клітин вирощували на поживному середовищі DМЕМ (НеLа), RPMI (Нер G2) або αМЕМ (культури МСК) із додаванням 10% ембріональної бичачої сироватки, 2 мМ L-глютаміну, 40 мкг/мл гентаміцину. Трастузумаб додавали в концентрації 5 мкг/мл та інкубували протягом 72 год. Потім клітини забарвлювали залізним гематоксиліном, гематоксиліном Бемера, еозином, барвником Май-Грюнвальда.
У культурі інтактних клітин НеLа переважали кулясті клітини, а клітини Hep G2 мали полігональну форму з чітко окресленими краями та потовщеними відростками. Після впливу трастузумабу на пухлинні культури спостерігали значне розпластання клітин, що є морфологічною ознакою зниження проліферативної активності, фенотип клітин набував типових епітеліальних ознак. МСК у контролі мали витягнуту, веретеноподібну форму з тоненькими довгими відростками, а після дії трастузумабу — округлу форму з короткими та товстими відростками. Ядерно-цитоплазматичне співвідношення (ЯЦС) у культурі HeLa при дії трастузумабу зменшується, а в культурі МСК — зростає. У культурі Hep G2 достовірної різниці ЯЦС не виявлено.
Отже, трастузумаб знижує проліферативну активність і стимулює втрату деяких рис пухлинних культур епітеліального походження, тоді як при впливі на МСК — змінює синтетичну активність ядра та перебудови цитоскелета.
Стан клітинного імунітету при періопераційному знеболенні у хворих на рак нирки
М.О. Катриченко, І.І. Лісний, Р.І. Сидор, С.В. Ушаков
Національний інститут раку, Київ, Україна
Однією з відомих причин смерті при онкопатології є розвиток метастазів і рецидивів після лікування.
Періопераційні фактори, в тому числі різні групи анальгетиків, впливають на клітинну імунну відповідь, пригнічуючи активність натуральних кілерних клітин і цитотоксичних Т-лімфоцитів, які є важливими складовими протипухлинного імунітету.
Метою нашого дослідження було вивчення впливу анальгетиків, опіоїдів і нестероїдних протизапальних препаратів на деякі ланки імунної системи у хворих на рак нирки при хірургічному лікуванні.
Виділено 2 групи хворих: у групі О (n=21) перед операцією застосовували комбінацію морфін + наркотин + папаверин + кодеїн + тебаїн (алкалоїди опію) 2% 1 мл внутрішньом’язово, яку в подальшому вводили для післяопераційного знеболення. У групі Д (n=21) у періопераційний період застосовували декскетопрофен 50 мг внутрішньом’язово.
Оперативне втручання виконано під інгаляційною анестезією севофлураном у сполученні з епідуральною анестезією ропівакаїном 0,2%.
Оцінку болю після операції проводили за візуальною аналоговою шкалою. У всіх хворих виконали забір крові за добу до початку дослідження: до премедикації, перед початком операції при поступленні в операційну, в кінці операції та через 3 доби після оперативного втручання для оцінки маркерів CD3, CD4, CD8, CD16. Аналіз виконували за допомогою методу прямої імунофлюоресценції з використанням моноклональних антитіл до відповідних маркерів.
Встановлено, що середня інтенсивність болю через 12 год після операції у хворих групи О становила 3,6±0,9 бала, групи Д — 3,4±1,1 бала. Через добу після операції середня інтенсивність болю під час руху в групі О досягла 4,1±1,1 бала, а в групі Д — 3,5±0,9 бала. Середньодобова доза комбінації морфін + наркотин + папаверин + кодеїн + тебаїн у хворих у групі О становила 60 мг. У групі декскетопрофену жодному хворому не вводили опіоїдні анальгетики.
У хворих групи О на 2-му етапі дослідження кількість Т-лімфоцитів зменшилася на 20,3% порівняно з показниками до премедикації, тоді як у групі Д таке зниження становило 10%. Абсолютна кількість CD16 лімфоцитів у хворих у групі О на 3-тю добу після операції зменшилася на 52%, а відносна — на 29%. Відповідно, у групі О відносні показники CD3 становили 61%, у групі Д — 65%; CD8 у групі О — 33%, групі Д — 34%; CD4 у групі О — 33%, групі Д — 36%.
Встановлено, що алкалоїди опію чинять більш виражений вплив на кількість і функціональну активність натуральних кілерних клітин порівняно з декскетопрофеном.
Оцінка безпеки та ефективності використання епідуральної анальгезії з двома катетерами при торакоабдомінальних операціях
В.О. Кислицька, А.П. Перконос, А.В. Науменко
Національний інститут раку, Київ, Україна
Оперативні втручання на стравоході супроводжуються значним больовим синдромом, що потребує адекватного знеболення. Епідуральна анальгезія з одним катетером не завжди забезпечує адекватний ефект.
Мета роботи — оцінити ефективність епідуральної анальгезії з двома катетерами в післяопераційний період у хворих після торакоабдомінальних операцій.
На базі відділення анестезіології та інтенсивної терапії Національного інституту раку у період з травня 2011 р. по теперішній час триває проспективне дослідження, в яке включено 40 пацієнтів, середній вік — 57±4 роки. Для післяопераційного знеболення використовували епідуральну анальгезію з двома катетерами, які встановлювали на двох рівнях: верхній рівень катетеризації — ThIV–V, нижній рівень — ThVIII–IX. Післяопераційну анальгезію забезпечували подовженою інфузією ропівакаїну 0,2% або бупівакаїну 0,125% зі швидкістю 5–8 мл/год. Для оцінки ефективності знеболення в післяопераційний період реєстрували інтенсивність болю за 10-бальною візуально-аналоговою шкалою (ВАШ), рівень глюкози в крові та показники гемодинаміки.
У пацієнтів на 1-шу добу інтенсивність болю за ВАШ становила 2,2±0,5 бала, на 2-гу — 1,8±0,4 бала і на 3-тю — 1,6±0,3 бала. Рівень глікемії як стрес-реакції на біль на 1-шу добу досяг 6,2±1,4 ммоль/л, на 2-гу — 5,9±1,2 ммоль/л, на 3-тю — 6,1±1,1 ммоль/л. При аналізі змін середнього артеріального тиску (АТ) та частоти серцевих скорочень (ЧСС) значного зниження цих показників також не відзначено. На 1-шу добу середній АТ становив 77±7 мм. рт. ст., ЧСС — 80±12 уд./хв, на 2-гу — 75±6 мм. рт. ст. та 84±11 уд./хв, на 3-тю — 78±7 мм. рт. ст. та 78±12 уд./хв відповідно.
Висновки:
1. Використання епідуральної анальгезії з двома катетерами забезпечує адекватне знеболення при торакоабдомінальних оперативних втручаннях.
2. Застосування епідуральної анальгезії з двома катетерами не викликає значного зниження АТ і ЧСС, що свідчить про безпеку такого знеболення.
Хірургічне лікування дітей із нейробластомою
(досвід відділення)
Г.І. Климнюк, Е.В. Шайда, С.В. Павлик, О.Й. Іжовський, О.В. Білоконь, М.О. Стежка
Національний інститут раку, Київ, Україна
Нейробластома (НБ) — це злоякісна пухлина симпатичної нервової системи ембріонального походження, що є однією з найбільш поширених солідних утворень у дітей. Займає 3-тє рангове місце у структурі дитячої онкозахворюваності. Пухлина має надзвичайно високу схильність до генералізації процесу.
У науково-дослідному відділенні дитячої онкології Національного інституту раку за період з 2008 по 2013 р. отримали лікування 152 пацієнтів із НБ. В основну групу включено 76 хворих із НБ, яким було проведено оперативне лікування, в контрольну — також 76 хворих, яким хірургічне лікування не проводили.
В основній групі загалом виконано: 32 лапаротомії з видаленням пухлини заочеревинного простору, з яких 6 доповнено лімфодисекцією та 14 — регіонарною лімфаденектомією; 10 торакотомій із видаленням пухлини заднього середостіння, з яких у 1 хворого була виконана комбінована операція з видалення пухлини заднього середостіння з атиповою резекцією верхньочасткового сегмента правої легені; 5 радикальних нефрадреналектомій; 24 операції адреналектомії; 5 операцій з видалення НБ інших локалізацій; 6 операцій з видалення локального рецидиву пухлини та 2 операції з видалення повторного рецидиву НБ.
В основній групі, за даними статистичного відділу, за звітний період всього померли 13 (17%) хворих, у них було діагностовано первинно-метастатичну (ПМ) НБ. У контрольній групі загинули 39 (51%) хворих, з яких у 6 було встановлено III стадію пухлинного процесу, у 33 пацієнтів — ПМ НБ.
Вищий показник 4-річної виживаності відзначають в основній групі — 63,2%, нижчий — у контрольній — 23,7%.
При проведенні порівняння медіани виживаності в різних групах хворих найвищий показник реєструють серед оперованих та неоперованих пацієнтів із локальними НБ — >5 років, тоді як в оперованих із ПМ НБ — 34 міс, неоперованих із ПМ НБ — 20 міс.
Хірургічне лікування є важливим етапом терапії дітей із НБ, що статистично достовірно покращує виживаність при локальних та місцево-розповсюджених пухлинах групи стандартного ризику.
Хирургические методики лечения пациентов с опухолями костей таза
П.А. Ковальчук, С.И. Бойчук, В.Ю. Костюк, В.В. Остафийчук
Национальный институт рака, Киев, Украина
Цель исследования — продемонстрировать современные радикальные хирургические методики лечения пациентов с опухолями костей таза с применением различных методик реконструкции.
В исследование включено 73 пациента с первичными опухолями костей таза различной нозологии, которые проходили лечение в Национальном институте рака с 2010 по 2015 г. Среди них 37 — со злокачественными гистологическими вариантами, 36 — с доброкачественными. Метод лечения зависел от гистологической формы образования. Для доброкачественных преобладал хирургический с применением различных методик реконструкции (n=34). В лечении пациентов с саркомами костей таза применяли комбинированные методы специального лечения согласно принятым протоколам по высокому риску с последующей операцией (n=14), в случае хондросарком немезенхимального типа выполнено только оперативное лечение (n=23). Отказались от лечения или были признаны некурабельными 6 пациентов. Всего выполнено 66 операций: резекции без реконструкции тазового кольца — 41, резекции с реконструктивными методиками — 17, операции с удалением конечности — 8.
В группе доброкачественных опухолей локальных рецидивов после хирургического лечения не отмечено (медиана наблюдения — 36 мес). Общая 3-летняя выживаемость у пациентов с саркомами костей таза составила 39%. У 8 больных зафиксирован рецидив или прогрессирование заболевания в первый год наблюдения, у 6 (75%) из них — положительный край резекции или нарушение абластичности.
Лечение пациентов с опухолями костей таза зависит от гистологического варианта образования. Отдаленный результат во многом предопределяется радикальностью и абластичностью проведенной операции. Современные реконструктивные методики дают возможность в большинстве случаев выполнить органосохраняющие операции и добиться хороших функциональных результатов.
Стан анального сфінктера після застосування неоад’ювантної променевої терапії у хворих на рак прямої кишки
О.О. Колеснік, М.С. Кротевич, А.П. Безносенко, Д.Е. Махмудов
Національний інститут раку, Київ, Україна
Існує достатньо підтверджень негативного впливу променевої терапії на функцію анального сфінктера. Проте морфологічні зміни, які призводять до анальної інконтиненції після застосування різних схем неоад’ювантної променевої терапії (НПТ), залишаються невивченими.
Метою цього дослідження було вивчення гістологічних змін у тканині анального сфінктера після застосування різних схем та доз НПТ у комбінованому лікуванні хворих зі злоякісними пухлинами прямої кишки.
Проаналізовано гістологічні зміни тканини анального сфінктера у 49 пацієнтів після НПТ й екстирпації прямої кишки. У 12 пацієнтів проведено НПТ у сумарній вогнищевій дозі (СВД) 20 Гр крупними фракціями, у 14 хворих — у СВД 30 Гр дрібними фракціями, у 13 — у СВД 50–60 Гр дрібними фракціями. До контрольної групи увійшли 10 пацієнтів, яким НПТ не проводили.
Фіброз I ступеня виявляли переважно в групах 20 і 30 Гр — 75,1 та 64,3% відповідно. У групі 50–60 Гр фіброз II і III ступеня відзначили в 46,2 і 30,7% пацієнтів відповідно. Простежується тенденція до зменшення кількості нервових елементів при підвищенні дози опромінення, хоча достовірної різниці не отримано (р=0,28).
Внаслідок променевої альтерації розвиваються дегенеративні та запальні зміни у тканині анального сфінктера, які призводять до заміщення м’язових елементів фіброзною тканиною і є морфологічним субстратом для подальших функціональних змін.
Методика застосування зовнішньопечінкового гліссонового методу мобілізації воріт печінки при тотальній лапароскопічній правобічній гемігепатектомії (клінічний випадок)
О.О. Колеснік, А.В. Лукашенко, А.А. Бурлака, В.В. Приймак, Д.Е. Махмудов, І.Б. Щепотін
Національний інститут раку, Київ, Україна
У науково-дослідне відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку госпіталізовано хвору віком 53 років зі скаргами на загальну слабкість та біль у проекції правого підребер’я. Анамнез хвороби пацієнтки включав правобічну геміколектомію з приводу раку правого вигину ободової кишки. При детальному обстеженні пацієнтки виявлено метахронні метастази аденокарциноми ободової кишки на межі SgV/VI/VIII печінки. Виконано повністю лапароскопічну правобічну гемігепатектомію із застосуванням методики зовнішньопечінкового гліссонового методу мобілізації воріт печінки (extra-glissonian approach) (рисунок).
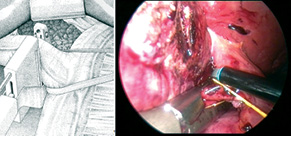
Рисунок. Методика зовнішньопечінкового гліссонового методу мобілізації воріт печінки. Гумовий тримач та судинний степлер заведено за праву гліссонову ніжку (схематично та інтраопераційно)
Пацієнтку виписали під нагляд онколога за місцем проживання на 8-му добу після хірургічного втручання. У ранній післяопераційний період ускладнень не виявлено.
Застосована техніка дозволила безпечно та ефективно лігувати необхідні стуктури воріт печінки в умовах лапароскопічної резекції печінки. Необхідне проведення рандомізованого дослідження з метою подальшого вивчення переваг і недоліків зовнішньопечінкового гліссонового методу мобілізації воріт печінки.
Комбіноване лікування хворих на рак прямої кишки ІІ–ІІІ стадії із застосуванням неоад’ювантної променевої терапії
О.О. Колеснік1, О.Ю. Столярова1, А.П. Безносенко1, Д.Е. Махмудов1, С.Б. Балабушко2, Д.М. Пішак3
1Національний інститут раку, Київ, Україна
2Чернігівський обласний онкологічний диспансер, Чернігів, Україна
3Миколаївський обласний онкологічний диспансер, Миколаїв, Україна
В Україні, як і в більшості країн світу, на момент встановлення діагнозу майже у 70% пацієнтів із раком прямої кишки (РПК) захворювання виявляють у ІІ–ІІІ стадії. Стандартом лікування даного контингенту хворих є комбінований метод, що передбачає використання неоад’ювантної променевої терапії (НПТ) і хірургічного втручання з виконанням тотальної мезоректумектомії.
Мета роботи — дослідити ефективність комбінованого лікування хворих на рак нижньоампулярного відділу прямої кишки ІІ–ІІІ стадії з використанням дрібно- або крупнофракційної НПТ.
Проведено проспективне мультицентрове рандомізоване дослідження в Національному інституті раку, Миколаївському та Чернігівському обласних онкологічних диспансерах за участю 251 хворого на РПК нижньоампулярного відділу. У І групі пацієнтів (n=150) НПТ застосовано за методикою крупного фракціонування разовою вогнищевою дозою (РВД) 4–5 Гр до сумарної вогнищевої дози (СВД) 20–25 Гр з хірургічним втручанням через 24–48 год. У ІІ групі (n=101) НПТ проводили упродовж 15 діб із РВД 2 Гр до СВД 30 Гр з подальшим хірургічним втручанням не раніше ніж через 3 тиж. Досліджували зміну розмірів пухлини за критеріями RECIST після НПТ, можливість підвищення відсотка виконання сфінктерозберігальних операцій (СЗО), рівень періопераційних ускладнень, віддалені результати лікування.
У 30 (29,7%) хворих ІІ групи відзначали часткову або повну регресію пухлини після НПТ до СВД 30 Гр. Кількість СЗО у ІІ групі становила 80,2%, у І групі — 60,1% (р<0,005). Рівень післяопераційних ускладнень суттєво не відрізнявся в обох групах (І група — 5,3%, ІІ група — 4,9%) (р>0,05). 5-річна загальна виживаність у ІІ групі становила 79,8%, у І групі — 70,6% (р=0,045). Локальний рецидив виник у 17 (11,3%) хворих І групи і у 6 (5,9%) — ІІ. 5-річна загальна виживаність хворих, які мали повну або часткову регресію, становила 88,6%, виживаність хворих зі стабілізацією процесу у тій самій групі — 76,9% (р=0,038).
НПТ дрібними фракціями сприяє стабілізації та регресії пухлинного процесу, що покращує безпосередні та віддалені результати лікування. Запропонована авторами методика дає можливість достовірно збільшити кількість СЗО і тим самим покращити якість життя хворих.
Показання, особливості та результати кишкової пластики сечоводів
О.А. Кононенко
Національний інститут раку, Київ, Україна
Втілення нових методів лікування (лапароскопічних, ендоскопічних), підвищення онкологічної захворюваності та розширення показань до оперативного і комбінованого лікування сприяють збільшенню кількості ятрогенних пошкоджень сечоводів (ЯПС), що є однією з причин зростання відсотка нефректомій. Існують різні захворювання, такі як рецидивна обструкція сечоводу, ретроперитонеальний фіброз, пухлини сечоводу, при яких кишкову пластику використовують як останній засіб у комплексній реконструкції сечовивідних шляхів.
Мета дослідження — визначити показання й оцінити результати кишкової пластики сечоводів.
До клінічного аналізу включено 165 пацієнтів із ЯПС (215 уражених сечоводів), у яких проведено обстеження та оперативне лікування із заміщенням сечоводу ізольованим сегментом тонкої кишки.
Однобічний уретерогідронефроз (УГН) діагностовано у 116 (70,3%) пацієнтів (єдиної нирки — 11), двобічний УГН — у 49 (29,7%).
Хворим проведено комплексне обстеження з вивченням анатомо-функціональних змін сечовидільної системи та функції нирок як до, так і після операції, що включало: лабораторні аналізи, ультразвукове дослідження, екскреторну урографію, антеградну пієлоуретерографію, цистографію, комп’ютерну томографію, магнітно-резонансну томографію, кліренс-тести ендогенного креатиніну, динамічну реносцинтиграфію, урофлоуметрію.
Вік пацієнтів коливався в межах 33–67 років і в середньому становив 56,4±8,2 року. Чоловіків було 76 (46,1%), жінок — 89 (53,9%).
Віддалені результати вивчено у 132 (80%) хворих, в термін від 3 міс до 25 років. Оцінку ефективності оперативного лікування проводили за 4-бальною шкалою.
Показаннями до виконання кишкової пластики сечоводів були: ЯПС — 53 (32,1%) пацієнти; мегауретер із втратою скоротливої активності (діаметр сечоводу >2,5 см) — 48 (29,1%); рецидивна обструкція верхніх сечових шляхів — 42 (25,5%); заочеревинний фіброз — 13 (7,9%); уротеліальний рак верхніх сечових шляхів — 9 (5,4%).
Сегментарну кишкову пластику сечоводів виконано у 27 (16,4%) хворих, субтотальну — 37 (22,4%), тотальну — 52 (31,5%). У 49 (29,7%) пацієнтів проведено двобічну уретероілеопластику. При двобічній кишковій пластиці сечоводів використовували один кишковий трансплантат, що розташовувався ізоперистальтично. Середня довжина тонкої кишки для заміщення сечоводу становила 21,4±3,6 см. Анастомоз сечоводів у кишку накладали методом «кінець у бік». Кишковий трансплантат розміщували в черевній порожнині, а анастомози — екстраперитонеально.
З метою запобігання міхурово-кишковому рефлюксу проводили моделювання дистального відділу кишкового трансплантата. У 106 (64,2%) хворих здійснювали вивертання 2–3 см дистального відділу слизової кишки з формуванням манжетки. У 59 (35,8%) пацієнтів антирефлюксну манжетку доповнювали її моделюванням за методикою інтраілеальної пластики проф. Е.О. Стаховського, що передбачало формування в місці кишково-міхурового анастомозу двох окремих каналів.
Проведення інтраілеальної пластики дозволило зменшити кількість міхурово-кишкового рефлюксу до 7 (11,8%) порівняно зі стандартною методикою манжетки, при якій рефлюкс виникав у 34 (32,1%) випадках (р=0,01; χ2=8,3).
Аналіз згідно з критеріями оцінки ефективності лікування показав, що у 31 (23,5%) пацієнта результат був відмінний, 53 (40,2%) — добрий, 25 (18,9%) — задовільний та у 23 (17,4%) — незадовільний.
Кишкова пластика сечоводів дає можливість зберегти нирку, тим самим зменшити кількість хворих із хронічною нирковою недостатністю і довічною сечовою стомою.
З метою запобігання міхурово-кишковому рефлюксу ефективним є застосування інтраілеальної пластики за методикою проф. Е.О. Стаховського з формуванням у дистальному відділі кишкового трансплантата двох окремих каналів.
Лазерне тестування крові хворих на рак грудної залози та їх родичів як попередній етап генотипування
Т.В. Крук, О.П. Пересунько
Буковинський державний медичний університет, Чернівці, Україна
Тестування жінок із раком грудної залози (РГЗ) на наявність мутацій у генах є складним і коштовним методом. Тому актуальним є відбір пацієнток для проведення подальшого молекулярно-генетичного скринінгу.
Мета дослідження — розробити попередні лазерні методи діагностики на матеріалі плазми крові пацієнток із РГЗ та їхніх родичів для подальшого відбору на генотипування.
Об’єктом дослідження при проведенні інфрачервоної спектрометрії (ІЧ-спектрометрії) була плазма крові: І група — практично здорові, у яких не визначаються мутації у генах ВRCAI, GSTPI, GSTTI та р53; ІІ група — родичі хворих і пацієнти контрольної групи, у яких виявлено ці мутації; ІІІ група — хворі на РГЗ із вищезазначеними мутаціями. Генотипування мутацій у генах BRCA1, GSTT1, GSTP1 та p53 проведено з використанням крові 101 пацієнтки, 50 родичів, 50 практично здорових пацієнток. Загальну геномну ДНК виділяли з крові згідно зі стандартним протоколом із використанням протеїнази К і додецилсульфату натрію як детергенту.
При проведенні генотипування мутацій генів глутатіон-S-трансферази та білка р53 показано наявність мутантних гомозиготних варіантів: за GSTР1 — у 9 (8,9%; р<0,005) хворих на РГЗ, 3 (6%; р<0,005) родичів, 4 (8%; р<0,005) пацієнток групи порівняння; за GSTТ1 — у 33 (32,7%; р<0,005) хворих на РГЗ, 6 (12%; р<0,005) родичів, 17 (34%; р<0,005) пацієнток групи порівняння; за р53 — у 5 (5%; р<0,005) хворих на РГЗ, 4 (8%; р<0,005) родичів та 4 (8%; р<0,005) пацієнток групи порівняння. Спектри характеризуються наявністю смуг поглинання, серед яких ми виділяли дві: перша — 1000–1800 см-1 та друга — 2800–3500 см-1. Виявлено різницю в поведінці спектра поглинання в ділянці 1300–1700 см-1 для пацієнтів ІІ і ІІІ груп. Встановлено, що діагностична точність методу ІЧ-спектрометрії становить 78%, чутливість — 83%.
Використання методу ІЧ-спектрофотометрії плазми крові дало можливість вперше експериментально розробити методику скринінгової спектрофотометрії крові як попереднього додаткового тесту, що дозволяє математично точно (р<0,001) диференціювати доклінічний РГЗ.
Оптимізація результатів лікування хворих на рак яєчника шляхом використання імунотерапії рекомбінантним інтерфероном альфа-2b
Т.В. Копиця, О.К. Шкурко
Медичний інститут Сумського державного університету, кафедра акушерства та гінекології, Суми, Україна Сумський обласний клінічний онкологічний диспансер, Суми, Україна
Рак яєчника (РЯ) розвивається на тлі імунодепресії, яка поглиблюється під дією протипухлинних методів лікування. Введення імунотропних препаратів, здатних стимулювати протипухлинний захист організму, сприяє поліпшенню результатів лікування хворих на РЯ.
Мета дослідження — вивчити вплив імунотерапії рекомбінантним альфа-2b інтерфероном на стан імунологічної та неспецифічної реактивності у пацієнтів із РЯ.
Обстежено 68 хворих на РЯ, які лікувалися в Сумському обласному клінічному онкологічному диспансері протягом 2008–2014 рр. Середній вік пацієнтів становив 53,4±1,8 року. Імунологічний статус оцінювали за кількістю лімфоцитів з маркерами CD3, CD4, CD8 методом проточної цитофлюориметрії. Кількість пухлинних клітин (ПК) визначали за кількістю великих гранулярних лімфоцитів. Імунологічні дослідження проводили на початку і після комплексного лікування.
Хворих рандомізували на 2 групи: 36 пацієнтів отримували стандартну програму лікування, у 32 її доповнювали ад’ювантною імунотерапією рекомбінантним альфа-2b інтерфероном. Препарат вводили по 3 млн МО внутрішньовенно щоденно протягом 10 днів. У хворих обох груп до лікування визначалося помірне зменшення загальної кількості CD3 до 36%, CD4 — до 28%, порушення імунорегуляторного індексу Тх/Тс (ІмІн) — до 1,2, зменшення кількості ПК — до 4,6%. Проведення хірургічного втручання, опромінення, поліхіміотерапії негативно впливало на імунологічні показники. У хворих 1-ї групи загальна кількість Т-лімфоцитів зменшилася до 27%, Т-хелперів — до 18%, ІмІн — до 0,8, ПК — до 2,4% (р<0,05). У жінок, які отримували імунотерапію, імунодепресивний вплив протипухлинних методів лікування був менш вираженим. Загальна кількість Т-лімфоцитів зменшилася до 32%, пул Т-хелперів — до 28%, ІмІн становив 1,0. Особливо виражений позитивний вплив мала імунотерапія на природну кілерну активність, кількість ПК під впливом рекомбінантного альфа-2b інтерферону зросла до 5,2%, що було суттєво більше порівняно з пацієнтками, які не отримували імунотерапії (p<0,05).
Отримані результати свідчать про порушення імунологічної та неспецифічної реактивності у хворих на РЯ та доцільність використання рекомбінантного альфа-2b інтерферону з метою корекції імунодефіциту.
Протипухлинна ефективність комбінованого застосування ксеногенної протипухлинної вакцини та доксорубіцину у мишей із карциномою легені Льюїс
О.О. Круць1, 2, О.П. Карпенко2, Г.В. Діденко2, Є.Г. Шпак2
1Київський національний університет імені Тараса Шевченка, Київ, Україна
2Інститут експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України, Київ, Україна
Мета роботи — дослідити протипухлинну ефективність комбінованої схеми застосування доксорубіцину та протипухлинної ксеногенної вакцини (ПКВ), виготовленої на основі курячих ембріональних білків.
Оцінку комбінованого застосування доксорубіцину з ПКВ, виготовленої на основі курячих ембріональних білків та цитотоксичного білоквмісного метаболіту B. subtilis B-7025, проводили на мишах лінії С57/В1асk з перещепленою карциномою легені Льюїс. Оперативне видалення первинного пухлинного вузла проводили на 20-ту добу після перещеплення пухлини. Доксорубіцин вводили внутрішньоочеревинно із розрахунку 0,04 мг на тварину на одне введення (1,5 мг/кг) трьохразово з інтервалом у 2 доби. Було випробувано два режими введення — неоад’ювантний та ад’ювантний. ПКВ застосовували: при неоад’ювантній хіміотерапії — на 3-тю добу після хірургічного видалення пухлини; при ад’ювантній хіміотерапії — на 3-тю добу після останнього введення доксорубіцину. Вакцинацію проводили трьохразово на 1-, 3- та 7-му добу від першого дня вакцинотерапії. Сумарна доза вакцини в перерахунку на білок на весь курс становила 1 мг на тварину. Після закінчення експерименту проводили оцінку функціональної активності імунних клітин у МТТ-тесті.
Найбільш ефективною виявилася схема комбінованованого застосування доксорубіцину в неоад’ювантному режимі з подальшим застосуванням ПКВ в ад’ювантному режимі. При використанні такої комбінації у 80% тварин були відсутні метастази в легенях, середній об’єм метастазів становив 0,036±0,036 мм3 на тварину проти 35,59±13,92 мм3 — у контролі пухлинного росту, а кількість метастазів сягала 0,6±0,6 шт. на тварину проти 10,38±3,17 шт. — у контролі пухлинного росту. У мишей цієї групи спостерігали відновлення функціональної активності лімфоцитів та макрофагів до рівня інтактних тварин.
Вплив різних режимів хіміотерапії раку грудної залози на систему згортання крові
А.В. Куник1, А.В. Прохач2
1ДЗ «Дніпропетровська медична академія МОЗ України», Дніпропетровськ, Україна
2КЗ «Клінічний онкологічний диспансер» Дніпропетровської обласної ради», Дніпропетровськ, Україна
У більшості хворих онкологічного профілю протипухлинні лікувальні дії супроводжуються гіпо- або гіперкоагуляційними змінами, тяжкість яких залежить від типу терапії, вихідного фону та особливостей хвороби.
Мета роботи — дослідити залежність частоти розвитку та характеру коагуляційних змін від виду та режиму системної терапії хворих на рак грудної залози.
Ретроспективно проаналізовано 8237 загальних аналізів крові та 1909 коагулограм у 440 жінок з раком грудної залози, що отримували лікування за стандартними схемами хіміотерапії та гормонотерапії на базі КЗ «Дніпропетровська міська багатопрофільна клінічна лікарня № 4» ДОР» за останні 4 роки. Досліджували показники тромбоцитів, протромбінового індексу, протромбінового часу та активованого парціального тромбопластинового часу. Перша група пацієнток отримувала монохіміотерапію паклітакселом (щотижневе введення) із залученням або без таргетних препаратів. Друга група хворих проходила лікування із застосуванням схеми доцетаксел + доксорубіцин ± циклофосфамід ± трастузумаб.
У більшості пацієнток першої групи виявили синдром гіперкоагуляції, що характеризувався підвищенням протромбінового індексу (у 35,23%), зниженням протромбінового часу (у 17,65%) та зниженням активованого парціального тромбопластинового часу (у 25,56%). У 40,88% хворих виявлено тромбоцитоз. У пацієнтів другої групи спостерігалися дещо інші зміни коагулограми, а саме: у 45,95% пацієнток зафіксовано підвищення протромбінового індексу, у 49,93% — підвищення протромбінового часу, у 38,57% — підвищення активованого парціального тромбопластинового часу. Причому частота тромбоцитопеній і тромбоцитозів була приблизно однаковою — 14,03 та 22,36% відповідно.
Монохіміотерапія зі щотижневим введенням паклитакселу характеризується високою частотою розвитку гіперкоагулятивних змін. Коагуляційні порушення при застосуванні комбінації доцетаксел + доксорубіцин ± циклофосфамід ± таргетні препарати не мають типової картини впливу на коагулограму (характерні як гіпо-, так і гіперкоагулятивні зміни).
Молекулярно-біологічні показники доброякісних і злоякісних пухлин яєчника
М.Г. Махортова, Л.С. Болгова, Т.М. Туганова, Н.М. Храновська, О.В. Скачкова, Т.М. Ярощук, С.В. Мариненко
Національний інститут раку, Київ, Україна
Рак яєчника є поширеним онкологічним захворюванням і посідає 3-тє місце у структурі злоякісних пухлин репродуктивної системи у жінок. Диференційна діагностика доброякісних (Д) та злоякісних (З) новоутворень яєчника (НЯ) часто викликає значні труднощі при їх морфологічному дослідженні, особливо коли ознаки атипії клітин не виражені. Вирішення цього питання є особливо важливим для визначення тактики лікування таких хворих. Молекулярно-біологічне дослідження за багатьма параметрами дозволяє встановити ступінь анаплазії пухлинної тканини, її проліферативну активність, характер пухлинного процесу.
Мета дослідження — виявити диференційно-діагностичні молекулярно-біологічні показники ДНЯ і ЗНЯ.
Досліджено операційний матеріал 16 хворих із НЯ. Середній вік становив 54,37±5,40 року. Матеріал усіх пацієнтів верифіковано гістологічно: у 6 (37,50%) діагностовано ДНЯ, у 10 (62,50%) — ЗНЯ. Суспензію пухлинних клітин (ПК) обробляли флюорохромом та досліджували на протоковому цитофлюориметрі FACS Calibur («Becton Dickinson», США). Визначали вміст ДНК ПК за фазами клітинного циклу, індекс проліферації (ІП). Отримані дані опрацьовано статистично.
При порівняльній оцінці даних у хворих із ДНЯ та ЗНЯ виявлено такі особливості: при ДНЯ — зростання вмісту ПК у G0+G1-фазі клітинного циклу (78,59±1,28%) та зменшення — у G2+M (7,50±1,64%), у S-фазі кількість ПК становить 12,19±1,86%, ІП — 19,69±2,39%; при ЗНЯ найвищий показник зафіксовано у G2+M-фазі — 13,34±1,92%, у S-фазі — 13,69±2,95%, ІП — 27,02±3,59% та найнижчий — у G0+G1-фазі — 72,48±2,87%.
Таким чином, при аналізі отриманих даних виявлено деякі диференційно-діагностичні відмінності молекулярно-біологічних показників у хворих із ДНЯ та ЗНЯ, які вказують на гетерогенність їхнього клітинного складу. ЗНЯ характеризуються значно вищими показниками клітин у S- та G2+M-фазах, а також ІП порівняно з аналогічними параметрами при ДНЯ.
Особенности рака эндометрия в возрастном аспекте
Е.М. Олешко, Р.И. Мусаев
Харьковская медицинская академия последипломного образования, Харьков, УкраинаХарьковский областной клинический онкологический центр, Харьков, Украина
Рак эндометрия (РЭ) остается одним из самых распространенных злокачественных новообразований, составляя 8,5% и занимая 3-е место среди онкологических заболеваний у женщин с тенденцией к увеличению количества больных репродуктивного возраста.
Цель исследования — изучить особенности морфологической структуры РЭ у пациенток различных возрастных периодов.
В исследование включено 360 больных РЭ I–IV стадии (Т1а–3bN0–1М0–1) в возрасте от 28 до 89 лет. Диагноз был верифицирован морфологически. Анализ данных проводили в зависимости от возрастного периода пациенток — репродуктивного, климактерического (перименопауза) и менопаузального.
Эндометриоидные формы РЭ составили абсолютное большинство (90,3%) и оказались наиболее характерными для женщин молодого возраста (94,2% больных). В климактерии частота неэндометриоидных форм РЭ повысилась в 2 раза (с 5,8% до 11,4% случаев). При этом эндометриоидные формы РЭ по-прежнему составляли абсолютное большинство (88,6%). У пациенток с РЭ, находящихся в менопаузе, частота анализируемых морфологических форм РЭ не имела принципиального отличия от таковой у больных климактерического возраста.
При сопоставлении частоты выявления новообразований разной степени дифференцировки у больных разных возрастных периодов отмечено превалирование (р<0,05) РЭ G1 (63,5%) у пациенток репродуктивного возраста в сравнении с климактерическим (41,0%) и менопаузальным (39,4%) периодами. Карциномы G2 не имели достоверной связи с возрастом пациенток. Новообразования G3–4 чаще (р<0,05) диагностированы у больных климактерического (22,8%) и менопаузального (23,6%) возраста.
Для больных РЭ в репродуктивном возрасте характерно наличие опухолей высокой степени дифференцировки. Достоверно реже у них диагностируют новообразования G3–4 в сравнении с больными в климактерический период и период мезопаузы.
Неэндометриоидные формы РЭ чаще возникают у пациенток в климактерическом возрасте и в период менопаузы по сравнению с репродуктивным периодом.
Комбіноване лікування хворих на саркому м’яких тканин
В.В. Остафійчук, С.І. Коровін, А.Ю. Палівець, М.Н. Кукушкіна, М.І. Палій
Національний інститут раку, Київ, Україна
Саркоми м’яких тканин (СМТ) є відносно малорозповсюдженою патологією, що становить від 1,0 до 2,5% серед усіх злоякісних новоутворень у дорослих. Цей вид пухлин вирізняється поганим прогнозом і перебігом.
Проаналізовано підсумки терапії хворих на СМТ ІІ–ІІІ стадії залежно від схем комбінованого лікування з обов’язковим поєднанням променевої терапії (ПТ) та хірургічного лікування в обсязі широкого видалення пухлини, в якому всіх пацієнтів розподілено на 4 групи. У першу групу увійшли 53 хворих, які отримали таке лікування: курс неоад’ювантної (НА) ПТ у сумарній вогнищевій дозі (СВД) 40–45 Гр з подальшим хірургічним втручанням. Друга група — 75 хворих, у яких проводили хірургічне лікування: курс НА ПТ у СВД 30–35 Гр, оперативне втручання з подальшим ад’ювантним лікуванням із застосуванням ПТ на ділянку післяопераційного рубця (ложе видаленої пухлини) у СВД 15–20 Гр. До третьої групи увійшли 95 пацієнтів, у яких лікування включало хірургічний етап з подальшою ад’ювантною ПТ, яка полягала в опроміненні ділянки післяопераційного рубця у СВД 50–55 Гр. Четверту групу сформовано з 60 хворих із проведеним лікуванням: курс НА ПТ у СВД 20 Гр при разовій вогнищевій дозі 5,0 Гр, хірургічний етап.
Загальна 3-річна виживаність у першій групі становила 64,3%, у другій — 69,2%, третій — 52,7%, четвертій — 66,8%. Локальна 3-річна безрецидивна виживаність дорівнювала відповідно 48,8; 46,3; 37,9 і 43,4%, а безметастатична 3-річна виживаність — 51,0; 61,6; 49,5 і 63,6% відповідно. Із вищезазначених даних випливає перевага застосування до- та післяопераційної ПТ над іншими схемами лікування.
Можна зробити висновок про перспективність поєднання НА та ад’ювантної ПТ для лікування хворих на СМТ.
Лазерна діагностика цитологічних мазків із шийки матки на наявність вірусу папіломи людини (HPV)
1О.П. Пересунько, 1Ю.Г. Карпенко, 2 С.Б. Єрмоленко
1Буковинський державний медичний університет, Чернівці, Україна
2Чернівецький національний університет ім. Ю. Федьковича, Чернівці, Україна
Головною концепцією етіопатогенезу раку шийки матки на сьогодні визнано вірусну гіпотезу. Центральне місце в ній займає вірус папіломи людини (HPV), патогенетичною цитологічною ознакою якого є наявність койлоцитів, або «повітряних» клітин (balloon-cell) (Koss, 1984).
Мета роботи — продемонструвати можливість лазерної діагностики цитологічних мазків шийки матки на наявність HPV з використанням спектрально-поляризаційних методів.
Досліджено 28 цитологічних мазків шийки матки з койлоцитозом, 18 — без койлоцитозу (контрольна група). За допомогою He-Ne-лазера нативні мазки із шийки матки опромінювали у широкому спектральному діапазоні λ=330–750 нм, досліджували зміни поляризаційних параметрів і моделювали анізотропну структуру шийки матки за значеннями лінійного дихроїзму та його спектральних залежностей. Довжина хвилі падаючого поляризованого випромінювання змінювалася в широкому діапазоні (видимого спектра).
Порівняння зразків шийки матки з койлоцитозом і без нього при опроміненні зміненою за діапазоном довжиною світлової хвилі поляризованого випромінювання показало суттєві відмінності в значеннях лінійного дихроїзму та його спектральних залежностях. За допомогою комп’ютерних програм обчислено різницю з характерним для койлоцитарної реакції показником у ділянці λ=395–415 нм.
Запропонований метод лазерної діагностики нативних цитологічних мазків шийки матки на наявність койлоцитозу дозволяє попередньо відбирати матеріал для подальших морфологічних досліджень.
Тестування жінок на папіломавірус (HPV) високого канцерогенного ризику
1О.П. Пересунько, 1Ю.Г. Карпенко, 2С.Б. Єрмоленко
1Буковинський державний медичний університет, Чернівці, Україна
2Чернівецький національний університет ім. Ю. Федьковича, Чернівці, Україна
Точний діагноз папіломавірусу людини (HPV-інфекції) ґрунтується на виявленні ДНК вірусу, що відображає тяжкість та прогноз перебігу захворювання. Вірусне навантаження менше 4 геномних еквівалентів (ГЕ) HPV високого канцерогенного ризику у зіскрібку (van Duin et al., 2002; Meberg et al., 2005), які припадають на 100 тис. клітин людини, є клінічно незначним, оскільки практично не трапляється при тяжкій дисплазії та раку. Навпаки, кількість вірусу >5 ГЕ на 100 тис. клітин визначається як підвищене навантаження HPV та асоціюється з високим ризиком розвитку тяжкої дисплазії та раку.
Мета дослідження — за допомогою лазерної діагностики нативних мазків-зіскрібків із шийки матки попередньо виявити тип вірусного навантаження HPV високого канцерогенного ризику перед проведенням полімеразної ланцюгової реакції (ПЛР).
Нативні цитологічні мазки із шийки матки опромінювали у широкому спектральному діапазоні He-Ne-лазером, досліджували зміни поляризаційних параметрів та моделювали анізотропну структуру шийки матки за значенням лінійного дихроїзму та його спектральних залежностей у спектральному інтервалі λ= 30–750 нм, порівнявши лазерні результати з вірусним навантаженням геномних еквівалентів HPV у мазку-зіскрібку методом ПЛР.
Встановлено, що λ=405–425 нм та відповідає ≤3 ГЕ на 100 тис. клітин (клінічно незначущий результат). Натомість λ=425–440 нм відповідає ≥4–5 ГЕ на 100 тис. клітин, що є клінічно значущим варіантом (високий канцерогенний ризик).
Використання цього способу дозволить підвищити точність відбору пацієнток для коштовної процедури — ДНК-діагностики HPV високого канцерогенного ризику стандартним методом ПЛР.
Визначення статусу метилювання генів-супресорів на позаклітинній та пухлинній ДНК хворих на нирково-клітинний рак
Л.В. Перета1, О.О. Банас1, К.В. Онищенко2, О.М. Кашпарова2, В.О. Корнюшин2
1ДУ «Інститут урології НАМН України», Київ, Україна
2Інститут молекулярної біології та генетики НАН України
Визначення рівня позаклітинної ДНК (пкДНК), що вивільняється внаслідок некрозу пухлини та метилування генів-супресорів, може слугувати онкомаркером для ранньої діагностики нирково-клітинного раку (НКР).
Мета дослідження — визначення метилування генів-супресорів пухлин LRRC3B, RASSF1A, APC для порівняння їхнього статусу на геномній ДНК (гДНК) тканини та пкДНК плазми крові хворих на НКР.
Досліджували зразки плазми крові до та після операції, тканини пухлини нирки, умовно нормальної тканини у 21 хворого, у якого проведено оперативне лікування з приводу НКР І–ІІІ стадії в 2013–2014 рр. У зразках визначали концентрацію ДНК. Для перевірки метилування виділену ДНК піддавали бісульфітній обробці, проводили метилспецифічну полімеразну ланцюгову реакцію (МС ПЛР) у реальному часі з праймерами до генів-супресорів LRRC3B, RASFF1A, APC.
Аналіз результатів метилування промоторних ділянок генів у пкДНК плазми крові до операції продемонстрував можливість виявлення метилування хоча б одного з трьох CpG-острівців. Метилування генів LRRC3B, RASSF1A, APC становило на пкДНК до операції відповідно 47,6; 55,0 і 60,0%; після операції — відповідно 4,8; 0 і 9,5%. Метилування цих генів сягало на гДНК пухлини відповідно 55,0; 42,1 і 40%; на гДНК умовно нормальної тканини — 5,2; 11,8 і 6,2% відповідно. МС ПЛР у реальному часі до першого CpG-острівця гена RASSF1A із праймерами до неметильованої ділянки показала наявність неметильованих ділянок ДНК пухлини у 94,1% пацієнтів та в 100% — наявність неметильованих ділянок ДНК умовно нормальної тканини. Одночасне метилування усіх трьох генів на пкДНК плазми крові до операції відзначали у 53,8% випадків.
Одержані результати метилування CpG-острівців генів LRRC3B, RASSF1A та APC на вільно циркулюючій пкДНК плазми крові та ДНК з пухлинної тканини хворих на НКР у подальшому можуть бути використані для створення тест-системи для ранньої діагностики злоякісних пухлин.
Порушення мітохондріального дихання в пухлинних клітинах
А.С. Петреєва, А.А. Білюк, Г.М. Світіна, Л.В. Гарманчук
Київський національний університет
імені Тараса Шевченка, Київ, Україна ННЦ «Інститут біології», Київ, Україна
Одним з головних факторів патогенезу багатьох захворювань, у тому числі онкологічних, є прогресуюча дисфункція мітохондрій. Порушення функціональної здатності компонентів дихального ланцюга мітохондрій і мікросом викликає оксидативний стрес, виникає кисневий дефіцит. За таких умов відбувається порушення функції мітохондріальних ферментів, зокрема сукцинатдегідрогенази (СДГ) та цитохромоксидази (ЦО).
Відповідно до цього метою роботи було визначення активності СДГ і ЦО у пухлинних клітинах на різних етапах росту та метастазування перещепленої карциноми легені Льюїс.
Використовували зразки пухлин карциноми легені Льюїс, узяті у мишей лінії С57/Black, на 14-, 19-ту та 25-ту добу після перещеплення. Отримання мітохондрій і внутрішніх мембран мітохондрій проводили згідно зі стандартними методиками після гомогенізації пухлин методами фракціонування клітинних органел при різних коефіцієнтах седиментації. Активність СДГ і ЦО визначали стандартними методами.
У ході дослідження з’ясовано, що на різних етапах розвитку пухлини змінюється активність як ЦО, так і СДГ. На 14-ту добу активність ЦО становила 2,4±0,15 мкмоль окисненого цитохрому (с/мг•хв), тоді як на 19-ту добу знизилася в 1,4 раза, а на 25-ту добу — майже в 7 разів порівняно з 14-ю добою. Щодо активності СДГ, то вона також знижувалася на 19-ту добу в 1,4 раза та 25-ту — в 1,6 раза порівняно з 14-ю добою.
У ході дослідження встановлено, що активність ферментів СДГ і ЦО, які є компонентами дихальних комплексів внутрішньої мітохондріальної мембрани, достовірно знижується залежно від етапів пухлинного росту клітин карциноми легені Льюїс.
Рівень експресії NF-кB клітинами HeLa за впливу епідермального фактора росту
Н.А. Петрук, І.В. Сараєва, Л.Л. Лахман, О.І. Джус, Л.В. Гарманчук
Київський національний університет
імені Тараса Шевченка, Київ, Україна ННЦ «Інститут біології», Київ, Україна
NF-κB є центральним елементом цілої низки сигнальних шляхів клітини, відіграє ключову роль у регуляції імунних реакцій, відповідає за продукцію цитокінів та виживання клітин у цілому. Із урахуванням виняткової залученості NF-κB у перебіг значної кількості внутрішньоклітинних процесів стає зрозумілим, чому дефекти в експресії та регуляції активності фактора безпосередньо пов’язані з такими серйозними патологіями, як рак, запальні та аутоімунні хвороби, септичний шок, вірусні інфекції.
Мета дослідження — визначити рівень експресії NF-κB клітинами HeLa при дії епідермального фактора росту (ЕФР).
Як експериментальну модель використано клітинну лінію HeLa (аденокарцинома шийки матки), яку вирощували на поживному середовищі DМЕМ із додаванням 10% ембріональної бичачої сироватки, 2 мМ L-глютаміну, 40 мкг/мл гентаміцину та в безсироваткових умовах. До клітин у шестилункові планшети додавали розчини ЕФР до кінцевої концентрації 5 нМ, після чого інкубували при температурі +37 °С із 5% СО2. Вивчення рівня експресії NF-κB у клітинах HeLa проведено за допомогою Вестерн-блот аналізу клітинних фракцій, попередньо інкубованих з ЕФР із застосуванням моноклональних антитіл до p50 та p65 NF-κB субодиниць.
Якщо в дефіцитних за поживним субстратом умовах культивування виявлено зростання експресії ізоформи p65 NF-κB на 23%, то за впливу ЕФР вона була зниженою на 14%. У той самий час для субодиниці з молекулярною масою 50 кДа виявлено протилежний патерн — зниження в дефіцитних умовах культивування на 13% та аналогічний відсоток зростання при дії ЕФР.
Зміна експресії NF-κB у відповідь на дію ЕФР може свідчити про опосередкований вплив активації рецепторів, лігандом яких є ЕФР.
Особливості анатомо-функціональних змін сечових шляхів при уротеліальному раку
М.В. Пікуль
Національний інститут раку, Київ, Україна
На сьогодні питання вибору методу хірургічного втручання при пухлинах верхніх сечових шляхів (пВСШ) залишається актуальним. Згідно з даними досліджень Dragicevic та співавторів (2009 р.) не відмічено достовірної різниці у виживаності пацієнтів, що підлягали органозберігаючим і радикальним хірургічним втручанням (РХВ): цей показник становить 55 та 59% відповідно. Не існує уніфікованої системи вибору методу хірургічного лікування при пВСШ.
Метою роботи був аналіз особливостей анатомо-функціональних змін сечових шляхів при уротеліальному раку та їхній вплив на вибір методу хірургічного втручання.
Проведено ретроспективний аналіз медичної документації 39 пацієнтів, котрим у клініці виконували оперативні втручання з приводу пВСШ з 2008 по 2015 р. Клінічний аналіз хворих проводили за віком, статтю, стадією захворювання, ступенем диференціації пухлини, даними рентгенологічних досліджень, показниками функції нирок, методом хірургічного втручання. Середній вік пацієнтів становив 57,4±6,2 року. Органозберігаючі оперативні втручання проведено в 11 (28,2%) пацієнтів, тоді як РХВ — у 28 (71,8%) випадках. Показанням до органозберігаючого лікування були: наявність уніфокального ураження верхніх сечових шляхів, задовільні показники функції нирки на боці ураження.
Тривалість спостереження для обох груп становила 21,3±4,5 міс (3–72 міс). Пухлини мали інвазивний характер у 25 (64,1%) хворих, місцево-поширений — у 14 (35,9%). Ступінь диференціювання пухлин становив G2–G3 за WHO (1973 р.). Пухлини локалізувалася у сечоводі у 12 (30,7%), порожнистій системі нирки — 17 (43,6%) пацієнтів, мультифокальне ураження зафіксовано у 10 (25,7%) випадках. Уретерогідронефроз на боці ураження виявлено у 19 (48,7%) хворих, серед яких термінальні зміни нирки відзначено в 11 (28,2%) випадках. Серед пацієнтів, котрі підлягали органозберігаючому лікуванню, у 7 (63,7%) випадках пухлина локалізувалася у нижній третині сечоводу, виконували резекцію сечоводу з уретероцистонеостомією. Пухлини середньої третини сечоводу діагностовано в 1 (9,1%) хворого — проведено резекцію сечоводу з субтотальною кишковою пластикою сечоводу. Пухлини верхньої третини сечоводу та ниркової миски виявлено в 3 (27,2%) випадках — проведено резекцію ураженого відділу з подальшою пластикою мисково-сечовідного сегменту. Серед пацієнтів, які підлягали РХВ, у 16 (57,1%) проведено радикальну нефруретеректомію, 9 (32,1%) — лапароскопічну нефруретеректомію, 3 (10,8%) — цистектомію, нефруретеректомію, уретерокутанеостомію.
Доопераційна загальна швидкість клубочкової фільтрації (ШКФ) становила для пацієнтів, що підлягали органозберігаючому лікуванню, 79±12,6 мл/хв, у хворих, що підлягали РХВ, — 82±9,8 мл/хв. При контрольному обстеженні через 6 міс після оперативного втручання загальна ШКФ досягла для органозберігаючих і РХВ 62±14,1 та 51±16,3 мл/хв відповідно.
Основою для вибору методу хірургічного втручання при уротеліальному раку має слугувати рівень анатомо-функціональних змін сечових шляхів. Найбільш сприятливою локалізацією для проведення органозберігаючого лікування є нижня третина сечоводу. Кращі функціональні результати у віддалений післяопераційний період відмічено у пацієнтів, що підлягали органозберігаючому лікуванню. Тактика вибору оптимального методу лікування при пВСШ потребує подальшого вивчення за участю більшої групи пацієнтів.
Анестезия минимальными дозами опиоидов в сочетании с эпидуральным введением бета-2-агонистов в онкохирургии
В.Ф. Присяжнюк, И.И. Лесной
Национальный институт рака, Киев, Украина
Радикальные операции в онкологии сопровождаются большой длительностью и травматичностью, что требует адекватного мультимодального периоперационного обезболивания. Эпидуральная анестезия и анальгезия создают благоприятный фон, при котором низкие концентрации ингаляционного анестетика и низкие дозы фентанила обеспечивают высококачественную и хорошо управляемую анестезию. Применение адъювантов эпидурально способствует снижению дозы используемых анестетиков без ухудшения качества обезболивания.
Целью нашего исследования было оценить эффективность и безопасность сочетанного эпидурального введения ропивакаина и дексмедетомидина при оперативных вмешательствах в проктологии.
В исследование включено 78 больных, у которых планировали операции на толстом кишечнике: 1-я группа — пациенты, которым эпидурально вводили ропивакаин в загрузочной дозе 20–24 мг в сочетании с дексмедетомидином 1 мкг/кг с последующей продленной инфузией ропивакаина 0,2% в дозе 8–10 мл/ч с дексмедетомидином 1,6–1,8 мкг/ч; 2-я группа больных получала ропивакаин в дозе 20–24 мг в сочетании с фентанилом 2 мкг/мл с последующей продленной инфузией ропивакаина 0,2% в дозе 8–10 мл/ч с фентанилом. В обоих группах общую анестезию поддерживали пропофолом 6–12 мг/кг/ч, миорелаксацию — атракурия безилатом в дозе 0,1–0,2 мг/кг. Мониторировали артериальное давление, частоту сердечных сокращений, показатели электрокардиограммы, биспектральный индекс, длительность пробуждения, общую дозу пропофола, атракурия безилата, потребность в фентаниле.
Больные в группах не различались по возрасту, полу, сопутствующей патологии. Дексмедетомидин при эпидуральном введении потенцировал действие препаратов для анестезии, что способствовало снижению общей дозы фентанила (р=0,0001), пропофола (р=0,0108), мышечных релаксантов (р=0,0001) с умеренным увеличением длительности пробуждения после анестезии (р=0,4902). Эпидуральное введение дексмедетомидина во время анестезии умеренно снижало артериальное давление и частоту сердечных сокращений, которые статистически значимо не отличались от таковых у больных с эпидуральным введением ропивакаина и фентанила. Сочетанное эпидуральное введение дексмедетомидина и ропивакаина является безопасным и эффективным.
Застосування тандемної трансплантації аутологічних стовбурових клітин периферичної крові при лікуванні дітей із нейробластомою високого ризику
І.О. Приходько, Г.І. Климнюк, Е.В. Шайда, С.В. Павлик
Національний інститут раку, Київ, Україна
Незважаючи на те що на сучасному етапі розвитку онкології у світі високодозова хіміотерапія з трансплантацією стовбурових клітин периферичної крові (СКПК) покращила прогноз та стала провідним методом у комплексному лікуванні дітей із нейробластомою високого ризику, результат залишається незадовільним через розвиток ранніх рецидивів чи прогресування захворювання. Провідні клініки світу почали вивчення ефективності подвійної чи потрійної (тандемної) високодозової хіміотерапії з трансплантацією аутологічних СКПК. Загальна 5-річна виживаність при використанні тандемної високодозової хіміотерапії з трансплантацією аутологічних СКПК становить 60%, 7-річна — 53%. Виживаність хворих із нейробластомою високого ризику до застосування високодозової хіміотерапії з трансплантацією аутологічних СКПК сягала лише 10–15%.
Мета дослідження — покращити результати лікування дітей, хворих на нейробластому, шляхом застосування тандемної високодозової хіміотерапії.
Із грудня 2012 р. по сьогодні у відділенні дитячої онкології Національного інституту раку проведено тандемну трансплантацію у 16 пацієнтів. Усі хворі — діти віком від 2 до 13 років (6 дівчаток та 10 хлопчиків). Показанням до проведення подвійної (тандемної) високодозової хіміотерапії була нейробластома групи високого ризику (IV стадія захворювання, N-myc-позитивна форма, ранній рецидив нейробластоми).
Наразі 5 пацієнтів померли від прогресування захворювання. 6 дітей отримують лікування з приводу рецидиву, що виник у ранній термін після тандемної трансплантації, 5 хворих знаходяться в ремісії і продовжують лікування (заплановані променева терапія, оперативне втручання, застосування 13-цис-ретиноєвої кислоти). Загальна виживаність цієї групи хворих становить 88,9%.
Застосування тандемної високодозової хіміотерапії з трансплантацією СКПК дає можливість забезпечити високу інтенсивність і результативність лікування при його відносній безпеці.
Підготовка та проведення високотехнологічної дистанційної променевої терапії у хворих на рак передміхурової залози у Всеукраїнському центрі радіохірургії
О.В. Сафронова
Клінічна лікарня «Феофанія» ДУС, Всеукраїнський центр радіохірургії, Київ, Україна
Через високу променеву резистентність пухлин передміхурової залози при проведенні дистанційної променевої терапії (ДПТ) сечовий міхур і пряма кишка отримують значне дозове навантаження. Тому для покращення якості життя хворих на рак передміхурової залози (РПЗ) потрібно застосовувати весь арсенал новітніх технологій, які могли б удосконалити підведення лікувальної дози та забезпечити зниження дозового навантаження на прилеглі структури.
Мета дослідження — впровадження у Всеукраїнському центрі радіохірургії КЛ «Феофанія» ДУС алгоритму підготовки та проведення високотехнологічної ДПТ при лікуванні хворих на РПЗ.
У відділенні променевої терапії центру у період 2011–2014 рр. проліковано 49 пацієнтів із РПЗ. При І–IІІ (Т1–3сN0–1M0) стадії застосовували променеву терапію з модульованою інтенсивністю дози (IMRT) під контролем зображення (IGRT).
Для підготовки та проведення високотехнологічної ДПТ у всіх пацієнтів впроваджено такий лікувальний алгоритм: ретельне обстеження для визначення ступеня поширеності процесу; передпроменева топометрична підготовка на комп’ютерному томографі з використанням фіксуючих підставок; контуринг патологічного вогнища та основних структур малого таза із застосуванням методики суміщення зображення з магнітно-резонансною томографією з болюсним підсиленням; індивідуальне планування з верифікацією плану та лікування на лінійному прискорювачі під контролем зображення.
Практичне впровадження такої моделі з використанням IMRT та IGRT дозволило підвищити якість променевого лікування хворих на РПЗ за рахунок формування чіткого послідовного алгоритму підготовки та проведення терапії. Сеанси опромінення під контролем зображення у пацієнтів із РПЗ дозволяють знизити відсоток виникнення проявів місцевої токсичності за рахунок редукування дози навантаження на сечовий міхур і пряму кишку.
Профілактика кардіотоксичних ускладнень антрациклінової хіміотерапії у хворих на рак грудної залози
Л.А. Сивак, А.В. Аскольський, М.Ю. Кліманов, С.А. Лялькін, Н.М. Майданевич, Н.В. Касап
Національний інститут раку, Київ, Україна
Більшість хворих на рак грудної залози (РГЗ) у процесі сучасного комплексного лікування отримують поліхіміотерапію (ПХТ) з антрациклінами.
Мета дослідження — поліпшення результатів хіміотерапевтичного лікування та якості життя хворих на РГЗ шляхом профілактики і усунення ранньої антрациклінової кардіотоксичності.
У дослідження включено 146 хворих на РГЗ, у яких у комплексному лікуванні застосовували ПХТ за схемою FAC (4–6 курсів). На початку терапії, після кожних 2 курсів ПХТ і після закінчення лікування досліджували клінічні та інструментальні маркери кардіотоксичності: збільшення коригованого інтервалу Q–T, зменшення кінцевого діастолічного об’єму та фракції викиду лівого шлуночка. Застосовано розроблений алгоритм терапії супроводу з метою подолання кардіотоксичності хіміотерапевтичного лікування (триметазидин щоденно в дозі 60 мг/добу, за наявності синусової тахікардії та нормального або підвищеного тиску — атенолол у дозі 50 мг/добу, за наявності нормокардії чи брадикардії — еналаприл у дозі 5 мг/добу).
При застосуванні алгоритму профілактики кардіотоксичності у хворих із групи високого ризику частота виникнення синусової тахікардії знизилася на 11,4% (з 20% у контрольній групі до 8,6% — в основній), артеріальної гіпертензії — на 9,7% (з 20% у контрольній групі до 10,3% — в основній), аритмії — на 3,8% (з 7,2% у контрольній групі до 3,4% — в основній). Крім того, частота подовження інтервалу Q–Tc зменшилася на 25,1%, а фракції викиду лівого шлуночка — на 15,2%.
Застосування розробленого алгоритму профілактики кардіотоксичності у хворих на РГЗ дозволяє зменшити кардіотоксичні прояви ПХТ, покращити якість життя пацієнтів.
Нейротоксичність сучасних протипухлинних препаратів
Л.А. Сивак, Н.О. Верьовкіна, С.А. Лялькін, Н.М. Майданевич, А.В. Аскольський, М.Ю. Кліманов, Н.В. Касап
Національний інститут раку, Київ, Україна
Індукована хіміотерапією периферична нейропатія (ІХПН) є одним з основних дозолімітувальних побічних ефектів багатьох широко застосовуваних хіміотерапевтичних препаратів. Актуальність питання нейротоксичності зумовлена великою розповсюдженістю ІХПН та її значним впливом на якість життя та функціональну активність пацієнтів.
Метою дослідження є визначення груп ризику щодо розвитку ІХПН та оптимізації профілактичної терапії цього ускладнення.
У дослідження включено 70 хворих на рак грудної залози ІІ–ІV стадії, які отримували лікування на основі таксанів. Прояви нейропатії оцінювали за допомогою опитувальника EORTC QLQ-CIPN20 та критеріїв CTC AE version 4.
У нашому дослідженні нейропатія І ступеня розвинулася у 56 (80%) пацієнтів, ІІ ступеня — у 28 (40%) та ІІІ ступеня — у 3 (4,3%) хворих. Клінічно найчастіше нейротоксичність проявлялася парестезіями, онімінням або болісністю за типом «рукавичок-шкарпеток». Нейропатичний біль найчастіше обмежений кінчиками пальців нижніх і верхніх кінцівок. Суттєве зниження повсякденної активності розвинулося у 3 пацієнток.
У більшості випадків нейротоксичність виникала після 3-го циклу хіміотерапії у пацієнтів віком старше 40 років з наявністю супутньої патології.
Визначено, що найбільш значущими факторами ризику у нашому дослідженні були вік, супутня патологія (нейропатія різного генезу), попереднє лікування нейротоксичними протипухлинними препаратами, а також розвиток гострого больового синдрому, асоційованого з прийомом паклітакселу протягом першого циклу хіміотерапії. Ці фактори ризику в майбутньому можна використовувати для стратифікації груп ризику та розробки алгоритмів терапії супроводу при застосуванні нейротоксичних схем хіміотерапії.
Сучасні погляди на профілактику гастроінтестинальної токсичності у хворих на метастатичний «тричі негативний» рак грудної залози
Л.А. Сивак, Н.М. Майданевич, С.А. Лялькін, А.В. Аскольський, М.Ю. Кліманов, Н.В. Касап, Н.О. Верьовкiна
Національний інститут раку, Київ, Україна
На сьогодні залишається актуальною проблема прогнозування виникнення токсичних ускладнень хіміотерапії (ХТ) з боку шлунково-кишкового тракту, що дасть змогу її попередити чи зменшити та покращити якість життя хворих.
Мета дослідження — профілактика гастроінтестинальної токсичності шляхом визначення факторів прогнозу у хворих на метастатичний «тричі негативний» рак грудної залози на фоні стандартної ХТ.
Проведено лікування 48 пацієнтів із раком грудної залози ІІ–ІV стадії, средній вік яких становив 49,8±9,8 року. Використовували клініко-лабораторні, інструментальні та молекулярно-генетичні методи дослідження (поліморфізм генів GSTP1 та MTHЕR). Прояви токсичності ХТ досліджували на 7-й, 14-й та 21-й день після кожного курсу ХТ за критеріями NCIC-СТС.
Визначено, що у 95,6% хворих, що потребували проведення симптоматичного лікування, виникла нудота, у 20,4% — блювання, 31,6% — запори, 3,8% — діарея, 3,9% — стоматит. У 41,3% пацієнтів відмічали зміну смаку. На основі проведених досліджень виділено фактори ризику розвитку гастроінтестинальної токсичності: супутні захворювання шлунково-кишкового тракту (r=0,42; р<0,05), вік хворих до 45 років (r=0,58; p<0,05), проведення більше 3 циклів ХТ (r=0,37; p<0,05), гетерозиготний тип успадкування генотипу GSTP1 (Ile/Val). 42,4% хворих увійшли до групи високого ризику розвитку токсичності, для якої розроблено та застосовано алгоритм терапії супроводу гастроінтестинальної токсичності. Результати лiкування продемонстрували, що прояви еметичного синдрому знизилися на 38,7% (з 95,6 до 56,9%) після 4-го курсу, на 19,5% (з 56,9 до 37,4%) — після 6-го курсу, блювання в жодному випадку не зафіксовано. Хворі отримали 4–6 курсів ХТ із мінімальними проявами токсичності, що значно покращило якість їхнього життя.
Визначення факторів прогнозу токсичності ХТ дозволило виділити групу пацієнтів високого ризику розвитку гастроінтестинальної токсичності та розробити алгоритм терапії супроводу. Застосування лікування супроводу у хворих групи високого ризику дозволило провести ХТ без вимушених перерв між курсами та корекції доз препаратів, а також покращити якість життя пацієнтів.
Вплив алкалоїдів опію та декскетопрофену на рівень періопераційної імуносупресії у хворих на рак нирки
Р.І. Сидор1, 2, І.І. Лісний1, Н.М. Храновська1, О.В. Скачкова1, О.І. Горбач1, 2, М.О. Катриченко1
1Національний інститут раку, Київ, Україна
2Київський національний університет
імені Тараса Шевченка, Київ, Україна
Перебіг пухлинного процесу багато в чому залежить від стану імунної системи пацієнта. Низка періопераційних стресових факторів, у тому числі застосування опіоїдних анальгетиків, здатна прямо чи опосередковано впливати на стан імунної системи хірургічних хворих. Оптимізація методів періопераційної анальгезії, спрямована на зменшення вираженості періопераційної імуносупресії, може знизити ризик розвитку метастазів і пухлинного прогресування у пацієнтів онкологічного профілю, а також зменшити кількість післяопераційних ускладнень.
Метою роботи було порівняти вплив опіоїдного анальгетика — комбінації морфін + наркотин + папаверин + кодеїн + тебаїн — та нестероїдного анальгетика декскетопрофену на клітини імунної системи хворих на рак нирки в динаміці періопераційного періоду.
Одна група хворих (n=15) отримувала в премедикації та для післяопераційного знеболення алкалоїди опію (група О), друга (n=16) — декскетопрофен (група Д). Забір периферичної крові проводили на 4 етапах: до премедикації, безпосередньо перед операцією, одразу після оперативного втручання та на 3-тю добу після операції. Кількісний склад популяцій лейкоцитів периферичної крові визначали на гематологічному аналізаторі. Кількість HLA-DR+ активованих лімфоцитів і моноцитів обчислювали методом проточної цитофлюориметрії.
У хворих обох груп після операції реєстрували значне зростання кількості лейкоцитів, в основному за рахунок фракції нейтрофілів. Абсолютна кількість нейтрофілів у периферичній крові пацієнтів обох груп на 3-ю добу після операції була в 2 рази більшою порівняно зі значеннями на етапі до премедикації, в той час як абсолютна кількість лімфоцитів зменшилася на 24% у групі О та на 21% — у групі Д (р<0,05). Відносна кількість HLA-DR+ моноцитів у периферичній крові хворих групи О почала зменшуватися вже після премедикації і на 3-тю добу після операції знизилася до 77,1±2,1% проти 90,5±1,1% — на етапі до премедикації (p<0,05), тоді як у пацієнтів групи Д аналогічний показник знизився з 89,3±1,1 до 83,2±1,0%. Зниження експресії HLA-DR на моноцитах є характерним для стану імуносупресії та корелює з негативним перебігом захворювання при раку нирки (Hase et al., 2011).
Таким чином, застосування декскетопрофену на противагу алкалоїдам опію дозволяє знизити рівень періопераційної імуносупресії у хворих на рак нирки.
Експресія PD-L лігандів як прогностичний фактор при лімфомі Ходжкіна
Т.В. Скрипець, І.А. Крячок, О.І. Новосад, Н.М. Храновська, Н.М. Свергун
Національний інститут раку, Київ, Україна
Планування оптимального режиму хіміотерапії первинних хворих на класичну лімфому Ходжкіна (кЛХ) необхідно проводити з урахуванням факторів ризику несприятливого перебігу захворювання. Клінічний прогноз кЛХ може прямо залежати від передачі сигнальних шляхів між клітинами Ріда — Штернберга та іншими клітинами мікрооточення. Актуальним залишається вивчення факторів, які дозволять прогнозувати перебіг пухлинного процесу у первинних хворих на кЛХ, вдосконалити індивідуальний прогноз для кожного пацієнта.
49 пацієнтів із ЛХ (стадія IIA — 23, IIB — 3, III–IV — 23 хворих) включено у дослідження. Пацієнти отримали лікування за схемами ABVD або BEACOPP 14-esc як терапію І лінії та променеву терапію. Рівень експресії PD-L1, PD-L2 проаналізовано за допомогою real-time RT-PCR на біопсійному матеріалі лімфатичних вузлів.
Серед 49 пацієнтів рівень загальної відповіді на терапію І лінії становив 95,9% (n=47), з яких 73,5% досягли повної відповіді (ПВ), а 22,4% (n=11) — часткової. Прогресування захворювання при терапії зареєстровано у 2 пацієнтів. Серед хворих із ПВ у 9 діагностовано рецидив (медіана — 24 міс; діапазон 12–36 міс). У 26,5% (n=13) пацієнтів із кЛХ не виявлено експресії PD-L1. Встановлено, що рівень експресії PD-L1 є значно вищим при варіанті нодулярного склерозу та на пізніх стадіях захворювання (p=0,19). Експресія PD-L2 не залежала від гістологічного варіанта кЛХ, стадії захворювання та прогнозу. ROC-аналіз показав, що рівень експресії PD-L1 у пухлині — це важливий маркер, який асоціюється з клінічним прогнозом перебігу захворювання для пацієнтів із кЛХ (Se=87,5%; Sp=64,5%; AUC=0,75; p=0,002). Виявлено, що експресія PD-L1 впливає на безрецидивну виживаність пацієнтів із кЛХ: 2-річна безрецидивна виживаність становила 47% проти 95% (високий та/або низький рівень експресії PD-L1 чи взагалі відсутня експресія відповідно; р<0,005).
Наявність експресії PD-L1 у пухлинних клітинах може слугувати фактором прогнозу виживаності хворих на кЛХ. Високий рівень експресії маркера PD-L1 слід вважати додатковим чинником ризику несприятливого перебігу кЛХ. Отримані дані свідчать про доцільність включення біологічних характеристик пухлини як нових параметрів для оцінки прогнозу перебігу захворювання.
Модифікований метод неоад’ювантної терапії хворих на місцево-поширений рак грудної залози
І.І. Смоланка, В.Е. Орел, І.В. Досенко, А.Д. Лобода
Національний інститут раку, Київ, Україна
Чверть випадків раку грудної залози (РГЗ) в Україні діагностують у занедбаних стадіях, що призводить до зростання витрат на лікування у 25–30 разів порівняно з виявленням пухлини на ранній стадії. При занедбаних стадіях захворювання виникає необхідність застосування неоад’ювантних передопераційних методів лікування для збільшення кількості органозберігаючих операцій і можливості проведення реконструктивних хірургічних втручань з метою підвищення якості життя пацієнток. Одним із методів підсилення дії неоад’ювантної поліхіміотерапії (НПХТ) є застосування магнітотермії (МТ). За розробленою методикою у клініці Національного інституту раку проліковано 127 хворих на місцево-поширений (МП) РГЗ, що склали основну групу дослідження; за стандартною методикою проліковано 117 пацієнток. У подальшому порівняли результати їх лікування.
Повну регресію пухлини виявлено у 6,3±3,1% пацієнток основної групи, часткову регресію — у 49,2±6,3% хворих. Стабілізацію процесу зафіксовано у 38,1±6,1% пацієнток. Регресію метастатично уражених регіонарних лімфатичних вузлів відзначали у 55,6±6,3% хворих основної групи.
Проведення НПХТ з використанням МТ при комплексному лікуванні хворих на МП РГЗ сприяє вірогідному збільшенню об’єктивної відповіді пухлини на лікування (дозволяє підвищити на 13,3% часткову регресію первинної пухлини та на 14,9% — регресію метастатичних лімфовузлів).
Застосування НПХТ на фоні МТ дає можливість на 13,4% збільшити відсоток проведення органозберігаючих операцій та на 14,5% — реконструктивно-відновних.
Вивчення лікувального патоморфозу у хворих є необхідним критерієм оцінки ефективності терапії та прогнозування перебігу захворювання. Остаточне значення об’ємної частки життєздатної пухлинної тканини у хворих основної групи становило 24,4±0,2%. У групі пацієнток, що отримували НПХТ тільки за традиційною схемою, цей показник сягав більше — 35,4±0,25%.
Отримані результати свідчать про ефективність застосування МТ при комплексному лікуванні хворих на МП РГЗ.
Вплив часу та органозберігаючих оперативних втручань на вибір тактики лікування інвазивного раку сечового міхура
Е.О. Стаховський, П.С. Вукалович, О.А. Войленко, Ю.В. Вітрук, М.В. Пікуль
Національний інститут раку, Київ, Україна
На сьогодні рівень летальності серед хворих на інвазивний рак сечового міхура (іРСМ) залишається досить високим. Актуальним є питання термінів проведення хірургічного лікування при іРСМ від часу встановлення діагнозу до виконання цистектомії. Багато авторів (May M. et al., 2004; Chang S.S. et al., 2005; Shariat S.F. et al., 2006) показали, що подовження періоду спостереження знижує ступінь диференціювання пухлини та підвищує ризик прогресування захворювання. Недослідженим залишається вплив попереднього лікування у пацієнтів з іРСМ на результати проведення цистектомії.
Метою дослідження була оцінка часу спостереження та попередньої терапії як факторів, що впливають на результати хірургічного лікування іРСМ.
Ретроспективно проаналізовано медичну документацію 70 пацієнтів з іРСМ, котрі проходили обстеження та лікування у відділі пластичної та реконструктивної онкоурології у період з 2008 по 2015 р. До групи увійшли хворі, у яких термін від встановлення діагнозу до звернення в клініку становив ≥6 міс та які мали в анамнезі ≥2 органозберігаючих оперативних втручань. Клінічний аналіз пацієнтів проводили за віком, статтю, стадією захворювання, ступенем диференціації пухлини, даними рентгенологічних досліджень, методом хірургічного втручання. Середній вік пацієнтів становив 59±5,3 року. Більшість попередніх оперативних втручань становили трансуретральні резекції стінки сечового міхура — 94%, відкриті резекції стінки сечового міхура проведено у 6% випадків.
Тривалість спостереження для групи пацієнтів становила 26,2±8,6 міс. Ступінь ризику за шкалою ASA коливався від I до IV. Ступінь диференціювання пухлини за WHO у пацієнтів групи становив: у 15 (21,4%) випадках — G1, у 30 (42,9%) — G2, у 25 (35,7%) — G3. Пухлини з глибокою інвазією м’язового шару (T2b) склали 30 (42,9%) випадків, мали місцево-поширений характер росту (T3–T4) у 40 (57,1%) пацієнтів. 53 (75,7%) хворим групи в клініці виконано радикальну (60,3%) або «вимушену» (39,7%) цистектомію, 17 (24,3%) рекомендована симптоматична або хіміотерапія за місцем проживання. Метастазування в тазові лімфатичні вузли виявлено у 32 (45,7%) пацієнтів, гістологічно верифіковано у 23 (32,9%) випадках. Після проведення цистектомії локальне рецидивування та метастазування виявлено у 37 (52,9%) пацієнтів. Ад’ювантну хіміотерапію проведено 29 (41,4%) хворим. Рівень 5-річної загальної виживаності для групи становив 38%, канцерспецифічної виживаності — 42%.
Радикальна цистектомія залишається золотим стандартом лікування іРСМ. Подовження термінів спостереження від моменту виявлення іРСМ до проведення радикального оперативного втручання та наявність органозберігаючих оперативних втручань в анамнезі погіршують прогноз захворювання.
Результати проміжного аналізу рандомізованого проспективного багатоцентрового дослідження «R-da-EPOCH проти R-CHOP у пацієнтів з первинною медіастинальною лімфомою»
Я.А. Степанішина1, К.С. Філоненко1, О.І. Новосад1, І.Б. Титоренко1, І.А. Крячок1, К.В. Самохвал2
1Національний інститут раку, Київ, Україна
2Черкаський обласний онкологічний диспансер, Черкаси, Україна
Наразі не існує стандарту терапії першої лінії у пацієнтів із первинною медіастинальною В-клітинною лімфомою (ПМВКЛ). Тому пошук оптимального режиму хіміотерапії (ХТ) для цієї категорії пацієнтів є перспективним напрямом досліджень.
Мета роботи — порівняти ефективність і токсичність лікування за схемами ХТ R-da-EPOCH і R-CHOP у хворих на ПМВКЛ.
У дослідження включено 57 хворих із 5 центрів із вперше діагностованою ПМВКЛ. Медіана віку становила 30 років (17–45 років). Учасниками були 39 (68,4%) жінок та 18 (31,6%) чоловіків. Хворі були рандомізовані у дві групи, що отримували ХТ за схемою R-da-EPOCH (32 особи) та R-CHOP (25 осіб). Стадіювання, що проводили до та після ХТ, включало КТ- або ПЕТ/КТ-дослідження всього тіла. Оцінку відповіді на терапію проводили згідно з критеріями Cheson 1999, 2007 років та критеріями Deauville. Усі пацієнти отримали 6 курсів ХТ ± променеву терапію на зону середостіння 30–36 Гр.
Загальна відповідь на терапію становила 100% у групі R-da-EPOCH та 78% — у групі R-CHOP (p<0,01). Частота повних ремісій досягла 75 та 48% відповідно (p<0,05). Первинно-рефрактерний перебіг зареєстровано у 3 (12,0%) хворих у групі R-CHOP. Ранній рецидив захворювання діагностовано в 1 пацієнта у групі R-da-EPOCH. Усі хворі мали прояви токсичності. Не виявлено достовірної різниці у рівні токсичності в обох групах. Аналіз токсичності тяжкого ступеня показав, що лікування було ускладнено анемією III–IV ступеня в 1 випадку в групі R-da-EPOCH та у 2 — у групі R-CHOP. Фебрильна нейтропенія зареєстрована у 4 (12,5%) та у 3 (12,0%) хворих відповідно. В усіх випадках негематологічна токсичність була I–II ступеня.
Лікування хворих на ПМВКЛ обома схемами ХТ має задовільну ефективність і токсичність, однак рівень загальної відповіді та частота повних ремісій у групі R-da-EPOCH достовірно вищі порівняно з групою R-CHOP. Рівень токсичності був зіставним в обох групах. Для аналізу віддалених результатів необхідно продовжити дослідження.
Імуногістохімічні особливості диференційної діагностики трофобластичної хвороби вагітності
Л.М. Таран, О.М. Грабовий
Національний інститут раку, Київ, Україна
Трофобластична хвороба вагітності — гетерогенна група новоутворень трофобласта, що включає міхуровий занос і трофобластичні пухлини. Найбільш розповсюдженими з них є доброякісні неоплазії — повний і частковий міхуровий занос. Однак ці стани можуть трансформуватися у хоріокарциному, пухлину плацентарного ложа чи епітеліоїдну трофобластичну пухлину. Особливу складність викликає диференційна діагностика цих пухлин при морфологічному дослідженні, оскільки його часто проводять на матеріалі зіскрібків порожнини матки, де матеріал пухлини фрагментований і може бути представлений у вигляді окремих скупчень клітин без чітких фенотипових ознак. Дослідження із застосуванням імуногістохімічного (ІГХ) методу можуть значно підвищити точність морфологічної діагностики цих неоплазій.
Мета роботи — вивчити морфологічні та ІГХ особливості диференційної діагностики різних видів трофобластичної хвороби вагітності та можливих варіантів їх поєднання.
Досліджено операційний матеріал та матеріал зіскрібків порожнини матки від 21 пацієнтки з трофобластичною хворобою вагітності. Гістологічне типування проведено у поєднанні рутинного та ІГХ дослідження з антитілами проти р57, р63 та Кі-67.
При обстеженні 16 пацієнток з міхуровим заносом у 6 випадках мала місце підозра на поєднання міхурового заносу з трофобластичною пухлиною. При проведенні ІГХ дослідження в 2 випадках підтверджено поєднання міхурового заносу з трофобластичною пухлиною плацентарного ложа, а в 4 — виявлено посилену реакцію плацентарної ділянки на фоні міхурового заносу. Характерними ІГХ ознаками хоріокарциноми були висока експресія Кі-67 (>40%) та відсутність експресії р63. Позитивна експресія р63 відмічена при епітеліоїдній трофобластичній пухлині (Кі-67 >10%) і при вузлику плацентарного ложа (Кі-67 <10%). Відсутність реакції р63 відзначали при посиленій реакції плацентарної ділянки (Кі-67 <1%) та при трофобластичній пухлині плацентарного ложа (Кі-67 >1%). Крім того, експресія р57 визначалася у стромі ворсин часткового міхурового заносу та була відсутня при повному міхуровому заносі.
ІГХ дослідження є високоінформативним допоміжним методом диференційної діагностики різних видів трофобластичної хвороби вагітності та можливих варіантів їх поєднання.
Резекція іn situ split — ефективний метод індукції гіпертрофії паренхіми печінки при розширених резекціях
І.А. Тіунова1, А.В. Лукашенко 2, І.М. Мотузюк1
1Національний медичний університет ім. О.О. Богомольця, Київ, Україна
2Національний інститут раку, Київ, Україна
В Україні колоректальний рак посідає 3-тє місце у структурі смертності від злоякісних новоутворень. У 50% хворих виявляють метастатичне ураження печінки. 80–90% пацієнтів із IV стадією раку мають нерезектабельні метастази. Основною причиною неоперабельності є брак залишкової паренхіми при численних білобарних ураженнях.
Мета дослідження — порівняти ефективність застосування стандартних методик двоетапних операцій і резекції in situ split.
Під час хірургічного видалення метастазів колоректального раку в печінку, які попередньо вважали неоперабельними, використовували резекцію in situ split (n=3) та методику стандартних двоетапних резекцій (СДР) (n=3).
Медіана часового проміжку між хірургічними етапами in situ split становила 10±1 діб, при СДР — 56±11,3 діб (р=0,001). Медіана відсоткових часток гіпертрофії у хворих групи in situ split сягала 68%, у групі СДР — 56% (р=0,39). В обох групах післяопераційні ускладнення не перевищували ступінь ІІІа згідно з класифікацією Clavien — Dindo. Період спостереження за пацієнтами групи резекції in situ split становив 5±2,5 міс, у групі СДР — 4±3,6 міс.
Використання резекції in situ split дозволяє радикально лікувати хворих, які раніше вважалися неоперабельними, та знизити ризик гострої печінкової недостатності при розширених резекціях.
Прогностическое значение экспрессии VEGF в опухолевых клетках у больных серозным раком яичника
Ю.Г. Ткаля1, Л.И. Воробьева1, В.С. Свинцицкий1, С.В. Неспрядько1, А.В. Турчак1, И.В. Гончарук1, Н.Ю. Лукьянова2, В.Ф. Чехун2
1Национальный институт рака, Киев, Украина
2Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев, Украина
Особенности клинического течения рака яичника (РЯ) в значительной степени определяются гетерогенностью молекулярно-биологических маркеров опухолевых клеток и их сложными взаимоотношениями с факторами микроокружения, что в совокупности формирует опухолевый фенотип. Одним из видов микроокружения опухолевых клеток является ангиогенез, наиболее изученным ангиогенным фактором — фактор роста эндотелия сосудов (VEGF — vascular endothelial growth factor). Повышенную экспрессию VEGF и его тирозинкиназных рецепторов регистрируют почти во всех опухолях яичника. С гиперэкспрессией VEGF связывают агрессивное течение и неблагоприятный прогноз многих злокачественных заболеваний. В некоторых работах, посвященных РЯ, показано, что гиперэкспрессия VEGF в клетках РЯ также указывает на неблагоприятный прогноз заболевания. Однако существуют и противоположные сведения.
Цель работы — исследовать экспрессию VEGF в опухолевых клетках серозного РЯ, оценить прогностическое значение этого маркера.
Проведены ретроспективный анализ историй болезни 104 больных серозным РЯ III стадии (все больные получили комбинированное лечение, которое заключалось в выполнении циторедуктивной операции с последующей химиотерапией в адъювантном режиме) и иммуногистохимическое исследование парафиновых блоков их операционного материала. Изучена экспрессия VEGF в опухолевых клетках серозного РЯ. Проведен анализ корреляционной связи между экспрессией VEGF в опухоли и клинико-морфологическими показателями. Оценена общая и безрецидивная выживаемость больных РЯ в зависимости от VEGF-статуса опухоли, определено прогностическое значение этого маркера.
Позитивную экспрессию VEGF в опухолевых клетках отмечали у 44,2% больных серозным РЯ, из них у 32,7% выявили гиперэкспрессию этого маркера. Установлено отсутствие корреляционной связи между экспрессией VEGF в опухоли яичника и клинико-морфологическими показателями, однако выявлена корреляция между экспрессией VEGF и риском рецидива заболевания (r=0,5; р<0,01). Однофакторный анализ показал достоверно низкую общую (р=0,027) и безрецидивную (р=0,025) выживаемость больных с VEGF-позитивным статусом РЯ. Кокс-регрессионным анализом установлено неблагоприятное прогностическое значение VEGF-позитивной опухоли для общей (ОР 1,6; 95% ДИ 1,1–2,3) и безрецидивной (ОР 1,5; 95% ДИ 1,1–2,2) выживаемости больных РЯ.
VEGF-позитивный серозный РЯ является предиктивным фактором неблагоприятного течения опухолевого процесса. Гиперэкспрессию VEGF в серозном РЯ можно рассматривать как критерий для решения вопроса применения таргетной терапии в комплексном лечении больных.
Досвід лікування хворих на рак шкіри методом аплікаційної брахітерапії
Т.В. Удатова, О.С. Сілаєва, Н.В. Черенько
Клінічна лікарня «Феофанія» ДУС, Всеукраїнський центр радіохірургії, Київ, Україна
У структурі захворюваності немеланомні злоякісні новоутворення шкіри займають 2-ге місце. Частіше виникають у людей віком 50–70 років (переважно у чоловіків). За гістологічною будовою у більшості випадків виявляють базальноклітинний і плоскоклітинний рак шкіри (РШ).
Мета роботи — впровадити та оцінити ефективність аплікаційного методу брахітерапії при лікуванні хворих на РШ на апараті Gamma Med Plus.
Відділення брахітерапії Всеукраїнського центру радіохірургії обладнане апаратом Gamma Med Plus із радіоактивним джерелом Ir-192. Лікування хворих на РШ проводили за допомогою аплікаторів або гнучких провідників, закріплених на індивідуальній термопластичній масці. Перед початком лікування забезпечували КТ-підготовку та планування лікування в системі Brachy Vision. Розрахунок дози здійснювали на глибину 0,3–0,5 см від поверхні шкіри. Разова вогнищева доза становила 5 Гр, сумарна — 45–50 Гр (ритм опромінення — 2 рази на тиждень), що ізоефективно досягало 60–65 Гр.
Нами проліковано 27 пацієнтів з РШ, з них 17 (63%) — із базальноклітинним, 10 (37%) —плоскоклітинним. У всіх хворих відзначали виражену променеву реакцію у вигляді гіперемії, дерматиту. Через місяць після закінчення лікування відмічали стихання променевих реакцій та відновлення шкіри без видимих дефектів. У всіх пацієнтів зафіксовано позитивну динаміку — повну резорбцію пухлини.
Аплікаційний метод контактної променевої терапії дає можливість скоротити термін лікування хворих на РШ та отримати позитивний результат без видимих косметичних дефектів.
Рак глотки в Кировоградской области. Анализ основных статистических показателей за 2009–2014 гг.
Д.Ю. Фёдоров, В.И. Ярынич, К.В. Ярынич, Т.П. Максимова
Кировоградский областной онкологический диспансер, Кировоград, Украина
Рак глотки не входит в первую десятку в структуре заболеваемости населения злокачественными новообразованиями в Украине, однако занимает десятое место в структуре смертности среди мужчин.
Изучены данные Национального канцер-регистра Украины и Кировоградского областного канцер-регистра.
Заболеваемость злокачественными новообразованиями глотки в Кировоградской области в 2014 г. составила 7,5 на 100 тыс. населения. В 2009–2013 гг. данный показатель зафиксирован на уровне 4,5–6,4 на 100 тыс. населения, а в Украине в 2013 г. — 5,5 на 100 тыс. населения. Количество больных с IV стадией опухолевого процесса в области достигло в 2014 г. 50,7%, а в 2009–2013 гг. — 23,6–43,9%, тогда как в Украине в целом в 2013 г. — 30,0%. Смертность на 100 тыс. населения в 2014 г. в регионе составила 4,9, а в период 2009–2013 гг. — 2,5–4,6 на 100 тыс. населения, тогда как в Украине в 2013 г. — 3,8 на 100 тыс. населения. Количество пациентов, у которых опухоли выявлены при профосмотрах, в 2014 г. составило 7,2%, в 2010–2013 гг. — 7,3–12,2%, в Украине в 2013г. этот показатель достиг 11,4%. В Кировоградской области охват специальным лечением составил в 2014 г. 78,3%, в 2009–2013 гг. — 67,2–77,3%, в Украине в 2013 г. — 75,5%.
В 2014 г., по сравнению с периодом 2009–2013 гг., в Кировоградской области повысилась заболеваемость злокачественными новообразованиями глотки. Также отмечают увеличение количества запущенных случаев и возрастание смертности от данного заболевания. Уменьшилось количество больных, выявленных при профосмотрах. Несколько увеличился охват специальным лечением.
Доопераційна хіміопроменева терапія з внутрішньоартеріальним введенням цитостатиків у хворих на рак внутрішньогрудного відділу стравоходу
Р.І. Фридель
Національний інститут раку, Київ, Україна
Рак стравоходу — злоякісне захворювання, що характеризується високою частотою раннього лімфогенного метастазування та розвитком дисфагії. На основі проведених метааналізів рандомізованих досліджень більшість вчених надає перевагу комплексному підходу до лікування пацієнтів із цією нозологічною формою, який передбачає застосування доопераційної хіміопроменевої терапії з подальшим хірургічним втручанням.
Метою дослідження було порівняльне вивчення ефективності неоад’ювантної радіохіміотерапії з внутрішньоартеріальним та внутрішньовенним введенням цитостатиків. У дослідження включено 54 хворих із гістологічно підтвердженим діагнозом плоскоклітинного раку внутрішньогрудного відділу стравоходу ІІ–ІІІ стадії, яких рандомізували у 2 групи: 26 — в основну, 28 — у контрольну. Пацієнти основної групи отримували доопераційну хіміопроменеву терапію з внутрішньоартеріальним введенням цитостатиків, а контрольної — стандартну хіміопроменеву терапію з внутрішньовенним введенням препаратів. Хіміотерапію та променеву терапію застосовували одночасно, через 2–3 тиж хворих оперували.
Патоморфологічні дані про відповідь пухлини на проведене лікування одержано у 42 хворих — по 21 випадку в контрольній та основній групах. Результати виявилися такими: у контрольній групі повної регресії пухлини досягнуто у 3 хворих, часткової — у 16, стабілізації процесу — у 2. В основній групі в 1 пацієнта підтверджено повну регресію, у 19 — часткову, стабілізацію процесу виявлено в 1 хворого. У 8 пацієнтів контрольної групи та у 6 основної після проведеного хіміопроменевого лікування порівняно з вихідними даними зафіксовано зниження стадії — показник N1 знизився до N0.
На основі аналізу застосування хіміопроменевої терапії у хворих на рак внутрішньогрудного відділу стравоходу можна зробити висновок, що протипухлинна відповідь є вираженою в обох досліджуваних групах. Остаточні висновки щодо доцільності застосування доопераційної хіміопроменевої терапії з внутрішньоартеріальним введенням цитостатиків у хворих на рак внутрішньогрудного відділу стравоходу можна зробити лише після вивчення віддалених результатів.
Причини розвитку мікроцисти
М.В. Чепурнатий
Національний інститут раку, Київ, Україна
Мікроциста — це захворювання, що призводить до зменшення об’єму сечового міхура та значних порушень уродинаміки верхніх і нижніх сечовивідних шляхів, розвитку виражених дизуричних розладів і, як наслідок, соціальної дезадаптації та інвалідизації хворих. Неадекватна діагностика та, відповідно, неефективне лікування пацієнтів із цією патологією спричиняє розвиток тяжких ускладнень та різко знижує якість їхнього життя.
Мета роботи — провести аналіз, вивчити причини мікроцисти та проаналізувати тактику хірургічного лікування цієї категорії пацієнтів.
Проведено ретроспективний аналіз обстежень і лікування 38 хворих, що перебували в клініці пластичної та реконструктивної урології та онкоурології протягом 1996–2014 рр. Вік пацієнтів становив від 19 до 72 років (52±6,2 року). Чоловіків було 29 (76,3%), жінок — 9 (23,7%). Для визначення анатомо-функціональних змін сечовивідних шляхів в алгоритм обстеження входили: ультразвукове дослідження (УЗД) для оцінки стану ниркової паренхіми, визначення об’єму сечового міхура, залишкової сечі; урофлоуметрія; цистоскопія. Рентгенологічні обстеження (оглядова, екскреторна урографія, висхідна та мікційна уретроцистографія), комп’ютерну томографію та магнітно-резонансну томографію застосовували для підтвердження раку сечового міхура.
Основним етіологічним фактором розвитку мікроцисти був рак сечового міхура, який діагностовано у 18 (47,4%), інтерстиціальний цистит — у 6 (15,8%), туберкульоз сечовивідних шляхів (СВШ) — у 3 (7,9%); травму сечового міхура та уретри — у 3 (7,9%); стриктуру уретри — у 3 (7,9%) випадках; аномалії розвитку СВШ — в 1 (2,6%); променевий цистит — у 4 (10,5%) хворих.
За даними УЗД, об’єм сечового міхура становив від 19 до 70 мл (35±8 мл). При визначенні стану уродинаміки верхніх СВШ уретерогідронефроз діагностовано у 29 (78,9%) випадках, із них: двобічний — у 19 (50,0%) хворих, однобічний — у 8 (21,0%); уретерогідронефроз єдиної нирки — у 3 (7,9%). За результатами мікційної цистографії активний двобічний рефлюкс виявлено у 8 (21,0%), односторонній — у 7 (18,4%) пацієнтів.
Цистектомію виконано у 18 (47,4%) випадках — як основне показання радикального лікування раку сечового міхура. Залежно від анатомо-функціональних змін СВШ були використані такі варіанти реконструктивних операцій: при поширенні раку сечового міхура на уретру, порушенні прохідності уретри внаслідок стриктури, променевої терапії — зовнішня деривація сечі (за Брікером або Куком) — у 18 (47,4%) випадках; ілеонеоцистопластика — у 6 (15,8%) хворих — як варіант деривації сечі при збереженні задовільної прохідності уретри та шийки сечового міхура; при задовільних показниках ниркової функції, відсутності даних щодо онкопроцесу у 14 (36,8%) випадках використовували пластику детубуляризованим сегментом клубової кишки (ілеоцистопластика).
Мікроциста — це поліетіологічне захворювання, що призводить до порушень уродинаміки по верхніх СВШ, порушень сечовипускання і врешті — до нетримання сечі. Тактика хірургічного лікування мікроцисти залежить від етіологічного фактора.
Вплив варіанта радикальної мастектомії на перебіг постмастектомічної лімфореї у хворих на рак грудної залози
В.В. Шевченко
Cумський державний університет, кафедра загальної хірургії, радіаційної медицини та фтизіатрії
Сумський обласний клінічний онкологічний диспансер, Суми, Україна
Найчастішими ускладненнями радикальної мастектомії (РМЕ) у хворих на рак грудної залози (РГЗ) залишається лімфорея та утворення сером. Тривала лімфорея та сероми можуть спричинити інфікування рани, некроз шкіри, розходження країв рани, що збільшує термін перебування хворих у стаціонарі та економічні витрати на їх лікування. При різних варіантах РМЕ об’єм видалених тканин відрізняється, що може істотно впливати на тривалість лімфореї та частоту утворення сером.
Мета дослідження — вивчити залежність тривалості та об’єму постмастектомічної лімфореї від варіанта РМЕ у хворих на РГЗ.
Проаналізовані тривалість та об’єм лімфореї після РМЕ у 402 хворих на РГЗ, які були прооперовані у Сумському обласному онкологічному диспансері протягом 2013–2014 рр. Залежно від варіанта РМЕ хворих рандомізували на 3 групи, які не відрізнялися за віком, антропометричними даними та стадією злоякісного процесу. РМЕ за Halsted — Meyer виконано у 5 (1,2%), за Patey — Dyson — у 112 (27,9%), за Madden — у 285 (70,9%) пацієнтів.
Після РМЕ за Halsted — Meyer лімфорея тривала 23,4±2,1 доби, коротшою вона була після РМЕ за Patey — Dyson, склавши 19,4±2,1 доби. Найменшу тривалість лімфореї зареєстровано у хворих після РМЕ за Madden — 16,1±1,8 доби, яка була суттєво меншою порівняно з РМЕ за Halsted — Meyer (p<0,05). Залежно від варіанта РМЕ об’єм лімфореї також був різним. Найбільшим він був після РМЕ за Halsted — Meyer, склавши 1645 ±6,1 мл. Після РМЕ за Madden та Patey — Dyson об’єм лімфореї був значно меншим, коливаючись від 560 до 900 мл (p<0,05). Порівнючи частоту утворення сером, інфекційних ранових ускладнень і тривалість стаціонарного лікування хворих при різних варіантах РМЕ визначено, що після РМЕ за Madden ці показники були найнижчими.
Тривалість лімфореї та її об’єм корелюють із варіантом оперативного втручання. Найменшими вони виявилися після РМЕ за Madden, що сприяло зниженню частоти післяопераційних ранових ускладнень та скороченню терміну стаціонарного лікування хворих на РГЗ.
Особливості стану систолічної, діастолічної функції лівого шлуночка серця в онкологічних хворих при різних режимах хіміотерапевтичного лікування
Л.А. Шевчук, О.І. Солодянникова, Т.С. Головко
Національний інститут раку, Київ, Україна
Розглянуто актуальні питання кардіодепресивного впливу хіміотерапевтичного лікування, необхідність оптимального методу діагностики при моніторингу терапії.
Мета роботи — вивчення систолічної, діастолічної дисфункції серця при плануванні, на етапах лікування, після закінчення поліхіміотерапії.
Ретроспективно проаналізовано моніторинг результатів ехокардіографії пацієнтів віком 21–70 років, що проходили лікування в клініці Національного інституту раку. Досліджено 2 групи пацієнтів: 1-ша — пацієнти з кардіальною патологією (n=43), 2-га — без ознак кардіальної патології (n=50). У 1-й групі виділено підгрупи: 7 (16,3%) пацієнтів із лімфомою Ходжкіна (ЛХ), 21 (48,8%) — з неходжкінськими лімфомами (НХЛ), 15 (34,9%) — раком грудної залози (РГЗ). У 2-й групі підгрупи: 8 (16,0%) — ЛХ, 30 (60,0%) — НХЛ, 12 (24,0%) — РГЗ. Усім пацієнтам виконано трансторакальну ехокардіографію за стандартною методикою до проведення, на парних етапах та після поліхіміотерапії. Оцінювали лінійні розміри та об’єм лівого шлуночка (ЛШ) (кінцевий систолічний і діастолічний об’єм та розмір), міжшлуночкової перетинки, задньої стінки ЛШ, ударний об’єм, фракцію викиду (ФВ) ЛШ, лінійні розміри лівого передсердя, аорти, проводили допплерівську оцінку швидкості потоку трансмітрального наповнення ЛШ. Відхилення від норми показників розцінювали як прояви патології серця.
У пацієнтів 1-ї групи виявлено: розширення порожнин серця (ліве передсердя ≥40 мм±2,2%, збільшення кінцевого систолічного та діастолічного об’єму та розміру), наявність клапанної патології (незначної, помірної, значної регургітації), гіпертрофію міокарда ЛШ (135–140±3,4%); зниження ФВ до 10% (до проведення терапії — 55,4±3,6%; після — 49,46±2,3%); діастолічна дисфункція I–III типів.
У пацієнтів 2-ї групи — зниження ФВ (до 10%): до проведення терапії вона становила 66,4±2,2%, після — 57,2±3,6%; діастолічна дисфункція I та II типу.
ФВ ЛШ є найбільш поширеним показником при моніторингу кардіотоксичності, але при цьому не враховуються істинні масштаби ураження міокарда. Ехокардіографія з використанням розроблених показників для оцінки діастолічної функції дозволяє визначати на більш ранньому етапі субклінічні порушення функції серця.
Досвід виконання одномоментних резекцій при раку прямої кишки із синхронним метастатичним ураженням печінки
І.Б. Щепотін, О.О. Колесник, А.А. Бурлака, А.В. Лукашенко
Національний інститут раку, Київ, Україна
Колоректальний рак займає одне з провідних місць у структурі онкологічної захворюваності та смертності у світі. У 20% пацієнтів на момент первинної діагностики раку прямої кишки (РПК) виявляють віддалені синхронні метастази, третина з яких локалізується в печінці. Резекція печінки залишається єдиним методом, який дозволяє достовірно покращити віддалені результати лікування хворих на метастатичний рак прямої кишки із синхронним метастатичним ураженням печінки (сМ-РПК). Однак, основним предметом дискусій при плануванні мультимодального лікування для даної когорти хворих залишається вибір хірургічної стратегії видалення первинної пухлини та віддалених метастазів.
Мета дослідження — оптимізація хірургічної тактики лікування пацієнтів із сМ-РПК у мультимодальному підході з метою поліпшення безпосередніх та віддалених результатів.
Проведено аналіз рандомізованого дослідження за участю 41 пацієнта із сМ-РПК, в якому їх рандомізували в групи комбінованого (І група) та етапного (ІІ група) хірургічного лікування.
Медіана загальної виживаності пацієнтів після етапних резекцій становила 32 міс, тоді як у І групі її не досягнуто взагалі. Загальний рівень післяопераційних ускладнень в обох групах був без статистично значущої різниці (р=0,56). Варто зазначити, що співвідношення пацієнтів із вираженими ускладненнями (Clavien Grades IIIa, IIIb, IVa) також не відрізнялося між групами комбінованого та етапного хірургічного лікування (р=0,34). У групі етапних резекцій (ІІ група) загальна кумулятивна 3-річна виживаність становила 40%, тоді як комбінований хірургічний підхід (ІІ група) сприяв вищому рівню виживаності — 61,9% (р<0,001).
Комбіновані резекції у хворих на сМ-РПК дозволяють досягнути кращих результатів загальної 3-річної виживаності порівняно з етапними резекціями. Проведення радикальної терапії шляхом комбінованих резекцій покращує якість життя пацієнтів, скорочує терміни стаціонарного лікування.
Неоад’ювантна поліхіміотерапія та виживаність хворих на рак шлунка
І.Б. Щепотін, О.О. Колесник, А.А. Бурлака, А.В. Лукашенко, Ю.О. Жуков, Д.Е. Махмудов
Національний інститут раку, Київ, Україна
Рак шлунка (РШ) є одним із найбільш поширених злоякісних новоутворень в Україні та в інших країнах світу. Традиційним методом лікування таких пацієнтів є післяопераційна системна терапія. Однак досі відсутні міжнародні рекомендації щодо застосування неоад’ювантної поліхіміотерапії (НПХТ) у хворих на РШ.
Проведено аналіз рандомізованого дослідження з вивчення ефективності комбінованого лікування хворих на резектабельні форми РШ із застосуванням режиму НПХТ FLEP, яке включило 62 хворих на РШ, у клініці Національного інституту раку в період 2008–2014 рр.
Виявлено кореляційний зв’язок між рівнем експресії молекулярного маркера VEGFR-1 у клітинах пухлин РШ і чутливістю останніх до режиму НПХТ FLEP. Виявлено статистично значущу різницю за рівнем 3-річної загальної виживаності (58 та 49% для груп комбінованого та самостійного лікування відповідно). Дослідження об’єму первинних пухлин РШ також продемонструвало статистично значущу різницю до та після проведення НПХТ — 182±11,4 мм3 та 112±8,7 мм3 відповідно (p<0,001).
Комбіноване лікування хворих на резектабельні форми РШ із застосуванням НПХТ дозволяє покращити загальну 3-річну виживаність. НПХТ забезпечує ранню регресію первинних пухлин, що попереджує розвиток метастатичної хвороби. Доведено високу чутливість і специфічність маркера VEGFR-1 у хворих на РШ.
Результати хірургічного лікування хворих на метастатичний колоректальний рак із синхронним ураженням печінки
І.Б. Щепотін, О.О. Колеснік, А.А. Бурлака, А.В. Лукашенко, В.В. Приймак
Національний інститут раку, Київ, Україна
Синхронне метастатичне ураження печінки при колоректальному раку (сМ-КРР) є вкрай несприятливим прогностичним фактором. Хірургічне лікування залишається найбільш ефективним методом, який здатний достовірно подовжити життя таких пацієнтів.
Матеріали досліджень базуються на вивченні результатів лікування 126 хворих на сМ-КРР (рТ1–4N0–2M1 — при раку ободової кишки та рТ1–3N0–2M1 — при раку прямої кишки), яким виконано одномоментне (І група) чи двоетапне (ІІ група) хірургічне лікування за період із 2008 по 2015 р. на базі науково-дослідного відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку.
Сумарний рівень післяопераційних ускладнень, зареєстрованих за 30-денний післяопераційний період, становив 33,3 та 21,7% у хворих І та ІІ груп відповідно (р=0,38). Більшість серйозних ускладнень (≥ІІІа рівня за шкалою Clavien — Dindo) зафіксовано у когорти пацієнтів, які перенесли «велику» резекцію печінки (20,9%), тоді як при «малих» резекціях цей показник становив 4,8% (р=0,007). Сумарний ліжко-день становив 18±9,5 та 31±7,8 доби відповідно для І та ІІ групи (р<0,001). Також виявили перевагу одномоментної хірургічної тактики за тривалістю оперативних втручань, яка сягала 367±71,8 хв у групі одномоментних резекцій та 515±119,1 хв — у пацієнтів із двоетапними хірургічними втручаннями (р<0,001).
Одномоментні резекції ≤3 сегментів печінки з метастазами та товстого кишечнику з первинною пухлиною при сМ-КРР є безпечною хірургічною тактикою (ускладнення ≥ІІІa ступеня становлять 4,8%). Одномоментні резекції >3 сегментів печінки з метастазами та прямої кишки із первинною пухлиною при сМ-РПК достовірно збільшують ускладнення ≥ІІІa рівня (20,9%) (р=0,007). Одномоментні резекції забезпечили зменшення терміну стаціонарного лікування на 58,1% та тривалості оперативних втручань на 71,3% (р<0,001). Середня вартість лікування 1 хворого на сМ-КРР із застосуванням двоетапних резекцій перевищила таку в групі пацієнтів із проведенням одномоментного хірургічного лікування на 40,9%.
Результати хірургічного лікування при місцево-поширених формах раку шлунка
І.Б. Щепотін, О.О. Колесник, А.А. Бурлака, А.В. Лукашенко, В.В. Приймак, Ю.О. Жуков
Національний інститут раку, Київ, Україна
Хірургічний метод лікування при локалізованих формах раку шлунка (РШ), зокрема гастректомія (ГЕ), забезпечує задовільні безпосередні та віддалені результати, однак досі не існує чіткого алгоритму лікування при місцево-поширених формах РШ (Т4). Розширені мультиорганні резекції (РМР) асоціюються зі зростанням рівнів ускладнень і смертності в післяопераційний період. Таким чином, чітка стратегія хірургічного лікування хворих на РШ Т4 на сьогодні відсутня.
Проаналізовано 470 випадків захворювання на РШ. Пацієнти отримували хірургічне чи комбіноване лікування із 1993 по 2014 р. у клініці Національного інституту раку. У всіх хворих діагностовано поширення пухлини на суміжні органи (Т4) і виконано РМР. Пацієнти були розділені на 3 групи, що отримували радикальні РМР (R0), паліативні РМР (R1, 2) та симптоматичне хірургічне лікування.
Інфекційні ускладнення в зоні оперативного втручання та недостатність анастомозів були найбільш частими ускладненнями в групі пацієнтів із радикальними та паліативними РМР (16,4 та 4,8% відповідно), післяопераційна смертність в обох групах становила 12%. Загальна 5-річна виживаність досягла у групі радикальних і паліативних РМР 37 та 13% відповідно. У групі пацієнтів, які отримували симптоматичний обсяг хірургічного лікування, 5 років пережили 2,1% хворих.
Виконання радикальних РМР (R0) у хворих на РШ Т4 дозволяє покращити безпосередні та віддалені результати лікування. Високий рівень ускладнень і смертності в післяопераційний період є більш частим, ніж при стандартних оперативних втручаннях, однак виконання R0-резекцій дозволяє значно покращити віддалені результати у цієї когорти хворих.
Методика формирования ручного гастроэзофагеального анастомоза после проксимальной резекции желудка
И.Б. Щепотин, Е.А. Колесник, С.И. Киркилевский, А.В. Лукашенко, А.А. Бурлака, М.А. Волк
Национальный институт рака, Киев, Украина
За последние десятилетия заболеваемость на рак проксимального отдела желудка повысилась. Общеизвестный факт, что у большинства пациентов после проксимальной резекции желудка (ПРЖ) развивается рефлюкс-эзофагит. Поэтому очень важной является разработка оптимального способа реконструкции при ПРЖ с целью улучшения качества жизни.
В исследование включены 324 пациента, которым выполняли ПРЖ с рандомизацией по типу реконструкции: степлерный анастомоз (СА), ручной стандартный анастомоз по методике Ivor Lewis (РСА) и антирефлюксная методика формирования ручного гастроэзофагеального анастомоза (аРСА).
По данным эндоскопического контроля через 1 ч после хирургического лечения в группе СА рефлюкс-эзофагит отмечали в 40,6; 30,2 и 13,2% случаев, а в группе РСА — в 17,3; 13,5 и 8,6% соответственно степеням А, В, и С Лос-Анжелесской классификации. Тогда как в группе аРСА зарегистрированы случаи рефлюкс-эзофагита только А и В степени (14,1 и 1,7% соответственно). Согласно критериям шкалы EORTC QOL (QLQ-25) проявления диспепсии, изжоги или наличия ощущения кислоты или желчи во рту в группах аРСА составляли 1,2±0,08 и 1,2±0,08, тогда как в группах РСА и СА — 1,8±0,1; 1,8±0,2 и 2,2±0,2; 1,8±0,1 соответственно (p<0,05).
Модифицированная методика формирования гастроэзофагеального анастомоза является безопасной, легко реализуемой и эффективной, а также позволяет снизить риск возникновения рефлюкса-эзофагита после ПРЖ.
Результати рандомізованого дослідження: гастректомія з бурсектомією у хворих на рак шлунка
І.Б. Щепотін, О.О. Колеснік, А.В. Лукашенко, А.А. Бурлака, М.А. Волк, Д.Е. Махмудов, В.В. Приймак
Національний інститут раку, Київ, Україна
Мета дослідження — оцінити безпеку та ефективність виконання бурсектомії під час хірургічного лікування хворих на рак шлунка (РШ).
У дослідження включено пацієнтів, яким за період з 2008 по 2014 р. проведено хірургічне лікування, з гістологічно підтвердженим резектабельним РШ (T1–4N0–2M0). Хворих рандомізували у групи хірургічного лікування: основна група (ОГ) — виконано гастректомію (ГЕ) з лімфодисекцією (ЛД), контрольна (КГ) — ГЕ з ЛД і бурсектомією. Завдання — оцінити безпеку та ефективність виконання бурсектомії при РШ.
До ОГ включено 278 пацієнтів, до КГ — 276. Групи репрезентативні за віком, статтю, локалізацією пухлини, стадією та обсягом операції. Час виконання хірургічного втручання у хворих із КГ порівняно з ОГ становив відповідно180±23 хв проти 160±19 хв. Інтраопераційна крововтрата у групах ОГ та КГ досягла 110±37 та 110±31 мл відповідно. Післяопераційної летальності в обох групах не зареєстровано. Рівень ускладнень у ранній післяопераційний період становив для КГ та ОГ 18,4 и 13,4% відповідно (р=0,86). Найбільш поширеним ускладенням був гострий післяопераційний панкреатит. У всіх пацієнтів проведено консервативне лікування. Загальна 5-річна виживаність була вищою в КГ (52,2%) порівняно з ОГ (38,7%) (p<0,05).
Застосування ГЕ з ЛД та бурсектомією є безпечним підходом до хірургічного лікування у хворих із резектабельним РШ. Виконання бурсектомії покращує 5-річну виживаність.
Влияние периоперационных гемотрансфузий на непосредственные результаты хирургического лечения рака ободочной кишки
И.Б. Щепотин, Е.А. Колесник, А.В. Лукашенко, Д.Э. Махмудов, А.А. Бурлака, М.А. Волк
Национальный институт рака, Киев, Украина
Влияние сопутствующей анемии и проводимых периоперационных гемотрансфузий (ПГТ) на результаты лечения больных раком ободочной кишки (РОК) остается актуальным и малоизученным вопросом.
Цель исследования — изучить влияние анемии и ПГТ на результаты хирургического лечения пациентов с РОК.
Пациенты с анемией средней и тяжелой степени, которым проводили хирургическое лечение по поводу РОК, разделены на 2 группы. Основная группа (ОГ) — терапия по программе быстрого восстановления, без проведения ПГТ. Контрольная группа (КГ) — по тем же показаниям применяли ПГТ. Изучены степень тяжести анемии, трансфузионный статус и их влияние на результаты лечения.
Исследованы 280 пациентов; 159 — с анемией средней и тяжелой степени, из них 73 — в ОГ, 86 — КГ. Группы репрезентативны. В ОГ у 49 (67%) пациентов виявлено анемию средней степени, у 24 (33%) — тяжелой. В КГ соответственно — у 52 (60%) и 34 (40%) (p=0,236 и 0,172). ПГТ были выполнены 50 (58%) пациентам КГ (р<0,01). Послеоперационных осложнений (ПОО) зафиксировано достоверно больше в КГ — 17 (23%) против 8 (9%) (р<0,05). Послеоперационная летальность была выше в КГ — 4,7% против 0% (р<0,05). Относительный риск (ОР) развития ПОО у пациентов с анемией тяжелой степени оказался незначительным — 0,43 (95% доверительный интервал (ДИ) 1,125–2,9) (р=0,812) в ОГ и 0,96 (95% ДИ 1,66–2,86) (р=0,113) — в КГ. Проведение ПГТ оказалось неблагоприятным прогностическим фактором — среди пациентов, у которых применили эту методику, у 37 (43%) развились ПОО (р<0,05). ОР при 95% ДИ 1,42 (1,03–2,01).
Анемия средней и тяжелой степени у пациентов, которым показано хирургическое лечение РОК, выступила незначительным фактором риска. Проведение ПГТ повышает риск ПОО и уровень послеоперационной летальности.
Роль мультивисцеральных резекций в хирургическом лечении местно-распространенного рака ободочной кишки с инвазией в органы гепатопанкреатобилиарной зоны
И.Б. Щепотин, Е.А. Колесник, А.В. Лукашенко, Д.Э. Махмудов, А.А. Бурлака, М.А. Волк
Национальный институт рака, Киев, Украина
Выполнение en-bloc мультивисцеральных резекций (МВР) при местно-распространенном раке ободочной кишки является общепризнанным золотым стандартом лечения пациентов с данной патологией. Лечебная тактика при инвазии рака ободочной кишки в органы гепатопанкреатобилиарной зоны (ГПБЗ) остается изученной недостаточно, оставляя открытым целый ряд вопросов максимально рациональной хирургической тактики.
Цель исследования — изучить непосредственные и отдаленные результаты выполнения МВР при местно-распространенном раке ободочной кишки с инвазией в органы ГПБЗ.
В исследование включены 625 пациентов. МВР выполнены у 237 (38,0%) больных, из них 39 (16,5%) — при инвазии в органы ГПБЗ. Также проанализированы результаты лечения 32 пациентов, которым по тем же показаниям выполнены паллиативные (R1 или R2) резекции ободочной кишки.
Осложнения III–IV класса по Clavien — Dindo и послеоперационная летальность в группах всех МВР, МВР при инвазии в структуры ГПБЗ и при паллиативных МВР составили 19,0 и 3,3%; 39,0 и 0%; 6,25 и 3,0% соответственно. Основными видами осложнений были гнойно-септические, в группе МВР с инвазией в органы ГПБЗ — наружные панкреатические свищи. Общая 5-летняя выживаемость в группе всех МВР составила 60,7±3,9%, медиана — 23 мес, в группе МВР при инвазии в органы ГПБЗ — 49±3% и 19,6 мес, в группе паллиативных резекций при воспалительной инфильтрации — 32±6% и 22,7 мес, при опухолевой инвазии — 6±4% и 4,2 мес соответственно.
Выполнение радикальных МВР при местно-распространенном раке ободочной кишки с инвазией в органы ГПБЗ является оправданной и предпочтительной стратегией хирургического лечения данной когорты пациентов.
Результаты хирургического лечения рака ободочной кишки с применением мультимодальной программы быстрого восстановления
И.Б. Щепотин, Е.А. Колесник, А.В. Лукашенко, Д.Э. Махмудов, В.В. Приймак, А.П. Безносенко
Национальный институт рака, Киев, Украина
Колоректальный рак занимает лидирующие позиции в структуре онкологической заболеваемости во всем мире. Более 70% пациентов имеют I–III стадию заболевания и являются кандидатами на проведение радикального хирургического лечения, осложнения которого отмечают в 20–30%. Применение мультимодальной программы быстрого восстановления выступает одним из путей улучшения этих результатов.
Цель исследования — изучить влияние применения мультимодальной программы быстрого восстановления на непосредственные результаты хирургического лечения рака ободочной кишки.
В рандомизированное мультицентровое исследование включено 280 пациентов. Пациентам основной группы (ОГ) — 115 больных — хирургическое лечение рака ободочной кишки проводили с применением мультимодальной программы быстрого восстановления, контрольной группы 1 (КГ1) — 80 больных — и контрольной группы 2 (КГ2) — 85 пациентов — с применением традиционной методики.
Значимых различий в зависимости от антропометрических параметров, стадии и локализации опухоли, а также вида выполненных операций не получено. Послеоперационные осложнения в ОГ, КГ1 и КГ2 развились в 10 (8,7%), 16 (20%) и 15 (18%) случаях соответственно, послеоперационная летальность — у 1 (0,9%), 5 (6,25%) и 1 (1,2%) пациентов соответственно. Относительный риск развития послеоперационных осложнений в КГ1 и КГ2 составил 2,198 (95% ДИ 1,122–4,305). Общий период реабилитации для ОГ, КГ1 и КГ2 достиг 6,3±3,4, 18,4±8,7 и 15±7 сут соответственно.
Применение мультимодальной программы быстрого восстановления в хирургическом лечении больных раком ободочной кишки достоверно снижает количество послеоперационных осложнений и относительный риск их развития.
Результаты хирургического лечения нейроэндокринных опухолей толстой кишки
И.Б. Щепотин, Е.А. Колесник, А.В. Лукашенко, Д.Э. Махмудов, В.В. Приймак, А.П. Безносенко, А.А. Бурлака, М.А. Волк
Национальный институт рака, Киев, Украина
Нейроэндокринные опухоли — редкая группа опухолей, происходящих из клеток диффузной нейроэндокринной системы. Клинико-морфологические характеристики этих редких опухолей, динамика их развития и результаты хирургического лечения остаются недостаточно изученными.
Цель исследования — оценить отдаленные результаты хирургического лечения пациентов с нейроэндокринными опухолями толстой кишки.
На основании данных Национального канцер-регистра, больничного канцер-регистра и данных историй болезни проведен ретроспективный анализ 56 пациентов, у которых в период с 1993 по 2013 г. (20 лет) применяли хирургическое лечение в клинике Национального института рака.
По состоянию на 2013 г. умерли 17 (31%) пациентов, из них 11 (20%) — от прогрессирования основного заболевания, 6 (11%) — в связи с ранними и поздними осложнениями. Рецидив первичной опухоли выявлен у 7 (13%) пациентов. Уровень общей 5-летней выживаемости составил 41,7±6,4% с медианой в 22 мес, общей 5-летней безрецидивной выживаемости — 32,4±7,8%. Для сравнения проведен анализ выживаемости пациентов с аденокарциномами ободочной и прямой кишки. Общая 5-летняя выживаемость для пациентов с нейроэндокринными опухолями оказалась выше, чем в группе аденокарцином ободочной и прямой кишки — 41,7±6,4 и 33±9,1% соответственно. Общая 5-летняя безрецидивная выживаемость отличалась незначительно — 32,4±7,8 и 29,6±5,9%.
Нейроэндокринные опухоли толстой кишки представляют собой редкую группу злокачественных опухолей, значительно отличающихся от аденокарцином как биологически, так и клинически. Радикальное хирургическое лечение может быть одним из методов выбора в лечении больных с данной патологией.














Leave a comment