Низькоопіоїдна анестезія при колоректальних операціях в онкохірургії
Лісний І.І.1, Колеснік О.О.1, Закальська Х.А.2, Горкавий Є.О.1, Махмудов Д.Е.1
Резюме. Досліджено ефективність і безпеку застосування дексмедетомідину як анальгетичного ад’юванта при анестезіологічному забезпеченні колоректальних операцій в онкохірургії, а також для оцінки опіоїдзберігаючого ефекту дексмедетомідину під час анестезії. Для цього пацієнтам додатково до загальної комбінованої анестезії призначали інтраопераційну інфузію дексмедетомідину з попереднім введенням навантажувальної дози. Результати нашого дослідження показали, що застосування дексмедетомідину під час оперативного втручання суттєво знижує інтраопераційні потреби в опіоїдах, зменшує інтенсивність післяопераційного болю, а також, імовірно, може сприяти зниженню депресії імунної системи та підвищувати виживаність хворих у віддалений післяопераційний період. Використання дексмедетомідину як компонента мультимодальної анестезії не викликало виражених порушень гемодинаміки, що свідчить про його безпеку в зазначених дозах.

Вступ
Відомо, що одним із першочергових завдань сучасної медицини є зниження ризиків виникнення післяопераційних ускладнень. Основною причиною останніх вважають хірургічну стрес-відповідь — комплекс змін нейроендокринного, метаболічного та запального характеру, що розвиваються в результаті хірургічної травми [1]. Такі зміни, що спершу мають компенсаторно-пристосувальний характер, можуть із часом стати надмірними та патологічно спрямованими. Вираженість і тривалість хірургічної стрес-відповіді визначаються насамперед травматичністю втручання, тому особливого значення ця проблема набуває при онкологічних операціях, які передбачають не лише видалення самої пухлини, а й широку лімфодисекцію і денервацію.
Відповідно, періопераційне знеболення в онкологічних хворих також має низку особливостей. Хворі зі злоякісними пухлинами істотно відрізняються від пацієнтів загальнохірургічних клінік соматичним і психологічним станом, особливостями імунної реактивності, наслідками хіміо- та променевої терапії [2]. Такі пацієнти потребують адекватного знеболення в періопераційний період. Неадекватне усунення болю є не лише порушенням фундаментальних прав людини [3], а в онкології ще й сприятливим чинником ракової прогресії [4].
Важливим фактором, що визначає успішний результат лікування, запобігає розвиткові ранніх і пізніх ускладнень, росту пухлини, утворенню метастазів та виникненню рецидивів і, зрештою, летальності, є стан імунної системи. Однак проведення високоінвазивних хірургічних втручань, підсилене іншими чинниками, спричинює супресію імунітету пацієнтів. Періопераційний період є проангіогенним станом, при якому циркуляція високих концентрацій факторів росту пухлини, включаючи судинний ендотеліальний фактор росту, призводить до прогресії мінімального залишкового захворювання. Періопераційна супресія імунної системи може бути пов’язана з розвитком післяопераційного рецидиву раку навіть після успішного видалення первинного вогнища. Безпосередньо інтраопераційна реакція на хірургічно індукований стрес проявляється збільшенням кількості циркулюючих природних клітин-кілерів (NK-клітин), посиленням їхньої активності, супроводжуваної післяопераційним зниженням до нормальних або субнормальних значень. Тому актуальною постає проблема пошуку оптимальних методів анестезії та періопераційної анальгезії, спрямованих на зменшення хірургічно індукованої імуносупресії та пов’язаних із нею негативних наслідків у пацієнтів із онкопатологією.
Існують принаймні три періопераційні фактори, здатні змістити баланс у бік розвитку пухлини. Перший — власне хірургічна операція, яка сприяє вивільненню пухлинних клітин у циркулююче кров’яне русло, призводить до пригнічення клітинно-опосередкованого імунітету, включаючи цитотоксичні Т-клітини та NK-клітини, зниження циркулюючої концентрації пухлинзв’язаних антиангіогенних факторів, підвищення концентрації проангіогенних факторів, а також вивільнення факторів, які спричинюють ріст локальних і віддалених злоякісних клітин. Другий чинник — застосування інгаляційної анестезії, яка порушує імунну функцію за рахунок пригнічення нейтрофілів, макрофагів, дендритних клітин, Т-клітин і NK-клітин. Третій фактор — опіоїди, які руйнують і клітинний, і гуморальний імунітет, знижуючи активність NK-клітин, продукцію імуностимулюючих цитокінів, антитіл, а також фагоцитарну активність. Більше того, морфін може посилювати процеси ангіогенезу і впливати на ріст пухлинних клітин, що сприяє розвиткові метастазів.
Попри це, на сьогодні опіоїди залишаються пріоритетними препаратами для знеболення. Згідно з рекомендаціями PROSPECT на всіх етапах періопераційного знеболення залежно від інтенсивності болю застосовують сильні або слабкі опіоїди. Необхідність пошуку методів ефективного антиноцицептивного захисту пацієнта при виконанні травматичних хірургічних втручань спонукала до застосування мультимодальної комбінованої анестезії. Вона передбачає поєднане використання регіонарної анестезії з місцевими анестетиками, опіоїдних анальгетиків, нестероїдних протизапальних препаратів (НСПЗП), парацетамолу, метамізолу та допоміжних лікарських засобів. Для зменшення вираженості побічних ефектів опіоїдних анальгетиків у онкологічних хворих можна застосовувати НСПЗП, які дозволяють або зовсім відмовитися від опіоїдів, або значно знизити їх дозу. НСПЗП можуть знижувати ризик розвитку пухлини за рахунок гальмування активності циклооксигенази 2 (ЦОГ 2) — фермента, що відповідає за продукцію різних простагландинів. Останні (особливо простагландин Е2) відіграють ключову роль у прискоренні проліферації пухлинної тканини. НСПЗП здатні прискорювати апоптоз пухлинних клітин і гальмувати ангіогенез. Анестетики-анальгетики, які застосовують в анестезіології (кетамін, тіопентал, оксид азоту, інгаляційні анестетики, морфін, фентаніл), негативно впливають на імунну систему, а саме на NK-клітини. Місцеві анестетики виявляють іншу дію: лідокаїн інгібує рецептори епідермального фактора росту і проліферацію пухлинних клітин in vitro, ропівакаїн пригнічує ріст ракових клітин. Інгібітори ЦОГ-2 проявляють антиангіогенний, антипухлинний ефект у моделях на тваринах [5]. Як компоненти мультимодальної анестезії можуть використовувати також α2-агоністи, що володіють анальгетичним ефектом при гострому, нейропатичному болю при спінальному та епідуральному введенні, а cialis viagra compare також симпатолітичним і седативним ефектами [6].
Основою антиноцицептивного захисту при високотравматичних онкологічних операціях є комбіноване попереджувальне багаторівневе знеболення з акцентом на превентивну блокаду патологічної аферентної імпульсації з операційної рани. Впливаючи на різні ланки ноцицепції, можна досягнути більш вираженого анальгетичного ефекту меншими дозами засобів, відповідно, знизити вираженість їхньої побічної небажаної дії. Тобто, можна припустити, що забезпечення адекватного знеболення має протективний ефект проти хірургічно індукованого метастазування.
Анальгезія без опіоїдів — один із ключових факторів у доктрині швидкого відновлення після операції (Enhanced Recovery After Surgery — ERAS). Протокол ERAS передбачає низку заходів ведення хворих у періопераційний період, у тому числі застосування епідуральної анестезії та анальгезії без опіоїдів [7, 8]. Дотримання цих рекомендацій зменшує тривалість перебування пацієнтів у стаціонарі на 30%, частоту ускладнень — на 45%, смертність — на 30% [7]. У зв’язку з вищезазначеним метою нашого дослідження було вивчення ефективності та безпеки застосування дексмедетомідину — агоніста α2-адренорецепторів — як компонента анестезії при хірургічних операціях в онкопроктології.
Об’єкт і методи дослідження
Проспективне дослідження виконано в науково-дослідному відділенні анестезіології та інтенсивної терапії Національного інституту раку (м. Київ) із 03.02.2015 по 14.07.2015 р. У дослідження включено 60 хворих на колоректальний рак, стадія T2–3N0M0, які за класифікацією ASA були пацієнтами класу ІІ–ІІІ. Отримано інформовану згоду всіх хворих на участь у дослідженні.
У групу дослідження (Гр. 1) були включені пацієнти (n=15) з колоректальним раком, яким операцію виконували в умовах загальної інгаляційної анестезії севофлураном за методикою низького потоку в поєднанні з епідуральною анестезією. Епідуральний блок виконували на рівні ThX–ThXI за стандартною методикою. Після контрольної тест-дози епідурально вводили 10–12 мл 0,2% розчину ропівакаїну в комбінації з фентанілом (2 мкг/мл). До початку застосування наркозу в цій групі внутрішньовенно болюсно вводили дексмедетомідин у дозі з розрахунку 1 мкг/кг, введення якого під час операції продовжували зі швидкістю 0,6 мкг/кг/год. Припиняли інфузію дексмедетомідину безпосередньо перед закінченням операції за 10–15 хв до відключення севофлурану. М’язову релаксацію підтримували атракуріумом згідно з рекомендаціями виробника під контролем електроміографії. Після інтубації трахеї проводили комбіновану анестезію на основі севофлурану за методикою низького потоку (0,5 л/хв) у концентрації 0,4–1,5 МАК, достатній для підтримання біспектрального індексу на рівні 40–50. У схему мультимодальної анестезії було включено внутрішньовенне введення НСПЗП декскетопрофену 50 мг і парацетамолу 1000 мг за 20–30 хв до початку операції.
У групу порівняння (Гр. 2) включено 45 хворих, зіставних із Гр. 1 за віком, індексом маси тіла (ІМТ) та оперативними втручаннями. Анестезію проводили за схемою, описаною для Гр. 1, але без використання дексмедетомідину. Для інтраопераційної анестезії застосовували фентаніл у загальнорекомендованих дозах. Середній вік хворих становив у Гр. 1 — 55±9,8 року, а в Гр. 2 — 61±9,3 року (р=0,055), ІМТ у Гр. 1 сягав 26±4,9 кг/м, а в Гр. 2 — 26±3,7 кг/м (р=0,784), співвідношення чоловіки/жінки в Гр. 1 становило 8/7, а в Гр. 2 — pharmacy 24/21 (р=0,618).
Інтраопераційно проводили моніторинг показників серцево-судинної та дихальної систем: неінвазивний артеріальний тиск (АТ) (середній), частота серцевих скорочень (ЧСС) кожні 5 хв, електрокардіограма, SpO2, BIS, etCO2, etSev, МАК за допомогою монітора «Phillips MP60».
Після закінчення операції, виходу з анестезії та екстубації трахеї пацієнтів переводили в палату відділення анестезіології та інтенсивної терапії. Усім пацієнтам планово призначали знеболення НСПЗП за такою схемою: декскетопрофен 50 мг внутрішньовенно 3 рази на добу, парацетамол 1000 мг внутрішньовенно крапельно 3 рази на добу та продовжену епідуральну анальгезію 0,2% розчином ропівакаїну у поєднанні з фентанілом (2 мкг/мл) зі швидкістю 6–8 мл/год. Для вимірювання інтенсивності післяопераційного болю використовували візуально-аналогову шкалу (ВАШ) болю. Основними критеріями оцінки результатів дослідження були інтраопераційна потреба в анальгетиках/анестетиках, швидкість пробудження, частота і характер ускладнень.
Тривалість анестезії обчислювали як час від початку анестезії до екстубації хворого після закінчення операції. Тривалість пробудження визначали як час від припинення подачі севофлурану до buy cialis досягнення показника біспектрального індексу 70 одиниць. Статистичну обробку отриманих результатів проводили за допомогою програмного забезпечення STATISTICA 8.0 (StatSoft. Ink., 2008). Розподіл неперервних даних у групах оцінювали шляхом побудови діаграм розподілу, а також за критерієм Колмогорова — Смирнова. Враховуючи те, що розподіл у групах був аномальним, порівняння між групами проводили, використовуючи непараметричні методи оцінки даних. Описова статистика включала обчислення середнього значення зі стандартною похибкою і 95% довірчим інтервалом (ДІ), стандартного відхилення, медіани та квадратильного рoзмаху (діапазон між 25-м і 75-м процентилем). Порівняння rapid heart beat with viagra між групами кількісних показників проводили з використанням критерію Манна — Уїтні, якісних — двостороннього критерію Фішера. Статистично значущими відмінності вважали при ймовірності похибки 1-го роду <5% (р<0,05).
Результати дослідження
У дослідження включено 65 хворих: у Гр. 1 — 17, у Гр. 2 — 48. Через неадекватний епідуральний блок 2 пацієнтів із Гр. 1 і 3 — із Гр. 2 було виключено з дослідження. Характеристика хворих, ASA статус, тривалість операції та анестезії представлено в таблиці.
Таблиця. Характеристика та періопераційні показники хворих, включених у дослідження
| Гр. 1, n=15 | Гр. 2, n=45 | р | |
| Стать, чоловіки/жінки | 8/7 | 24/21 | 0,618 |
| Вік, років | 55±9,8 | 61±9,3 | 0,055 |
| ІМТ, кг/м | 26±4,9 | 26±3,7 | 0,784 |
| ASA статус, ІІ/ІІІ | 12/3 | 38/7 | >0,05 |
| Тривалість операції, хв | 159±25 | 163±17 | 0,342 |
| Тривалість анестезії, хв | 156±28 | 163±17 | 0,422 |
| Загальна доза фентанілу, мкг | 61,5±50 | 341,3±102 | 0,00001 |
| Загальна доза релаксантів, мг | 69,6±11 | 75,9±17 | 0,412 |
| Об’єм інтраопераційної інфузії, мл | 2342±500 | 2329±707 | 0,8560 |
| Необхідність у симпатоміметиках | 4/15 | 3/45 | 0,0524 |
| Тривалість пробудження, хв | 9,6±2,8 | 10,4±2,6 | 0,6468 |
При оцінці загальної кількості фентанілу, застосованого під час операції на 1 пацієнта, встановлено, що у Гр. 1 вона становила в середньому лише 61,5±50 мкг, основна доза була введена під час інтубації трахеї, причому в 7 хворих не було необхідності введення фентанілу на час інтубації трахеї. Упродовж операції тільки в 1 пацієнта виникла потреба введення фентанілу під час операції, в решти хворих такої необхідності не було. У хворих у Гр. 2 загальна кількість фентанілу, використаного під час операції на 1 пацієнта, становила 341,3±102 мкг, що в 5 разів більше, ніж у Гр. 1 (р=0,00001).
При аналізі глибини седації під час анестезії встановлено, що при застосуванні дексмедетомідину надмірна седація не розвивалася. Показники BIS були в рекомендованих межах, не знижувалися <40 пунктів (рис. 1). При порівнянні показників BIS у Гр. 1 і Гр. 2 не виявлено значущих відмінностей упродовж анестезії.
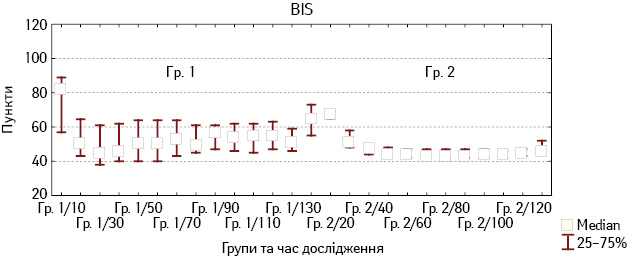
Рис. 1. Зміни показників BIS у хворих Гр. 1 і Гр. 2 під час анестезії
Тривалість пробудження після анестезії суттєво не відрізнялася між групами і у Гр. 1 становила 9,6±2,8 хв, а у Гр. 2 — 10,4±2,6 хв. Потреба в м’язових релаксантах під час анестезії у Гр. 1 сягала 69,6±10 мг і статистично значуще не відрізнялася від даних у Гр. 2 (75,9±12 мг). Інтраопераційна інфузійна підтримка у хворих Гр. 1 також статистично значуще не різнилася від показників у Гр. 2 (див. таблицю).
Аналіз зміни середнього артеріального тиску (АТсер) показав, що при застосуванні дексмедетомідину у хворих із Гр. 1 АТ помірно знижувався, починаючи з 10 хв від початку анестезії, і був стабільним упродовж всієї операції. Водночас у хворих із Гр. 2 показник гемодинаміки суттєво не відрізнявся на всіх етапах хірургічного втручання (рис. 2).
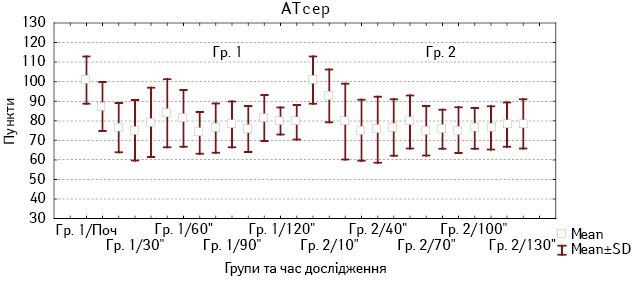
Рис. 2. Зміни АТсер у хворих Гр. 1 і Гр. 2 під час анестезії
При використанні дексмедетомідину як компонента анестезії відзначено помірне зниження ЧСС, яке починалося при болюсному введенні препарату і зберігалося упродовж анестезії. При порівнянні змін ЧСС, які відзначалися у хворих Гр. 2, не виявлено статистично значущих відмінностей на етапах анестезіологічного забезпечення (рис. 3).
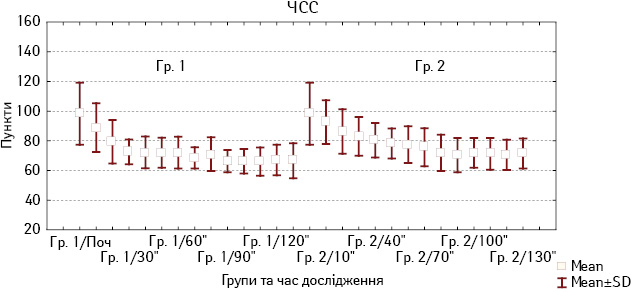
Рис. 3. Зміни ЧСС у хворих Гр. 1 і Гр. 2 під час анестезії
Необхідність використання симпатоміметиків (подовжене внутрішньовенне введення дофаміну) виникла в 4 хворих Гр. 1 і у 3 — Гр. 2 (р=0,0524). Використання дофаміну мало короткочасний характер і сприяло швидкій стабілізації гемодинаміки. У післяопераційний період у жодного хворого не було необхідності в симпатоміметичній підтримці.
Обговорення результатів дослідження
Комбінація сильних опіоїдів із неопіоїдними анальгетиками під час анестезії (наприклад із НСПЗП, парацетамолом) набула останнім часом широкої популярності [9]. Такий мультимодальний підхід сприяє зменшенню вираженості післяопераційного болю, зниженню інтраопераційної та післяопераційної потреби в опіоїдних анальгетиках і, отже, опіоїдасоційованих побічних ефектів. Вважається, що методика опіоїдзберігаючої анестезії та анальгезії дозволяє уникати ятрогенного підвищення інтенсивності післяопераційного болю [10], а також зниження імуносупресії як під час операції, так і в ранній післяопераційний період [11].
Попри те, що селективний і керований агоніст центральних α2-адренорецепторів дексмедетомідин був синтезований ще у 80-х рр. ХХ століття, ґрунтовних робіт щодо застосування його як компонента мультимодальної анестезії поки не достатньо.
Такі властивості α2-агоністів, як седація, сон, анксіолізис, симпатолізис і анальгезія, роблять цю групу препаратів придатними ад’ювантами для мультимодальної анальгезії [12, 13]. Антиноцицептивний ефект зумовлений стимуляцією α2-адренорецепторів, розташованих у центральній нервовій системі, зокрема спинному мозку. Низкою досліджень показано, що α2-агоністи при внутрішньовенному введенні потенціюють ефект опіоїдних анальгетиків [10]. Smith H. і співавтори [14] показали, що з α2-агоністів дексмедетомідин володіє кращим профілем безпеки та ефективності в усуненні болю порівняно з клофеліном. Поки не зрозуміло, яким чином періопераційне введення α2-агоністів зменшує періопераційне споживання опіоїдів і дозволяє взагалі відмовитися від введення опіоїдних препаратів під час анестезії. Окрім того, ризик виникнення побічних ефектів α2-агоністів (брадикардія, артеріальна гіпотензія) може стримувати анестезіологів від широкого застосування цієї групи препаратів як компонента мультимодальної анальгезії/анестезії.
Тому нами проведено дослідження ефективності та безпеки застосування дексмедетомідину як анальгетичного ад’юванта при анестезіологічному забезпеченні колоректальних операцій в онкохірургії, а також для оцінки опіоїдзберігаючого ефекту дексмедетомідину під час анестезії.
Для цього пацієнтам додатково до загальної комбінованої анестезії призначали інтраопераційну інфузію дексмедетомідину з попереднім введенням навантажувальної дози. Результати нашого дослідження показали, що застосування дексмедетомідину під час оперативного втручання дозволило знизити загальну дозу фентанілу в 5,6 раза.
Фактично, фентаніл вводили тільки на інтубацію трахеї, причому лише в половині випадків. Інтраопераційне введення дексмедетомідину показало виражений опіоїдзберігаючий ефект. Дослідженнями попередніх років було показано, що зниження дози опіоїдів під час операції і в післяопераційний період було більш вираженим порівняно з парацетамолом [15] та зіставне з кетаміном і НСПЗП [16]. Інші автори [17] продемонстрували зниження концентрації інгаляційного анестетика і дози введених опіоїдів, необхідних для забезпечення адекватного рівня знеболення при використанні дексмедетомідину під час анестезії. Є також дані, що підтверджують наявність стрес-протекторних, нейро- і нефропротективних властивостей цього препарату [18–20]. У метааналізі G. Blaudszun і співавторів [21] проведено оцінку впливу інтраопераційної інфузії дексмедетомідину на основні показники якості післяопераційного періоду. У результаті встановлено достовірне зниження загальної дози застосовуваних опіоїдів, суб’єктивне зменшення вираженості больового синдрому і частоти випадків післяопераційної нудоти та блювання.
Результати проведеного нами дослідження показали здатність дексмедетомідину стабілізувати інтраопераційну гемодинаміку, що корелює з даними зарубіжних авторів [6]. У нашому дослідженні введення дексмедетомідину під час анестезії на фоні застосування епідуральної анестезії та інгаляції севофлурану не викликало значного зниження АТсер і розвитку брадикардії, що потребували симптоматичної терапії. Публікацій про гемодинамічний вплив дексмедетомідину під час анестезії небагато: лише в одному дослідженні виявлено підвищення ризику розвитку брадикардії після операції. Немає повідомлень про значні побічні гемодинамічні ефекти, що потребували б пролонгованого введення симпатоміметиків для стабілізації гемодинаміки. Однак при використанні блокаторів β-адренорецепторів (на фоні прийому α-2 агоністів) можливе підвищення ризику порушення мозкового кровообігу та смерті [22].
У нашому дослідженні ми не виявили відмінностей у тривалості пробудження після анестезії. Незважаючи на те що дексмедетомідин має седативний ефект, ми не спостерігали збільшення тривалості пробудження хворих при його використанні під час операції. Подібні результати були отримані і в дослідженні G. Blaudszun і співавторів [21]. Вірогідним поясненням цього може бути анестетикзберігаючий ефект дексмедетомідину [12], при якому значно знижується використання анестетиків із кінцевим результатом скорочення часу пробудження після анестезії. Також ми не відзначили суттєвого поглиблення рівня свідомості (під контролем BIS) при використанні дексмедетомідину. У перебігу анестезії значення BIS не виходили за межі 40–60 пунктів. Швидке пробудження після введення дексмедетомідину можна пояснити тим фактом, що індукована α2-адренорецепторами седація якісно нагадує нормальний сон — фазу нешвидкого руху очних яблук (NREM) [23], зокрема ендогенні, сон-промотуючі провідні шляхи можуть давати опосередковану α2-адренорецепторами седацію. Так, L.E. Nelson і співавтори [24], використовуючи складні імуногістохімічні методики та фармакологічні антагоністи, показали, що ендогенні шляхи забезпечення сну залучаються при седації дексмедетомідином. Таким чином, участь NREM фази сну в седації дексмедетомідином може пояснити, чому хворі, які, здавалося б, глибоко сплять під час седації, відносно швидко прокидаються, як після природного сну.
ВИСНОВКИ
У хворих, яким проводять хірургічні втручання, особливо в онкохірургії, періопераційне системне введення агоністів α2-адренорецепторів, зокрема дексмедетомідину, значно знижує інтраопераційні потреби в опіоїдах (володіє опіоїдзберігаючим ефектом), знижує інтенсивність післяопераційного болю. Також можна припустити, що редукція загальної дози опіоїдів під час онкохірургічних втручань може сприяти зниженню ступеня депресії імунної системи і підвищувати виживаність хворих у віддалений післяопераційний період. Використання дексмедетомідину як компонента мультимодальної анестезії не викликало виражених порушень гемодинаміки, що дає підставу говорити про його безпеку в зазначених дозах.
Список використаної літератури
1. Gottschalk A., Sharma S., Ford J. et al. (2010) The role of the perioperative period in recurrence after cancer surgery. Anesth. Analg., 110(6): 1636–1643.
2. Горобец Е.С., Груздев В.Е., Зотов A.B. и др. (2009) Мультимодальная комбинированная анестезия при травматичных операциях. Общая реаниматология, 5(3): 45–50.
3. Brenan F., Carr D., Cousins M. (2007) Pain management: a fundamental human right. Anesth. Analg., 1–5: 206–21.
4. Kurosawa S. (2012) Anesthesia in patients with cancer disorders. Curr. Opin. Anaesthesiol., 25(3): 376–384.
5. Snyder G.L., Greenberg S. (2010) Effect of anaesthetic technique and other perioperative factors on cancer recurrence. Br. J. Anaesth., 105(2): 106–115.
6. Aho M., Lehtinen A-M., Erkola O. et al. (1991) The effect of intravenously administered dexmedetomidine on perioperative hemodynamics and isoflurane requirements in patients undergoing abdominal hysterectomy. Anesthesiology, 74: 997–1002.
7. Varadhan K.K., Neal K.R., Dejong K.H.C. et al. (2010) The enhanced recovery after surgery (ERAS) pathway for patients undergoing major elective colorectal surgery: A meta-analysis of randomized controlled trials. Clinical Nutrition, 29: 434–440.
8. Paranjpe J.S. (2013) Dexmedetomidine: expanding role in anesthesia. Med. J. DY Patil. Univ., 6(1): 5–13.
9. Rasmussen M.L., Mathiesen O., Dierking G. et al. (2010) Multimodal analgesia with gabapentin, ketamine and dexamethasone in combination with paracetamol and ketorolac after hip arthroplasty: a preliminary study. Eur. J. Anaesthesiol., 27: 324 –30.
10. Grosu I., de Kock M. (2011) New concepts in acute pain management: strategies to prevent chronic postsurgical pain, opioid-induced hyperalgesia, and outcome measures. Anesthesiol. Clin., 29: 311–27.
11. Bakan M., Umutoglu T., Topuz U. et al. (2015) Opioid-free total intravenous anesthesia with propofol, dexmedetomidine and lidocaine infusions for laparoscopic cholecystectomy: a prospective, randomized, double-blinded study. Revista Brasileira de Anesthesiologia, 65(3): 191–199.
12. Kamibayashi T., Maze M. (2000) Clinical uses of alpha 2-adrenergic agonists. Anesthesiology, 93: 1345–9.
13. Mantz J., Josserand J., Hamada S. (2011) Dexmedetomidine: New insights. Eur. J. Anaesthesiol., 28: 3–6.
14. Smith H., Elliott J. (2001) Alpha(2) receptors and agonists in pain management. Curr. Opin. Anaesthesiol., 14: 513–8.
15. Remy C., Marret E., Bonnet F. (2005) Effects of acetaminophen on morphine side-effects and consumption after major surgery: meta-analysis of randomized controlled trials. Br. J. Anaesth., 94: 505–513.
16. Elia N., Lysakowski C., Tramer M.R. (2005) Does multimodal analgesia with acetaminophen, nonsteroidal antiinflammatory drugs, or selective cyclooxygenase-2 inhibitors and patient-controlled analgesia morphine offer advantages over morphine alone? Meta-analyses of randomized trials. Anesthesiology, 103: 1296–304.
17. Gurbet A., Basagan-Mogol E., Turker G. et al. (2006) Intraoperative infusion of dexmedetomidine reduces perioperative analgesic requirements. Can. J. Anaesth., 53(7): 646–52.
18. Leino K., Hynynen M., Jalonen J. et al. (2011) Renal effects of dexmedetomidine during coronary artery bypass surgery. BMC Anesthesiol., 11(9): 11–9.
19. Shukry M., Miller J.A. (2010) Update on dexmedetomidine: use in nonintubated patients requiring sedation for surgical procedures. Ther. Clin. Risk Manag., 6: 111–21.
20. Ma D.,
Rajakumaraswamy N., Maze M. (2005) Alpha2-adrenoceptor agonists: shedding light on neuroprotection? Br. Med. Bull., 71: 77–92.
21. Blaudszun G., Lysakowski C., Elia N., Tramer M.R. (2012) Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials. Anesthesiology, 116(6): 1312–22.
22. Devereaux P.J., Yang H., Yusuf S. et al. (2008) Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): A randomised controlled trial. Lancet, 371: 1839–47.
23. Venn R.M., Hell J., Grounds R.M. (2000) Respiratory effects of dexmedetomidine in the surgical patient requiring intensive care. Critical Care, 4: 302–8.
24. Nelson L.E., Lu J., Guo T. et al. (2003) The alpha2-adrenoreceptor agonist dexmedetomidine converges on an endogenous sleep promoting pathway to exert its sedative effects. Anesthesiology, 98: 428–36.
Низкоопиоидная анестезия при колоректальных операциях в онкохирургии
Национальный институт рака, Киев
Национальный медицинский университет им. А.А. Богомольца, Киев
Резюме. Проведено исследование эффективности и безопасности применения дексмедетомидина как анальгетического адъюванта при анестезиологическом обеспечении колоректальных операций в онкохирургии, а также для оценки опиоидсохраняющего эффекта дексмедетомидина во время анестезии. Для этого пациентам дополнительно к общей комбинированной анестезии назначали интраоперационную инфузию дексмедетомидина с предварительным введением нагрузочной дозы. Результаты нашого исследования показали, что применение дексмедетомидина во время оперативного вмешательства существенно снижает интраоперационные потребности в опиоидах, уменьшает интенсивность послеоперационной боли, а также, вероятно, может способствовать снижению степени депрессии иммунной системы и увеличивать выживаемость больных в отдаленный послеоперационный период. Использование дексмедетомидина как компонента мультимодальной анестезии не вызвало выраженных нарушений гемодинамики, что позволяет говорить о его безопасности в указанных дозах.
дексмедетомидин, опиоиды, иммуносупрессия, онкохирургия, мультимодальная анестезия.
Адреса:
buy cialis online Лісний Іван Іванович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: woodmanivan@yahoo.com














Leave a comment