Використання індукційної хіміотерапії в комплексному лікуванні хворих на рак ротової порожнини з урахуванням імуногістохімічних факторів
Резюме. Проведено лікування хворих на плоскоклітинний рак ротової порожнини ІІ–IV стадії з використанням індукційної хіміотерапії та променевої терапії до сумарної вогнищевої дози 60 Гр за розщепленою методикою. 68 пацієнтів першої групи отримували хіміотерапію за схемою TPF, а 75 учасників другої групи — PF. Проведено порівняння безпосередніх і віддалених результатів комбінованого та комплексного лікування залежно від обраної схеми поліхіміотерапії. Проаналізовано гематологічну токсичність застосовуваної хіміопроменевої терапії та її вплив на якість життя хворих. Проведено імуногістохімічне дослідження з визначенням рівнів експресії β-тубуліну та τ-білка. Встановлено прогностичне значення цих імуногістохімічних маркерів щодо результатів терапії хворих на рак ротової порожнини з використанням таксанів.
 Рак ротової порожнини (РРП) являє собою збірне поняття, яке включає такі нозологічні форми: рак язика та дна ротової порожнини, рак слизової оболонки верхньої та нижньої губи, щоки, альвеолярних відростків верхньої та нижньої щелепи, твердого та м’якого піднебіння. Об’єднувати пухлини цих локалізацій дозволяє майже однорідна гістологічна будова, а саме: 90–95% становить плоскоклітинний рак [1].
Рак ротової порожнини (РРП) являє собою збірне поняття, яке включає такі нозологічні форми: рак язика та дна ротової порожнини, рак слизової оболонки верхньої та нижньої губи, щоки, альвеолярних відростків верхньої та нижньої щелепи, твердого та м’якого піднебіння. Об’єднувати пухлини цих локалізацій дозволяє майже однорідна гістологічна будова, а саме: 90–95% становить плоскоклітинний рак [1].
Щорічно в Україні виявляють близько 2 тис. нових випадків РРП; майже половина (47,3%) пацієнтів звертаються в спеціалізовані лікувальні установи з ІІІ–IV стадією пухлинного процесу. Це, у свою чергу, зумовлює високі показники смертності. Протягом першого року з моменту встановлення діагнозу в Україні помирають 41,2% хворих [2].
Лікування пацієнтів із III–IV стадією має включати всі основні терапевтичні підходи, які існують в арсеналі онколога: променеву терапію, хіміотерапію та хірургічне втручання.
Упродовж тривалого часу променеву терапію вважали основним методом лікування хворих на РРП. У пацієнтів із РРП І стадії можливе досягнення повного одужання за рахунок використання лише променевої терапії. У хворих із ІІ–IV стадією, як правило, не відмічають повної регресії після проведення тільки цього виду терапії. З метою підвищення ефективності опромінення як радіомодифікатори застосовують гіпертермію та магнітотермію, хіміопрепарати (тегафур, капецитабін тощо) [3].
За останні десятиріччя традиційна променева терапія зазнала змін. Використання сучасної радіологічної апаратури призвело до зменшення розсіяного опромінення здорових тканин і дало можливість підвести більшу дозу опромінення до пухлинного осередку, збільшити сумарну вогнищеву дозу до 70 Гр. Менша кількість променевих ускладнень дозволяє відмовитися від перерви при проведенні променевої терапії за розщепленою методикою на користь безперервного опромінення та навіть застосовувати два сеанси опромінення протягом доби. Відносно променевої терапії хіміотерапія може бути проведена як неоад’ювантна, індукційна чи одночасна.
Неоад’ювантна хіміотерапія передбачає застосування на першому етапі 2–3 курсів поліхіміотерапії (ПХТ), а потім оцінку безпосередніх результатів лікування. Позитивний ефект вважають сприятливим прогностичним фактором і призначають променеву терапію, у разі відсутності ефекту від хіміотерапії застосовують хірургічне лікування. Така методика дозволяє у частини хворих виконати органозберігаючі хірургічні втручання, що позитивно позначається на якості життя та рівні інвалідизації пацієнтів. Після операції променеву терапію призначають в ад’ювантному режимі, особливо наполягаючи на її проведенні за наявності інших несприятливих прогностичних чинників, а саме: виявлення пухлинних клітин по краю резекції; екстракапсулярного поширення метастатичної пухлини в уражених регіонарних лімфатичних вузлах; пухлинних емболів у судинах.
Широкого застосування набула друга методика поєднання хіміо- та променевої терапії, яка включає проведення курсу ПХТ і з наступного дня після її закінчення — променевого лікування. Така хіміотерапія отримала назву «індукційна», тому що за рахунок її радіоіндукуючого впливу відбувається підвищення ефективності променевої терапії шляхом подолання радіорезистентності пухлинних клітин. Вона передбачає проведення 4–5-денного курсу ПХТ, після закінчення якого (з наступного дня) розпочинається променева терапія.
При проведенні опромінення за розщепленою методикою хіміотерапію призначають перед кожним циклом радіотерапії. Дози хіміопрепаратів суттєво не відрізняються від неоад’ювантних [4].
Метою індукційної хіміотерапії є зменшення розміру пухлини, зниження інтенсивності больового синдрому та покращання якості життя хворих. За рахунок посилення локорегіонарного контролю за пухлинним процесом при проведенні індукційної хіміо- та променевої терапії вдається отримати високу частоту повних регресій, а при частковій регресії — виконувати органозберігаючі оперативні втручання [5].
Одночасна хіміопроменева терапія полягає у призначенні протипухлинних агентів на тлі опромінення пухлинного осередку. До переваг такого підходу слід віднести скорочення термінів перебування в стаціонарі, зниження матеріальних затрат, а до недоліків — підвищення токсичності лікування, яке потребує редукції доз хіміопрепаратів.
Широке застосування в лікуванні хворих на РРП отримала схема внутрішньовенної ПХТ PF, яка включає цисплатин у дозі 100 мг/м і 5-флуороурацил 4000 мг/м; на її основі почали розробляти нові схеми терапії [6].
Суттєвою перешкодою для ефективного проведення хіміотерапії є медикаментозна резистентність пухлини, подолання якої можливе за рахунок використання принципово нових препаратів, методичних підходів і тактики протипухлинного лікування [7, 8].
На початку 90-х рр. ХХ ст. з’явився новий клас протипухлинних препаратів рослинного походження — таксани (паклітаксел і доцетаксел). У 1962 р. був отриманий паклітаксел з кори тиса тихоокеанського (Taxus brevifolia), а пізніше, в 1986 р., із голок європейського тиса (Taxus baccata) вчені одержали доцетаксел. З 1992 р. препарати широко застосовуються в клінічній онкології [9].
На основі цих препаратів була запропонована схема системної ПХТ TPF: доцетаксел у дозі 75 мг/м або паклітаксел у дозі 200 мг/м, цисплатин 100 мг/м та 5-флуороурацил 4000 мг/м [6, 10].
Нами проведено дослідження ефективності індукційної хіміотерапії з використанням хіміопрепаратів групи таксанів за схемою TPF і променевої терапії за розщепленою методикою до сумарної вогнищевої дози 60 Гр (перша група, n=68). 75 хворих другої групи також отримували індукційну хіміотерапію та променеву терапію, але в них застосовували хіміотерапію за схемою PF.
Усім пацієнтам робили загальний аналіз до початку лікування, а також на 8-й, 15-й та 21-й день кожного циклу лікування. У разі виникнення додаткових скарг або відхилень у показниках інтервали між аналізами скорочували.
У значної частини, а саме у 62 (43,36%) хворих — 32 (47,06%) першої та 30 (40,00%) другої групи, під час проведення хіміопроменевої терапії взагалі не було жодних відхилень від нормальних показників загального аналізу крові.
Протягом першого етапу комбінованого лікування у пацієнтів першої групи дещо частіше спостерігали розвиток нейтропенії. Нейтропенія встановлена у 18 (26,47%) хворих першої групи та у 8 (10,67%) — другої. У тому числі нейтропенія ІV ступеня виявлена у 3 (4,41%) та у 1 (1,33%) хворого відповідно.
Кумулювання токсичної дії призвело до більш частого розвитку нейтропенії під час другого етапу хіміопроменевої терапії. Нейтропенію виявлено у 26 (38,24%) хворих першої групи та у 15 (20,00%) — другої. Зокрема нейтропенію ІV ступеня зафіксовано у 5 (7,35%) та у 2 (2,67%) випадках відповідно.
Проведено аналіз порушень інших показників загального аналізу крові упродовж двох етапів індукційної хіміотерапії та променевої терапії.
У 53 хворих відмічено ізольоване порушення одного ростка гемопоезу (у 18 — тільки анемія, у 31 — лише лейкопенія, у 4 — тільки тромбоцитопенія): у 22 (32,35%) пацієнтів першої групи та у 31 (41,33%) — другої.
Порушення відразу двох паростків гемопоезу відмічено 23 (16,08%) хворих, трьох — у 5 (3,50%) учасників обох груп. За групами ці пацієнти розподілилися майже однорідно: 14 (20,59%) — у першій та 14 (18,67%) — у другій.
За допомогою опитувальника EORTC-QLQ-H&N35 нами проведено дослідження змін якості життя хворих.
Незначне погіршення самопочуття за рахунок болісності під час харчування, важкості при ковтанні, сухості в ротовій порожнині та в’язкості слини відмічено під час першого етапу лікування у 24 (35,29%) та 26 (34,67%) хворих першої та другої груп відповідно. Після другого етапу кількість пацієнтів із незначним погіршенням якості життя зменшилася — 20 (29,41%) та 22 (29,33%) осіб відповідно — за рахунок збільшення кількості хворих із помірним і вираженим погіршенням.
Помірне погіршення якості життя під час першого етапу хіміопроменевої терапії відзначено у 34 (50,00%) хворих першої групи та у 38 (50,67%) — другої. Під час другого етапу відмічено більшу кількість пацієнтів, які не дуже добре перенесли лікування — 36 (52,94%) та 39 (52,0%) відповідно у двох групах. Основними скаргами було спотворення смаку та запаху їжі, виражені труднощі при ковтанні твердої їжі, тимчасові труднощі при ковтанні рідини, погіршення самопочуття. Доводилося пояснювати хворим, що ці зміни є тимчасовими, заспокоювати та рекомендувати продовжувати нормальне харчування відповідно до режиму дня, незважаючи на відсутність апетиту та нудоту, з метою запобігання зменшенню маси тіла та виснаженню внутрішніх резервів організму.
Виражене погіршення якості життя було зумовлене інтенсивним больовим синдромом, потребою постійно приймати знеболювальні засоби, поганим самопочуттям. Через тріщини в кутках рота, болісність слизової оболонки альвеолярних відростків і надмірну чутливість зубів пацієнти були неспроможні широко відкрити рот, почистити зуби. Порушення ковтання унеможливлювало приймання будь-якої їжі, а інколи й рідини, призводило до зменшення маси тіла. Такі негативні побічні явища фіксували після першого етапу у незначної кількості хворих — 10 (14,71%) та 11 (14,67%) відповідно у групах. Кількість таких пацієнтів трохи збільшилася під час проведення другого етапу — 12 (17,65%) та 14 (18,67%) відповідно.
Проаналізовані дані свідчать, що додавання таксанів до схеми ПХТ не призводить до погіршення якості життя хворих на РРП.
Проведення індукційної хіміотерапії та променевої терапії із застосуванням таксанів призвело до кращого локорегіонарного контролю за пухлинним процесом.
Аналіз безпосередніх результатів лікування хворих на РРП продемонстрував значні переваги при призначенні таксанів. Так, у пацієнтів першої групи повну регресію пухлини реєстрували більш ніж у 3 рази частіше, ніж у хворих другої групи — 29,41±5,53% проти 9,33±3,36%. Виявлена різниця є статистично достовірною (рис. 1).
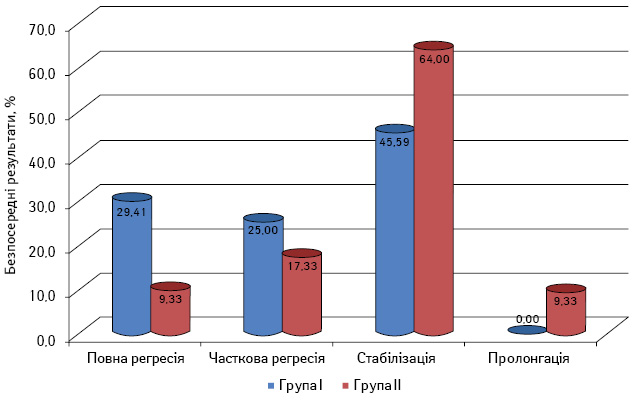
Також у першій групі відмічено більшу кількість хворих із частковою регресією — 25,00±5,25% проти 17,34±4,37%. Така різниця не є вірогідною, але підтверджує тенденцію до кращого локорегіонарного контролю за пухлиною в разі призначення таксанів хворим на РРП.
Підвищення частоти повної та часткової регресії пухлини у хворих першої групи призвело до відповідного статистично достовірного зростання частоти виникнення стабілізації захворювання у пацієнтів другої групи — 45,59±6,04 та 64,00±5,54% відповідно.
Дуже важливо, що в жодного хворого першої групи не зафіксовано пролонгації пухлинного процесу, на відміну від пацієнтів другої групи (9,33±3,36%), що свідчить про високу чутливість злоякісних пухлин ротової порожнини до препаратів групи таксанів та ефективність обраного методу лікування.
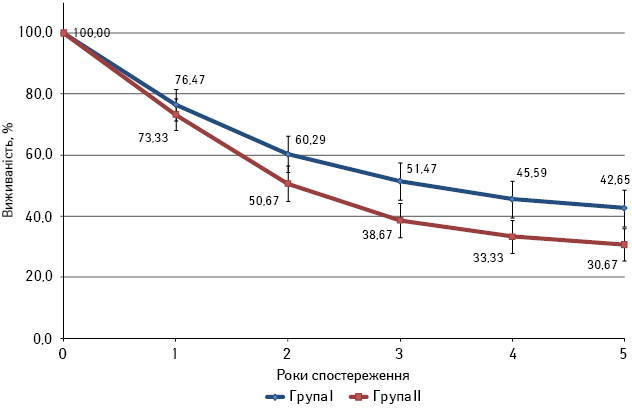
Включення у схему лікування препаратів групи таксанів вірогідно підвищило 5-річну виживаність хворих на РРП. Починаючи з 3-го року спостереження відмічено статистично вірогідну перевагу у виживаності пацієнтів, лікування яких було доповнено введенням таксанів у схему індукційної ПХТ. Так, 3-річний рубіж із моменту встановлення діагнозу подолали 35 (51,47±6,06%) хворих першої групи та 29 (38,67±5,62%) — другої.
Така закономірність зберігається протягом 4-го та 5-го років спостереження з моменту встановлення діагнозу. Таким чином, 4 роки з часу встановлення діагнозу прожили 31 (45,59±6,04%) та 25 (33,33±5,44%) пацієнтів відповідно. 5-річна виживаність становила 42,65±6,00% у хворих, комбіноване та комплексне лікування яких було розпочате з індукційної ПХТ із використанням схеми ПХТ TPF, та 30,67±5,32% — у групи з використанням схеми PF (рис. 2).
Покращання безпосередніх і віддалених результатів індукційної хіміотерапії та променевої терапії за рахунок використання таксанів зробило поштовх до пошуку факторів, які впливають на такі переваги у хворих першої групи.
Точкою прикладання, або молекулярною мішенню, для препаратів групи таксанів є білок β-тубулін. Тубулін — гетеродимер, що складається з субодиниць α- і β-тубуліну. Ці субодиниці, молекулярна маса кожної з яких становить близько 55 кДа, гомологічні, але не ідентичні. Гетеродимери α- та β-тубуліну — це основний будівельний блок мікротрубочок. Мікротрубочки — внутрішньоклітинні ниткоподібні структури циліндричної форми, містяться лише в еукаріотичних клітинах. Вони беруть участь у підтриманні форми клітини, виконуючи функцію цитоскелета, і є лініями транспорту всередині клітини, а також відіграють ключову роль у мітозі, формуючи мітотичне веретено ділення [11].
Ріст мікротрубочок відбувається за рахунок полімеризації з боку, який росте («+» кінець), та деполімеризації з протилежного боку («–» кінець). Таксани блокують процеси деполімеризації, за рахунок чого тубулін перестає вивільнятися з «–» кінця мікротрубочки. Через відсутність «будівельного матеріалу» ріст мікротрубочки призупиняється. Наявні мікротрубочки утворюють патологічні структури.
Таким чином порушуються процеси росту клітини, формування веретена ділення, розподілу хромосом під час мітозу, призупиняється ділення клітини, запускаються механізми апоптозу пухлинної клітини.
Високий вміст β-тубуліну в цитоплазмі пухлинної клітини не дозволяє молекулам таксанів зв’язати весь вільний β-тубулін, не відбувається реалізації лікувального ефекту таксанів, і процес поділу клітини не зупиняється [12].
Іншим асоційованим із мікротрубочками протеїном є τ-білок (тау-білок), який зв’язується з β-тубуліном за рахунок тих самих рецепторів, що й паклітаксел. Висока концентрація цього білка не дозволяє молекулам таксанів взаємодіяти з молекулами β-тубуліну, які вже зв’язані з τ-білком, та тривало утримувати зв’язаний β-тубулін за рахунок конкурентної дії τ-білка.
У науково-дослідному відділенні патологічної анатомії та гістології Національного інституту раку під керівництвом професора О.М. Грабового були виконані імуногістохімічні дослідження рівнів експресії β-тубуліну та τ-білка в пухлинному матеріалі, взятому при біопсії.
Імуногістохімічні дослідження проведені за стандартною методикою [13] з використанням первинних антитіл проти β-тубуліну (Tubulin-β, Rabbit Polyclonal Antibody) та τ-білка (Tau Ab-3, Rabbit Polyclonal Antibody, «Thermo Scientific Immunohistochemistry Products», США).
Цитоплазматичну експресію β-тубуліну та τ-білка оцінювали з використанням бальної шкали, розробленої компанією «DAKO» і схваленої USFDA, у якій:
- (–) — повна відсутність продукту реакції чи незначне його виявлення в цитоплазмі пухлинних клітин;
- (+) — наявність продукту реакції в цитоплазмі менш ніж 10% клітин пухлини;
- (++) — виражена кількість продукту реакції в цитоплазмі 11–50% клітин пухлини;
- (+++) — наявність яскраво вираженого продукту реакції в усій масі цитоплазми 51–100% клітин пухлини.
Враховуючи необхідність аналізу даних імуногістохімічних маркерів для вивчення ефективності хіміотерапії з/без використання препаратів групи таксанів, застосовували загальноприйняту методику оцінки експресії β-тубуліну та τ-білка, яку використовували у хворих на рак яєчника [14], шлунка [15], легені [16, 17], грудної залози [18] та при цілій низці локалізацій [19], а саме: експресію «—» та «+» оцінювали як низьку, а «++» та «+++» — як високу.
Проведено аналіз безпосередніх результатів лікування хворих на РРП залежно від рівня експресії β-тубуліну за групами дослідження. У першій групі було 33 (48,53%) пацієнти з низькою експресією β‑тубуліну та 35 (51,47%) — з високою, а в другій групі — 37 (49,33%) з низькою та 38 (50,67%) — з високою. Розподіл хворих за цим показником у групах дослідження ідентичний.
Проаналізовано прогностичне значення експресії β-тубуліну щодо безпосередніх результатів лікування хворих на РРП.
У пацієнтів, які отримували індукційну хіміотерапію за схемою TPF, досягнуто повної регресії пухлини у 16 (48,49±8,70%) осіб із низькою експресією β-тубуліну проти 4 (11,43±5,38%) — з високою. Різниця є статистично достовірною (рис. 3).
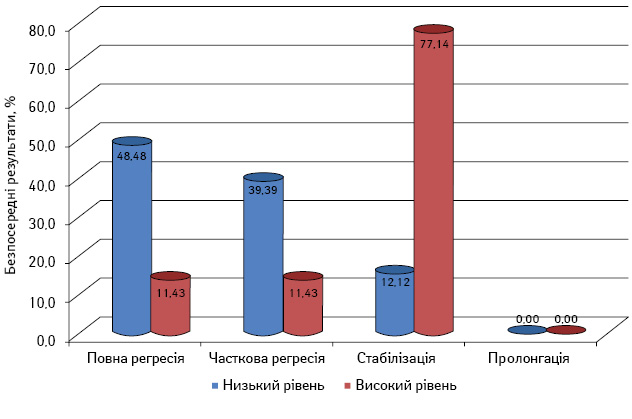
Також у хворих із низькою експресією β-тубуліну відмічено вірогідно більше випадків регресії пухлини понад 50% — 13 (39,39±8,51%) проти 4 (11,43±5,38%). Частка стабілізації захворювання була більшою серед пацієнтів із високою експресією β-тубуліну — 4 (12,12±5,68%) проти 27 (77,14±7,10%) відповідно.
Випадків пролонгації пухлинного процесу у хворих першої групи не зафіксовано.
У пацієнтів другої групи статистично вірогідних відмінностей безпосередніх результатів комбінованого лікування залежно від рівня експресії β-тубуліну не виявлено.
Проведено аналіз прогностичного впливу експресії β‑тубуліну на віддалені результати комбінованого та комплексного лікування хворих на РРП із використанням індукційної ПХТ за схемами TPF і PF.
У першій групі пацієнтів, лікування яких починали з внутрішньовенного введення таксанів, відмічено статистично вірогідний зворотний вплив експресії β-тубуліну на виживаність (при низькому рівні експресії β-тубуліну виживаність була кращою).
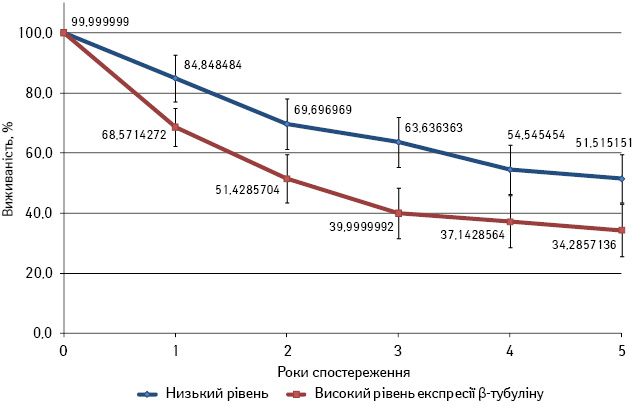
Оскільки значна частина хворих на РРП помирає протягом першого року з моменту встановлення діагнозу, виражені переваги в показниках виживаності були помітні відразу. Відмітку один рік подолали 28 (84,85±6,24%) пацієнтів першої групи з низькою експресією β‑тубуліну та 24 (68,57±7,85%) — з високою.
Ця різниця набуває статистичного значення вже протягом першого року з моменту встановлення діагнозу зі збереженням вагомості таких відмінностей протягом усього 5-річного періоду спостереження.
Максимальну статистичну відмінність встановлено на відмітці 3 роки з моменту діагностування хвороби у 21 (63,64±8,37%) пацієнта з низькою та у 14 (40,00±8,28%) — з високою експресією β‑тубуліну.
Це пояснюється зниженням темпу смертності хворих протягом 4–5-го років після встановлення діагнозу. 5-річної виживаності пацієнтів, які отримували індукційну хіміотерапію за схемою TPF із низьким та високим рівнем експресії β‑тубуліну, досягнуто у 17 (51,52±8,70%) та 12 (34,29±8,02%) хворих відповідно.
Наочно динаміку виживаності зображено на графіку (рис. 4), де показники виживаності доповнені планками похибок, які демонструють статистичну вірогідність отриманих результатів.
Проведено аналіз впливу рівня експресії τ-білка в пухлинних клітинах хворих на РРП на безпосередні результати лікування по групах. Кількість пацієнтів із низькою експресією τ-білка в пухлині серед учасників першої групи становила 22 (32,35%), а з високою — 46 (67,65%). У другій групі кількість хворих із низьким рівнем експресії τ-білка в пухлині досягла 26 (34,67%), а з високим — 49 (65,33%). Розподіл всередині груп однаковий.
Проаналізовано безпосередні результати лікування хворих на РРП першої групи залежно від рівня експресії τ-білка. Так, серед 22 пацієнтів із низькою експресією τ-білка повної регресії досягнуто у 13 (59,09±10,48%), на відміну від хворих із високою експресією τ-білка, у яких повну регресію відзначено у 7 (15,22±5,30%). Різниця є статистично достовірною (рис. 5).
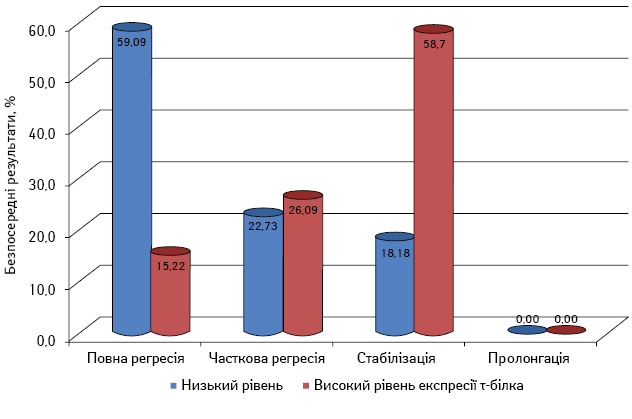
Часткову регресію відмічено у 5 (22,73±8,93%) та у 12 (26,09±6,47%) хворих відповідно.
Ще одну статистично значущу різницю за показником «стабілізація пухлинного процесу» зафіксовано у 4 (18,18±8,22%) пацієнтів із низькою експресією τ-білка та у 27 (58,70±7,26%) — з високою. Пролонгації хвороби в учасників першої групи не виявлено.
Кращі безпосередні результати у хворих із низькою експресією τ-білка, комбіноване лікування яких включало внутрішньовенне введення таксанів, зумовлені більш тривалим зв’язуванням молекул таксанів із β-тубуліном в умовах зниженого конкурування за рецептори, що надає більше шансів для реалізації терапевтичного ефекту.
В абсолютному значенні вплив низької експресії β-тубуліну у пацієнтів першої групи (n=68) був вираженішим — 16 хворих з повною регресією пухлини проти 13, але за рахунок рідшого виявлення низького рівня експресії τ-білка відносний вплив останнього виявився більш значним — 48,49±8,70% проти 59,09±10,48% відповідно.
У хворих другої групи статистично вірогідних відмінностей безпосередніх результатів комбінованого лікування залежно від рівня експресії τ-білка не виявлено.
Рівень експресії τ-білка не мав прогностичного значення щодо віддалених результатів комбінованого та комплексного лікування хворих на РРП із використанням індукційної ПХТ як за схемою TPF, так і за PF.
Висновки
1. Незначне посилення гематологічної токсичності за рахунок призначення препаратів групи таксанів зумовлює необхідність динамічного гематологічного контролю.
2. Додавання таксанів під час проведення хіміопроменевої терапії не призводить до погіршення якості життя хворих.
3. Проведення індукційної хіміотерапії та променевої терапії з використанням таксанів покращує безпосередні та віддалені результати комбінованого та комплексного лікування хворих на РРП.
4. Встановлено прогностичне значення експресії β-тубуліну щодо безпосередніх і віддалених результатів лікування хворих на РРП із використанням таксанів. Так, у пацієнтів із низьким рівнем β-тубуліну призначення таксанів на 37,05% частіше приводить до повної регресії пухлини та на 17,23% покращує 5-річну виживаність порівняно з хворими з високим рівнем експресії.
5. Встановлено прогностичне значення експресії τ-білка щодо безпосередніх і віддалених результатів лікування хворих на РРП із використанням таксанів. Так, у пацієнтів із низьким рівнем експресії τ‑білка призначення таксанів на 43,87% частіше приводить до повної регресії пухлини порівняно з хворими з високою експресією цього протеїну. На віддалені результати терапії рівень експресії τ-білка не впливає.
Список використаної літератури
1. Feller L., Lemmer J. (2012) Oral squamous cell carcinoma: epidemiology, clinical presentation and treatment. J. Cancer Ther., 3: 263–8.
2. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін.; ред. докт. мед. наук О.О. Колеснік (2015) Рак в Україні, 2013–2014. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України № 16. Київ. 106 с.
3. Cтандарти діагностики і лікування онкологічних хворих (2008) Онкологія, 10 (№1 додаток). 80 с.
4. Argiris A., Karamouzis M.V., Raben D. (2008) Head and neck cancer. Lancet, 371(9625): 1695–1709.
5. Вихлянов И.В. (2005) Оптимизация комплексного лечения плоскоклеточного рака полости рта и ротового отдела глотки. Дис…. докт. мед. наук, Барнаул. 288 с.
6. Posner M.R., Hershock D.M., Blajman C.R. et al. (2007) Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N. Engl. J. Med., 357: 1705–15.
7. Alfarouk K.O., Stock C.M., Taylor S. et al. (2015) Resistance to cancer chemotherapy: failure in drug response from ADME to P-gp. Cancer Cell Int., 15: 71–83.
8. Манзюк Л.В., Артамонова Е.В. (2006) Таксотер в химиотерапии рака молочной железы. Рус. мед. журн., 24: 1753–7.
9. Vermorken J.B., Remenar E., van Herpen C. et al. (2007) Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer. N. Engl. J. Med., 357: 1695–704.
10. Caponigro F., Milano A., Basile M. et al. (2006) Recent advances in head and neck cancer therapy: the role of new cytotoxic and molecular-targeted agents. Curr. Opin. Oncol., 18: 247–52.
11. Зайцев А.В. (2015) Изучение взаимодействия микротрубочек с белками кинетохорного комплекса. Дис…. канд. біол. наук, Москва. 118 с.
12. Cullen K.J., Schumaker L., Nikitakis N. et al. (2009) β-Tubulin-II expression strongly predicts outcome in patients receiving induction chemotherapy for locally advanced squamous carcinoma of the head and neck: a companion analysis of the TAX 324 trial. J. Clin. Oncol., 27 (36): 6222–8.
13. Dabbs D.J. (2014) Diagnostic immunohistochemistry: theranostic and genomic applications: 4ed. Elsevier Health Sciences, New York. 960 p.
14. Ferrandina G., Zannoni G.F., Martinelli E. et al. (2006) Class III beta‑tubulin overexpression is a marker of poor clinical outcome in advanced ovarian cancer patients. Clin. Cancer Res., 12 (9): 2774–9.
15. Urano N., Fujiwara Y., Dokiet Y. et al. (2006) Clinical significance of class III beta-tubulin expression and its predictive value for resistance to docetaxel-based chemotherapy in gastric cancer. Int. J. Oncol., 28 (2): 375–81.
16. Seve P., Reiman T., Dumontet C. (2010) The role of beta III tubulin in predicting chemoresistance in non-small cell lung cancer. Lung Cancer, 67: 136‑43.
17. Zhang H.L., Ruan L., Zheng L.M. et al. (2012) Association between class III β-tubulin expression and response to paclitaxel/vinorebine-based chemotherapy for non-small cell lung cancer: A meta-analysis. Lung Cancer, 77 (1): 9–15.
18. Rouzier R., Rajan R., Wagner P. et al. (2005) Microtubule-associated protein tau: A marker of paclitaxel sensitivity in breast cancer. Proc. Natl. Acad. Sci., 102 (23): 8315–20.
19. Smoter M., Bodnar L., Duchnowska R. et al. (2011) The role of Tau protein in resistance to paclitaxel. Cancer Chemother. Pharmacol., 68 (3): 553–7.
Использование индукционной химиотерапии в комплексном лечении больных раком ротовой полости с учетом иммуногистохимических факторов
Национальный институт рака, Киев
Резюме. Проведено лечение больных плоскоклеточным раком полости рта II–IV стадии с использованием индукционной химиотерапии и лучевой терапии до суммарной очаговой дозы 60 Гр по расщепленной методике. 68 больных первой группы получали химиотерапию по схеме TPF, а 75 участников второй группы — PF. Проведено сравнение непосредственных и отдаленных результатов комбинированного и комплексного лечения в зависимости от выбранной схемы полихимиотерапии. Проанализирована гематологическая токсичность проводимой химиолучевой терапии и ее влияние на качество жизни больных. Выполнены иммуногистохимические исследования с определением уровней экспрессии β-тубулина и τ-белка. Установлено прогностическое значение данных иммуногистохимических маркеров относительно результатов лечения больных раком ротовой полости с использованием таксанов.
рак ротовой полости, индукционная химиотерапия, таксаны, иммуногистохимические маркеры, бета-тубулин, тау-белок.














Leave a comment