Патоморфологічні зміни внутрішніх органів при гострому поширеному перитоніті на тлі раку товстої кишки в експерименті
Іващук О.І., Гушул І.Я., Бодяка В.Ю.
Резюме. У статті представлено результати експериментального дослідження патоморфологічних змін внутрішніх органів, а також динаміки фібринолітичної та протеолітичної активності очеревини, видового складу і популяційного рівня мікроорганізмів перитонеального ексудату за гострого поширеного перитоніту на тлі злоякісного новоутворення товстої кишки. Отримані результати патоморфологічного дослідження вказують на появу дрібновогнищевих осередків центролобулярного колікваційного некрозу печінкової тканини, підвищення відсотка колабованих клубочків ниркової тканини. Наявність злоякісного новоутворення товстої кишки за гострого поширеного перитоніту призводить до вірогідного переважання показників фібринолітичної та протеолітичної активності очеревини із негативною динамікою впродовж усього терміну дослідження. Такий «онкологічний перитоніт» характеризується вірогідним збільшенням кількості висіяних штамів K. pneumoniae, мікроорганізмів роду Proteus, дріжджоподібних грибів роду Candida, ростом S. aureus, а також зростанням популяційного рівня E. coli, K. pneumoniae, мікроорганізмів роду Proteus та Streptococcus, дріжджоподібних грибів роду Candida.

Вступ
Незважаючи на розвиток сучасної онкології, рак товстої кишки дедалі більше привертає увагу багатьох вчених і клініцистів у зв’язку з неухильним зростанням захворюваності на цю патологію [3].
Більшість пацієнтів звертаються до лікувального закладу із захворюванням в останніх стадіях, що досить часто супроводжується ускладненнями, такими як кишкова непрохідність, перфорація стінки товстої кишки або власне ракової пухлини. Це призводить до розвитку гострого поширеного перитоніту (ГПП), летальність за якого залишається на високому рівні [1, 4].
Така висока смертність зумовлена тим, що перитоніт виникає на тлі вже існуючих патологічних змін, спричинених злоякісним новоутворенням товстої кишки, особливістю перебігу якого є відсутність чітких меж, швидке розповсюдження патологічного процесу по черевній порожнині, поява та підтримання «вадливих кіл», складність діагностики тощо. Усе це значно ускладнює перебіг ГПП і призводить до незадовільних результатів його лікування [6, 8].
Вивчення особливостей перебігу ГПП, який виник на тлі раку товстої кишки, дасть змогу розробити нові підходи до лікувальної тактики.
Мета дослідження — вивчити патоморфологічні зміни внутрішніх органів, фібринолітичну та протеолітичну активність очеревини, а також видовий склад і популяційний рівень мікроорганізмів перитонеального ексудату за ГПП на тлі злоякісного новоутворення товстої кишки в експерименті.
Об’єкт і методи дослідження
Експериментальні дослідження виконано на 56 статевозрілих нелінійних щурах середнього віку обох статей масою не менше 200 г, яким змодельовано ГПП шляхом інтраперитонеального введення 30% калової суспензії в кількості 1 мл на 100 г маси тварини [2].
Усі дослідні тварини були поділені на дві групи — основну та порівняння. Основну групу склали 32 щури, яким за 2 тиж до моделювання ГПП прищеплено пухлину Герена у товсту кишку, згідно із запропонованою нами методикою [5]. До групи порівняння належали 24 тварини без прищепленої пухлини Герена.
Забір біологічного матеріалу проводили через 24 та 48 год після моделювання ГПП під загальним внутрішньом’язовим знеболенням (розчин хлоралгідрату 200–250 мг/кг) з дотриманням правил асептики. Після виконання лапаротомії проводили бактеріологічне дослідження перитонеального ексудату.
Забір біологічного матеріалу здійснювали у ті самі терміни. Для визначення фібринолітичної та протеолітичної активності очеревини після виконання лапаротомії висікали шматок великого чепця, який поміщали в охолоджений боратний буфер (рН 9,0).
Після аутопсії тварин висікали шматки печінки, нирки та легені з метою подальшого проведення патоморфологічного дослідження.
Оперативні втручання виконували в умовах віварію Вищого державного навчального закладу України «Буковинський державний медичний університет» відповідно до національних вимог «Загальних етичних принципів експериментів на тваринах» (Україна, 2011), які узгоджені з положенням «Європейської конвенції про захист хребетних тварин, що використовуються для експериментів та інших наукових цілей» (Страсбург, Франція, 1985).
Евтаназію щурів здійснювали у стані глибокого наркозу тварин шляхом уведення надлишкової кількості наркотичного препарату, згідно з етичними стандартами та чинними рекомендаціями і відповідно до Закону України від 21.02.2006 р. № 3447-1 «Про захист тварин від жорстокого поводження».
Для світлооптичного дослідження (при гістологічному вивченні) біоптати тканини печінки, нирки та легені фіксували в 10% нейтральному формаліні. Парафінові зрізи забарвлювали гематоксиліном та еозином. Використовували описову методику виявлених патоморфологічних змін.
Зважені наважки тканини великого чепця гомогенізували в боратному буфері та визначали фібринолітичну та протеолітичну активність за методикою О.Л. Кухарчука (1996) [7] із використанням реактивів фірми «Simko Ltd.» (Львів, Україна). Вивчали такі показники:
- сумарна фібринолітична активність (СФА), яку розраховували за формулою = 8000•E440/наважка (мг) = результат E440/мг/год (одиниця виміру);
- неферментативна фібринолітична активність (НФА) за аналогічною формулою = результат E440/мг/год;
- ферментативна фібринолітична активність (ФФА) за формулою = СФА — НФА.
Для визначення протеолітичної активності слизової оболонки дванадцятипалої кишки використовували кольорогенні сполуки: альбумін (лізис низькомолекулярних білків), казеїн (лізис високомолекулярних білків), колаген (лізис колагену). Результат оцінювали за такою формулою: 8000•E440/наважка (мг) = результат E440/мг/год (одиниця виміру).
Для якісної та кількісної оцінки аеробних і факультативно-анаеробних збудників проводили посіви перитонеального ексудату на середовище Ендо, тіогліколеве середовище, жовтковий агар, анаеробний кров’яний агар і культивували при температурі 37 °С упродовж 7 діб. Для біохімічної ідентифікації грамнегативної флори використовували тест-системи фірми «Біомерн» на приладі «Mini Api» (Франція). З метою визначення росту патогенних грибів застосовували середовище Сабуро.
Після інкубації підраховували кількість колонієутворювальних одиниць (КУО), які виявлено в досліджуваному матеріалі, та подавали в десяткових логарифмах (lg КУО).
Статистичний аналіз отриманих результатів проводили з використанням електронних таблиць Microsoft Excel та пакета програм статистичної обробки PAST. Для перевірки нормальності розподілу даних у вибірках застосовували критерії Шапіро — Вілка. Розбіжності між групами досліджень визначали за допомогою критеріїв Манна — Уїтні. Результат вважали вірогідним, якщо коефіцієнт вірогідності становив ≤0,05, що є загальноприйнятим у медико-біологічних дослідженнях.
Результати
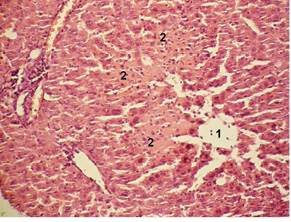
При дослідженні гістологічних препаратів печінкової тканини тварин обох дослідних груп упродовж усього терміну спостереження відмічали явища гідропічної та зернистої дистрофії, повнокров’я центральних вен печінкової частки, нерівномірного набряку інтерстицію просторів Діссе. Починаючи з 24-ї години спостереження у тварин основної групи, на відміну від групи порівняння, фіксують дрібні осередки центролобулярного колікваційного некрозу, що пояснюється ураженням організму злоякісним новоутворенням у поєднанні з токсичним впливом ГПП (рис. 1).
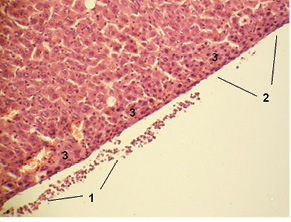
Печінкова тканина під капсулою Глісона тварин обох дослідних груп характеризувалася повнокров’ям синусоїдів, вираженим набряком просторів Діссе, що пояснюється реактивним впливом ексудату черевної порожнини, всмоктуванням токсинів. Слід зазначити, що у тварин основної групи на зовнішній поверхні капсули печінки виявлено нерівномірне нашарування неповноцінних фібринових ниток із невеликою кількістю лейкоцитів. У всіх тварин групи порівняння відмічали виражене нашарування фібрину на капсулі печінки, яке має суцільний характер, із великою кількістю лейкоцитів (рис. 2).
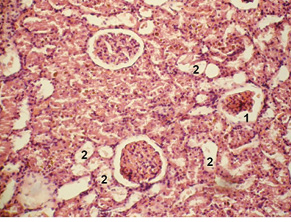
Ниркова тканина тварин групи порівняння на 24-ту та 48-му години дослідження характеризувалася набряком інтерстицію сосочка, кіркової та, особливо, мозкової речовин. Відзначено венозне повнокров’я кіркової речовини. В обох дослідних групах відмічали зернисту та гідропічну дистрофію епітелію звивистих канальців зі злущенням в їх просвіт фрагментів апікальних частин (клазматоз). Слід зазначити, що майже у всіх тварин основної групи, починаючи з 24-ї години спостереження, понад 10% ниркових клубочків були колабовані (рис. 3).
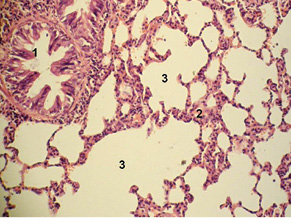
Упродовж усього терміну спостереження патоморфологічна картина легень тварин обох дослідних груп характеризувалася наявністю емфізематозних ділянок, більш виражених в основній групі, вогнищевим повнокров’ям вен середнього та дрібного калібру. Відмічено десквамацію епітелію в дрібних та середніх бронхах (рис. 4).
Результати дослідження, наведені в табл. 1, свідчать про вірогідне переважання СФА, НФА та ФФА у тварин основної групи впродовж усього терміну спостереження. На 48-му годину після моделювання ГПП відмічається зниження вищезазначених показників, проте ця динаміка вірогідна тільки у тварин групи порівняння. В обох дослідних групах протягом усього періоду дослідження переважають показники НФА над ФФА.
Таблиця 1. Динаміка СФА очеревини після моделювання ГПП на тлі злоякісного новоутворення товстої кишки у різні терміни спостереження (М±m), Е440/мг/год
| Показники | Термін після моделювання ГПП | |||
| 24 год | 48 год | |||
| Група порівняння, n=14 | Основна група, n=18 | Група порівняння, n=12 | Основна група, n=15 | |
| СФА | 54,28±2,441 | 67,49±2,447 (p<0,01) |
41,21±1,831* | 59,85±3,264 (p<0,001) |
| НФА | 28,11±1,668 | 36,18±1,278 (p<0,01) |
22,03±0964* | 32,63±1,912 (p<0,01) |
| ФФА | 26,17±1,194 | 31,31±1,254 (p<0,05**) |
19,17±0,954* | 27,22±1,436 (p<0,001**) |
n — кількість спостережень; p — різниця показників між обома дослідними групами; * — вірогідні зміни порівняно з 24-ю годиною спостереження у відповідній групі.
Представлені в табл. 2 результати дослідження вказують на вірогідне переважання протеолітичної активності альбуміну, казеїну та колагену в тварин основної групи впродовж усього терміну дослідження. Також відмічено зростання протеолітичної активності альбуміну та казеїну на 48-му годину дослідження, проте ця різниця вірогідна тільки у тварин основної групи. Протеолітична активність колагену в обох дослідних групах тварин на 48-му годину спостереження вірогідно знижується.
Таблиця 2. Динаміка протеолітичної активності очеревини після моделювання ГПП на тлі злоякісного новоутворення товстої кишки у різні терміни спостереження (М±m), Е440/мг/год
| Показники | Термін після моделювання ГПП | |||
| 24 год | 48 год | |||
| Група порівняння, n=14 | Основна група, n=18 | Група порівняння, n=12 | Основна група, n=15 | |
| Лізис альбуміну | 38,67±1,626 | 45,61±1,658 (p<0,01) |
43,23±2,102 | 51,38±2,206 (p<0,05*) |
| Лізис казеїну | 108,51±3,123 | 121,84±3,895 (p<0,05) |
112,49±2,625 | 133,43±2,936 (p<0,001*) |
| Лізис колагену | 27,41±2,132 | 34,78±2,009 (p<0,05) |
19,82±1,385* | 28,23±1,542 (p<0,01*) |
n — кількість спостережень; p — різниця показників між обома дослідними групами; * — вірогідні зміни порівняно з 24-ю годиною спостереження у відповідній групі.
Підсумовуючи результати проведеного дослідження, слід відмітити, що моделювання ГПП призводить до посилення процесів фібринолізу, проте в подальшому ця динаміка змінюється у зворотному напрямі з невірогідною різницею показників у тварин основної групи. У щурів основної групи рівень НФА вірогідно перевищує ФФА, що свідчить про зниження процесів спайкоутворення очеревини.
При посіві ексудату черевної порожнини у тварин обох дослідних груп виявлено ріст культур Escherichia coli (E. сoli), Klebsiella pneumoniae (K. pneumoniae), мікроорганізмів роду Proteus (P. vulgaris, P. mirabilis, P. morganii), мікроорганізмів роду Streptococcus та дріжджоподібних грибів роду Candida. Також в основній групі тварин у 5 випадках виявлено Staphylococcus aureus (S. aureus).
Аналізуючи результати дослідження видового складу перитонеального ексудату, які подано в табл. 3, слід відмітити найбільшу кількість висіяних штамів E. coli, яка переважає у всіх дослідних групах тварин впродовж усього терміну спостереження. На 48-му годину дослідження кількість висіяних штамів K. pneumoniae невірогідно зростає, проте в основній групі їхня частка в 1,71 раза (p<0,05) більша, ніж в групі порівняння. В обох дослідних групах відмічається збільшення кількості висіяних штамів мікроорганізмів роду Proteus на 48-му годину спостереження із вірогідною різницею показників в основній групі. У ці терміни дослідження кількість висіяних штамів мікроорганізмів роду Proteus у тварин основної групи в 2,17 раза (p<0,05) більша, ніж у групі порівняння. Кількість висіяних штамів мікроорганізмів роду Streptococcus на 48-му годину спостереження в основній групі тварин більша, проте ця різниця невірогідна. На 48-му годину дослідження обсяг висіяних штамів дріжджоподібних грибів роду Candida в основній групі тварин в 3,0 раза (p<0,05) більший, ніж у групі порівняння.
Таблиця 3. Видовий склад та популяційний рівень мікрофлори перитонеального ексудату після моделювання ГПП на тлі злоякісного новоутворення товстої кишки у різні терміни спостереження (М±m)
| Дослідна група тварин | Термін після моделювання ГПП | |||
| 24 год | 48 год | |||
| Кількість штамів | Кількість колоній, lg KУO/см | Кількість штамів | Кількість колоній, lg KУO/см | |
| Порівняння (n=12) |
12 |
E. coli 4,16±0,154 |
12 |
E. coli 4,83±0,286 (p1>0,05) |
| 4 |
K. pneumoniae 3,28±0,215 |
7 |
K. pneumoniae 3,82±0,198 (p1>0,05) |
|
| 4 | М/о роду Proteus 2,73±0,155 |
6 | Роду Proteus 3,21±0,156 (p1>0,05) |
|
| − | − | 3 | М/о роду Streptococcus 3,04±0,153 |
|
| − | − | 3 | Гриби роду Candida 2,75±0,151 |
|
| Основна (n=16) |
16 |
E. coli 4,76±0,241 (p>0,05) |
16 |
E. coli 5,66±0,263 (p<0,05; p1<0,05) |
| 7 |
K. pneumoniae 3,88±0,122 (p<0,05) |
12 |
K. pneumoniae 4,41±0,17 (p<0,05; p1<0,05) |
|
| 8 | М/о роду Proteus 3,43±0,144 (p<0,05) |
13 | М/о роду Proteus 3,91±0,225 (p<0,05; p1>0,05) |
|
| 4 | М/о роду Streptococcus 2,92±0,151 |
8 | М/о роду Streptococcus 3,65±0,147 (p<0,05; p1<0,01) |
|
| − | − | 5 |
S. aureus 3,12±0,149 |
|
| − | − | 9 | Гриби роду Candida 3,48±0,175 (p<0,05) |
|
n — кількість спостережень; м/о — мікроорганізми; p — різниця показників між обома дослідними групами; p1 — різниця показників порівняно з 24-ю годиною спостереження.
Результати дослідження популяційного рівня мікроорганізмів перитонеального ексудату свідчать про зростання кількості колоній E. coli на 48-му годину спостереження, проте ця динаміка вірогідна тільки у тварин основної групи. Також в основній групі на 48-му годину спостереження популяційний рівень Е. coli вірогідно вищий проти показників групи порівняння у відповідні терміни дослідження.
Популяційний рівень K. pneumoniae в основній групі вірогідно перевищує цей показник у групі порівняння впродовж усього терміну дослідження із вірогідною динамікою росту на 48-му годину спостереження.
Кількість колоній мікроорганізмів роду Proteus в основній групі протягом усього терміну дослідження вірогідно більша, ніж у групі порівняння. Динаміка збільшення кількості колоній мікроорганізмів роду Proteus на 48-му годину невірогідна в обох дослідних групах.
На 48-му годину спостереження відмічається вірогідне зростання популяційного рівня мікроорганізмів роду Streptococcus в основній групі тварин із вірогідним переважанням показників проти групи порівняння у відповідні терміни.
В основній групі тварин кількість колоній дріжджоподібних грибів роду Candida вірогідно перевищує показники в групі порівняння.
Обговорення
Підсумовуючи результати проведеного патоморфологічного дослідження, слід зазначити, що виявлені патоморфологічні зміни внутрішніх органів мають дещо схожу картину, яка характерна для ГПП, проте наявність злоякісного новоутворення товстої кишки призводить до появи деяких особливостей. Так, тканина печінки при злоякісній пухлині товстої кишки характеризується наявністю дрібних осередків центролобулярного колікваційного некрозу. Для ниркової тканини характерна наявність більшої кількості колабованих клубочків капсули Шумлянського — Боуена. Легені не мають суттєвих відмінностей, проте за наявності злоякісного новоутворення товстої кишки відмічаються більш виражені емфізематозні ділянки, що можна пояснити ушкодженням сурфактанту, зниженням еластичності легеневої тканини внаслідок токсичного впливу ракової пухлини. При дослідженні міокарда та селезінки особливих відмінностей не виявлено.
Враховуючи мізерне нашарування фібрину з незначною кількістю лейкоцитів на вісцеральній поверхні печінки та селезінки, слід відмітити досить погану адгезивну здатність очеревини за наявності злоякісного новоутворення товстої кишки, що, можливо, пояснює чимале поширення ексудату по черевній порожнині з маловираженою клінічною картиною.
Виникнення вищезазначених патологічних змін внутрішніх органів за ГПП онкологічного генезу можна пояснити тривалим впливом токсинів, хронічною анемією, гіпопротеїнемією, що зумовлено наявністю злоякісного новоутворення товстої кишки. Моделювання ГПП нашаровує його патологічний вплив, тим самим поглиблює та пришвидшує процеси органної дисфункції, що доводить патоморфологічна картина внутрішніх органів.
Моделювання запального процесу в черевній порожнині супроводжується суттєвими змінами протеолітичної активності очеревини відносно всіх основних білкових фракцій. У тварин основної групи, на відміну від групи порівняння, відмічається вірогідне зростання лізису альбуміну та казеїну впродовж усього терміну дослідження. Протеолітична активність колагену в обох дослідних групах, навпаки, на 48-му годину вірогідно знижується.
Моделювання ГПП на тлі злоякісного новоутворення товстої кишки призводить до зростання лізису низько- та високомолекулярних білків, фібринолітичної активності очеревини із переважанням неферментативного фібринолізу, що вказує на знижені адгезивні властивості останньої.
Аналізуючи результати проведеного мікробіологічного дослідження, слід зазначити, що розвиток ГПП на тлі раку товстої кишки впродовж 48 год характеризується вірогідним збільшенням кількості висіяних штамів K. pneumoniae, мікроорганізмів роду Proteus, дріжджоподібних грибів роду Candida, ростом S. aureus, а також зростанням популяційного рівня E. coli, K. pneumoniae, мікроорганізмів роду Proteus та Streptococcus, дріжджоподібних грибів роду Candida.
Висновки
1. Для ГПП, який виник внаслідок ускладнення раку товстої кишки, характерна менша адгезивна здатність очеревини, що патоморфологічно доводить нашарування незначної кількості фібрину та лейкоцитів на вісцеральній поверхні внутрішніх органів, а також вірогідне переважання показників фібринолітичної і протеолітичної активності очеревини із негативною динамікою впродовж усього терміну дослідження.
2. Сформований ГПП на тлі раку товстої кишки протягом 48 год характеризується вірогідним збільшенням кількості висіяних штамів K. pneumoniae, мікроорганізмів роду Proteus, дріжджоподібних грибів роду Candida, ростом S. aureus, а також зростанням популяційного рівня E. coli, K. pneumoniae, мікроорганізмів роду Proteus та Streptococcus, дріжджоподібних грибів роду Candida.
3. Наявність злоякісного новоутворення товстої кишки за ГПП характеризується появою дрібновогнищевих осередків центролобулярного колікваційного некрозу печінкової тканини, підвищенням відсотка колабованих клубочків ниркової тканини, що значно обтяжує перебіг печінково-ниркової дисфункції при цьому ускладненні.
Перспективність дослідження
Вважаємо за доцільне дослідити патоморфологічні особливості внутрішніх органів хворих на ГПП, який виник внаслідок ускладнення раку товстої кишки.
Список використаної літератури
1. Бойко В.В., Криворучко І.А., Тесленко С.М., Сивожелізов А.В. (2008) Поширений гнійний перитоніт. Прапор, Харків, 280 с.
2. Василик В.М. (2006) Моделювання калового перитоніту у білих щурів. Вісн. пробл. біол. мед., 2: 417–418.
3. Галайчук І.Д., Дрижак В.І., Домбрович М.І. та ін. (2008) Порівняльний аналіз результатів діагностики та лікування хворих на колоректальний рак. Онкологія, 10(1): 125–129.
4. Гресько М.М., Стасишена О.В., Колібаба С.В. (2014) Сучасні діагностичні критерії гострого перитоніту. Наук. вісн. Міжнар. гуманітарного університету, 7: 13–14.
5. Гушул І.Я., Іващук І.О., Давиденко І.С. та ін. (2015) Моделювання раку товстої кишки. Клін. експерим. патологія, XIV (1(51): 44–46.
6. Гушул І.Я., Іващук О.І., Бодяка В.Ю. (2015) Особливості перебігу гострого поширеного перитоніту онкологічного ґенезу. Буковинський медичний вісник, 19(2(74): 62–65.
7. Кухарчук О.Л. (1996) Патогенетична роль та методи корекції інтегративних порушень гормонально-месенджерних систем регуляції гомеостазу натрію при патології нирок [Дис…. д.мед. наук]. Одеса: Одеський державний медичний університет, 300 с.
8. Antadze A.A. (2013) Surgical treatment for complicated forms of colorectal cancer. Georgian Med. News, 225: 7–11.
Патоморфологические изменения внутренних органов при остром распространенном перитоните на фоне рака толстой кишки в эксперименте
Резюме. В статье представлены результаты экспериментального исследования патоморфологических изменений внутренних органов, а также динамики фибринолитической и протеолитической активности брюшины, видового состава и популяционного уровня микроорганизмов перитонеального экссудата при остром распространенном перитоните на фоне злокачественного новообразования толстой кишки. Полученные результаты патоморфологического исследования указывают на появление мелкоочаговых зон центролобулярного коликвационного некроза печеночной ткани, повышение процента колабированных клубочков почечной ткани. Наличие злокачественного новообразования толстой кишки при остром распространенном перитоните приводит к достоверному превосходству показателей фибринолитической и протеолитической активности брюшины с негативной динамикой на протяжении всего времени исследования. Такой «онкологический перитонит» характеризуется достоверным увеличением количества высеянных штаммов K. pneumoniae, микроорганизмов рода Proteus, дрожжеподобных грибов рода Candida, ростом S. aureus, а также увеличением популяционного уровня E. coli, K. pneumoniae, микроорганизмов рода Proteus и Streptococcus, дрожжеподобных грибов рода Candida.
злокачественное новообразование толстой кишки, острый распространенный перитонит.
Адреса:
Гушул Іван Ярославович
58000, Чернівці, вул. Героїв Майдану, 53/35
Тел.: (095) 888-58-40
E-mail: ivanhushul@ukr.net














Leave a comment