Прояви ранньої антрациклінової кардіотоксичності у хворих на рак грудної залози, які отримують поліхіміотерапію
Аскольский А.В.1, Сивак Л.А.1, Жарінов О.Й.2, Антомонов М.Ю.3, Шевчук Л.А.1
- 1Національний інститут раку, Київ
- 2Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 3ДУ «Інститут громадського здоров’я ім. О.М. Марзєєва НАМН України», Київ
Резюме. Прояви ранньої антрациклінової кардіотоксичності у хворих на рак грудної залози, які отримують поліхіміотерапіюВідомо, що застосування доксорубіцину в кумулятивній дозі 450 мг/м2 супроводжується зростаючим ризиком розвитку систолічної дисфункції міокарда і, як наслідок, серцевої недостатності. Водночас більшість пацієнток з раком грудної залози на ранніх стадіях сумарно отримують не більше 300 мг/м2 доксорубіцину. З метою вивчення кардіотоксичності низьких кумулятивних доз доксорубіцину в дослідження включено 50 хворих на рак грудної залози II і III стадії, які отримали 6 циклів стандартної антрациклінової поліхіміотерапії (ПХТ) у рамках комплексного лікування за радикальною програмою. До початку спеціального лікування, на етапах хіміотерапії та через 3 міс після останнього циклу ПХТ проведено комплексне обстеження серцево-судинної системи: вимірювання артеріального тиску, частоти серцевих скорочень, електрокардіографія, ехокардіографія. На етапах лікування та через 3 міс після останньої ПХТ у 8 (16%) пацієнток зареєстровано появу синусової тахікардії, у 11 (22%) — артеріальної гіпертензії ІІ ступеня, у 13 (26%) — подовження коригованого інтервалу Q–T (за даними електрокардіографії), у 15 (30%) — діастолічної дисфункції 1-го типу (за даними допплерехокардіографії). Натомість, використання доксорубіцину в низьких кумулятивних дозах не впливало на систолічну функцію міокарда. Отримані результати дають підстави для пошуку шляхів профілактики кардіотоксичності доксорубіцину.

Вступ
У 2012 р. в 38 країнах Європи, включаючи Україну, зареєстровано 364,4 тис. нових випадків раку грудної залози (РГЗ), а за показником захворюваності (108,8 випадку на 100 тис. жіночого населення) ця хвороба займає перше місце серед усіх онкологічних нозологічних форм [1]. У більшості випадків хворі з ранньою стадією РГЗ отримують неоад’ювантну та/або ад’ювантну поліхіміотерапію (ПХТ) на основі антрациклінових антибіотиків, а саме доксорубіцину [2].
Доксорубіцин уперше виділений з бактерії Streptomyces peucetius компанією «Farmitalia Research Laboratories» в Мілані, Італія, на початку 1960-х років, а в 1974 р. схвалений для застосування в США [3]. Але, на жаль, застосування доксорубіцину обмежене кумулятивно залежною кардіальною токсичністю, яка може призводити до застійної серцевої недостатності та дилатаційної кардіоміопатії. Порушення клітинних структур і функцій призводить до зниження скоротливості та розтяжності міокарда, і цей ефект посилюється при збільшенні тривалості дії препарату [4]. Залежно від термінів розвитку і механізму ушкоджувальної дії, кардіотоксичність буває гострою та відтермінованою (кумулятивною). Гостра кардіотоксичність проявляється у момент введення хіміопрепарату або протягом тижня. Її можливими ознаками є синусова тахікардія, аритмії, шлуночкова тахікардія. Втім частота симптомної гострої кардіотоксичності не перевищує 1%, і вона проходить після припинення введення антрациклінів.
Відтерміновану токсичність поділяють на ранню, таку, що діагностується впродовж першого року (до 1 року), і пізню — в період від 1 до 30 років. Основним її проявом є порушення скоротливої здатності міокарда. Наголосимо, що дисфункція шлуночків серця, серцева недостатність і аритмії можуть виникати через роки після проведення ПХТ [5].
Загалом, РГЗ є наразі однією з найкраще вивчених нозологічних одиниць в онкології. Завдяки сучасному комплексному лікуванню за радикальною програмою з використанням оперативного втручання, антрациклінової хіміотерапії, променевої терапії, гормонотерапії більшість жінок із раннім РГЗ отримали шанс на одужання. Відтак, дедалі більш актуальним стає питання моніторингу функціонального стану серцево-судинної системи протягом та після спеціального лікування для своєчасної діагностики та лікування серцево-судинних ускладнень [6]. Зважаючи на це, метою дослідження була оцінка кардіотоксичності стандартної антрациклінової ПХТ у хворих на РГЗ ранньої стадії.
Об’єкт і методи дослідження
У дослідження включено 59 жінок із вперше виявленим РГЗ II і ІІІ стадії, яким показане комплексне лікування за радикальною програмою. Усім пацієнткам була призначена стандартна нео- та/або ад’ювантна ПХТ, променева терапія, оперативне лікування, гормонотерапія при люмінальному типі РГЗ [7]. Кожна пацієнтка отримала загалом 6 циклів ПХТ за стандартною схемою FАС (циклофосфамід 500 мг/м2 в 1-й день внутрішньовенно, доксорубіцин 50 мг/м2 в 1-й день циклу внутрішньовенно, 5-флуороурацил 500 мг/м2 в 1-й день циклу внутрішньовенно). Таким чином, прижиттєва кумулятивна доза доксорубіцину у всіх пацієнток становила 300 мг/м2. Усім пацієнткам виконували радикальне оперативне лікування (мастектомія або квадрантектомія чи секторальна резекція з лімфаденектомією). Кінцевим етапом комплексного лікування була променева терапія на гамма-терапевтичному апараті «THERATRON» (сумарна вогнищева доза 40–42 Гр). Усі етапи обстеження і лікування здійснювалися у профільних відділеннях Національного інституту раку у 2010–2014 рр.
Критерії включення пацієнтів у дослідження:
1. Письмова згода на участь у дослідженні, бажання та можливість виконання процедур дослідження та спостереження після завершення лікування.
2. Морфологічно підтверджений РГЗ II або III стадії, який підлягає комплексному лікуванню за радикальною програмою.
3. Показана нео- та/або ад’ювантна ПХТ за схемою FAC (5-флуороурацил, доксорубіцин, циклофосфамід) загальною кількістю 6 циклів.
4. Показана ад’ювантна променева терапія.
Критерії невключення пацієнтів у дослідження:
1. Хіміотерапія або променеве лікування в анамнезі.
2. Використання в лікуванні трастузумабу.
3. Ад’ювантна променева терапія на лінійному прискорювачі.
4. Будь-яке супутнє захворювання в стадії декомпенсації.
5. Наявність клінічно значущої кардіоваскулярної патології.
Критерії виключення пацієнток з дослідження на етапах спостереження:
1. Проведення менше або більше 6 циклів ПХТ за схемою FAC.
2. Зміна схеми хіміотерапії.
3. Непроведення ад’ювантної променевої терапії.
9 пацієнток у процесі лікування вибули з дослідження через появу критеріїв виключення: 2 пацієнтки пройшли менше 6 циклів ПХТ за протоколом FAC, у 5 хворих змінено схему ПХТ через прогресування захворювання, 2 пацієнтки пройшли променеву терапію на лінійному прискорювачі. Таким чином, у підсумку було проаналізовано результати обстеження та лікування 50 пацієнток.
Вік учасниць на момент залучення в дослідження становив 31–67 років, середній вік — 53,14±1,2 року. Усі пацієнтки, включені в дослідження, за результатами вихідного клініко-інструментального обстеження не мали хвороб серцево-судинної системи, зокрема стенокардії чи інших клінічних форм ішемічної хвороби серця, артеріальної гіпертензії ІІІ ступеня, серцевої недостатності ІІ–ІІІ стадій, зниження фракції викиду лівого шлуночка (ФВЛШ) <50%, гемодинамічно значущих вад серця, хронічних порушень серцевого ритму.
Перед кожним циклом ПХТ, а також через 3 міс після ії завершення в рамках загальноклінічного обстеження у всіх пацієнток реєстрували рівень артеріального тиску і частоту серцевих скорочень (ЧСС). За необхідності корекції підвищеного рівня артеріального тиску призначали еналаприл, починаючи з дози 5 мг/добу, з можливістю титрування до максимальної дози 20 мг/добу. У всіх зареєстрованих випадках синусової тахікардії потреби у спеціальному лікуванні не було.
Електрокардіографію (ЕКГ) проводили з використанням діагностичного комплексу CARDIO (ТОВ «MIDA», Україна) до початку ПХТ, перед 2-м, 4-м, 6-м циклами і через 3 міс після завершення ПХТ. Здійснювали стандартні виміри тривалості інтервалів та амплітуди зубців ЕКГ. Коригований інтервал Q–T оцінювали за формулою Базетта:
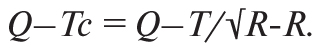
Подовження інтервалу Q–T діагностували у випадку, якщо тривалість Q–Tс перевищувала 460 мс.
Трансторакальну ехокардіографію (ехоКГ) за стандартною методикою, а також допплерівську ехоКГ із застосуванням кардіологічного датчика з частотною характеристикою 2,0–4,0 МГц виконували на ультразвуковому сканері NEMIO XG («Toshiba Medical System Corporation», Японія). Визначали кінцево-діастолічний та кінцево-систолічний об’єм лівого шлуночка (ЛШ), кінцево-діастолічний розмір ЛШ, об’єм лівого передсердя, діаметр аорти, розраховували ФВЛШ.
Для оцінки діастолічної функції ЛШ використовували допплер-ехоКГ в імпульсному режимі. Вивчали швидкість трансмітрального кровотоку із визначенням максимальної швидкості раннього (хвиля Е) і пізнього (хвиля А) діастолічного наповнення ЛШ та розраховували їх співвідношення (Е/А). Допплер-ехоКГ-дослідження передбачало також визначення періоду сповільнення піку раннього наповнення ЛШ (DT). Інтерпретацію показників здійснювали за рекомендаціями робочої групи Європейського кардіологічного товариства [8]. Трансторакальну ехоКГ виконували до лікування, перед 6-м циклом ПХТ та через 3 міс спостереження.
Виявлені побічні явища хіміотерапії з боку серцево-судинної системи оцінювали за шкалою СTCAE 4.0 [9]. Первинна статистична обробка кількісних показників включала розрахунок середнього арифметичного (M), похибки середньоарифметичного значення (m). Взаємозв’язок між кількісними змінними визначали за допомогою парного коефіцієнта кореляції Пірсона. Математичну обробку отриманих результатів виконували з використанням стандартного статистичного пакета STATISTICA 8.0.
Результати та їх обговорення
Здійснено аналіз результатів комплексного обстеження серцево-судинної системи в динаміці протягом стандартного спеціального лікування хворих на РГЗ. ЧСС протягом всього періоду спостереження коливалася від 57 до 89 уд./хв (рис. 1).
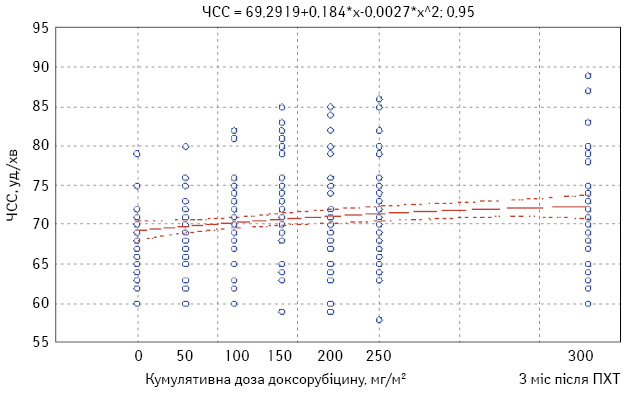
У 8 (16%) пацієнток протягом ПХТ зареєстрована синусова тахікардія, серед них у 2 пацієнток — після 2-го циклу, у 6 пацієнток — після 5-го циклу; вона зберігалася протягом наступних 6 циклів хіміотерапії. Через 3 міс після завершення ПХТ синусова тахікардія зникла у 5 пацієнток, зберігалася у 3 хворих. У табл. 1 наведено показники ЧСС, оціненого перед кожним циклом ПХТ, і через 3 міс після завершення лікування.
Таблиця 1. Середня ЧСС на етапах ПХТ
| Цикли терапії |
Перед 1-м |
Перед 2-м |
Перед 3-м | Перед 4-м | Перед 5-м | Перед 6-м | 3 міс після ПХТ |
| Середня ЧСС, уд./хв | 69,2±0,5 | 69,2±0,7 | 69,9±0,7 | 70,1±0,8 | 70,4±0,9 | 71,6±0,9 | 72,4±0,9 |
На етапах ПХТ здійснювали також вимірювання артеріального тиску. Рівень систолічного артеріального тиску під час ПХТ коливався в межах від 110 до 150 мм рт. ст. (рис. 2), діастолічного — від 70 до 90 мм рт. ст. (рис. 3).
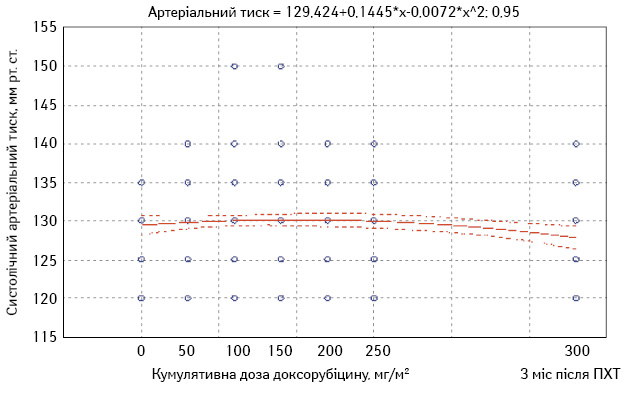
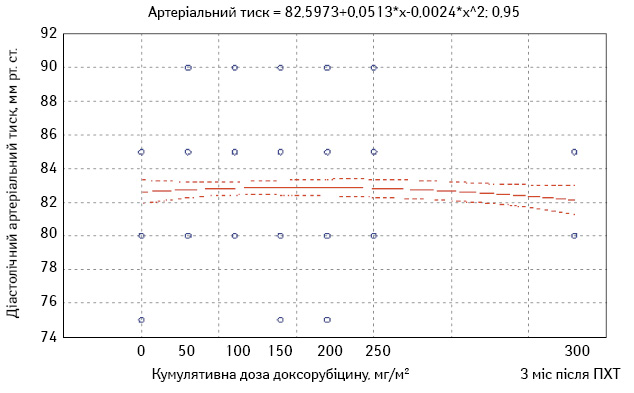
При вихідному дослідженні у всіх пацієнток зареєстровано нормальні значення систолічного і діастолічного артеріального тиску. У 11 (22%) хворих на етапах ПХТ виявлено артеріальну гіпертензію ІІ ступеня. У всіх випадках у пацієнтів з артеріальною гіпертензією на фоні застосування еналаприлу вдалося досягнути цільових рівнів артеріального тиску, що дало змогу не відтерміновувати ПХТ і не знижувати дози її компонентів. У табл. 2 наведені середні значення систолічного і діастолічного тиску на етапах ПХТ.
Таблиця 2. Середні рівні артеріального тиску на етапах ПХТ
| Термін обстеження | Систолічний тиск, мм рт. ст. | Діастолічний тиск, мм рт. ст. |
| Перед 1-м циклом | 128,9±0,7 | 82,5±0,5 |
| Перед 2-м циклом | 129,4±0,7 | 82,2±0,4 |
| Перед 3-м циклом | 131,2±0,9 | 83,8±0,5 |
| Перед 4-м циклом | 131,0±0,8 | 83,1±0,5 |
| Перед 5-м циклом | 130,3±0,7 | 82,4±0,5 |
| Перед 6-м циклом | 128,4±0,8 | 82,6±0,4 |
| Через 3 міс після ПХТ | 128,1±0,7 | 82,2±0,4 |
При аналізі даних ЕКГ в динаміці протягом хіміотерапевтичного лікування патологічні зміни виявлено у 8 (16%) пацієнток. У 4 хворих спостерігали виражене зниження амплітуди комплексів QRS, депресію сегмента ST на ≥1 мм відзначено в 1 пацієнтки, появу блокади ніжок пучка Гіса — у 3 хворих. Слід зазначити, що неспецифічні патологічні зміни на ЕКГ зареєстровані перед 2-м циклом у 3 хворих, перед 6-м циклом — у 4, через 3 міс після останнього курсу ПХТ — лише в 1 хворої.
Окрему увагу приділено вивченню змін тривалості інтервалу Q–Tc. За весь період спостереження серед усіх учасниць мінімальне значення тривалості інтервалу Q–Tc становило 321 мс, максимальне — 486 мс (рис. 4).
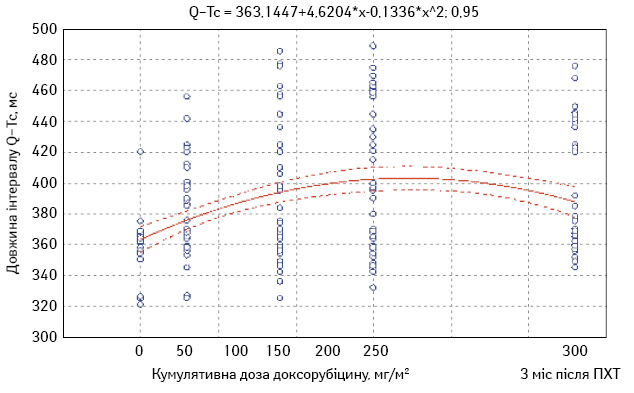
До початку лікування у всіх пацієнток довжина коригованого інтервалу Q–Tc була в межах норми. У 13 (26%) хворих на фоні ПХТ встановлено збільшення тривалості коригованого інтервалу Q–T (у 10 пацієнток — I ступеня, у 3 пацієнток — II ступеня). У табл. 3 наведено показники середнього значення тривалості Q–Tc до лікування, на етапах ПХТ і через 3 міс після завершення лікування.
Таблиця 3. Середнє значення тривалості інтервалу Q–Tc на етапах ПХТ
| Цикли терапії | Перед 1-м | Перед 2-м |
Перед 4-м | Перед 6-м | 3 міс після ПХТ |
| Тривалість Q–Tc, мс | 361±1,9 | 378±4,3 | 393±6,1 | 401±6,9 | 387,9±5,2 |
Отримані дані свідчать про поступове збільшення тривалості інтервалу Q–Tc на фоні ПХТ, тобто з підвищенням кумулятивної дози доксорубіцину. Але через 3 міс після завершення хіміотерапії фіксували зменшення тривалості інтервалу Q–Tc, яке, втім, не досягло початкового рівня.
За даними ехоКГ-дослідження, у жодної пацієнтки ФВЛШ істотно не змінилася після 5 циклів ПХТ. Але в 1 хворої відмічено зниження ФВЛШ на 13% від вихідного рівня через 3 міс після закінчення ПХТ, що відповідає I ступеню систолічної дисфункції за шкалою CTCAE 4.0. Середні значення ФВЛШ перед, протягом та після ПХТ наведено в табл. 4.
Таблиця 4. Середні значення ФВЛШ на етапах ПХТ
| Цикли терапії | Перед 1-м | Перед 6-м | 3 міс після ПХТ |
| ФВЛШ, % | 57,5±0,2 | 55,9±0,3 | 55,3±0,2 |
Таким чином, даних про значущі порушення систолічної функції ЛШ при кумулятивній дозі доксорубіцину 300 мг/м2 не отримано. Натомість, на фоні ПХТ у 15 (30%) пацієнток спостерігали зміни показників діастолічної функції серця.
Про діастолічну дисфункцію 1-го типу свідчили такі ознаки: подовження часу ізоволюмічного розслаблення, підвищення швидкості трансмітрального кровотоку в фазу систоли передсердь, зниження піку Е, зменшення співвідношення Е/А. Слід зазначити, що у 9 пацієнток діастолічну дисфункцію 1-го типу встановлено перед 6-м циклом, у 6 — через 3 міс після завершення ПХТ. Пацієнткам з ознаками діастолічної дисфункції було рекомендоване подальше спостереження і, за необхідності, лікування у кардіолога.
Протягом 3 міс після останнього курсу ПХТ у більшості пацієнток виявлено зникнення синусової тахікардії і артеріальної гіпертензії, на відміну від подовження інтервалу Q–Tc та діастолічної дисфункції 1-го типу.
Відповідно до результатів нашого дослідження, довжина інтервалу Q–Tc наростала з кожним наступним циклом ПХТ, залишаючись в межах норми протягом всього періоду спостереження у 17 (34%) хворих, досягла I ступеня у 10 (20%) пацієнток і II ступеня — у 3 (6%) хворих. Пік подовження інтервалу Q–Tc зафіксовано через 1 міс після введення останньої дози доксорубіцину (рис. 4). З огляду на дані кореляційного аналізу та терміни виникнення, подовження інтервалу Q–Tc I і II ступеня у 13 (26%) пацієнток можна розглядати як ранні ознаки кардіотоксичності доксорубіцину. Аналогічні дані про діагностичну значущість інтервалу Q–Tc отримано також при дослідженні кардіотоксичності деяких інших цитостатиків і таргетних препаратів [10]. Дані літератури і власний досвід свідчать, що збільшення тривалості інтервалу Q–Tc, навіть якщо показник не виходить за межі норми, може розцінюватися як ранній прогностичний маркер кардіотоксичності [11].
Слід зазначити, що у жодної пацієнтки не відмічено розгорнутих проявів кардіотоксичності доксорубіцину. Класичним критерієм останньої є застійна серцева недостатність, яка виникає в 1–2% випадків при кумулятивній дозі 300 мг/м2, і частота якої поступово зростає при підвищенні загальної кумулятивної дози до 450–550 мг/м2. При подальшому збільшенні дози ризик виникнення серцевої недостатності зростає стрімко [12]. Це ускладнення переважно асоціюється зі зменшенням ФВЛШ у разі використання доксорубіцину у високих кумулятивних дозах. У нашому дослідженні зниження ФВЛШ I ступеня фіксували лише в 1 пацієнтки з 50 досліджуваних, причому воно не супроводжувалося появою клінічних ознак серцевої недостатності.
Важливе значення можуть мати результати оцінки діастолічної функції серця, зміни якої можуть передувати формуванню клінічних проявів серцевої недостатності. Отримані результати свідчать про виникнення доклінічної діастолічної дисфункції серця 1-го типу при низьких кумулятивних дозах доксорубіцину через 3 міс після останньої дози препарату. За даними ехоКГ, перед 6-м циклом ПХТ у 9 (18%) пацієнток діагностували діастолічну дисфункцію 1-го типу. Через 3 міс після введення останньої дози доксорубіцину діагностовано 6 нових випадків розвитку діастолічної дисфункції 1-го типу та підтверджено ії наявність у всіх 9 попередньо виявлених.
Терміни появи патологічних змін ЕКГ і діастолічної функції серця в обстежених хворих аналогічні даним ретроспективного аналізу трьох клінічних досліджень за участю 630 пацієнток, пролікованих доксорубіцином, в якому пік антрациклінової кардіотоксичності відмічали через 2–4 міс після останньої дози доксорубіцину [13, 14].
Висновки
На підставі результатів власного дослідження та аналізу даних літератури можна зробити такі висновки:
1. Проведення 6 циклів стандартної ПХТ за схемою FAC у хворих на РГЗ в рамках лікування за радикальною програмою супроводжується розвитком серцево-судинних ускладнень: синусової тахікардії — у 16% хворих, артеріальної гіпертензії — у 22%, подовження інтервалу Q–Tc — у 26%, діастолічної дисфункції — у 30%.
2. Зазначені прояви кардіотоксичності ПХТ не призвели у жодного пацієнта до редукції доз або відтермінування циклів хіміотерапії.
3. Синусова тахікардія і артеріальна гіпертензія, очевидно, пов’язані з інтоксикаційним синдромом на фоні ПХТ і не є специфічними проявами кардіотоксичності доксорубіцину.
4. Специфічними проявами ранньої антрациклінової кардіотоксичності при кумулятивній дозі 300 мг/м2 є подовження інтервалу Q–Tc і розвиток діастолічної дисфункції 1-го типу при збереженій систолічній функції міокарда.
Отримані результати дають підґрунтя для пошуку шляхів специфічної профілактики кардіотоксичності доксорубіцину.
Список використаної літератури
1. Ferlay J., Steliarova-Foucher E., Lortet-Tieulent J. et al. (2012) Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur. J. Cancer., 49: 1374–1403.
2. Siegel R., DeSantis C., Virgo K. et al. (2012) Cancer treatment and survivorship statistics, 2012. Cancer J. Clin., 62: 220–241.
3. Ewer M.S., Ewer S.M. (2015) Cardiotoxicity of anticancer treatments. Nat. Rev. Cardiol., 12: 620.
4. Zhang S., Liu X., Bawa-Khalfe T. et al. (2012) Identification of the molecular basis of doxorubicin-induced cardiotoxicity. Nat. Med.,18: 1639–1642.
5. Lenihan D.J., Oliva S., Chow E.J., Cardinale D. (2013) Cardiac toxicity in cancer survivors. Cancer, 119(11): 2131–2142.
6. Zamorano J.L., Lancellotti P., Rodriguez D. (2016) ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. Eur. Heart J., 37: 2768–2801.
7. Наказ МОЗ України від 30.06.2015 № 396 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при раку молочної залози».
8. Plana J.C., Galderisi M., Barac A. et al. (2014) Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur. Heart J. Cardiovasc. Imaging, 15: 1063–1093.
9. Trotti A., Colevas A.D., Setser A. et al. (2008) CTCAE v 4.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin. Radiat. Oncol., 13(3): 176–181.
10. Sawaya H., Sebag I.A., Plana J.C. et al. (2012) Assessment of echocardiography and biomarkers for the extended prediction of cardiotoxicity in patients treated with anthracyclines, taxanes, and trastuzumab. Circ. Cardiovasc. Imaging, 5: 596–603.
11. Voigt J.U., Pedrizzetti G., Lysyansky P. et al. (2015) Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur. Heart J. Cardiovasc. Imaging,16: 1–11.
12. Perez E.A., Suman V.J., Davidson N.E. et al. (2008) Cardiac safety analysis of doxorubicin and cyclophosphamide in the North Central Cancer Treatment Group N9831 adjuvant breast cancer Trial. J. Clin. Oncol., 26: 1231–1238.
13. Ryberg M., Nielsen D., Cortese G. et al. (2008) Insight into epirubicin cardiac toxicity: competing risks analysis of 1097 breast cancer patients. J. Nat. Cancer Inst.,100.
14. Swain S.M., Whaley F.S., Ewer M.S. (2003) Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer, 97: 2869–2879.
Проявления ранней антрациклиновой кардиотоксичности у больных раком грудной железы, получающих полихимиотерапию
2Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
3ГУ «Институт общественного здоров’я им. А.М. Марзеева
НАМН Украины», Киев
Резюме. Известно, что использование доксорубицина в кумулятивной дозе ≥450 мг/м2 сопровождается риском развития систолической дисфункции миокарда и, как следствие, сердечной недостаточности. В то же время большинство пациенток с раком грудной железы на ранних стадиях суммарно получают не более 300 мг/м2 доксорубицина. С целью изучения кардиотоксичности низких кумулятивных доз доксорубицина в исследование включено 50 больных раком грудной железы II и III стадии, которые получили 6 циклов стандартной антрациклиновой полихимиотерапии (ПХТ) в рамках комплексного лечения по радикальной программе. К началу специального лечения, на этапах химиотерапии и через 3 мес после последнего цикла ПХТ проведено комплексное обследование сердечно-сосудистой системы: измерение артериального давления, частоты сердечных сокращений, электрокардиография, эхокардиография. На этапах лечения и через 3 мес после окончания ПХТ у 8 (16%) пациенток зарегистрировано появление синусовой тахикардии, у 11 (22%) — артериальной гипертензии II степени, у 13 (26%) — удлинение корригированного интервала Q–T (по данным электрокардиографии), у 15 (30%) — диастолической дисфункции 1-го типа (по данным допплерэхокардиографии). В свою очередь, использование доксорубицина в низких кумулятивных дозах не влияло на систолическую функцию миокарда. Полученные результаты дают основания для поиска путей профилактики кардиотоксичности доксорубицина.
Ключевые слова: рак грудной железы, полихимиотерапия, антрациклины, кардиотоксичность, корригированный интервал Q–T, диастолическая дисфункция левого желудочка.
Manifestations of early anthracycline cardiotoxicity in patients with breast cancer receiving combination chemotherapy
2Shupyk National Medical Academy of Postgraduate Education, Kyiv
3SI «O.M. Marzeiev Institute for Public Health of the NAMS of Ukraine», Kyiv
Summary. It is well known that the use of a cumulative doxorubicin doses ≥450 mg/m2 is accompanied by increased risk of systolic dysfunction and as consequence heart failure. However, most patients with breast cancer at early stages receive no more than 300 mg/m2 of doxorubicin. 50 patients with breast cancer stage II and III were included to the study in order to investigate cardiotoxicity of the low cumulative doxorubicin dose. Each patient received 6 cycles of the standard anthracycline-containing chemotherapy as a part of comprehensive radical treatment. Before anticancer treatment, during chemotherapy and 3 months after the last dose examination of the cardiovascular system (blood pressure, heart rate, electrocardiography, echocardiography) were conducted for all the patients. During the chemotherapy and 3 months after the last dose the appearance of sinus tachycardia was registered in 8 (16%) patients, arterial hypertension II degree — in 11 (22%) patients, corrected Q–T interval prolongation (according to electrocardiography) — in 13 (26%) patients, diastolic dysfunction type 1 (according to Doppler echocardiography) — in 15 (30%) patients. Instead, usage of small doxorubicin cumulative doses had no effect on systolic function. The results provide grounds for searching ways of doxorubicin cardiotoxicity prevention.
Key words: breast cancer, chemotherapy, anthracyclines, cardiotoxicity, corrected Q–T interval, diastolic left ventricular dysfunction.
Адреса:
Аскольський Антон В’ячеславович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: anton.askolsky@gmail.com














Leave a comment