Визначення вмісту у пухлинах головного мозку клітин, що мають молекулярні маркери стовбурових клітин
Лісяний М.І., Бельська Л.М., Потапова А.Г., Лісяний О.М.
Резюме. Стовбурові CD133+ пухлинні клітини головного мозку характеризуються необмеженою здатністю до самопідтримки, утворення нових пухлин при трансплантації в експерименті імплантації, хіміо- та радіорезистентності. Водночас ще недостатньо вивчена експресія інших маркерів стовбурових клітин CD34, CD90 та CD15 молекул на клітинах головного мозку різного походження та ступеня злоякісності. Метою роботи було вивчення експресії маркерів стовбурових клітин CD133, CD90, CD34 та CD15 молекул на клітинах пухлин головного мозку різного походження та ступеня злоякісності. Досліджено біоптати (115 зразків) пухлин головного мозку різного генезу. Фрагменти пухлини механічно подрібнювали та готували суспензії клітин стандартної концентрації (1•106/мл) у поживному середовищі Ігла. Вивчення вмісту стовбурових пухлинних клітин проводили за допомогою моноклональних антитіл до молекул CD133, CD15, CD34, CD90 виробництва «Beckman Coulter» на проточному цитофлюориметрі «FC-500» («Beckman Coulter», США). Отримані результати опрацьовували методами математичної статистики. У пухлинах головного мозку різного походження містяться стовбурові прогеніторні клітини, на яких експресовані CD133, CD34, CD15 та CD90 молекули. Ці клітини визначаються у злоякісних гліомах у 1,5–2,0 раза частіше, ніж у доброякісних, що дозволяє стверджувати про їхню онкостимулювальну роль у канцерогенезі, а саме про участь мезенхімальних та гемопоетичних прогеніторних клітин в ангіогенезі та інфільтративному рості цих пухлин. Вміст стовбурових CD133+ клітин у межах одного гістологічного типу пухлин досить широко коливається — від відсутності до великого відсотка клітин. У пухлинах головного мозку визначаються клітини, що експресують маркери нейрональних, гемопоетичних та мезенхімальних типів стовбурових клітин, вміст яких залежить від походження та ступеня злоякісності новоутворень.
 Останнім часом велику увагу приділяють вивченню клітин, які виділяються з різних пухлин, в тому числі злоякісних пухлин головного мозку, що мають властивості стовбурових пухлинних клітин (СПК). СПК головного мозку характеризуються необмеженою здатністю до самопідтримки, утворення пухлини при ортотопічній імплантації, генетичних пошкоджень, генерації пухлинних клітин [1]. СПК володіють високою здатністю до інвазії, стимулюють формування кровоносних судин і є ініціювальним чинником рухливості клітин [2, 3]. Крім того, вони беруть участь у стимуляції канцерогенезу: з’являється все більше доказів того, що ці клітини призводять до прогресії пухлини [4] і метастазування [5]. Цей тип клітин відповідає за хіміо-, радіорезистентність, рецидивування після хірургічного втручання та променевої терапії.
Останнім часом велику увагу приділяють вивченню клітин, які виділяються з різних пухлин, в тому числі злоякісних пухлин головного мозку, що мають властивості стовбурових пухлинних клітин (СПК). СПК головного мозку характеризуються необмеженою здатністю до самопідтримки, утворення пухлини при ортотопічній імплантації, генетичних пошкоджень, генерації пухлинних клітин [1]. СПК володіють високою здатністю до інвазії, стимулюють формування кровоносних судин і є ініціювальним чинником рухливості клітин [2, 3]. Крім того, вони беруть участь у стимуляції канцерогенезу: з’являється все більше доказів того, що ці клітини призводять до прогресії пухлини [4] і метастазування [5]. Цей тип клітин відповідає за хіміо-, радіорезистентність, рецидивування після хірургічного втручання та променевої терапії.
Слід зазначити, що досі до кінця не з’ясовано панель специфічних маркерів СПК. Показано, що стовбурові клітини, виділені з гліом, експресують маркери CD133, CD105, CD90, CD15, CD24, CD20, CD44, Nanog, Oct 3/4, CXCR4 (CD184), NF (neurofilament protein), GAPDH (human glyceroldehydrodes-3-phosphate dehydrogenase). Крім цього, СПК головного мозку експресують маркери, характерні для нейрональних стовбурових клітин, такі як GFAP (glial fibrillary acid protein), нестин, Sox-2, Misashi-1, Bmi-1, та не експресують ранні (Tuj1) і пізні (NeuN) нейрональні маркери та олігодендрогліальний маркер Oleg-1 [6]. CD133+ клітинний маркер є трансмембранним глікопротеїдом (промінін-1) з п’ятьма трансмембранними доменами і двома великими N-глікозильованими позаклітинними петлями, який локалізується на випинаннях плазматичної мембрани і мікродоменах. Промінін-1 вперше виявлено на гемопоетичних стовбурових CD34+ клітинах, отриманих із фетальної печінки, а в подальшому з крові пуповини і периферичної крові та ембріонального і дорослого мозку. Незважаючи на невідому клітинну функцію промініну-1, він є маркером багатьох ідентифікованих СПК, включаючи СПК гліом, легенів, печінки, передміхурової залози тощо [7, 8].
За допомогою цитофлюорометрії продемонстровано [9, 10], що вміст CD133+ клітин у гліобластомах становив 0,1–46,8%, медулобластомах — 6,1–45,4%, а пілоцитарних астроцитомах — 3,5–37,1%.
Природа та роль CD34+ гемопоетичних клітин досить добре досліджена як при гематологічній, так і онкологічній патології. CD15 глікопротеїн, як відомо, експресується на диференційованих мієлоїдних клітинах, включаючи гранулоцити, моноцити, макрофаги та гладкі клітини, і не виявляється на еритроцитах, тромбоцитах, лімфоцитах та гемопоетичних прогеніторних стовбурових клітинах. Водночас це класичний маркер класичної Ходжкінської лімфоми, до 15% Т-лімфоцитів лімфоми експресують CD15 маркер [11].
Крім того, CD15 молекулу виявляють на клітинах різних епітеліальних пухлин, таких як аденокарцинома легені, товстого кишечнику та грудної залози, саркоми щитоподібної залози, та пухлинах головного мозку, в гліомах, менінгіомах, краніофаренгіомах та зрілих тератомах [12, 13].
CD90 молекула є маркером гемопоетичних, мезенхімальних стовбурових клітин печінки та СПК раку печінки. Показана висока частота виявлення CD90+ клітин при злоякісних гліомах та відсутність цієї популяції клітин при доброякісних астроцитомах і в нормальній тканині [14].
Ще недостатньо вивчена експресія цих маркерів стовбурових клітин на клітинах головного мозку різного походження та ступеня злоякісності. Метою роботи було вивчення експресії маркерів стовбурових клітин CD133, CD90 та CD15 молекул на клітинах пухлин головного мозку різного походження та ступеня злоякісності.
Об’єкт і методи дослідження
Матеріалом дослідження слугували біоптати (115 зразків) пухлин головного мозку різного генезу. Гістологічне дослідження біопсійного матеріалу здійснювали у відділі нейропатоморфології ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» згідно з останньою Міжнародною класифікацією пухлин центральної нервової системи (ЦНС) Всесвітньої організації охорони здоров’я (2007).
Пухлинну тканину з біопсійного матеріалу забирали під час оперативного втручання в середовище Ігла. Фрагменти пухлини механічно подрібнювали ножицями та шляхом пропускання через шприц з товстою голкою готували суспензії клітин стандартної концентрації (1•106/мл) у поживному середовищі Ігла [15]. Життєздатність клітин оцінювали в стандартному тесті за допомогою вітального фарбування розчином 0,2% трипанового синього.
Вивчення вмісту СПК проводили за допомогою моноклональних антитіл до молекул CD133, CD15, CD34, CD90 з використанням подвійних комбінацій моноклональних антитіл виробництва «Beckman Coulter» на проточному цитофлюориметрі «FC-500» («Beckman Coulter», США) за програмою Cytomics CXP Softwar в гейтованому (лімфоцитарному) та негейтованому режимах [16]. Реакцію визначення субпопуляцій стовбурових клітин за допомогою моноклональних антитіл проводили згідно з інструкцією виробників антитіл, інкубуючи 100 мкл пухлинних клітин із певним розведенням антитіл протягом 30 хв та подальшим лізисом домішок еритроцитів лізуючим розчином [17].
Математичну обробку отриманих результатів проводили на персональному комп’ютері з використанням пакета програм «Statistica 6,0» із визначенням середнього та стандартного відхилення (M±SD) та використанням t-критерію Стьюдента. Різницю вважали достовірною при р<0,05.
Результати досліджень
У наших дослідженнях визначали вміст CD133+ клітин у вихідній суспензії пухлин ЦНС різного гістогенезу та різного ступеня злоякісності (рис. 1, 2). Як видно з даних, наведених на рис. 1, у вихідній суспензії клітин пухлин кількість CD133+ клітин була різною, у гліобластомах та анапластичних астроцитомах у всіх досліджуваних зразках перевищувала 3% і становила в середньому 8,92±6,81% в зразках гліобластом та 7,98±4,62% — у зразках анапластичних астроцитом, тоді як у доброякісних астроцитомах виявлено 4,14±3,36%. Велику кількість CD133+ клітин виявляли у медулобластомах — >10%, а у менінгіомах було значно менше цих клітин — 6,41±2,36%, а це свідчить про наявність у різних за природою пухлинах головного мозку клітин, що експресують CD133 маркер СПК.
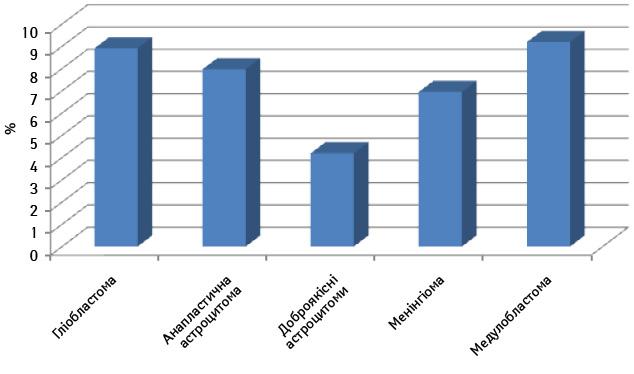
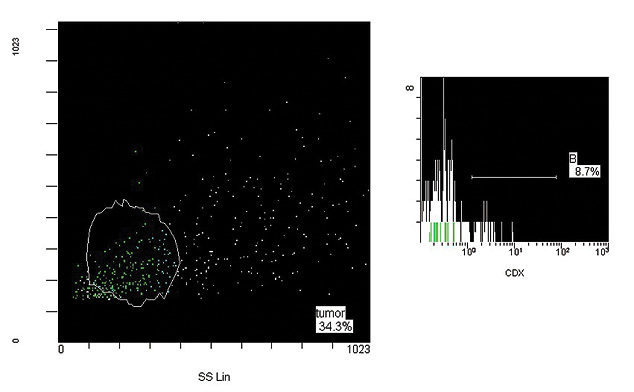
Рис. 2. Гістограма (зразок медулобластоми) CD133+ клітини, вихідна суспензія
Отримані результати збігаються з наведеними вище даними літератури і свідчать на можливий зв’язок цих клітин зі ступенем злоякісності, темпом росту, степенем васкуляризації та іншими біологічними характеристиками пухлин, які можуть бути асоційовані не лише з CD133+ пухлинними клітинами, а й з іншими типами стовбурових клітин організму. При дослідженні вмісту у доброякісних та злоякісних гліальних пухлинах стовбурових гемопоетичних CD34+, мезенхімальних CD90+ та CD15+ клітин була встановлена певна залежність рівня цих клітин від ступеня злоякісності новоутворень (табл. 1).
Таблиця 1. Вміст різних субпопуляцій стовбурових клітин в біоптатах гліом різного ступеня анаплазії
| Тип пухлини | Фенотип пухлин | |||
| CD133+ (n=71) |
CD15+ (n=71) |
CD34+ (n=19) |
CD90+ (n=19) |
|
| Гліоми | 7,64±5,48 | 8,87±3,42 | 5,10±2,76 | 7,24±3,48 |
| Гліома ІІ | 4,14±3,36 | 5,64±2,87 | 2,31±0,71* | 5,24±1,43 |
| Гліома ІІІ–IV | 8,45±5,72 | 10,51±3,69 | 5,54±1,44 | 7,86±2,59 |
*Різниця показників (р<0,05) відносно інших фенотипів клітин у групі гліом II ступеня злоякісності.
Як свідчать дані, наведені в табл. 1, вміст CD34+ клітин у біоптатах злоякісних гліом статистично вірогідно (р<0,05) перевищував відповідні показники, що визначалися у доброякісних астроцитомах. Кількість CD34+ клітин при доброякісному перебігу гліом була вдвічі меншою порівняно з кількістю CD15+, CD90+ та CD133+ клітин, що визначалися у цих пухлинах. При злоякісному перебігу гліом також фіксують зменшення кількості CD34+ клітин в 2 рази порівняно з кількістю CD15+ клітин, в 1,5 раза порівняно з кількістю CD90+ та CD133+ клітин. Вміст CD90+ клітин змінювався залежно від ступеня злоякісності пухлин. Так, у хворих з гліомами ІІ ступеня злоякісності кількість таких клітин становила 5,24±1,43%, що було в 1,5 раза меншим за відповідний показник у хворих з гліомами ІІІ–ІV ступеня злоякісності. Кількісно вміст CD90+ клітин у гліальних пухлинах був подібний до вмісту CD133+ клітин, що наводить на думку, що ці дві молекули можуть бути одночасно присутні на одних і тих самих клітинах.
При дослідженні вмісту СD15+ клітин у суспензії клітин гліальних пухлин різного ступеня злоякісності виявлено, що, по-перше, у гліальних пухлинах їх концентрація найвища, по-друге, при гліомах ІІІ–ІV ступеня злоякісності кількість СD15+ клітин становила 10,51±3,69%, а у біоптатах доброякісних гліом було 5,64±2,87%, а це в середньому вдвічі менше порівняно з кількістю таких клітин при злоякісному перебігу гліом.
Таким чином, у результаті проведених досліджень встановлено, що гліальні пухлини головного мозку інфільтровані стовбуровими клітинами, які мають нейрональні, мезенхімальні та гемопоетичні маркери. При злоякісному перебігу гліом (ІІІ і ІV ступеня злоякісності) у тканині пухлин визначається підвищення порівняно з доброякісними пухлинами вмісту як CD133+ СПК, які можуть призводити до прогресування пухлини [32] і метастазування [33, 34] та зумовлювати хіміо-, радіорезистентність, а також підвищення вмісту CD15+ та CD90+, що може свідчити про наявність у тканині гліом стовбурових клітин гемопоетичного походження. Гліальні пухлини були найменш інфільтровані гемопоетичними CD34+ стовбуровими клітинами, хоча і для них характерна залежність від ступеня злоякісності гліом. Поясненням появи різних типів стовбурових клітин в гліальних пухлинах може бути те, що це необхідно для успішного їх розвитку, формування судинної мережі та інфільтративного росту. Невідомо, що спонукає різні стовбурові клітини накопичуватися у пухлині: чи це певні чинники пухлинних клітин, наприклад хемоатрактанти, чи це чинники CD133+ СПК, яким необхідна кооперація з іншими, не пухлинними стовбуровими клітинами. Привертає до себе увагу ще й той факт, що однотипні за гістологічними характеристиками пухлини можуть мати різний вміст стовбурових клітин, в одних більше, а в інших менше CD133+ клітин (табл. 2).
Таблиця 2. Вміст CD133+ клітин у різних пухлинах головного мозку
| Тип пухлини | Частота виявлення CD133+ клітин | |
| <3% CD133+ клітин |
>3% CD133+ клітин |
|
| Гліобластома (n=24) | 0/24 | 24/24 |
| Анапластична астроцитома (n=12) | 0/12 | 12/12 |
| Фібрилярно-протоплазматична астроцитома (n=5) | 2/5 | 3/5 |
| Медулобластома (n=6) | 0/6 | 6/6 |
| Анапластична олігодендрогліома (n=11) | 0/11 | 11/11 |
| Менінгіома (n=9) | 2/9 | 7/9 |
У пухлинах гліобластом та анапластичних астроцитом у всіх досліджуваних зразках виявляли >3% CD133+ клітин, тоді як у доброякісних гліомах (дифузно-протоплазматичні астроцитоми) вміст CD133+ клітин перевищував 3% у 3 із 5 випадків (67,4%). У пухлинах медулобластом у 100% випадків кількість CD133+ клітин перевищувала 3% і коливалася в межах 3,9–18,7%. Вміст CD133+ клітин у біоптатах менінгіом перевищував 3% у 7 із 9 випадків (77,7%) та в середньому становив 7,96±5,23%. Подібну картину спостерігали з іншими клітинами, на яких експресуються досліджувані маркери.
Отже, проведені дослідження показали, що в пухлинах головного мозку, особливо високого ступеня злоякісності (гліомах та медулобластомах), поряд із CD133+ СПК містяться й інші стовбурові клітини гемопоетичного та мезенхімального походження, які не належать до нервових СПК. Потребує пояснення феномен, чому гемопоетичних CD34+ клітин, з якими пов’язують ангіогенез у пухлинах [18, 19], міститься найменша кількість, тоді як CD15+ клітин (теж гемопоетичного походження) у 2 рази більше. Це можна пояснити тим, що у пухлинній тканині певної кількості можуть бути присутні гранулоцити, на яких також експресується CD15+ молекула. Умовно пухлини головного мозку різного гістологічного походження, а саме гліоми, медулобластоми, менінгіоми, можна поділити на пухлини з високим та низьким рівнем стовбурових клітин, що може бути пов’язане з біологічними особливостями цих пухлин та клінічним перебігом патологічного процесу. Не виключено й інше пояснення: СПК одночасно можуть експресувати як CD133+, CD15+, так і CD90+ молекули, що не дає зробити однозначного висновку про наявність у пухлині різних типів стовбурових клітин [14]. Але враховуючи, що CD34+ клітин у пухлинній тканині у 2 рази менше за інші клітини, можна припустити, що це окремі субпопуляції стовбурових клітин. Отримані дані свідчать не лише про те, що у різних за походженням пухлинах головного мозку містяться стовбурові клітини, а й про те, що можуть бути пухлини однієї гістологічної будови з різним вмістом стовбурових клітин. Це досить складно пояснити, існують різні думки про прогностичне значення стовбурових клітин [20], тому потрібні подальші дослідження з урахуванням особливостей росту та поглибленого вивчення гістологічної будови пухлин і клінічного перебігу захворювання.
Висновки
1. У пухлинах головного мозку різного походження містяться стовбурові прогеніторні клітини, на яких експресовані CD133+, CD34+, CD15+ та CD90+ молекули, що свідчить про можливу присутність у цих пухлинах поряд з нейрональними ще й мезенхімальних та гемопоетичних стовбурових клітин.
2. Стовбурові прогеніторні клітини, на яких експресовані CD133+, CD34+, CD15+ та CD 90+ молекули, виявляють у 1,5–2,0 раза частіше у злоякісних гліомах, ніж у доброякісних, що дозволяє стверджувати про їхню онкостимулювальну роль в канцерогенезі, а саме пов’язувати з участю мезенхімальних та гемопоетичних прогеніторних клітин в ангіогенезі та інфільтративному рості цих пухлин.
3. Вміст стовбурових клітин, на яких експресована CD133+ молекула, досить широко коливається в межах одного гістологічного типу пухлин — від відсутності до великого відсотка (15–20%) клітин (наприклад менінгіоми та доброякісні астроцитоми).
4. Враховуючи, що кількісно вміст CD133+, CD15+ та CD90+ клітин у різних пухлинах головного мозку подібний, не можна виключати припущення, що ці молекули присутні одночасно на одній і тій самій стовбуровій або пухлинній клітині.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Vescovi A.L., Gall R., Reynolds B.A. (2006) Brain tumour stem cells. Nat. Rev. Canser, 6: 425–436.
2. Reya T., Morrison S.J., Clarke I.L., Weissman I.L. (2001) Stem cells, cancer, and cancer stem cells. Nature, 414: 105–111.
3. Clevers H. (2011) The cancer stem ceil: Premises, promises and challenges. Nat. Med., 17: 313–319.
4. Dalerba P., Cho R.W., Rlarke T.W. (2007) Cancer stem cells: Models and concepts. Ann. Rev. Med., 58: 267–284.
5. Wicha M.S. (2006) Cancer stem cells and metastasis: Lethal seeds. Clin. Cancer Res., 12: 5606–5607.
6. Choung Y.K., Tohn T.B., Zaiden N. et al. (2009) Cryopreservation of neurospheres derived from human glioblastoma multiforme. Stem Cells, 27(1): 29–39.
7. Suetsugu A., Nagaki M., Aokil H. et al. (2006) Characterization of CD133+ hepatocellular carcinoma cells as cancer stem/progenitor cells. Biochem. Biophys. Res. Commun., 29(4): 820–824.
8. Galli R., Binda E., Orfanelli U. et al. (2004) Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res., 1(19): 7011–7021.
9. Singh K., Clarke K., Terasaki M. et al. (2003) Identification of a cancer stem cell in human brain tumors. Cancer Res, 63: 5821–5828.
10. Лисяный Н.И. (2011) Иммунология и иммунотерапия опухолей головного мозга. Киев, 189 с.
11. Barry T.S., Jaffe E.S., Sorbara L. et al. (2003) Pittaluga S Peripheral T-cell lymphomas expressing CD30 and CD15. Am. J. Surg. Pathol., 27(12): 1513–1522.
12. Reifenberger G., Sieth P., Niederhaus M.W., Wechsler W. (1992) Expression of CD1 Wechsler 5 in tumours of the nervous system. Histochem. J., 24(11): 890–901.
13. Read T.A., Fogarty M.P., Markant S.L. et al. (2009) Identification of CD15 as a marker for tumor-propagating cells in a mouse model of medulloblastoma. Cancer Cell., 15: 135–147.
14. He J., Liu Y., Zhuet T. et al. (2009) CD90 is identified as a marker for cancer stem cells in primary high-grade gliomas using tissue microarrays. Mol. Cell. Proteomics, 11(6): 145–152.
15. Божкова В.П., Брежетоаский Л.А., Буравлев В.М. (1988) Руководство по культивированию нервной ткани. Методы. Техника. Проблемы. Наука, Москва, 318 с.
16. Lyons A.B., Wong S., Hume D. et al. (1994) Determination of lymphocyte division by flow cytometry. J. Immun. Methods, 171: 131–137.
17. Пинегин Б.В., Ярилин А.А., Симонов А.В. и др. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной системы человека. Пособие для врачей. Москва, 57 с.
18. Doucette T., Rao G., Yang Y. et al. (2011) Mesenchymal stem cells display tumor-specific tropism in an RCAS/Ntv-a glioma model. Neoplasia, 13(8): 716–725.
19. Birnbaum T., Roider J., Schankin C.J. et al. (2007) Malignant gliomas actively recruit bone marrow stromal cells by secreting angiogenic cytokines. J. Neurooncol., 83(3): 241–247.
20. Kim K.J., Lee K.H., Kim H.S. et al. (2011) The presence of stem cell marker-expressing cells is not prognostically significant in glioblastomas. Neuropathol., 31: 494–502.
Определение содержания в опухолях головного мозга клеток, имеющих молекулярные маркеры стволовых клеток
ГУ «Институт нейрохирургии им. акад. А.П. Ромоданова
НАМН Украины», Киев
Резюме. Стволовые CD133+ опухолевые клетки головного мозга характеризуются неограниченной способностью к самоподдержанию, образованию новых опухолей при трансплантации в эксперименте, химио- и радиорезистентностью. Однако еще недостаточно изучена экспрессия других маркеров стволовых клеток CD34, CD90 и CD15 молекул на клетках головного мозга разного происхождения и степени злокачественности. Целью работы было изучение экспрессии маркеров стволовых клеток CD133, CD90, CD34 и CD15 молекул на клетках опухолей головного мозга разного происхождения и степени злокачественности. Исследовано биоптаты (115 образцов) опухолей головного мозга разного генеза. Фрагменты опухоли механически измельчали и готовили суспензии клеток стандартной концентрации (1•10/мл) в питательной среде Игла. Изучение содержимого стволовых опухолевых клеток проводили с помощью моноклональных антител к молекулам CD133, CD15, CD34, CD90 производства «Beckman Coulter» на проточном цитофлюориметре «FC-500» («Beckman Coulter», США). Полученные результаты обрабатывались методами математической статистики. В опухолях головного мозга разного происхождения содержатся стволовые прогениторные клетки, на которых экспрессируются CD133, CD34, CD15 и CD90 молекулы. Данные клетки определяются в злокачественных глиомах в 1,5–2,0 раза чаще, чем в доброкачественных, что позволяет утверждать об их онкостимулирующей роли в канцерогенезе, а именно об участии мезенхимальных и гемопоэтических прогениторных клеток в ангиогенезе и инфильтративном росте этих опухолей. Содержание стволовых CD133+ клеток в пределах одного гистологического типа опухолей достаточно широко колеблется — от отсутствия к большому проценту клеток в ткани. В опухолях головного мозга определяются клетки, которые экспрессируют маркеры нейрональных, гемопоэтических и мезенхимальных типов стволовых клеток, содержание которых зависит от происхождения и степени злокачественности новообразований.
стволовые клетки, CD-маркеры, глиомы, глиобластомы, менингиомы, медулобластомы.
Адреса:
Лісяний Микола Іванович
04050, Київ, вул. П. Майбороди, 32
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України»
Тел.: (044) 483-81-93
E-mail: nimun.neuro@gmail.com














Leave a comment