Особливості життєздатності, експресії білків адгезії та клітинного цитоскелета клітин ліній ракулегені А-549 і грудної залози T47D при використанні технології магнітної нанотерапії
Бездєнєжних Н.О.1, Орел В.Е.2, Семесюк Н.І.1, Лихова О.О.1, Охріменко Р.А.1, Рихальський О.Ю.2, Романов А.В.2, Кудрявець Ю.Й.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Національний інститут раку, Київ
Резюме. Досліджено особливості життєздатності й експресії білків адгезії та клітинного цитоскелета клітин ліній раку легені A-549 і грудної залози T47D залежно від магнітних властивостей магнітного нанокомплексу (МНК) на основі наночастинок Fe3O4 з антрацикліновим антибіотиком доксорубіцином (ДР) при використанні технології магнітної нанотерапії. В експериментах in vitro життєздатність клітин раку легені людини А-549 та грудної залози людини T47D мала в усіх дослідах сильну від’ємну кореляцію з концентрацією препаратів (у середньому коефіцієнт кореляції становив r=–0,71). У проведених експериментах виявлено відмінності в порушеннях експресії молекул міжклітинної адгезії та протеїнів, що формують цитоскелет, під впливом МНК та електромагнітного опромінення на відміну від дії ДР. Загальним для обох моделей є достовірне зниження експресії Е-кадгерину під дією як ДР, так і МНК й електромагнітного опромінення. При цьому встановлено тенденцію до залежності експресії молекул міжклітинної адгезії та протеїнів від магнітних характеристик МНК. З урахуванням отриманих результатів прогноз розвитку технології магнітної нанотерапії — це реалізація можливості дистанційно керованого за допомогою зовнішніх магнітних полів локального впливу на окисно-відновні (редокс) реакції та рівень токсичності у злоякісних пухлинах під час хіміотерапії хворих онкологічного профілю.

Вступ
Останніми роками магнітні наночастинки (НЧ) оксиду заліза привертають увагу онкологів як компоненти протипухлинного магнітного нанокомплексу (МНК) [1, 2], адже достатньо висока загальна токсичність відомих протипухлинних препаратів спонукає до пошуку нових та вдосконалення існуючих терапевтичних засобів з метою підвищення їх ефективності, безпеки та вибірковості дії [3]. Одним із підходів, при якому використовуються МНК, є модуляція біологічних ефектів протипухлинних препаратів постійним магнітним полем (ПМП) як складовою протипухлинної наносистеми спрямованого транспорту. У роботі колективу авторів показано, що при поєднаній дії ПМП і НЧ феромагнетика спостерігається ефект посилення дії ПМП, що проявляється у зростанні сумарного цито- та генотоксичного впливу цих чинників на клітини [4].
Протипухлинний механізм дії технології магнітної нанотерапії заснований на комбінованому локальному впливі слабких постійних і змінних магнітних полів на кінетику магнетохімічних вільнорадикальних реакцій в умовах помірної радіочастотної гіпертермії пухлини з МНК. Необхідні магнітні характеристики МНК отримують із використанням механомагнітохімічного синтезу на основі ефекту магнітного резонансу. Протипухлинний ефект технології магнітної нанотерапії залежить від магнітних характеристик МНК, до складу якого входять НЧ оксиду заліза та протипухлинний агент, зокрема доксорубіцин (ДР) [5, 6]. Відомо, що НЧ виявляють свою цито- та генотоксичність, впливаючи таким чином на проліферацію клітин та їх життєздатність. Однак молекулярні механізми прояву подібних ефектів НЧ залишаються не розкритими [7].
Магнітні НЧ потрапляють всередину клітин шляхом ендоцитозу та накопичуються в клітинних органелах, індукуючи оксидативний стрес і як результат — активацію захисних механізмів у клітині, які реалізуються через експресію низки антиоксидантних білків. Крім того, внутрішньоклітинна передача сигналу в результаті активації МАРК і NF-κB сигнальних шляхів сприяє продукції прозапальних цитокінів, хемокінів і матриксних металопротеїназ та апоптозу [8, 9]. Подібна взаємодія НЧ з пухлинними клітинами впливає на їх морфологію та імунофенотип, експресію певних генів, задіяних у процесі проліферації або апоптозу [10–12]. Встановлено, що формування високозлоякісного фенотипу пухлинних клітин значною мірою пов’язане з реалізацією програми епітеліально-мезенхімального переходу (ЕМП), або трансдиференціювання, процесу, необхідного для ембріонального розвитку та процесу регенерації, але вкрай небажаного при утворенні пухлинного осередку. Індукція ЕМП при пухлинному прогресуванні призводить до перепрограмування епітеліальних клітин, щільно пов’язаних між собою, у клітини з мезенхімальними характеристиками, які володіють високою здатністю до міграції і, відповідно, до інвазії та дисемінації, що призводить до активізації метастатичного каскаду [13–16].
Особливістю функціонування програми ЕМП є її епігенетичний контроль, реалізація програми не потребує клітинного ділення, тобто рух у мезенхімальний чи, навпаки, в епітеліальний фенотип, який може бути індукований відповідними чинниками протягом короткого часу без геномних порушень. Реверсія ЕМП у мезенхімально-епітеліальний перехід буде супроводжуватися втратою злоякісних характеристик пухлинних клітин, як це було показано за допомогою вимикання чи вмикання окремих елементів сигнального шляху програми ЕМП за допомогою інтерферону [17–19] або малих інтерферуючих (міРНК) чи антисенс-РНК. Однак на цей час відомий дуже широкий спектр активаторів програми ЕМП, але недостатньо даних про можливість її дерегуляції нанорозмірними чинниками оксиду заліза.
Відомо, що основними критеріями ЕМП є порушення щільних міжклітинних контактів в епітеліальних тканинах внаслідок значних змін молекул цитоскелета клітин та білків системи адгезії, зокрема пригнічення експресії Е-кадгерину та посилення експресії N-кадгерину, що, в свою чергу, модулює експресію іншого білка — β-катеніну, регуляторна роль якого може змінюватися залежно від його внутрішньоклітинної локалізації. Важливо підкреслити, що β-катенін активує транскрипцію цілої низки генів, включених у контроль клітинної проліферації та адгезії і, як наслідок, сприяє зміні фенотипу пухлинної клітини в напрямку підвищення її метастатичного потенціалу [20].
Сучасна ад’ювантна високодозова хіміотерапія, водночас з її позитивними протипухлинними ефектами, має суттєві недоліки: низьку вибірковість та високу загальну токсичність, генотоксичність і високу мутагенність та, що особливо важливо, може індукувати ЕМП пухлинних клітин, що є тригером метастазування і зростання лікарської стійкості [21–23]. Усе це свідчить про необхідність пошуку додаткових шляхів впливу за допомогою технології магнітної нанотерапії на злоякісність пухлинних клітин із використанням сучасних поглядів на їх біологію.
З урахуванням вищезазначеного метою роботи було дослідження особливостей життєздатності й експресії білків адгезії та клітинного цитоскелета клітин ліній раку легені A-549 і грудної залози T47D залежно від магнітних властивостей МНК на основі НЧ Fe3O4 з антрацикліновим антибіотиком ДР та електромагнітного опромінення (ЕО) при використанні технології магнітної нанотерапії.
Об’єкт і методи дослідження
Культури клітин. Об’єктами дослідження були: клітини раку грудної залози людини — лінія T47D та недрібноклітинного раку легені людини — лінія А-549, отримані з Клітинного банку ліній з тканин людини та тварин Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького Національної академії наук України. Клітини культивували у повному поживному середовищі DMEM з 10% сироватки ембріонів теляти, 40 мкг/мл гентаміцину. Досліджувані клітини культивували у пластиковому посуді у зволоженій атмосфері з 5% СО2 при 37 °С. Зміну середовища і пересів клітин проводили за стандартною методикою.
Для дослідження впливу препаратів на клітини використовували такі методи: цитоморфологічний аналіз за допомогою світлового мікроскопа, фарбування клітин барвником кристалічним фіолетовим та вітальним — трипановим синім.
Суспензію клітин висаджували на 96-лункові планшети в концентрації 3•104 клітин/лунку в 100 мкл повного ростового середовища. Через 24–48 год вносили препарати, інкубували клітини за стандартних умов протягом наступних 48 год.
Кількісний аналіз цитотоксичності. Оцінку цитотоксичної активності досліджених чинників проводили в колориметричному тесті з використанням барвника кристалічного фіолетового (Sigma, США). Після інкубації з досліджуваними препаратами з лунок планшета видаляли культуральне середовище, наносили по 50 мкл на лунку барвника на 10 хв. Через 10 хв барвник змивали 3–4 рази проточною водою та видаляли залишки рідини, розчиняли його етанолом та фіксували результати за допомогою мультилункового спектрофотометра (Labsystems Multiskan PLUS, Фінляндія) при довжині хвилі 540 нм [24]. Для кількісного аналізу живих та мертвих клітин при дії досліджуваних препаратів застосовували стандартний метод із використанням вітального барвника трипанового синього. Для визначення ефекту комбінованої дії ЕО та досліджуваних комбінацій препаратів клітини вирощували в чашках діаметром 40 мм (2•105 клітин на чашку) за стандартних умов протягом 24 год, після чого додавали препарати та через деякий час опромінювали їх протягом 30 хв.
Підрахунок живих та загиблих клітин (X) здійснювали за допомогою камери Горяєва через 48 год після опромінення, забарвлювали клітини трипановим синім та визначали кількість клітин за формулою:
А/80•2 = Х•106 клітин в мл
середовища,
де А — кількість клітин, що була нарахована у камері Горяєва (в 5 квадратах); 2 — розведення з трипановим синім (1:1).
МНК. Як самостійні частини або складові препаратів були використані НЧ оксиду заліза Fe3O4 діаметром <50 нм (Sigma, Aldrich) й ДР (Пфайзер, Італія). Механомагнітохімічний синтез МНК проводили за допомогою механомагнітного реактора «ММР1» (Національний інститут раку, Україна). МНК піддавали постійній механічній активації з інтенсивністю підведення механічної енергії 20 Вт/г та частотою 35 Гц за допомогою просторового коливання камери з кульками та одночасній дії радіочастотного випромінювання від індуктора з частотою 40 МГц з вихідною потужністю 2 Вт і при змінних параметрах ПМП неодимових магнітів протягом 5 хв [5]. Були синтезовані чотири типи зразків МНК з відмінними магнітними характеристиками (табл. 1) [25].
Таблиця 1. Магнітні характеристики зразків*
| Параметр | МНК1 | МНК2 | МНК3 | МНК4 |
| Магнітний момент, mS, емо/г | 8,4 | 15,8 | 13,7 | 10,8 |
| Коерцитивна сила, НС, Гс | 12,6 | 9,7 | 49,3 | 10,1 |
| g-фактор | 2,45 | 2,45 | 2,33 | 2,42 |
*Офіцинальний ДР — діамагнетик, питомий магнітний момент m = — 1,18 емо/г при 3000 E.
ЕО. Для просторово неоднорідного ЕО використовували прототип апарата «Магнітерм» («Радмір», Україна) з магніто-дипольним аплікатором, що мав голчастий локалізатор та неодимовий постійний магніт з максимальною магнітною індукцією ПМП 0,4 Тл на відстані 8 мм від кінця диполів. Параметри ЕО: частота — 40 МГц, вихідна потужність — 60 Вт [26].
Імуноцитохімічний аналіз. Для проведення імуноцитохімічного аналізу досліджувані клітини вирощували на покривних скельцях у стерильних умовах в поживному середовищі RPMI-1640 або DMEM із 10% сироватки новонародженого теляти в 5% СО2 при 37 °С протягом 24–96 год. Потім скельця з клітинами поміщали у фіксуючий розчин (метанол + ацетон у співвідношенні 1:1) на 2 год при –20 °С, після чого інкубували протягом 20 хв із 1% розчином бичачого сироваткового альбуміну і на 1 год наносили моноклональні антитіла проти E-кадгерину, β-катеніну та віментину. Для візуалізації застосовували систему Ultra Vision LPValue Detection system, яка містить детекційні антитіла, кон’юговані з пероксидазою, активність якої виявляли за допомогою субстрату діамінобензидину (DAB). Після проведення імуноцитохімічної реакції препарати промивали проточною водою та дофарбовували розчином гематоксиліну та еозину (15–30 с), після чого препарати поміщали в Faramount Aqueous Mounting Medium [27]. Рівень експресії відповідних маркерів оцінювали класичним методом за шкалою H-score:
S = 1•A + 2•B + 3•C,
де S — показник «H-score», значення якого знаходиться у межах від 0 (білок не експресується) до 300 (сильна експресія у 100% клітин); А — відсоток клітин із забарвленням слабкої інтенсивності; В — відсоток клітин із забарвленням помірної інтенсивності; С — відсоток клітин із забарвленням сильної інтенсивності [28, 29].
Статистичний аналіз. Статистичну обробку даних проводили за t‑критерієм Стьюдента з попередньою перевіркою гіпотези про нормальний закон розподілу випадкової величини за критерієм Колмогорова — Смірнова, використовуючи пакет програм STATISTICA 6.0 (StatSoft).
Результати та їх обговорення
На першому етапі роботи досліджено життєздатність пухлинних клітин після дії МНК із різними магнітними характеристиками (рис. 1). Життєздатність клітин раку легені людини лінії А-549 та грудної залози людини лінії T47D мала у всіх експериментах сильну від’ємну кореляцію з концентрацією використаних препаратів. У середньому коефіцієнт кореляції становив r=–0,71. Максимальне зниження життєздатності клітин раку легені людини лінії А-549 (66%) відносно дії ДР відзначали під впливом МНК1 при концентрації препаратів 0,8 мкг/мл, а для клітин грудної залози людини лінії T47D (32%) — під впливом МНК2 при концентрації препаратів 0,2 мкг/мл. Зміна кількості життєздатних пухлинних клітин мала нелінійний характер залежно від величини магнітного моменту МНК.
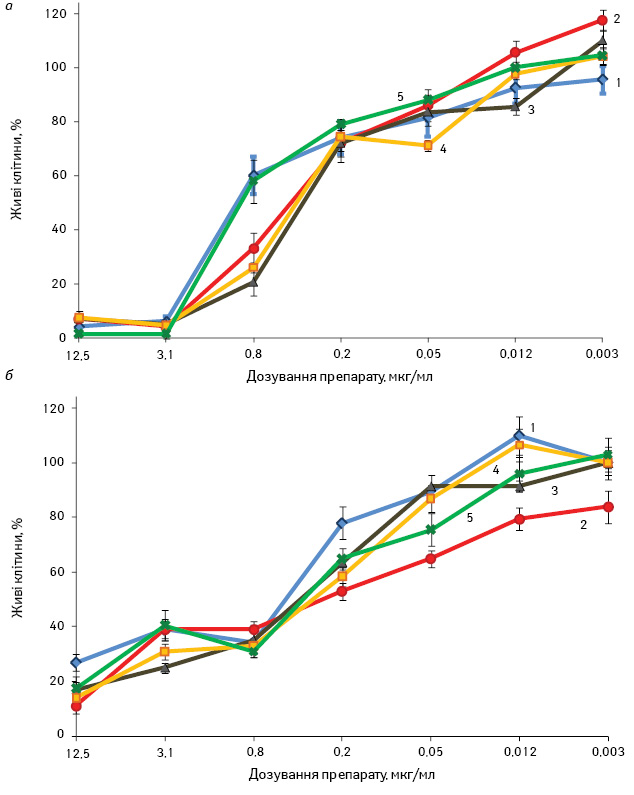
Найбільш ймовірними біохімічними факторами, що впливали на життєздатність пухлинних клітин, були вільні радикали. Вони каталізувалися в реакціях Фентона та Габера — Вейса залізом МНК, які володіли різними магнітними властивостями. Це ініціювало різний рівень оксидативного стресу в мітохондріях та призводило до підвищення ймовірності загибелі пухлинних клітин [30].
Наступним етапом було порівняльне дослідження впливу МНК1 із МНК2 та ЕО на життєздатність клітин (табл. 2 та 3).
Таблиця 2. Життєздатність клітин недрібноклітинного раку легені людини А‑549 після впливу препаратів та ЕО
| № | Варіант впливу | Живі клітини, % | |
| 1 | Контроль (без впливу) | 100 | 100 |
| 2 | ЕО | 83,0±6,0* | 83,0±6,0* |
| Концентрація препарату | |||
| 0,01 мкг/мл | 0,05 мкг/мл | ||
| 3 | ДР | 48,0±4,7* | 27,0±2,5* |
| 4 | ДР + ЕО | 50,0±2,0* | 31,0±4,0%* |
| 5 | МНК1 | 58,0±4,2* | 38,0±2,2*+ |
| 6 | МНК1 + ЕО | 49,0±2,7* | 26,0±1,0*§ |
| 7 | МНК2 | 39,0±1,7*§ | 26,0±0,7*§ |
| 8 | МНК2 + ЕО | 38,0±2,7*§ | 22,0±1,2*§ |
*Статистично значущі відмінності порівняно з контролем з рівнем значущості р<0,05.
+Статистично значущі відмінності порівняно з відповідною дозою ДР з рівнем значущості р<0,05.
§Статистично значущі відмінності порівняно з відповідною дозою МНК1 з рівнем значущості р<0,05.
Таблиця 3. Життєздатність клітин раку грудної залози людини T47D після впливу препаратів та ЕО
| № | Варіант впливу | Живі клітини, % | |
| 1 | Контроль (без впливу) | 100 | 100 |
| 2 | ЕО | 101,0±3,6 | 101,0±3,6 |
| Концентрація препарату | |||
| 0,01мкг/мл | 0,05 мкг/мл | ||
| 3 | ДР | 66,3±2,6* | 42,0±7,0* |
| 4 | ДР + ЕО | 67,0±1,6* | 46,6±5,6* |
| 5 | МНК1 | 72,7±3,7* | 59,0±3,0*+ |
| 6 | МНК1 + ЕО | 76,0±1,0*+ | 56,0±2,3* |
| 7 | МНК2 | 68,3±5,6* | 41,6±2,0*§ |
| 8 | МНК2 + ЕО | 59,3±3,6*§ | 43,6±2,3*§ |
*Статистично значущі відмінності порівняно з контролем із рівнем значущості р<0,05.
+Статистично значущі відмінності порівняно з відповідною концентрацією ДР з рівнем значущості р<0,05.
§Статистично значущі відмінності порівняно з відповідною концентрацією МНК1 з рівнем значущості р<0,05.
Аналіз наведених результатів свідчить про те, що самостійне ЕО зменшувало кількість живих клітин на 17% лише недрібноклітинного раку легені людини А-549.
Після дії офіцинального ДР у дозі 0,05 мкг/мл зафіксовано мінімальну кількість життєздатних клітин недрібноклітинного раку легені людини А‑549, яка становила 27,0±2,5%.
Для клітин раку грудної залози людини T47D мінімальна кількість життєздатних клітин (42,0±7,0%) також виявлена після дії офіцинального ДР у дозі 0,05 мкг/мл. Додаткове ЕО суттєво не впливало на життєздатність клітин під впливом ДР.
Мінімальну кількість життєздатних клітин обох ліній реєстрували при самостійному впливі МНК1 та МНК2, як і при застосуванні офіцинального ДР, у дозі 0,05 мкг/мл. Додаткове ЕО після введення МНК зменшувало в середньому на 86% кількість життєздатних клітин лише недрібноклітинного раку легені людини А-549 порівняно з контрольною групою. Мінімальна кількість (22,0±1,2%) життєздатних клітин А-549 була зафіксована після дії МНК2 у дозі 0,05 мкг/мл із застосуванням ЕО. Слід відмітити, що у всіх проведених порівняльних дослідах МНК2 сприяв більшому протипухлинному ефекту стосовно клітин А-549 та Т47D (кількість життєздатних клітин в середньому була меншою на 27%) проти МНК1.
Щодо механізмів зв’язку між зовнішнім впливом ЕО та протипухлинним ефектом МНК із різними магнітними характеристиками можна припустити, що при використанні технології магнітної нанотерапії цілком імовірно ініціюється виникнення електромагнітного поля в тонких нанорозмірних шарах між НЧ з ДР та злоякісними клітинами внаслідок опромінення зовнішнім електромагнітним полем, що також викликає магніторезонансні ефекти [31]. Подальша біологічна інтерпретація протипухлинної дії пов’язана з дерегуляцією редокс-стану електронтранспортного ланцюга мітохондрій у злоякісних пухлинах [32], що приводить до їх загибелі шляхом апоптозу та некрозу.
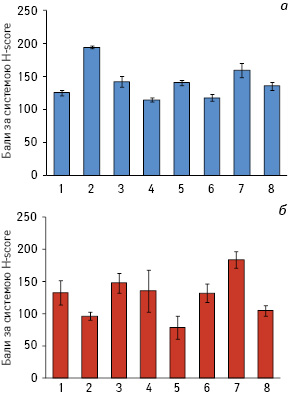
Для більш глибокого розуміння механізмів комплексного цитотоксичного впливу ЕО та МНК із різними магнітними характеристиками на життєздатність клітин раку грудної залози та раку легені людини було проведено імуноцитохімічний аналіз на предмет дослідження деяких антигенів, що є маркерами ЕМП in vitro, зокрема епітеліальних клітин — Е‑кадгерину та β-катеніну (табл. 4 та 5) і мезенхімальних — віментину (рис. 2). Розміри, форма НЧ та особливості їх внутрішньоклітинного накопичення впливають на їхню взаємодію з елементами цитоскелета, що може відбуватися двома шляхами: або за рахунок безпосередньої взаємодії, коли НЧ знаходяться в цитоплазмі, чи опосередковано, коли НЧ містяться в ендосомах [32]. Оскільки цитоскелет відіграє важливу роль у багатьох внутрішньоклітинних сигнальних каскадах, важливим є з’ясування, чи можуть зміни в експресії білків цитоскелета, викликані МНК з різними магнітними властивостями, впливати на зміну фенотипу клітин.
Таблиця 4. Білкові маркери ЕМП клітин А-549 після впливу препаратів# та ЕО
| № | Клітини |
Білкові маркери (за системою H–score, балів) |
|
| β-катенін | E-кадгерин | ||
| 1 | Контроль (без впливу) | 95,6±21,0 | 141,3±6,0 |
| 2 | ЕО | 35,6±5,0* | 107,3±19,0 |
| 3 | ДР | 117,0±13,0 | 122,6±5,0* |
| 4 | ДР + ЕО | 52,0±2,0+ | 106,3±3,0*+ |
| 5 | МНК1 | 69,6±8,0+ | 104,3±3,0*+ |
| 6 | МНК1 + ЕО | 53,6±10,0+ | 121,6±9,0 |
| 7 | МНК2 | 30,3±5,0*+§ | 122,6±7,0§ |
| 8 | МНК2 + ЕО | 41,0±9,0*+§ | 114,6±7,0* |
#Концентрація препаратів 0,01 мкг/мл.
*Статистично значущі відмінності порівняно з контролем з рівнем значущості р<0,05.
+Статистично значущі відмінності порівняно з відповідною дозою ДР з рівнем значущості р<0,05.
§Статистично значущі відмінності порівняно з відповідною дозою МНК1 з рівнем значущості р<0,05.
Таблиця 5. Білкові маркери ЕМП клітин T47D після впливу препаратів# та ЕО
| № | Клітини |
Білкові маркери (за системою H–score, балів) |
|
| β-катенін | E-кадгерин | ||
| 1 | Контроль (без впливу) | 57,2±28,0 | 141,7±25,0 |
| 2 | ЕО | 135,0±33,0* | 107,0±1,0* |
| 3 | ДР | 186,4±38,0* | 108,6±3,0 |
| 4 | ДР + ЕО | 134,3±34,0 | 105,6±3,0 |
| 5 | МНК1 | 132,5±38,0 | 83,6±3,0*+ |
| 6 | МНК1 + ЕО | 136,0±22,0* | 121,0±1,0+§ |
| 7 | МНК2 | 183,1±27,0* | 146,3±27,0§ |
| 8 | МНК2 + ЕО | 166,4±24,0* | 130,6±11,0§ |
#Концентрація препаратів 0,01 мкг/мл.
*Статистично значущі відмінності порівняно з контролем з рівнем значущості р<0,05.
+Статистично значущі відмінності порівняно з відповідною дозою ДР з рівнем значущості р<0,05.
§Статистично значущі відмінності порівняно з відповідною дозою МНК1 з рівнем значущості р<0,05.
Самостійний вплив ЕО на клітини А-549 призводив до зменшення кількості β-катенін-позитивних клітин в 2,7 раза та на 24,1% — E-кадгерин-позитивних клітин (табл. 4). Одночасно відзначали збільшення частки віментин-позитивних клітин на 54,8% порівняно з контрольною групою (див. рис. 2). При аналогічному впливі клітини T47D реагують іншим чином: збільшується в 2,4 раза кількість β-катенін-позитивних клітин, зменшується на 24,5% кількість E‑кадгерин-позитивних клітин і зменшується на 27,6% кількість віментин-позитивних клітин (табл. 5, див. рис. 2). За умов самостійного впливу антрациклінового антибіотика ДР на клітини А-549 виявлено збільшення на 22,4% кількості β-катенін-позитивних та зменшення на 13,2% кількості E-кадгерин-експресуючих клітин відносно контролю. Аналогічним чином при впливі ДР на клітини T47D ініціюється зростання в 3,3 раза кількості β-катенін-позитивних клітин та зменшення на 23,4% E-кадгерин-експресуючих клітин порівняно з контрольною групою. Однак поєднана дія ДР та ЕО викликала інші ефекти: у популяції клітин А-549 відмічали зменшення на 45,6% частки β-катенін-позитивних та на 24,8% — E-кадгерин-експресуючих клітин, а в клітинах T47D навпаки — збільшення в 2,3 раза кількості β-катенін-позитивних і зменшення на 25,5% E-кадгерин-позитивних клітин.
Самостійна дія МНК2 на клітини А-549 порівняно з впливом МНК1 викликає зменшення у 2,3 раза кількості β-катенін-позитивних клітин, збільшення на 17,5% E-кадгерин-позитивних клітин та на 13,1% віментин-позитивних клітин. При дії МНК2 на клітини T47D відзначали збільшення на 38,2% кількості β-катенін-позитивних клітин, на 75,0% кількості E-кадгерин-позитивних клітин і в 2,3 раза віментин-позитивних клітин порівняно з впливом МНК1. Поєднана дія МНК2 та ЕО на клітини А-549 порівняно з МНК1 та ЕО викликала зменшення на 23,5% кількості β-катенін-позитивних та збільшення на 15,1% частки віментин-експресуючих клітин. Аналогічні чинники при дії на клітини T47D ініціювали підвищення на 22,4% β-катенін-позитивних, на 7,9% E-кадгерин-позитивних та зменшення на 20,5% кількості віментин-позитивних клітин порівняно з дією МНК1 та ЕО.
Можна стверджувати, що в проведених експериментах виявлено відмінності в порушеннях експресії молекул міжклітинної адгезії та протеїнів, що формують цитоскелет, під впливом МНК та ЕО на відміну від дії ДР. При цьому встановлено тенденцію до залежності експресії молекул міжклітинної адгезії та протеїнів і, як зазначено вище, життєздатності пухлинних клітин від магнітних характеристик МНК. Відомо, що експресія молекул міжклітинної адгезії впливає на механохімічну гетерогенність злоякісних пухлин. Механохімічна гетерогенність є відмінною рисою еукаріотичних клітин, що позначається на епігенетичній регуляції експресії генів за участю вільних радикалів [33–35]. Тому отримані особливості в експериментальних роботах, згідно з результатами [36–38], найбільш імовірно можуть бути пов’язані з впливом НЧ оксиду заліза також на генерацію активних форм кисню. Останні, залежно від магнітних властивостей МНК та параметрів ЕО, на основі магнетохімічних вільнорадикальних реакцій ініціюють різні клітинні сигнали, що вибірково змінюють експресію генів і клітинну морфологію відповідно до особливостей клітинних мішеней. Це дозволяє зробити подальший прогноз розвитку технології магнітної нанотерапії, який полягає у реалізації можливості дистанційно керованого за допомогою зовнішніх магнітних полів локального впливу на окисно-відновні (редокс) реакції та рівень токсичності у злоякісних пухлинах під час хіміотерапії хворих онкологічного профілю.
Висновки
1. В експериментах in vitro життєздатність клітин раку легені людини А-549 та грудної залози людини T47D мала в усіх дослідах сильну від’ємну кореляцію з концентрацією використаних МНК та ДР в середньому r=–0,71.
2. Експресія білків адгезії та клітинного цитоскелета під впливом МНК із різними магнітними властивостям та ЕО змінюється по-різному залежно від клітинних мішеней і відрізняється від ефектів впливу ДР. Загальним для обох моделей є достовірне зниження експресії Е-кадгерин під дією як ДР, так і МНК й ЕО.
3. Зміна життєздатності клітин раку легені людини А-549 та грудної залози людини T47D і порушення експресії білків адгезії та клітинного цитоскелета у цих клітинах мали нелінійний характер залежно від величини магнітного моменту МНК.
Список використаної літератури
1. Налєскіна Л.А., Бородай Н.В., Чехун В.Ф. (2003) Сьогодення та перспективи створення наносистем спрямованої доставки лікарських препаратів до пухлинних клітин. Онкологія, 11(3): 166–173.
2. Чехун В.Ф. (2008) Нанотехнології в онкології: від теорії до молекулярної візуалізації та керованої терапії. Онкологія, 10(4): 414–419.
3. Chekhun V.F. (2008) Nanothechnology in oncology: present and future. Exp. Oncol., 30(1): 2–3.
4. Чехун В.Ф., Лозовська Ю.В., Лук’янова Н.Ю. та ін. (2013) Оцінка цито- та генотоксичної дії наноферомагнетика та постійного магнітного поля в системі in vivo. Цитология и генетика, 47(3): 60–70.
5. Orel V.E., Shevchenko A.D., Nikolov N.A. et al. (2014) Comparative study of magnetic properties and antitumor effect of nanocomplexes from oxides iron nanoparticles and doxorubicin during radio-frequency hyperthermia of the Walker-256 carcinosarcoma. Nano Life, 4(2): 1450003. doi: 10.1142/S1793984414500032.
6. Salikhov K.M., Molin Y.N., Sagdeev R.Z. (1984) Spin polarization and magnetic effects in radical reactions. Amsterdam: Elsevier, 419 p.
7. Ahamed M., Akhtar M.J., Siddiqui M.A. et al. (2011) Oxidative stress mediated apoptosis induced by nickel ferrite nanoparticles in cultured A549 cells. Toxicology, 283(2): 101–108.
8. Lim D., Roh J.Y., Eom H.J. et al. (2012) Oxidative stress-related PMK-1 P38 MAPK activation as a mechanism for toxicity of silver nanoparticles to reproduction in the nematode Caenorhabditis elegans. Environ. Toxicol. Chem., 31(3): 585–592.
9. Lukianova N., Demash D., Borikun T. et al. (2013) Manifestation of key molecular genetic markers in pharmacocorrection of endogenous iron metabolism in MCF-7 and MCF-7/DDP human breast cancer cells. CellBio, 2(4): 217–227.
10. Choi Y.S., Kim H.S., Woo J. et al. (2014) Real-time imaging of the epithelial-mesenchymal transition using microRNA-200a sequence-based molecular beacon-conjugated magnetic nanoparticles. PLoS One, 9(7): e102164. doi: 10.1371/journal.pone.0102164.
11. Nichols B. (2003) Caveosomes and endocytosis of lipid rafts. J. Cell Sci., 116: 4707–4714.
12. Poteryaev D., Datta S., Ackema K. et al. (2010) Identification of the switch in early-to-late endosome transition. Cell, 141: 497–508.
13. Ковалёв А.А. (2011) Метастатический каскад как терапевтическая мишень. Здоров’я України, 4(17): 26–28.
14. Kalluri R., Weinberg R. (2009) The basics of epithelial-mesenchymal transition. J. Clin. Invest., 119(6): 1420–1428.
15. Polyak K., Weinberg R.A. (2009) Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nat. Rev. Cancer, 9(4): 265–273.
16. Mani S.A., Guo W., Liao M.J. et al. (2008) The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell, 133(4): 704–715.
17. Kudryavets Yu.I., Bezdenezhnykh N.O., Lukyanova N.Yu. et al. (2008) Modifying influence of prolonged action of interferon on phenotypic characteristics of human lung cancer cells in vitro. Exp. Oncol., 30(4): 283–288.
18. Kudryavets Yu.I., Bezdenezhnykh N.O., Lykhova O.O. et al. (2011) The role of interferon as a modifier of epithelial-mesenchymal transition in tumor cells. Exp. Oncol., 33(3): 178–181.
19. Lykhova O., Kovalova O., Bezdenezhnykh N. et al. (2016) Inhibition of malignant potential and expression of proteins associated with epithelial-mesenchymal transition in Lewis lung carcinoma cells transduced with murine ifn-β gene in recombinant baculovirus. Exp. Oncol., 38(1): 72–78.
20. Schmalhofer O., Brabletz S., Brabletz T. (2009) E-cadherin, β-catenin, and ZEB1 in malignant progression of cancer. Cancer Metastasis Rev., 28(1): 151–166. doi: 10.1007/s10555-008-9179-y.
21. Yang A.D., Fan F., Camp E.R. et al. (2006) Chronic oxaliplatin resistance induces epithelial-to-mesenchymal transition in colorectal cancer cell lines. Clin. Cancer Res., 12(14 Pt 1): 4147–4153.
22. Li Q.Q., Chen Z.Q., Cao X.X. et al. (2011) Involvement of NF-κB/miR-448 regulatory feedback loop in chemotherapy-induced epithelial-mesenchymal transition of breast cancer cells. Cell Death Differ., 18(1): 16–25.
23. Sun L., Yao Y., Liu B. et al. (2012) MiR-200b and miR-15b regulate chemotherapy-induced epithelial-mesenchymal transition in human tongue cancer cells by targeting BMI1. Oncogene, 31(4): 432–445.
24. Vega-Avila E., Pugsley K.M. (2011) An overview of colorimetric assay methods used to assess survival or proliferation of mammalian cells. Proc. West Pharmacol. Soc., 54: 10–14.
25. Orel V.E., Shevchenko A.D., Rykhalskiy A.Y. et al. (2015) Investigation of nonlinear magnetic properties magneto-mechano-chemical synthesized nanocomplex from magnetite and antitumor antibiotic doxorubicin. In: Fesenko O., Yatsenko L. (eds.) Nanocomposites, Nanophotonics, Nanobiotechnology, and Applications. Springer Proc. Phys., 156: 103–110.
26. Орел В.Е., Бездєнєжних Н.О., Шевченко А.Д. та ін. (2011) Дослідження впливу електромагнітного опромінення та магніточутливого нанокомплексу на клітини аденокарциноми. Клин. онкол., 4(4): 148–152.
27. Глузман Д.Ф., Абраменко И.В., Скляренко Л.М. и др. (2000) Диагностика лейкозов. Атлас и практическое руководство. Под ред. Д.Ф. Глузмана. К.: Морион, 224 с.
28. McCelland R.A., Wilson D., Leake R. (1991) A multicentre study into the reliability of steroid receptor immunocytochemical assay quantification. Eur. J. Cancer, 27: 711–715.
29. Detre S., Saccani Jotti G., Dowsett M. (1995) A «quickscore» method for immunohistochemical semiquantitation: validation for oestrogen receptor in breast carcinomas. Clin. Pathol., 48: 876–878.
30. Singh N., Jenkins J.S., Asadi R. et al. (2010) Potential toxicity of superparamagnetic iron oxide nanoparticles (SPION). Nano Reviews, 1. doi: 10.3402/nano.v1i0.5358.
31. Orel V., Shevchenko A., Romanov A. et al. (2015) Magnetic properties and antitumor effect of nanocomplexes of iron oxide and doxorubicin. Nanomed. Nanotech. Biol. Med., 11(1): 47–55.
32. Soenen S.J., Himmelreich U., Nuytten N. et al. (2011) Cytotoxic effects of iron oxide nanoparticles and implications for safety in cell labelling. Biomaterials, 32(1): 195–205.
33. Edelman G.M. (1989). Topobiology. J. Sci. Amer., 260: 76–88.
34. Cartagena-Rivera A.X, Wang W.-H., Geahlen R.L. et al. (2015) Fast, multi-frequency, and quantitative nanomechanical mapping of live cells using the atomic force microscope. Sci. Reports 5, Article number 11692. doi: 10.1038/srep11692.
35. Hitchler M.J., Domann F.E. (2007) An epigenetic perspective on the free radical theory of development. Free Radic. Biol. Med., 43(7): 1023–1036.
36. Бурлака А.П., Сидорик Е.П. (2014) Редоксзависимые сигнальные молекулы в механизмах опухолевого процесса. Киев: Наукова думка, 255 с.
37. Ke-Hua Zhang, Hong-Yu Tian, Xia Gao, et al. (2009) Ferritin heavy chain-mediated iron homeostasis and subsequent increased reactive oxygen species production are essential for epithelial-mesenchymal transition. Cancer Res., 69(13): 5340–5348.
38. Weston C., Connor J. (2014) Evidence for the Influence of the iron regulatory MHC class I molecule HFE on tumor progression in experimental models and clinical populations. Transl. Oncogenomics, 6: 1–12.
Особенности жизнеспособности, экспрессии белков адгезии и клеточного цитоскелета клеток линий рака легких А-549 и грудной железы T47D при использовании технологии магнитной нанотерапии
Резюме. Исследованы особенности жизнеспособности и экспрессии белков адгезии и клеточного цитоскелета клеток линий рака легкого A-549 и грудной железы T47D в зависимости от магнитных свойств магнитного нанокомплекса (МНК) на основе наночастиц Fe3O4 с антрациклиновым антибиотиком доксорубицином (ДР) при использовании технологии магнитной нанотерапии. В экспериментах in vitro жизнеспособность клеток рака легкого человека А‑549 и грудной железы человека T47D имела во всех опытах сильную отрицательную корреляцию с концентрацией препаратов (среднее значение коэффициента корреляции r=–0,71). В проведенных экспериментах выявлены различия в нарушениях экспрессии молекул межклеточной адгезии и протеинов, формирующих цитоскелет, под воздействием МНК и электромагнитного облучения в отличие от действия ДР. Общим для обеих моделей является достоверное снижение экспрессии Е-кадгерина под действием как ДР, так МНК с электромагнитным облучением. При этом установлена тенденция зависимости экспрессии молекул межклеточной адгезии и протеинов от магнитных характеристик МНК. С учетом полученных результатов прогноз развития технологии магнитной нанотерапии — это реализация возможности дистанционно управляемого с помощью внешних магнитных полей локального влияния на окислительно-восстановительные (редокс) реакции и уровень токсичности в злокачественных опухолях при химиотерапии больных онкологического профиля.
культуры клеток злокачественных опухолей, магнитная нанотерапия, магнитный нанокомплекс, доксорубицин.
Адреса:
Орел Валерій Еммануїлович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Е-mail: v-orel@voliacable.com
Тел.: (044) 257-60-68














Leave a comment