Саркоми м’яких тканин: діагностика та лікування
Остафійчук В.В., Коровін С.І., Палівець А.Ю., Кукушкіна М.М., Кротевич М.С.
Резюме. Саркоми м’яких тканин являють собою групу злоякісних новоутворень, що за особливостями росту, клінічним перебігом і прогнозом належать до числа найбільш злоякісних пухлин людини. У зв’язку з низькою розповсюдженістю патології єдиної тактики й алгоритму лікування пацієнтів із цим захворюванням не існує. У представленій роботі викладено сучасні уявлення і стан розв♥’язання проблеми діагностики та лікування сарком м’яких тканин.

Вступ
Саркоми м’яких тканин (СМТ) характеризуються низькою розповсюдженістю (1,0–2,5% усіх злоякісних новоутворень дорослого населення людей [1]), частим рецидивуванням, мультицентричним ростом, ранньою появою віддалених гематогенних метастазів і несприятливим прогнозом [2]. Рівень 5-річної виживаність досягає 87% для високодиференційованих сарком і 62% — для низькодиференційованих [3]. При діагностиці СМТ виникають проблеми з тим, що повільний ріст пухлини аж ніяк не доводить, що вона доброякісного характеру, хоча тільки одна із 200 пухлин м’яких тканин є злоякісною [4].
Діагностика СМТ і біопсія пухлини
Візуально неможливо впевнено класифікувати пухлину м’яких тканин як доброякісну чи злоякісну, але є певні ознаки, які можуть свідчити про злоякісність пухлини, до них належать:
- діаметр пухлинного утворення (> 5 см);
- інтенсивне збільшення пухлини в розмірах;
- біль та набряк у ділянці пухлинного утворення;
- підфасціальне розташування пухлини.
Наявність цих ознак дає право розглядати пухлину як злоякісну (ймовірність такого діагнозу становить 86% [5]), поки не буде гістологічно продемонстрована її доброякісна природа. У діагностичному алгоритмі першочерговим кроком є фізикальне обстеження. Існує п’ять основних критеріїв оцінки фізикального обстеження:
- розташування пухлини;
- форма;
- розмір;
- відношення до оточуючих тканин;
- стан регіонарних лімфатичних вузлів.
Регіонарні лімфатичні вузли слід досліджувати з метою виключення метастатичного ураження, хоча поширення саркоми переважно відбувається гематогенним шляхом [6]. Наступним кроком є ультразвукове дослідження ділянки локалізації пухлини. Проведення магнітно-резонансної томографії з контрастуванням забезпечує найбільш повну інформацію про пухлину [7]. Кожну пухлину, яка накопичує контрастну речовину, слід розглядати як злоякісну (рисунок), поки не буде доведено доброякісність процесу за допомогою гістологічної верифікації. Магнітно-резонансна томографія дозволяє провести точний просторовий анатомічний аналіз і правильне планування біопсії та наступного оперативного лікування.
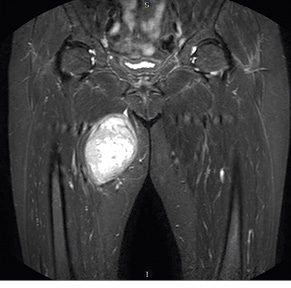
Та найважливішим моментом в діагностиці СМТ є проведення біопсії пухлини. Завдання, яке ставить перед собою біопсія, — це, зокрема, виявлення ознак злоякісності, визначення морфологічного підтипу СМТ та встановлення рівня гістологічного диференціювання пухлини.
При діагностиці СМТ біопсія може бути проведена декількома способами: відкритим методом (інцизійна біопсія), шляхом оперативного взяття матеріалу та пункційним методом (товстоголкова, тонкоголкова або трепан-біопсія). Пункційний варіант біопсії є найкращим у зв’язку з малоінвазивністю цього методу. Однак відкрита інцизійна біопсія може розглядатися у хворих без остаточно встановленого діагнозу або після неінформативної попередньо проведеної пункційної біопсії через обмежену кількість забраного матеріалу.
Гістологічна верифікація
Після проведення біопсії пухлинної тканини виконують гістологічне дослідження отриманого матеріалу. Для можливості прогнозування клінічного перебігу захворювання та планування схеми лікування мають бути оцінені гістологічний тип саркоми та ступінь злоякісності. У дослідженні W.O. Russel та співавторів [8] гістологічна оцінка була вельми суб’єктивна на основі клітинної верифікації, клітинного плеоморфізму та мітотичної активності. Для отримання найбільш ефективної інформації гістологічні параметри слід вибирати за допомогою багатофакторного аналізу, щоб використовувати тільки необхідні критерії, узагальнюючи всю прогностичну гістоморфологічну інформацію. Згідно з дослідженнями [9–11], в яких використовували цю методологію, основними параметрами є:
- гістологічний тип та підтип СМТ;
- ступінь диференціювання пухлини;
- вираженість некрозу пухлини;
- мітотичний індекс.
У декількох дослідженнях ще одним критерієм був ступінь судинної інвазії [12].
Система градації злоякісності пухлини переважно вказує на ймовірність розвитку віддалених метастазів і прогнозування загальної виживаності [13], але має низьке значення для прогнозування місцевого рецидиву, який в основному пов’язаний з чистотою хірургічного краю. Крім того, відповідь на проведення хіміотерапії краще простежується у пацієнтів із низькодиференційованими СМТ.
Двома найбільш широко використовуваними схемами градації СМТ є: градація Національного інституту раку США (National Cancer Institute — NCI) і система Французької федерації центру саркоми (French Federation of Cancer Centers Sarcoma Group — FFCCSG).
Система градації NCI базується на сукупності таких показників, як:
- гістологічний тип СМТ;
- місце розташування пухлини;
- некроз пухлини;
- клітинний плеоморфізм;
- мітотична активність.
Система FFCCSG реалізується шляхом оцінки трьох параметрів (табл. 1, 2):
- диференціювання пухлини;
- мітотичний індекс;
- некроз пухлини.
Таблиця 1. FFCCSG система оцінювання: визначення параметрів за рахунок сукупності балів
| Диференціація пухлини | |
| 1 бал | Саркоми дуже схожі на нормальну мезенхімальну тканину дорослих (наприклад чітко диференційована ліпосаркома) |
| 2 бали | Саркоми із наявністю гістологічної схожості із певним типом мезенхімальної тканини дорослих (наприклад міксоїдна ліпосаркома) |
| 3 бали | Ембріональна і недиференційована саркома та саркоми сумнівного типу, синовіальна саркома, остеосаркома, примітивна нейроектодермальна пухлина |
| Мітотичний індекс | |
| 1 бал | 0–9 мітозів у 10 досліджуваних полях* |
| 2 бали | 10–19 мітозів у 10 досліджуваних полях |
| 3 бали | ≥20 мітозів у 10 досліджуваних полях |
| Некроз пухлини | |
| 0 балів | Немає некрозів |
| 1 бал | ≤50% некрозу пухлини |
| 2 бали | ≥50% некрозу пухлини |
| Гістологічна градація | |
| Градація 1 | Сукупнісь балів — 2, 3 |
| Градація 2 | Сукупнісь балів — 4, 5 |
| Градація 3 | Сукупнісь балів — 6, 7, 8 |
*Поле дорівнює 0,1734 мм2.
Таблиця 2. FFCCSG система оцінювання: диференціація пухлини, оцінка відповідності гістологічному типу СМТ
| Добре диференційована ліпосаркома | 1 |
| Міксоїдна ліпосаркома | 2 |
| Круглоклітинна ліпосаркома | 3 |
| Плеоморфна ліпосаркома | 3 |
| Добре диференційовані фібросаркоми | 1 |
| Звичайні фібросаркоми | 2 |
| Погано диференційовані фібросаркоми | 3 |
| Міксофібросаркома | 2 |
| Плеоморфна міксофібросаркома з візерунком | 2 |
| Плеоморфна міксофібросаркома без візерунка | 3 |
| Гігантоклітинна міксофібросаркома | 3 |
| Добре диференційована лейоміосаркома | 1 |
| Звичайна лейоміосаркома | 2 |
| Слабо диференційована/плеоморфна/епітеліоїдна лейоміосаркома | 3 |
| Ембріональна/альвеолярна/плеоморфна рабдоміосаркома | 3 |
| Мезенхімальна хондросаркома | 3 |
| Остеосаркома | 3 |
| Примітивна нейроектодермальна пухлина | 3 |
| Злоякісна шваннома | 3 |
| Синовіальная саркома | 3 |
| Добре диференційована/ангіосаркома | 2 |
| Слабо диференційована/епітеліоїдна ангіосаркома | 3 |
| Епітеліоїдноподібні саркоми | 3 |
| Світлоклітинна саркома | 3 |
Стадіювання
Наразі основною системою стадіювання СМТ є система TNM, розроблена Американським товариством клінічної онкології (American Society of Clinical Oncology — ASCO) (табл. 3).
Таблиця 3. Стадіювання СМТ за TNM
| Градація СМТ за TNM | Опис |
| G1 | Високодиференційована та помірнодиференційована |
| G2 | Низькодиференційована |
| G3 | Недиференційована |
| T1 | Пухлина не більше 5 см в найбільшому вимірі |
| T1a | Пухлина розташована над фасцією та не проникає через неї |
| T1b | Пухлина залягає під фасцію або проникає через неї |
| T2 | Пухлина більше 5 см в найбільшому вимірі |
| T2a | Пухлина розташована над фасцією та не проникає через неї |
| T2b | Пухлина залягає під фасцію або проникає через неї |
| N0 | Метастази в регіонарних лімфовузлах відсутні |
| N1 | Метастази в регіонарних лімфовузлах |
| М0 | Віддалені метастази |
| M1 | Віддалені метастази |
| Стадії СМТ | |
| IA | T1aN0,NxM0, G1 T1bN0,NxM0, G1 |
| IB | T2aN0,NxM0, G1 T2bN0,NxM0, G1 |
| IIA | T1aN0,NxM0, G2–G3 T1bN0,NxM0, G2–G3 T2aN0,NxM0, G2–G3 |
| IIB | T2bN0,NxM0, G2–G3 |
| III | Tбудь-якеN1M0, Gбудь-яке |
| IV | Tбудь-якеNбудь-якеM1, Gбудь-яке |
Лікування локалізованих форм СМТ
Основним методом лікування пацієнтів із СМТ залишається хірургічний. Головним чинником ефективності застосування операції є дотримання вимог абластичності, провідним критерієм якої є показник чистоти країв резекції рани. Важливість визначення чистоти країв резекції видаленої пухлини як предиктора рецидиву СМТ було доведено W.F. Enneking та співавторами і O. Berlin та співавторами [14, 15]. На сьогодні існує декілька систем визначення чистоти країв резекції, зокрема: Union for International Cancer Control (UICC), FFCCSG, Japanese Orthopaedic Association Musculoskeletal Tumor Committee (JOA). Найпоширенішою системою визначення чистоти країв резекції є FFCCSG, яка побудована на основі системи UICC. За чистотою краю резекції розподіляються на:
- RX: наявність залишкової пухлини не може бути оцінена;
- R0: залишкової пухлинної тканини не виявлено;
- R1: мікроскопічно виявлено елементи пухлини;
- R2: макроскопічно визначено залишкову пухлину.
R0 (залишкової пухлинної тканини не виявлено) встановлюється тільки в тих випадках, коли залишкова пухлина не може бути виявлена за допомогою звичайних методів діагностики. Ця категорія відповідає ідеальним вимогам хірургічної резекції для лікування при СМТ.
Категорію R1 присвоюють у випадках, коли в післяопераційному макропрепараті залишкову пухлину виявляють шляхом мікроскопічного дослідження в навколишніх здорових тканинах.
R2 належить до випадків із макроскопічно видимими залишками пухлинної тканини, яку виявляють або клінічно, або патогістологічно в краях видаленого утворення.
Вплинути на прогноз перебігу СМТ після її видалення можуть і деякі інші морфологічні характеристики (табл. 4).
Таблиця 4. Характеристики, які використовуються в системі при прогнозі перебігу СМТ
| Система | Характеристики, які використовуються в системі при прогнозі перебігу СМТ | ||||||
| Межа резидуальної пухлини | Інвазія в судини | Некроз пухлини | Розмір пухлини | Проліферація клітин пухлини | Оцінка впливу передопераційного лікування |
Primitive vs recurrent |
|
| За Enneking | Так | Ні | Ні | Ні | Ні | Ні | Ні |
| UICC | Так | Ні | Ні | Ні | Ні | Ні | Ні |
| FFCCSG | Так | Ні | Ні | Ні | Ні | Ні | Ні |
| SIN | Ні | Так | Так | Так | Ні | Ні | Ні |
| Engellau | Ні | Ні | Так | Так | Так | Ні | Ні |
| AJCC | Ні | Ні | Так | Так | Ні | Ні | Ні |
| JOA | Так | Ні | Ні | Ні | Ні | Так | Так |
Існує доведена корелятивна залежність між показником чистоти країв резекції і частотою місцевих рецидивів (табл. 5).
Таблиця 5. П’ятирічна безрецидивна виживаність хворих на СМТ залежно від чистоти краю резекції пухлини [23]
| Дослідження | Кількість хворих | Чистота країв резекції | Локальні рецидиви за 5 років спостереження, % | ||
|
Системи визначення |
Результат | Кількість результатів, % | |||
| Stefanovski P., 2002 | 395 | FFCCSG | Негативний | 68 | 20 |
| Позитивний | 32 | 35 | |||
| Stojadinovic A., 2002 | 2084 | FFCCSG | Негативний | 78 | 15,2 |
| Позитивний | 22 | 28 | |||
| Koea, 2003 | 951 | FFCCSG | Негативний | 83 | 13 |
| Позитивний | 17 | 22 | |||
| Zagars G. et al., 2003 | 1225 | Не вказано | Негативний | 66 | 12 |
| Сумнівний | 19 | 26 | |||
| Позитивний | 15 | 38 | |||
| McKee M. et al., 2004 | 111 | Патологоанатомічний край, 1 мм | >10 мм | 47 | 16 |
| 1–9 мм | 41 | 42 | |||
| 0 мм | 12 | 42 | |||
| Gronchi P., 2005 | 642 | FFCCSG | Негативний | 87 | 12 |
| Позитивний | 13 | 26 | |||
Проте, за даними деяких авторів, виникнення локального рецидиву не має прямого впливу на ймовірність розвитку віддалених метастазів [16] і, таким чином, не зумовлює погіршення показника загальної виживаності [17–19]. Інші дослідники стверджують, що місцевий рецидив завжди знижує відсоток як безметастатичної, так і загальної виживаності [20–22].
Починаючи з 80-х років минулого сторіччя з метою запобігання місцевому рецидиву онкологи почали застосовувати комбінований підхід в лікуванні пацієнтів із СМТ [24].
Спочатку це було поєднання хірургічного лікування з променевою терапією, що дозволило покращити показники як локального контролю, так і загальної виживаності. Кількість рецидивів вдалося зменшити з 50 до 25% [25]. Перші рандомізовані дослідження з використанням оперативного лікування та курсу післяопераційної променевої терапії наведено в табл. 6.
Таблиця 6. П’ятирічна безрецидивна виживаність хворих на СМТ із використанням операції та курсу післяопераційної променевої терапії
| Дослідження | Кількість пацієнтів |
Безрецидивна виживаність (локальний контроль) |
Роки дослідження |
| McNeer G.P., 1968 [26] | 94 | 62/94 (66%) | 1968 |
| Spittle M.F., 1970 [27] | 49 | 38/49 (80%) | 1970 |
| Suit H.D., 1973 [28] | 57 | 50/57 (87%) | 1973 |
Важливим етапом у становленні використання променевої терапії в лікуванні при СМТ було проведення дослідження із застосуванням оперативного втручання у пацієнтів із СМТ кінцівок в обсязі ампутації ураженої кінцівки однієї групи та використання органозберігаючої операції із додаванням курсу післяопераційної променевої терапії. Так, в травні 1975 р. представлено рандомізоване дослідження [29], ініційоване NCI, результати якого представлено в табл. 7.
Таблиця 7. Результати рандомізованого дослідження лікування пацієнтів із СМТ кінцівок із використанням операцій, що призводять до каліцтва, та органозберігаючих операцій і курсу післяопераційної променевої терапії
| Групи | Ампутація | Органозберігаюча операція + курс післяопераційної терапії |
| Безрецидивна виживаність (локальний контроль) | 100% | 85% |
| Безметастатична виживаність | Немає даних | 78% |
| Загальна виживаність | 88% | 83% |
Предметом подальших наукових досліджень стала послідовність використання цих двох методів. Передопераційна променева терапія дозволяє збільшити кількість органозберігаючих операцій за рахунок:
- зменшення загального об’єму пухлини та перифокального набряку;
- формування псевдокапсули навколо новоутворення;
- більш чіткого відокремлення пухлини від навколишніх здорових тканин;
- впливу на субклінічні прояви пухлини в зоні ураження.
За даними літератури, неоад’ювантна променева терапія найбільш доцільна при місцево-розповсюджених формах захворювання, особливо при розмірах пухлини >8–10 см [30]. Безумовно, передопераційна терапія поліпшує результат дії хірурга під час операції, проте негативно впливає на післяопераційний перебіг. Післяопераційне опромінення не викликає таких загроз, однак не впливає на ефективність хірургічного етапу.
Проведено клінічні дослідження, які встановили перевагу рівня виживаності серед пацієнтів із застосуванням неоад’ювантної променевої терапії порівняно з хворими, що отримали ад’ювантну терапію [31–33]. Водночас використання передопераційного опромінення суттєво збільшує кількість післяопераційних ускладнень. Так, у роботі, ініційованій Національним інститутом раку Канади [34–36], де проводилося проспективне рандомізоване дослідження із порівняльною оцінкою до- та післяопераційного курсу променевої терапії, доведено, що відсоток ускладнень з боку рани при неоад’ювантному опроміненні досягає 35%, а при ад’ювантному — 17%.
Особливе місце в лікуванні пацієнтів із СМТ кінцівок займає брахітерапія [37]. Вона володіє низкою безсумнівних переваг:
- опромінюється безпосередньо ложе пухлини;
- ймовірність пошкодження навколишніх здорових тканин зведена до мінімуму;
- курс опромінення короткий (5–6 днів);
- кількість ускладнень досить мала (2%).
При порівнянні хірургічного лікування та комбінації хірургічного лікування + брахітерапії у пацієнтів із пухлинами з високим степенем злоякісності 5-річна безрецидивна виживаність становила 65 та 90% відповідно (р=0,013) [38]. Проте використання цієї методики можливо лише в післяопераційний період.
У подальшому до схем лікування хворих на СМТ були залучені протоколи хіміотерапії, які часто використовуються як в неоад’ювантній формі [39], так і в ад’ювантному режимі. У 1997 р. проведено метааналіз всіх відомих рандомізованих клінічних випробувань [40]. Результати цього мультицентрового метааналізу показали, що протоколи, які включали доксорубіцин, збільшують терміни від видалення пухлини до маніфестації місцевих і віддалених рецидивів, а також підвищують показники загальної виживаності.
Найбільш поширеними схемами системної хіміотерапії при СМТ є:
- CyVADIC: циклофосфамід 500 мг/м
внутрішньовенно (в/в), 1-й день; вінкристин 1,5 мг/м в/в, 1-й день; доксорубіцин 50 мг/м в/в, 1-й день; DTIC: дакарбазин 250 мг/м в/в, 1–5 дні. Повторення циклу поліхіміотерапії через 21 день. - Доксорубіцин 75–90 мг/м + іфосфамід 10 000 мг/м. Цитостатики вводять у режимі тривалої (до 72 год) в/в інфузії.
- MAID: месна 2500 мг/м, доксорубіцин 20 мг/м, іфосфамід 2500 мг/м, дакарбазин 300 мг/м.
- CDC: циклофосфамід 750 мг/м в/в, 1-й день; доксорубіцин 50 мг/м в/в, 1-й день; цисплатин 20 мг/м в/в, впродовж 1–5 днів.
- CDVC: цисплатин 100 мг/м в/в,
1-й день; доксорубіцин 25 мг/м в/в,
протягом 2–4 днів; вінкристин 1,5 мг/м в/в на 5-й день; циклофосфамід 600 мг/м в/в на 6-й день. - Епірубіцин 160 мг/м в/в, кожні 3 тиж (до 8 циклів) на фоні підтримки гемопоезу гранулоцитарним колонієстимулюючим фактором.
На відміну від кісткових сарком, при яких гістологічна оцінка некрозу пухлини після проведеного хіміотерапевтичного лікування затверджена як дуже важливий прогностичний фактор [41], не існує стандартизованого підходу до гістологічної оцінки реакції СМТ на проведену неоад’ювантну хіміотерапію [42]. Тільки останніми роками проводяться дослідження з визначення змін в мітотичному індексі [43], що дає можливість точного визначення реакції пухлинної тканини на проведення неоад’ювантної хіміотерапії.
Останнім часом проходять також дослідження із використанням таргетних препаратів при лікуванні пацієнтів із СМТ (табл. 8).
Таблиця 8. Дослідження застосування таргетних препаратів при лікуванні хворих на СМТ
| Дослідження | Рік | Фаза | Вид СМТ |
Механізми активації |
Застосовувані препарати |
Кількість пролікованих пацієнтів |
Результати |
| NCT01524926 [44] | — | II | Альвеолярна, світлоклітина СМТі альвеолярнарабдоміосаркома(старше 15 років) |
Alk/MET | Кризотиніб | 582 | Іде підбір пацієнтів |
| NCT00093080 [45] | 2004 | ІІ | Метастатична/ нерезектабельна СМТ |
mTOR inhibitor | Ридафоролімус | 212 | 28,8% Клінічна відповідь |
| NCT01614795 [46] | 2012 | ІІ | СМТ (1–30 років) | IGF-1R 1 mTOR | Циксутумумаб +темсиролімус | 43 | Клінічної відповіді не було |
| NCT01189253 [47] | 2011 | ІІІ | Місцево-розповсюджена чи метастатична СМТ | Невідомо | Трабектедин протидоксорубіцинвмісної терапії | 121 | Жодних істотних відмінностей не було. Клінічна відповідь вища при доксорубіцинвмісній терапії |
| NCT00217620 [48] | — | ІІ | СМТ | Інгібітор тирозинкінази |
Пазопаніб | 148 | Не було клінічної відповіді. Медіана загальної виживаності становила 17 міс |
Доведено, що комплексне використання променевої терапії, поліхіміотерапії та хірургічного лікування сприяє більш суттєвому підвищенню ефективності терапії порівняно з комбінацією лише поліхіміотерапії та хірургічного лікування [49]. Дискутабельним залишається питання, чи проводити неоад’ювантну променеву та поліхіміотерапію з метою покращення локального контролю, чи застосовувати в неоад’ювантному режимі тільки поліхіміотерапію з подальшою ад’ювантною променевою та поліхіміотерапією [50, 51].
Лікування метастатичних та нерезектабельних форм СМТ
Медіана виживаності після виникнення віддалених метастазів у хворих на СМТ становить близько 11–15 міс, лише 20–25% цих пацієнтів переживають 3 роки спостереження [52, 53]. Одним із прогностичних факторів, що впливають на тривалість життя пацієнтів, є відповідь пухлини на хіміотерапію [53].
Вибір системної поліхіміотерапії є індивідуальним і ґрунтується на декількох факторах, включаючи гістологічний підтип СМТ та біологічну поведінку хвороби, а також стан здоров’я пацієнта.
Усе частіше повідомляється, що різні гістологічні підтипи СМТ проявляють хіміочутливість до різних схем поліхіміотерапії. Як приклад, синовіальна саркома і міксоїдна ліпосаркома входять до числа більш хіміочутливих різновидів [54–57]. Зокрема, міксоїдна ліпосаркома, як правило, чутлива до доксорубіцину. Синовіальна саркома особливо чутлива до алкілуючих агентів, таких як іфосфамід [57]. Ангіосаркома є хіміочутливою при застосуванні таксану та паклітакселу [58–63].
Лейоміосаркома, міксоїдна фібросаркома, дедиференційована ліпосаркома та злоякісна шваннома є низькочутливими до поліхіміотерапії, однак реєструють відповіді на антрациклінвмісні схеми: доксорубіцин у комбінації з іфосфамідом [64, 65].
Список використаної літератури
1. Шугабейкер П.Х., Малауэр М.М. (1996) Хирургия сарком м’яких тканей. М.: Медицина: 440 с.
2. Shukla N.K., Deo S.V.S. (2011) Soft tissue sarcoma — review of experience at a Tertiary Care Cancer Centre. Indian J. Surg. Oncol., 2 (4): 309–312.
3. Lahat G., Tuvin D., Wei C. et al. (2008) New perspectives for staging and prognosis in soft tissue sarcomas. Ann. Surg. Oncol., 15: 2739–2748.
4. Lahat G., Lazar A., Lev D. (2008) Sarcoma epidemiology and etiology: potential environmental and genetic factors. Surg. Clin. N. Am., 88: 451–481.
5. Johnson C.J., Pynsent P.B., Grimer R.J. (2001) Clinical features of soft tissue sarcomas. Ann. R. Coll. Surg. Engl., 83: 203–205.
6. Harbitz F. (1909) Multiple neurofibromatosis (von Recklinghausen’s disease). Arch. Int. Med., 3: 32–65.
7. Misra A., Mistry N., Grimer R., Peart F. (2009) The management of soft tissue sarcoma. JPRAS, 62: 161–174.
8. Russell W.O., Cohen J., Enzinger F. et al. (1977) A clinical and pathological staging system for soft tissue sarcomas. Cancer, 40: 1562–1570.
9. Trojani M., Contesso G., Coindre J.M. et al. (1984) Soft tissue sarcomas of adults: study of pathological prognostic variables and definition of histopathological grading system. Int. J. Cancer, 33: 37–42.
10. Costa J., Wesley R. A., Glatstein E., Rosenberg S.A. (1984) The grading of soft tissue sarcomas: results of a clinicopathological correlation in a series of 163 cases. Cancer, 53: 530–541.
11. van Unnik J.A., Coindre J.M., Contesso G. et al. (1993) Grading of soft tissue sarcomas: experience of the EORTC soft tissue and bone sarcoma group. Eur. J. Cancer, 29: 2089–2093.
12. Gustafson P., Akerman M., Alvegard T.A. et al. (2003) Prognostic information in soft tissue sarcoma using tumour size, vascular invasion and microscopic tumour necrosis: the SIN-system. Eur. J. Cancer, 39: 1568–1576.
13. Krishnan Uni K. (2000) Grading of tumors. Chapter-1.Proceedings of the Fifth International CME and Update in Surgical Pathology. Hyderabad: CME.
14. Enneking W.F., Spanier S.S., Malawer M.M. (1981) The effect of the Anatomic setting on the results of surgical procedures for soft parts sarcoma of the thigh. Cancer, 47(5): 1005–1022.
15. Berlin O., Stener B., Angervall L. et al. (1990) Surgery for soft tissue sarcoma in the extremities. A multivariate analysis of the 6–26-year prognosis in 137 patients. Acta. Orthop. Scand., 61(6): 475–486.
16. Gustafson P., Rooser B., Rydholm A. (1991) Is local recurrence of minor importance for metastases in soft tissue sarcoma? Cancer, 67: 2083–2086.
17. Evans R.A. (1993) Soft tissue sarcoma: The enigma of local recurrence. J. Surg. Oncol., 53: 88–91.
18. Brennan M.F. (1997) The enigma of local recurrence. The Society of Surgical Oncology. Ann. Surg. Oncol., 4: 1–12.
19. Ueda T., Yoshikawa H., Mori S. et al. (1997) Influence of local recurrence on the prognosis of softtissue sarcomas. J. Bone Joint Surg. Br., 79: 553–557.
20. Sabolch A., Feng M., Griffith K. et al. (2012) Risk factors for local recurrence and metastasis in soft tissue sarcomas of the extremity. Am. J. Clin. Oncol, 35: 151–157.
21. Lewis J.J., Leung D., Heslin M. et al. (1997) Association of local recurrence with subsequent survival in extremity soft tissue sarcoma. J. Clin. Oncol., 15: 646–652.
22. Novais E.N., Demiralp B., Alderete J. et al. (2010) Do surgical margin and local recurrence influence survival in soft tissue sarcomas? Clin. Orthop. Relat. Res., 468: 3003–3011.
23. Satoshi Tsukushi, Yoshihiro Nishida, Hiroshi Urakawa (2014) Prognostic significance of histological invasion in high grade soft tissue sarcomas. Springerplus, 3: 544.
24. Ramesha G.K., Kumara A.V., Muralidhara H.B., Sampath S. (2011) Graphene and graphene oxide as effective adsorbents toward anionic and cationic dyes. J. Colloid Interface Sci., 361(1): 270–277.
25. Strander H., Turesson I., Cavallin-Ståhl E. (2003) A systematic overview of radiation therapy effects in soft tissue sarcomas. Acta Oncol., 42(5–6): 516–531.
26. McNeer G.P., Cantin J., Chu F., Nickson J.J. (1968) Effectiveness of radiation therapy in the management of sarcoma for the soft somatic tissues. Cancer, 22: 391–397.
27. Spittle M.F., Newton K.A., Mackenzie D.H. (1970) Liposarcoma: a review of 60 cases. Br. J. Cancer, 24: 696–704.
28. Suit H.D., Russell W.O., Martin R.G. (1973) Management of patients with sarcoma of soft tissue in an extremity. Cancer, 31: 1247–1255.
29. Rosenberg S.A., Tepper J., Glatstein E. et al. (1982) The treatment of soft-tissue sarcomas of the extremities: prospective randomized evaluation of (1) limb-sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann. Surg., 196: 305–315.
30. Suit H.D., Mankin H.J., Wood W.C. et al. (1988) Treatment of the patient with stage M0 soft tissue sarcoma. J. Clin. Oncol., 6(5): 854–862.
31. Cheng E.Y., Dusenbery K.E., Winters M.R., Thompson R.C. (1996) Soft tissue sarcomas: preoperative versus postoperative radiotherapy. J. Surg. Oncol., 61(2): 90–99.
32. Midis G.P., Pollock R.E., Chen N.P. et al. (1998) Locally recurrent soft tissue sarcoma of the extremities. Surgery, 123(6): 666–671.
33. Roberge D., Skamene T., Nahal A. et al. (2010) Radiological and pathological response following pre-operative radiotherapy for soft-tissue sarcoma. Radiother. Oncol., 97(3): 404–407.
34. O’Sullivan B., Davis A.M., Turcotte R. et al. (2002) Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial. Lancet, 359(9325): 2235–2241.
35. Davis A.M., O’Sullivan B., Turcotte R. et al. (2005) Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft tissue sarcoma. Radiother. Oncol., 75(1): 48–53.
36. Dickie C.I., Parent A.L., Griffin A.M. et al. (2009) Bone fractures following external beam radiotherapy and limb-preservation surgery for lower extremity soft tissue sarcoma: relationship to irradiated bone length, volume, tumor location and dose. Int. J. Radiat. Oncol. Biol. Phys., 75(4): 1119–1124.
37. Le O.T., Phillips T.L., Leibel S.A. (1998) Soft Tissue Sarcoma. Textbook of Radiation Oncology — Philadelphia: W.B. Saunders company: 1047–1066.
38. Harrison L.B., Franzese F., Gaynor J.J. et al. (1993) Long term results of a prospective randomized trial of adjuvant brachytherapy in the manage ment of completely resected soft tissue sarcomas of the extremity and superficial trunk. Int. J. Radiat. Oncol. Biol. Phys., 27: 259–304.
39. Eilber F.C., Rosen G., Eckardt J. et al. (2001) Treatment-induced pathologic necrosis: a predictor of local recurrence and survival in patients receiving neoadjuvant therapy for high-grade extremity soft tissue sarcomas. J. Clin. Oncol., 19(13): 3203–3209.
40. Sarcoma Meta-analysis Collaboration (1997) Adjuvant chemotherapy for localised resectable soft-tissue sarcoma of adults: meta-analysis of individual data. Sarcoma Metaanalysis Collaboration. Lancet, 350: 1647–1654.
41. Picci P., Rougraff B.T., Bacci G. et al. (1993) Prognostic significance of histopathologic response to chemotherapy in nonmetastatic Ewing’s sarcoma of the extremities. J. Clin. Oncol., 11(9): 1763–1769.
42. Lucas D.R., Kshirsagar M.P., Biermann J.S. et al. (2008) Histologic alterations from neoadjuvant chemotherapy in high-grade extremity soft tissue sarcoma: clinicopathological correlation. Oncologist, 13(4): 451–458.
43. Andreou D., Werner M., Pink D. et al. (2015) Prognostic relevance of the mitotic count and the amount of viable tumour after neoadjuvant chemotherapy for primary, localised, high-grade soft tissue sarcoma. Brit. J. Cancer, 112(3): 455–460.
44. Schoffski P. (2015) CREATE: Cross-tumoral phase 2 with crizotinib. СlinicalTrials.gov Identifier NCT01524926. Available at: https://clinicaltrials.gov/ct2/ show/NCT01524926?term5nct01524926&rank51.
45. Chawla S.P., Staddon A.P., Baker L.H. et al. (2015) Study of AP23573/MK-8669 (Ridaforolimus), a mammalian target of rapamycin (mTOR) inhibitor, in participants with advanced sarcoma (MK-8669–018 AM1).
46. Yoo C., Lee J., Rha S.Y. et al. (2013) Multicenter phase II study of everolimus in patients with metastatic or recurrent bone and soft-tissue sarcomas after failure of anthracycline and ifosfamide. Invest. New Drugs, 31(6): 1602–168.
47. Butrynski J.E. (2015) Doxorubicin hydrochloride or trabectedin in treating patients with previously untreated advanced or metastatic soft tissue sarcoma. Clinical Trials. gov Identifier NCT01189253. Available at: https://clinicaltrials.gov/ct2/show/NCT01189253? term5NCT01189253&rank51.
48. von Mehren M., Demetri G.D. (2015) S0505 Sorafenib in treating patients with advanced soft tissue sarcomas. ClinicalTrials.gov Identifier: NCT00217620. Available at: https://clinicaltrials.gov/ct2/show/NCT 00217620?term500217620&rank51.
49. Shapira O.M., Korach A., Izhar U. et al. (2013) Radical multidisciplinary approach to primary cardiac sarcomas. Eur. J. Cardio-Thorac. Surg., 44(2): 330–335.
50. Eilber F.C., Rosen G., Eckardt J. et al. (2001) Treatment-induced pathologic necrosis: a predictor of local recurrence and survival in patients receiving neoadjuvant therapy for high-grade extremity soft tissue sarcomas. J. Clin. Oncol., 19(13): 3203–3209.
51. Davis L., Ryan C. (2015) Preoperative therapy for extremity soft tissue sarcomas. Curr. Treat. Options Oncol., 16(6): 1–12.
52. Billingsley K.G., Burt M.E., Jara E. et al. (1999) Pulmonary metastases from soft tissue sarcoma: analysis of patterns of diseases and postmetastasis survival. Ann. Surg., 229: 602.
53. van Glabbeke M., van Oosterom A.T., Oosterhuis J.W. et al. (1999) Prognostic factors for the outcome ofchemotherapy in advanced soft tissue sarcoma: an analysis of 2,185 patients treated with anthracycline-containing first line regimens — a European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. J. Clin. Oncol., 17: 150.
54. Rosen G., Forscher C., Lowenbraun S. et al. (1994) Synovial sarcoma. Uniform response of metastases to high dose ifosfamide. Cancer, 73: 2506.
55. Spillane A.J., A’Hern R., Judson I.R. et al. (2000) Synovial sarcoma: a clinicopathologic, staging, and prognostic assessment. J. Clin. Oncol., 18: 3794.
56. Jones R.L., Fisher C., Al Muderis O., Judson I.R. (2005) Differential sensitivity of liposarcoma subtypes to chemotherapy. Eur. J. Cancer, 41: 2853.
57. Vlenterie M., Litière S., Rizzo E. et al. (2016) Outcome of chemotherapy in advanced synovial sarcoma patients: Review of 15 clinical trials from the European Organisation for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group; setting a new landmark for studies in this entity. Eur. J. Cancer, 58: 62.
58. Fata F., O’Reilly E., Ilson D. et al. (1999) Paclitaxel in the treatment of patients with angiosarcoma of the scalp or face. Cancer, 86: 2034.
59. Nagano T., Yamada Y., Ikeda T. et al. (2007) Docetaxel: a therapeutic option in the treatment of cutaneous angiosarcoma: report of 9 patients. Cancer, 110: 648.
60. Penel N., Bui B.N., Bay J.O. et al. (2008) Phase II trial of weekly paclitaxel for unresectable angiosarcoma: the ANGIOTAX Study. J. Clin. Oncol., 26: 5269.
61. Schlemmer M., Reichardt P., Verweij J. et al. (2008) Paclitaxel in patients with advanced angiosarcomas of soft tissue: a retrospective study of the EORTC soft tissue and bone sarcoma group. Eur. J. Cancer, 44: 2433.
62. Fury M.G., Antonescu C.R., van Zee K.J. et al. (2005) A 14-year retrospective review of angiosarcoma: clinical characteristics, prognostic factors, and treatment outcomes with surgery and chemotherapy. Cancer J., 11: 241.
63. Young R.J., Brown N.J., Reed M.W. et al. (2010) Angiosarcoma. Lancet Oncol., 11: 983.
64. Kroep J.R., Ouali M., Gelderblom H. et al. (2011) Firstline chemotherapy for malignant peripheral nerve sheath tumor (MPNST) versus other histological soft tissue sarcoma subtypes and as a prognostic factor for MPNST: an EORTC soft tissue and bone sarcoma group study. Ann. Oncol., 22: 207.
65. Widemann B.C., Reinke D., Helman L. et al. (2013) SARC006: Phase II trial of chemotherapy in sporadic and neurofibromatosis-associated high-grade malignant peripheral nerve sheath tumors (MPNSTs) (abstract 10522). J. Clin. Oncol., 31: abstr 10522.
Саркомы мягких тканей: диагностика и лечение
Национальный институт рака, Киев
Резюме. Саркомы мягких тканей представляют собой группу злокачественных новообразований, по особенностям роста, клиническому течению и прогнозу относящихся к числу наиболее злокачественных опухолей человека. В связи с низкой распространенностью патологии единой тактики и алгоритма лечения пациентов с этим заболеванием не существует. В представленной работе изложены современные представления и состояние решения проблемы диагностики и лечения сарком мягких тканей.
саркома мягких тканей, хирургическое лечение, полихимиотерапия.
Адреса:
Остафійчук Василь Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-99-46
E-mail: lugnik2007@gmail.com














Leave a comment