Лімфаденектомія та її ефективність при радикальній нефректомії у пацієнтів з раком нирки
Ковальський В.В.1, Фецич Т.Г.1, Дійчук Ю.П.2, Кальмук Б.З.2, Ковальчук Н.О.2, Ковальчук С.В.2, Куртяк М.Б.2, Юрчишин І.Я.2
- 1Львівський національний медичний університет імені Данила Галицького
- 2Львівський державний онкологічний реґіонарний лікувально-діагностичний центр, Львів

Вступ
Рак нирки (РН) становить 85–90% усіх новоутворень нирок та 3% усіх випадків онкологічних захворювань у дорослих [3, 10]. Приріст захворюваності РН в Європі та світі становить приблизно 2% щороку [9]. Не дивлячись на те, що у більшості хворих РН виявляють на стадії локалізованого пухлинного процесу, більш ніж у половини пацієнтів після хірургічного лікування розвиваються метастази [6]. Частота рецидиву у ложі видаленої нирки, причиною якого є нерадикальна операція, або лімфогенне поширення злоякісних пухлинних клітин, персистуючих в реґіонарних лімфатичних вузлах (ЛВ) [11,12], становить 1,8–14,6% [4, 5, 7, 8, 13, 14].
Враховуючи високу резистентність РН до протипухлинних препаратів та променевої терапії, радикальна нефректомія — єдиний ефективний метод лікування цієї патології, а також попередження прогресування захворювання в оперованих хворих. Одним з факторів, що впливає на об’єм хірургічного лікування, є наявність або відсутність метастазів в реґіонарних ЛВ. Доопераційне виявлення метастазів у ЛВ ускладнене, і без хірургічного втручання встановити істинний стан реґіонарного колектору часто не можливо, тому доцільність виконання і об’єм реґіонарної лімфаденектомії (ЛАЕ) при хірургічному лікуванні хворих на РН залишаються дискутабельними.
Мета роботи — оптимізація хірургічного лікування РН шляхом дослідження ефективності ЛАЕ. Для її досягнення вказаної було поставлено такі завдання: вивчити частоту ураження реґіонарних ЛВ при РН; дослідити роль ЛАЕ у постхірургічному стадіюванні процесу; проаналізувати інформативність інструментальних методів обстеження в діагностиці лімфаденопатій.
Матеріал та методи
Робота ґрунтувалася на обстеженні та результатах лікування 202 пацієнтів з діагнозом РН (чоловіки — 114 (56,4%), жінки — 88 (43,6%)), яке проводилося на базі Львівського державного онкологічного реґіонарного лікувально-діагностичного центру (ЛДОРЛДЦ) в період з 2007 по 2009 р. Вік хворих — від 25 до 81 року (медіана віку — 58,31±12,05).
Доопераційно стан реґіонарної лімфатичної системи оцінювався за допомогою ультразвукового дослідження (УЗД) та компьютерної томографії (КТ) — метастатично ураженими вважалися всі виявленні ЛВ: округлої форми (співвідношення поперечного і передньо-заднього розмірів ≈1:1, з «короткою» віссю >1,0 см), щільні, гіперваскуляризовані по периферії, дифузно неоднорідної структури з відсутністю диференціації мозкового шару і кори ЛВ. Iнтраопераційно — по щільності та збільшеному розміру, а післяопераційно — з використанням патоморфологічного дослідження.
Статистична обробка отриманих даних проводилася з використанням програми Statistica. Для опису аналізованих груп обчислено медіану та процентилі. Для дослідження кумулятивної виживаності хворих використовували цензорований метод Каплана — Мейера [1, 2]. Водночас, для визначення достовірності у різниці рівнів виживаності в окремих групах визначався логарифмічний ранговий коефіцієнт та його похибка.
Розподіл хворих за стадіями представлено на рис. 1.
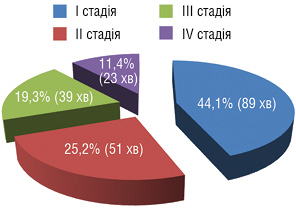
ЛАЕ мала місце у 119 (58,9%) випадках, у решти — 83 (41,1%) пацієнтів — ЛАЕ не виконувалася внаслідок невеликих розмірів ЛВ, що були розцінені як неметастатичні. Ці хворі становили контрольну групу.
Обмежена/факультативна ЛАЕ виконується при пухлинах Т1–2 (видаляються ЛВ з доопераційною/інтраопераційною підозрою на метастатичне ураження). Розширена лімфодисекція (видалення всієї жирової клітковини з ЛВ, оточуючої магістральні судини) — при пухлинах Т3–4, а також збільшених ЛВ. При раку правої нирки вона включає видалення латеро-, пре-, ретрокавальних, інтераортокавальних ЛВ від діафрагми до біфуркації правої загальної клубової артерії. При раку лівої нирки — латеро-, пре-, ретроаортальних і інтераортокавальних ЛВ від діафрагми до біфуркації лівої загальної клубової артерії.
Результати
При проведенні ЛАЕ кількість видалених ЛВ становила від 1 до 42 (медіана видалених ЛВ становила 10). Матеріал для гістологічного дослідження після ЛАЕ включав 8 та більше ЛВ у 73 випадках (61,3%), а менше 8 ЛВ — у 46 (38,7%) випадках.
У результаті післяопераційних морфологічних досліджень видалених препаратів у 12 (10,1%) пацієнтів гістологічно підтверджено метастатичне ураження ЛВ (рN+).
При післяопераційному стадіюванні процесу завдяки виконанню ЛАЕ і верифікації метастазів у ЛВ у 6 випадках (половині випадків рN+ і 5,0 % кількості хворих, яким виконувалася ЛАЕ) стадія захворювання змінилася (табл. 1): у 2 випадках встановлено ІІІ стадію захворювання, оскільки виявлено метастази раку в одному реґіонарному ЛВ, а у пацієнтів без віддалених метастазів встановлено IV стадію хвороби за рахунок рN2.
| № | Кількість видалених ЛВ (pN) | Кількість уражених ЛВ(pN +) | рТрNM | Стадія |
|---|---|---|---|---|
| 1 | 24 | 1 | pT2 pN1 M0 | III |
| 2 | 3 | 1 | pT2 pN1 M0 | III |
| 3 | 16 | 13 | pT3b pN2 M0 | IV |
| 4 | 9 | 3 | pT2 pN2 M0 | IV |
| 5 | 5 | 5 | pT2 pN2 M0 | IV |
| 6 | 3 | 2 | pT2 pN2 M0 | IV |
Показники, що характеризують інформативність КТ та УЗД для діагностики ураження ЛВ пухлинним процесом при РН наведені у табл. 2.
| Кількість рN+ | КількстьрN – | Разом | Чутливість (Se) | Специфічність (Sp) | |
|---|---|---|---|---|---|
| Кількість КТ сN+ | 7 | 4 | 11 | 77,78 | 90,91 |
| Кількість КТ сN – | 2 | 40 | 42 | ||
| Разом | 9 | 44 | 53 | ||
| Кількість УЗД сN+ | 6 | 8 | 14 | 66,67 | 90,24 |
| Кількість УЗД сN- | 3 | 74 | 77 | ||
| Разом | 9 | 82 | 91 | ||
Встановлено, що ймовірність того, що результат КТ буде позитивним при уражених ЛВ, тобто чутливість тесту, становить 77,78%; ймовірність негативного результату при неуражених ЛВ, тобто специфічність, становить 90,91%.
Водночас чутливість УЗД становить 66,67%, специфічність — 90,24%.
Таким чином, інформативність КТ у виявленні лімфогенних метастазів незначно перевищує таку при УЗД.
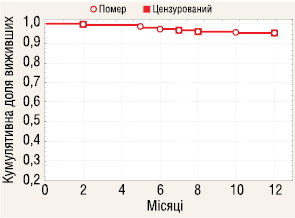
Проведено аналіз 1-річної виживаності пацієнтів з І–ІІІ стадіями хвороби (рис. 2). Із 179 аналізованих хворих протягом року після проведення операції 9 (5,03%) померли від прогресування захворювання. До цензурованих пацієнтів нами зараховано тих, хто вибув з дослідження з причини невідповідності програмі дослідження (2 померли від хвороб, не асоційованих з основною, та 4 відцензуровано з причини проведення ад’ювантної терапії). Відтак, кумулятивна доля тих, хто вижив протягом 1 року становить 0,95.
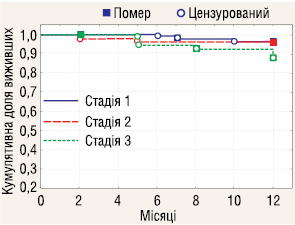
Аналіз 1-річної виживаності пацієнтів з РН залежно від стадії захворювання (рис. 3) не встановив достовірної різниці між річною виживаністю у пацієнтів з І–ІІІ стадіями хвороби (р=0,23).
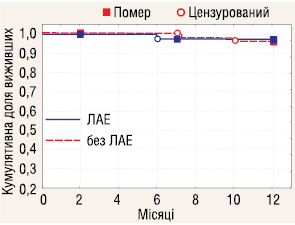
Досліджено 1-річну виживаність у пацієнтів з РН І–ІІІ стадій залежно від проведення ЛАЕ (рис. 4–6). Отримані дані вказують, що у пацієнтів з І, ІІ та ІІІ стадіями захворювання річна виживаність не залежала від проведення ЛАЕ.
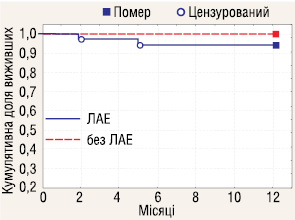
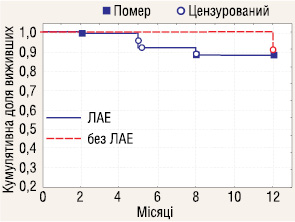
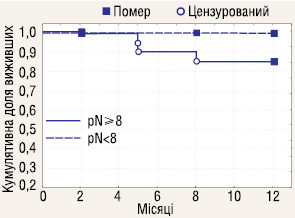
Проаналізовано річну виживаність залежно від кількості видалених ЛВ. До групи розширеної ЛАЕ включено пацієнтів, у яких було видалено 8 і більше ЛВ, всіх інших зараховано до групи обмеженої ЛАЕ. Отримані результати (рис. 7–9) показали, що об’єм ЛАЕ у аналізованих стадіях не впливає на річну виживаність у хворих з РН.
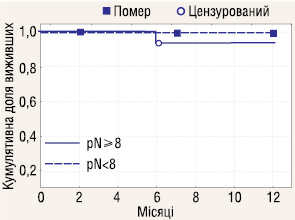
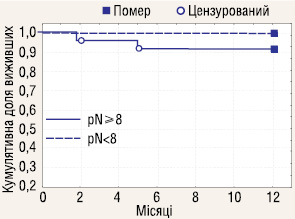
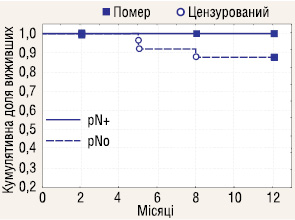
Досліджено річну виживаність у пацієнтів з ІІІ стадією РН, яким проводилася ЛАЕ (n=29) залежно від ураження реґіонарних ЛВ пухлинним процесом (pN+ n=3; pN0 n=26). Отримані результати (рис. 10) показали, що ураження метастазами реґіонарних ЛВ у пацієнтів з ІІІ стадією хвороби не впливає на річну виживаність у хворих з РН.
На основі проведеного аналізу можна зробити такі висновки:
- у 10,1% пацієнтів з РН гістологічно підтверджено метастази в ЛВ (рN1-2);
- у 5,0% хворих при постхірургічному стадіюванні процесу завдяки виконанню ЛАЕ і верифікації метастазів у ЛВ змінилася стадія захворювання, зокрема у 4 пацієнтів встановлена ІV стадія, що може впливати як на прогноз, так і на доцільність ад’ювантної терапії.
Діагностична інформативність КТ у виявленні лімфогенних метастазів незначно перевищує таку при УЗД.
1-річна виживаність пацієнтів з РН (І–ІІІ стадії) не залежить від проведення, об’єму ЛАЕ та ураження реґіонарних ЛВ пухлинним процесом. Для подальшого вивчення даного питання буде проведено аналіз 3- та 5-річної виживаності у пацієнтів з РН.
Література
- 1. Боровиков В.П. (2001) STATISTICA: искусство анализа данных на компьютере. Для профессионалов, 656 с.
- 2. Реброва О.Ю. (2002) Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica,312.
- 3. Bleumer I., Oosterwijk E., De M.P. et al. Immunotherapi for renal cell carcinoma. Eur Urol 2003, 44: 65–75.
- 4. Gez E., Libes M., Bar-Deroma R. et al. Postoperative irradiation in localized renal cell carcinoma: the Rambam Medical Center experience. Tumori 2002; 88(6): 500−2.
- 5. Itano N.B., Blute M.L., Spotts B., Zincke H. (2000) Outcome of isolated renal cell сarcinoma fossa recurrence after nephrectomy. J. Urol, 164(2): 322.
- 6. Janzen N.K., Kim H.L., Figlin R.A., Belldegrun A.S. (2003) Surveilance after radical or partial nephrectomy for localized renal cell сarcinoma and management of recurrent disease. Urol Clin North Am, 30(4): 843–52.
- 7. Leibovitch I., Raviv G., Mor Y. et al. (1995) Reconsidering the necessity of ipsilateral adrenalectomy for renal cell сarcinoma. Urologi, 46(3): 316−20.
- 8. Levy D.A., Slaton J.W., Swanson D.A., Dinney C.P. (1998) Stage specific guidelines for surveillance after radical nephrectomy for local renal cell сarcinoma. J. Urol, 159(4):1163−7.
- 9. Lindbland P. (2004) Epidemiology of renal cell carcinoma. Scand J Surg,93: 88-96.
- 10. Motzer R.J., Bander N.H., Nanus D.M. (1996) Renal-cell carcinoma. N Engl J Med, 335:865–875.
- 11. Moudouni S.M., Tazi Mokha K., Nouri M. et al. (1999 ) Renal cancer in adults. Review of 68 cases. Ann Urol (Paris) , 33(6-7): 395−401.
- 12. Panchev P., Ianev K., Georgsev M. et al. (2000) «Fossa» carcinoma — a relapse or «rest» carcinoma of the kidney? Khirurgiia (Sofiia) ;56(3–4): 33–4.
- 13. Saidi J.A., Newhouse J.H., Sawczuk I.S. (1998 ) Radiologic follow-up patients with T1-3a,b,c or T4N+M0 renal cell carcinoma after radical nephrectomy. Urologi, 52(6): 1000−3.
- 14. Takashi M., Hibi H., Ohmura M. et al. (1997) Renal fossa recurrence of a renal cell carcinoma 13 years after nephrectomy: a case report. Int J Urol, 4(5): 508−11.
Лимфаденэктомия и ее эффективность при радикальной нефрэктомии у пациентов с раком почки
Львовский национальный медицинский университет имени Дaнила Галицкого
Львовский государственный онкологический лечебно-диагностический центр
Резюме. Робота основана на обследовании и результатах лечения 202 пациентов с диагнозом рак почки . Анализ 1-летнего выживания по методу Каплана—Мейера не опредилил достоверного различия между годовым выживанием у пациентов І–ІІІ стадии в зависимости от проведения лимфаденэктомии; в то же время поражение метастазами регионарных лимфоузлов в ІІІ стадии не влияет на годовое выживание у больных с раком почки.
рак почки, лимфаденэктомия, годовое выживание, метастатическое поражение лимфоузлов.














Leave a comment