Вторинні ураження ЦНС у хворих на дифузну В-великоклітинну лімфому: проблеми, досягнення, перспективи
Резюме. Вторинні ураження центральної нервової системи (ЦНС) — нечасте (2–9%), проте грізне ускладнення дифузної В-великоклітинної лімфоми. В усьому світі проводиться пошук методик діагностики, профілактики та підвищення ефективності лікування таких пацієнтів. У статті представлено огляд літератури, присвячений проблемі діагностики та лікування вторинних уражень ЦНС, наведено алгоритми діагностики та лікування вторинних уражень ЦНС.

Вступ
У лікуванні пацієнтів з онкогематологічними захворюваннями протягом останніх десятиліть досягнуто значних успіхів, в тому числі при дифузній В-великоклітинній лімфомі (ДВВКЛ). Цей найбільш розповсюджений підтип неходжкінських лімфом є потенційно курабельним захворюванням; повне виліковування можливе у 50% хворих. Втім у частини пацієнтів перебіг захворювання є вкрай несприятливим. До таких хворих належать пацієнти з вторинним ураженням центральної нервової системи (ЦНС). До категорії «вторинних уражень ЦНС» включають ізольовані вогнища або комбінацію ураження структур ЦНС разом із системним ураженням при первинній діагностиці ДВВКЛ або рецидиві. Їх слід відокремлювати від поняття «первинної лімфоми ЦНС (ПЛЦНС)», що включає захворювання, яке локалізується лише в структурах ЦНС при встановленні діагнозу. При залученні органів ЦНС (первинно або у рецидиві) виживаність пацієнтів є вкрай незадовільною (2–9 міс). Лікування таких хворих вимагає особливих підходів, із застосуванням хіміопрепаратів, які проникають через гематоенцефалічний бар’єр (ГЕБ).
Епідеміологія. Клініка. Діагностика
Ураження ЦНС при первинній діагностиці ДВВКЛ виявляють у близько 5% випадків [1]. Ураження ЦНС при рецидиві розвивається у 2–9% випадків. У норвезькому дослідженні, в якому проведено аналіз даних 2514 пацієнтів з агресивними лімфомами, рецидив з ураженням ЦНС виявили у 106 (4,2%) осіб, при цьому у 66% із них він відбувся після завершення хіміотерапії (ХТ) першої лінії, а у 34% пацієнтів — під час її проведення [2]. Розповсюдження клітин лімфоми у структури ЦНС може відбуватися декількома шляхами: гематогенно, проростанням пухлини з уражених кісток або периневральними просторами [3]. Залучення структур ЦНС може проявлятися як ураженням тканини головного мозку, так і ураженням мозкових оболонок або інших структур ЦНС. Дані щодо локалізації ураження суттєво відрізняються в різних дослідженнях, проте найчастіше відмічають ураження мозкових оболонок/виявлення клітин лімфоми у спинномозковій рідині (СМР) (близько ⅔ випадків). Ураження спинного мозку або перидурального простору є досить рідкісною локалізацією і становить близько 4% випадків [2]. У більшості випадків стан пацієнта є тяжким, симптоматика швидко прогресує. Клінічна картина при ураженні ЦНС зумовлена локалізацією вогнищ і може проявлятися як симптомами підвищення внутрішньо-черепного тиску (головний біль, нудота, судоми), так і вогнищевою симптоматикою відповідно до функцій ураженої зони (парестезії, парези, зміни ментального статусу та ін.). Проте частина пацієнтів залишаються безсимптомними [4].
З метою підтвердження наявності ураження структур ЦНС застосовуються візуалізуючі методи дослідження та дослідження СМР. Найбільш показовим серед візуалізуючих методів дослідження залишається магнітно-резонансна томографія (МРТ). Цей метод дозволяє найкраще візуалізувати структури ЦНС та їх вогнищеве ураження. У пацієнтів, які мають протипоказання до проведення МРТ, може застосовуватися комп’ютерна томографія з внутрішньовенним контрастуванням. Роль надзвичайно популярного наразі методу позитронно-емісійної томографії (ПЕТ)/комп’ютерної томографії (КТ) чітко не визначена. Не підлягає сумніву діагностична цінність зазначеного методу у виявленні вогнищ лімфоми поза межами ЦНС [3]. Проте у дослідженнях, покликаних охарактеризувати роль ПЕТ у діагностиці уражень ЦНС, відсутня єдина думка щодо практичної цінності методу. Дискутабельними залишаються питання щодо зіставності змін, виявлених при ПЕТ та МРТ, оптимальної методики проведення ПЕТ (вид радіофармпрепарату) та ін. [9]. Органи ЦНС мають високий природній рівень накопичення 18F-флюородезоксиглюкози (18F-ФДГ), проте у пухлинній тканині, зокрема при ураженні лімфомою, рівень накопичення у вогнищі може бути у 2,5 раза вищим, ніж у сірій речовині [5]. Водночас згідно з даними N. Kawai та співавторів (2010) три з чотирьох сканів не дозволяють виявити вогнища у ЦНС [5]. Більшість публікацій, які стосуються ролі ПЕТ/КТ у діагностиці уражень ЦНС при ДВВКЛ, опубліковані у період 2008–2013 рр. З урахуванням відсутності більш актуальних публікацій проведення ПЕТ/КТ при ураженнях ЦНС відіграє другорядну роль порівняно з МРТ та в основному має за мету оцінку системності процесу [5–9].
Проведення люмбальної пункції з подальшим цитологічним або цитофлуориметричним дослідженням СМР дозволяє виявити клітини лімфоми у лікворі. Останній метод є більш інформативним [10, 11]. Під час дослідження ліквору необхідно провести підрахунок кількості лейкоцитів та їх морфологічне дослідження, визначення рівня протеїну та глюкози. Перші два показники, як правило, мають бути підвищеними, а рівень глюкози — зниженим. За даними A.J. Ferreri та співавторів (2009), проведення проточної цитофлуориметрії та виявлення аранжування генів важких ланцюгів імуноглобулінів також є обов’язковими методами обстеження [4].
Необхідність виконання біопсії вогнищ у ЦНС є одним з найбільш спірних питань. Згідно зі стандартами діагностики та лікування лімфом діагноз має бути підтверджено гістологічно, незалежно від того, чи це первинна діагностика, чи підозра на рецидив. Зокрема, у нашій країні при підозрі на рецидив ДВВКЛ з ізольованим ураженням ЦНС проведення біопсії у більшості випадків неможливе через брак часу та доступу до спеціалізованих центрів, які можуть провести таке втручання, та у зв’язку з високою вартістю самої процедури і подальшого лікування.
Прогноз у пацієнтів із вторинним ураженням ЦНС є несприятливим. Виживаність без лікування становить декілька місяців. У випадку рецидиву ДВВКЛ з або без ураження ЦНС виявлено статистично значущу різницю у виживаності хворих: 3-річна загальна виживаність (ЗВ) становила 11 та 27% відповідно (р=0,004) [12].
У зв’язку з несприятливим прогнозом у пацієнтів із вторинним ураженням ЦНС значна увага приділяється визначенню вірогідності розвитку цих уражень та їх профілактики. Питанню оцінки ризику розвитку вторинного ураження ЦНС та його профілактики присвячена стаття І.А. Крячок та співавторів (2016) [13].
Лікування
Незалежно від часу виникнення ураження структур ЦНС при ДВВКЛ, застосування стандартних курсів ХТ при цьому виді лімфом має надзвичайно низьку ефективність. Це пов’язано з тим, що більшість препаратів, які входять до складу стандартних курсів ХТ, не проникають через ГЕБ, а отже, не можуть впливати на пухлину. В алгоритм лікування пацієнтів з наявністю ураження ЦНС мають бути інкорпоровані такі препарати, як метотрексат (основний препарат у лікуванні лімфом з ураженням ЦНС) або цитарабін та алкілуючі агенти у високих дозах. Слід пам’ятати, що у випадку застосування якогось із цих препаратів (наприклад метотрексату) з метою профілактики ураження ЦНС та виникнення рецидиву, його повторне застосування у складі сальвадж-терапії має бути ретельно зважене. Також у схеми лікування можуть бути включені кортикостероїди, інтратекальна та променева терапія. Проте вони чинять скоріше паліативний ефект [4].
За потреби швидко зменшити вираженість симптомів, зумовлених ураженням ЦНС, та покращити загальний стан пацієнта можуть бути використані кортикостероїди. При внутрішньовенному введенні цих препаратів швидко досягається терапевтична концентрація в лікворі та тканині головного мозку. Покращення клінічної картини досягається як завдяки прямому цитотоксичному ефекту, так і зменшенню перитуморального набряку.
Інтратекальна терапія найчастіше застосовується у пацієнтів з ураженням мозкових оболонок (лептоменінгеальна форма). Як правило, 2 рази на тиждень застосовується комбінація з трьох препаратів (метотрексат, цитарабін, дексаметазон), які вводяться або шляхом люмбальної пункції, або через резервуар Оммайя. Її проведення дозволяє досить швидко зменшити кількість клітин лімфоми у лікворі та клінічні прояви захворювання [4].
Люмбальна пункція є технічно простою процедурою. Втім є низка публікацій, у яких доведено, що концентрація цитостатичних препаратів у лікворі на рівні головного мозку не є достатньою [4]. Встановлення резервуару Оммайя частіше використовується у педіатричній практиці, потребує додаткового медичного обладнання та є технічно більш складною процедурою. Водночас доставка цитостатичних препаратів здійснюється до ліквору, який омиває головний мозок.
При вивченні ефективності різних препаратів для інтратекального введення кращі результати досягаються при застосуванні ліпосомальних форм цитарабіну, що також допомагає зменшити прояви значної нейротоксичності інтратекальної терапії [14]. У дослідженні І фази, результати якого опубліковані американськими авторами, вивчали ефективність та токсичність інтратекального введення ритуксимабу у дозі 10–50 мг 2 рази на тиждень протягом 4 тиж у 14 пацієнтів з рефрактерними лімфомами ЦНС. Встановлено, що безпечною була доза до 25 мг, а при підвищенні дози до 50 мг з’явилися прояви токсичності. У 75% пацієнтів досягнуто повної цитологічної відповіді, а у 43% — загальної відповіді як за показниками СМР, так і вогнищами у паренхімі головного мозку [15]. Втім специфічних досліджень щодо ефективності інтратекальної терапії при вторинних ураженнях ЦНС не проводили. Більшість дослідників погоджуються з тим, що цей метод не може застосовуватися самостійно [4].
Лікування хворих на ДВВКЛ з ураженням ЦНС при первинному встановленні діагнозу
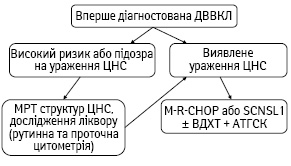
Перш за все слід зазначити, що навіть за відсутності симптомів ураження ЦНС хворим на ДВВКЛ, які мають високий ризик ураження ЦНС (усі пацієнти групи високого та високого проміжного ризику згідно зі шкалою міжнародного прогностичного індексу, пацієнти з окремими локалізаціями лімфоми (основа черепа, нирка, надниркова залоза, яєчко, грудна залоза та ін.)), має бути проведене обстеження з метою виключення наявності ураження ЦНС ще до початку проведення ХТ. У рамках рутинного обстеження пацієнтам має бути проведена МРТ та люмбальна пункція. Італійською групою з вивчення лімфом були опубліковані результати дослідження із залученням 180 хворих із вперше діагностованою ДВВКЛ, які мали високий ризик ураження ЦНС за відсутності неврологічної симптоматики. У 4% пацієнтів за результатами люмбальної пункції, проведеної до початку терапії, цитологічно виявлено клітини лімфоми в лікворі, а при проведенні проточної цитометрії клітини лімфоми зафіксовано у 10% хворих. Усі пацієнти отримували рутинну терапію та інтратекальне введення цитостатиків незалежно від результатів проточної цитофлуориметрії. Серед 18 пацієнтів з позитивним результатом проточної цитометрії зареєстровано 14 рецидивів [16].
Проведення терапії із застосуванням стандартних курсів ХТ (курси R-CHOP) не було ефективним у цій групі хворих. Відсутність досліджень, присвячених вивченню ефективності різних терапевтичних підходів у пацієнтів із синхронним системним ураженням ДВВКЛ та ураженням ЦНС при встановленні діагнозу, не дозволяють визначити певний «стандарт» у лікуванні таких хворих. Беручи за основу концепцію застосування системного введення метотрексату у високих дозах, найчастіше таким пацієнтам проводять лікування шляхом поєднання курсів ХТ за схемою R-CHOP та метотрексату [17]. У публікації J.L. Rubenstein та співавторів (2013) описано власний досвід клініки University of California, San Francisco [18]. У цьому закладі лікування хворих на ДВВКЛ розпочинається після комплексного обстеження органів ЦНС, пацієнти отримують 8 введень метотрексату у високих дозах (3–8 г/м) кожні 2 тиж та 6 курсів R-CHOP кожні 3 тиж (М-R-CHOP). Якщо введення обох частин курсу припадає на один тиждень, то метотрексат вводять у 1-й день, а R-CHOP розпочинають на 3-й день. Також автори пропонують пацієнтам, які досягли повної ремісії, проводити консолідацію із застосуванням режиму ЕА (етопозид 40 мг/м шляхом безперервної інфузії протягом 96 год та цитарабін 2 г/м протягом 2 год, усього проводиться 8 інфузій кожні 12 год) [19].
У проспективному дослідженні A.J. Ferreri та співавторів (2015) було проаналізовано дані 38 пацієнтів із вторинним ураженням ЦНС [20]. Серед них 16 пацієнтів мали ураження ЦНС при первинному встановленні діагнозу. Вони отримували терапію із застосуванням метотрексату і цитарабіну у високих дозах та подальшою високодозовою хіміоімунотерапією (ритуксимаб, циклофосфамід, цитарабін, етопозид) та підтримкою аутологічними стовбуровими клітинами (режим SCNSL1). До описаного режиму входило декілька етапів терапії. Пацієнти з ізольованим ураженням ЦНС одразу переходили до терапії за протоколом, а пацієнти із системним ураженням отримували 1 курс ХТ за протоколом R-CHOP з метою зменшення пухлинного навантаження, а потім починали лікування згідно з протоколом. Індукційна терапія складалася з двох курсів високодозового метотрексату та цитарабіну й інтратекального введення ліпосомального цитарабіну. Під час етапу інтенсифікації пацієнти отримували послідовні курси з ритуксимабом та високими дозами циклофосфаміду (у комбінації з інтратекальним введенням ліпосомального цитарабіну), цитарабіну та етопозиду (по одному курсу). Як консолідацію проводили високодозову ХТ із підтримкою аутологічними гемопоетичними стовбуровими клітинами (ВДХТ + АТГСК). Як режим кондиціонування застосовували курс з кармустином та тіотепою. П’ятирічна ЗВ становила 41±8% у загальній групі пацієнтів та 68±11% — у пацієнтів, які отримували ВДХТ + АТГСК [20].
Одна з можливих схем лікування хворих на ДВВКЛ з ураженням ЦНС на момент встановлення діагнозу ДВВКЛ представлена на рис. 1.
Лікування рецидивів або прогресування лімфоми з ураженням ЦНС під час проведення першої лінії терапії
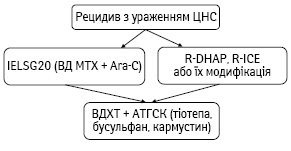
Чітко визначений «стандарт» лікування пацієнтів з рецидивом ДВВКЛ з ураженням ЦНС відсутній. Кількість досліджень, присвячених вивченню різних терапевтичних підходів у пацієнтів із рецидивом у ЦНС, також є обмеженою. Більшість даних екстраполюються з досліджень за участю пацієнтів з ПЛЦНС. Застосування терапії на основі метотрексату у високих дозах давно стало стандартним підходом до лікування хворих на ПЛЦНС. Ретроспективний аналіз, проведений американськими дослідниками, показав, що застосування метотрексату у схемах лікування пацієнтів з рецидивами у ЦНС є незалежним сприятливим прогностичним фактором. У дослідження включено дані 117 пацієнтів із вторинним ураженням ЦНС в рецидиві. Більшість із них отримували терапію з метотрексатом (n=71) у монорежимі (n=12) або в схемах поліхіміотерапії (n=59). Відмічено статистично значущу різницю у показниках ЗВ у пацієнтів, які отримували лікування з або без метотрексату (р=0,0076) [21]. Доза метотрексату, яка має бути інкорпорована в схеми терапії, становить понад 3,5 г/м, оскільки саме така доза при внутрішньовенному введенні дозволяє створити необхідні терапевтичні концентрації, як в тканині мозку, так і в СМР [22].
В іншому дослідженні показано, що застосування метотрексату у монорежимі не є оптимальним для пацієнтів з рецидивом у ЦНС [23]. У дослідження включено 23 пацієнти, які отримували терапію з метотрексатом у дозі 3,5 г/м, інтратекальним введенням цитарабіну щотижнево. Прокарбазин у дозі 100 мг/м у 2–15-й день отримували пацієнти, для яких терапія мала прийнятну токсичність. Після завершення ХТ усі пацієнти отримували променеву терапію. Загальна відповідь на терапію становила 100% при оцінці вогнищ ураження ЦНС та 47% — за показниками системного ураження. Втім кількість повних ремісій сягала лише 9%, медіана виживаності — 6 міс, 2-річна ЗВ — 15%. Таким чином, для пацієнтів із вторинним ураженням ЦНС у рецидиві кращою терапевтичною опцією є проведення поліхіміотерапії [23].
Застосування комбінації метотрексату та цитарабіну у високих дозах не було вивчено окремо у пацієнтів з рецидивом ДВВКЛ з ураженням ЦНС. Впровадження цього курсу у практику лікування таких пацієнтів також відбулося після публікації дослідження Міжнародної групи з вивчення екстранодальних лімфом (IELSG) у пацієнтів із ПЛЦНС. У рандомізованому дослідженні IELSG20 проводили порівняння ефективності та токсичності метотрексату у високих дозах у монорежимі (3,5 г/м) та у комбінації з цитарабіном у високих дозах (2 г/м кожні 12 год на 2–3-й день). Загальна відповідь на терапію становила 40 та 69% відповідно (р=0,009), 3-річна ЗВ — 32±8 та 46±9% відповідно (р=0,07). Після наведеної публікації комбінація ВДХТ метотрексатом та цитарабіном була названа золотим стандартом у лікуванні ПЛЦНС. Цей курс також почали застосовувати у пацієнтів із вторинним ураженням ЦНС [4].
Призначення стандартних курсів сальвадж-терапії, як-то R-DHAP чи R-ICE, також можливе, незважаючи на те, що їх доказова база щодо застосування є досить слабкою.
Єдине дослідження, в якому проводили оцінку застосування режиму (R-)DHAP у комбінації з високодозовим метотрексатом, опубліковане нідерландськими вченими. Група пацієнтів (n=36) отримувала лікування з цим режимом: DHAP — у стандартних дозах, ритуксимаб — на 5-й день, метотрексат — на 15-й день та інтратекальне введення ритуксимабу. Загальна відповідь на терапію становила 53%, медіана виживаності без прогресування захворювання та ЗВ — 6 та 7 міс відповідно [24].
Ефективність курсів ХТ за схемою ІСЕ досліджували у пацієнтів із рецидивними та рефрактерними формами ПЛЦНС. Схема ІСЕ виявилася досить результативною у цієї категорії хворих у рамках невеликого дослідження із залученням 17 пацієнтів, опублікованого французькими вченими. Проведення в середньому 4 курсів терапії дозволило досягти задовільної відповіді на терапію у 88% хворих. Шести пацієнтам на момент публікації проведено ВДХТ. Медіана ЗВ становила 220 днів у загальній групі та не була досягнута у пацієнтів, які отримали ВДХТ [25].
У іншому дослідженні, проведеному в Південній Кореї за участю 45 пацієнтів з рецидивними та рефрактерними формами ПЛЦНС, виконано порівняння ефективності курсів сальвадж-терапії за схемою R-ICE/D, що включала стандартний курс R-ICE з додаванням дексаметазону, та повторної терапії з метотрексатом. Загальна відповідь на терапію суттєво не відрізнялася в обох групах і становила 84,4 та 81,3% відповідно. Пацієнти, які отримали ВДХТ, мали кращі показники виживаності порівняно з тими, хто не отримував консолідацію [26].
В одному з досліджень проводили вивчення ефективності мультиагентного режиму — модифікованого Bonn-протоколу у 23 пацієнтів з рецидивами різних типів лімфом у ЦНС [27]. У цей режим включено метотрексат, вінкристин, іфосфамід, дексаметазон, циклофосфамід, цитарабін, віндезин. Більшість з пацієнтів (60%) мали ДВВКЛ. Проте результати терапії не були достатньо оптимістичними. Медіана ЗВ становила 7 міс.
Застосування ВДХТ + АТГСК є стандартною терапевтичною опцією для пацієнтів з рефрактерним або рецидивним перебігом ДВВКЛ. Аналогічно цей метод може застосовуватися і при повторному ураженні ЦНС. Проте і у випадку застосування ВДХТ надзвичайно велику роль відіграють курси сальвадж-терапії, проведені перед режимом кондиціонування. Адже саме якість відповіді на ХТ (як за системними вогнищами, так і за вогнищами у ЦНС) є ключовим прогностичним фактором ефективності проведення ВДХТ + АТГСК. Зокрема, у дослідженні британських вчених, які проаналізували дані з European Bone Marrow Transplant Lymphoma Registry, виявлено, що єдиним фактором, який впливав на прогнозування відповіді на ВДХТ + АТГСК, був статус пацієнта на момент проведення трансплантації. П’ятирічна виживаність без прогресування захворювання становила 42% у тих, хто не мав ураження ЦНС на момент проведення ВДХТ, проти 9% у пацієнтів з вогнищами у ЦНС (р=0,001) [28].
При системному рецидиві ДВВКЛ найбільш часто застосовується режим кондиціонування ВЕАМ. На жаль, наразі не проведено досліджень, які б дозволили визначити найбільш ефективний режим кондиціонування для пацієнтів з ураженням ЦНС. Наукове обґрунтування вибору режиму кондиціонування також екстраполюється з досліджень при ПЛЦНС. У таких пацієнтів режим кондиціонування із застосуванням кармустину, бусульфану та тіотепи був більш ефективним, ніж ВЕАМ [29–31]. Цей факт пояснюється більш високим проникненням препаратів, що входять до зазначених схем, через ГЕБ. Проникнення препарату становить 50–80% для режиму кармустин, бусульфан, тіотепа та 6–22% — для препаратів, що входять до схеми ВЕАМ [32].
Орієнтовна схема лікування хворих з рецидивом ДВВКЛ з ураженням ЦНС представлена на рис. 2.
Висновки
Вторинні ураження ЦНС при ДВВКЛ і далі залишаються одним із найскладніших терапевтичних завдань у сучасній гематології. Невелика кількість пацієнтів, надзвичайно несприятливий прогноз захворювання, відсутність необхідної кількості досліджень та, відповідно, єдиних підходів до терапії роблять цю категорію пацієнтів дуже складною.
Ураження ЦНС може виявлятися як в момент встановлення діагнозу ДВВКЛ, так і бути проявом рецидиву (з або без системного ураження лімфомою). Саме тому у пацієнтів із ДВВКЛ, що мають ризик або підозру на ураження ЦНС, необхідне ретельне обстеження з метою виявлення таких уражень уже в момент встановлення діагнозу лімфоми. Воно полягає у проведенні МРТ структур ЦНС та дослідженні ліквору із застосуванням проточної цитометрії. Більшість терапевтичних підходів запозичені з досвіду лікування при ПЛЦНС. При синхронному системному ураженні ЦНС під час первинної діагностики можливе додавання високодозового метотрексату до стандартних курсів ХТ за схемою R-СНОР або застосування режиму SCNSL1. При ураженні ЦНС в рецидиві ДВВКЛ можливе застосування курсів на основі високих доз метотрексату та цитарабіну (IELSG20) або курсів R-ICE з подальшим проведенням ВДХТ + АТГСК. Проведення подальших досліджень у таких пацієнтів дозволить підвищити ефективність лікування хворих із вторинними ураженнями ЦНС.
Список використаної літератури
1. Akkas B.E., Vural G.U. (2012) The incidence of secondary central nervous system involvement in patients with non-Hodgkin’s lymphoma as detected by 18F-FDG PET/CT. Nucl. Med. Commun., 34(1): 50–56.
2. Hollender A., Kvaloy S., Nome O. et al. (2002) Central nervous system involvement following diagnosis of non-Hodgkin’s lymphoma: a risk model. Ann. Oncol., 13(7): 1099–1107.
3. Rubenstein J., Ferreri A. J.M., Pittaluga S. (2008) Primary lymphoma of the central nervous system: epidemiology, pathology and current approaches to diagnosis, prognosis and treatment. Leuk. Lymphoma, 49(1): 43–51.
4. Ferreri A.J., Reni M., Foppoli M. et al. (2009) High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet, 374(9700): 1512–1520.
5. Kawai N., Zhen H.N., Miyake K. et al. (2010) Prognostic value of pretreatment 18F-FDG PET in patients with primary central nervous system lymphoma: SUV-based assessment. J. Neurooncol., 100(2): 225–232.
6. Mohile N.A., Deangelis L.M., Abrey L.E. (2008) The utility of body FDG PET in staging primary central nervous system lymphoma. Neuro Oncol., 10(2): 223–228.
7. Kawai N., Miyake K., Okada M. et al. (2013) Usefulness and limitation of FDG-PET in the diagnosis of primary central nervous system lymphoma. No Shinkei Geka., 41(2): 117–126.
8. Kawai N., Okubo S., Miyake K. et al. (2010) Use of PET in the diagnosis of primary CNS lymphoma in patients with atypical MR findings. Ann. Nucl. Med., 24(5): 335–343.
9. Okubo S., Zhen H.N., Kawai N. et al. (2010) Correlation of L-methyl-11C-methionine (MET) uptake with L-type amino acid transporter 1 in human gliomas. J. Neurooncol., 99(2): 217–225.
10. Hegde U., Filie A., Little R.F. et al. (2004) High incidence of occult leptomeningeal disease detected by flow cytometry in newly diagnosed aggressive B-cell lymphomas at risk for central nervous system involvement: the role of flow cytometry versus cytology. Blood., 105(2): 496–502.
11. Quijano S., López A., Manuel Sancho J. et al. (2009) Identification of leptomeningeal disease in aggressive B-cell non-Hodgkin’s lymphoma: improved sensitivity of flow cytometry. J. Clin. Oncol., 27(9): 1462–1469.
12. Boehme V., Zeynalova S., Kloess M. et al. (2007) Incidence and risk factors of central nervous system recurrence in aggressive lymphoma — a survey of 1693 patients treated in protocols of the German High-Grade Non-Hodgkin’s Lymphoma Study Group (DSHNHL). Ann. Oncol., 18(1): 149–157.
13. Крячок І.А., Філоненко К.С., Кущевий Є.В. (2016) Профілактика ураження центральної нервової системи у хворих на дифузну В-великоклітинну лімфом. Клин. онкол., 3(23): 63–66.
14. Glantz M.J., LaFollette S., Jaeckle K.A. et al. (1999) Randomized trial of a slow-release versus a standard formulation of cytarabine for the intrathecal treatment of lymphomatous meningitis. J. Clin. Oncol., 17(10): 3110–3116.
15. Rubenstein J.L., Li J., Chen L. et al. (2013) Multicenter phase 1 trial of intraventricular immunochemotherapy in recurrent CNS lymphoma. Blood, 121(5): 745–751.
16. Benevolo G., Stacchini A., Spina M. et al. (2009) Final results of a multicenter trial addressing role of CSF flow cytometric analysis in NHL patients at high risk for CNS dissemination. Blood, 120(16): 3222–3228.
17. Ferreri A.J., Bruno-Ventre M., Donadoni G. et al. (2014) Risk-tailored CNS prophylaxis in a mono-institutional series of 200 patients with diffuse large B-cell lymphoma treated in the rituximab era. Br. J., 168(5): 654–662.
18. Rubenstein J.L., Gupta N.K., Mannis G.N. et al. (2013) How I treat CNS lymphomas. Blood, 122(14): 2318–2330.
19. Wieduwilt M.J., Valles F., Issa S. et al. (2012) Immunochemotherapy with intensive consolidation for primary CNS lymphoma: a pilot study and prognostic assessment by diffusion-weighted MRI. Clin. Cancer Res., 18(4): 1146–1155.
20. Ferreri A.J., Donadoni G., Cabras M.G. et al. (2015) High doses of antimetabolites followed by high-dose sequential chemoimmunotherapy and autologous stem-cell transplantation in patients with systemic B-cell lymphoma and secondary CNS involvement: final results of a multicenter Phase II Trial. J. Clin. Oncol., 33(33): 3903–3910.
21. Doolittle N.D., Abrey L.E., Shenkier T.N. et al. (2008) Brain parenchyma involvement as isolated central nervous system relapse of systemic non-Hodgkin lymphoma: an International Primary CNS Lymphoma Collaborative Group report. Blood., 111(3): 1085–1093.
22. Millot F., Rubie H., Mazingue F. et al. (1994) Cerebrospinal fluid drug levels of leukemic children receiving intravenous 5 g/m methotrexate. Leuk. Lymphoma, 14(1-2): 141–144.
23. Bokstein F., Lossos A., Lossos I.S., Siegal T. (2002) Central nervous system relapse of systemic non-Hodgkin’s lymphoma: results of treatment based on high-dose methotrexate combination chemotherapy. Leuk. Lymphoma, 43(3): 587–593.
24. Doorduyn J.K., van Imhoff G.W., van Montfort K.C. et al. (2012) Treatment of secondary central nervous system lymphoma with intrathecal rituximab, high dose methotrexate and R-DHAP, followed by autologous stem cell transplantation. A Phase II HOVON Study. Blood, 120: 306.
25. Choquet S., Grenier A., Houillier C. et al. (2015) Very high efficiency of ice (ifosfamide-carboplatin-etoposide) in relapse/refractory (R/R) primary central nervous system (PCNSL) and vitreo-retinal (VRL) Non Hodgkin Lymphoma. a LOC Network Multicenter Retrospective Study on 58 Cases. Blood, 126: 1524.
26. Choi M.K., Kang E.S., Kim D.W. et al. (2013) Treatment outcome of relapsed/refractory primary central nervous system diffuse large B-cell lymphoma: a single-center experience of autologous stem cell transplantation. Int. J. Hematol., 98(3): 346–354.
27. Patrij K., Reiser M., Wätzel L. et al. (2011) Isolated central nervous system relapse of systemic lymphoma (SCNSL): clinical features and outcome of a retrospective analysis. Ger. Med. Sci., 9: 11.
28. Williams C.D., Pearce R., Taghipour G. et al. (1994) Autologous bone marrow transplantation for patients with non-Hodgkin’s lymphoma and CNS involvement: those transplanted with active CNS disease have a poor outcome — a report by the European Bone Marrow Transplant Lymphoma Registry. J. Clin. Oncol., 12(11): 2415–2422.
29. Abrey L. E., Moskowitz C. H., Mason W. P. et al. (2003) Intensive methotrexate and cytarabine followed by high-dose chemotherapy with autologous stem-cell rescue in patients with newly diagnosed primary CNS lymphoma: an intent-to-treat analysis. J. Clin. Oncol., 21: 4151–4156.
30. Kasenda B., Schorb E., Fritsch K. et al. (2012) Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma — a long-term follow-up study. Ann. Oncol., 23(10): 2670–2675.
31. Ferreri A.J., Crocchiolo R., Assanelli A. et al. (2008) High-dose chemotherapy supported by autologous stem cell transplantation in patients with primary central nervous system lymphoma: facts and opinions. Leuk. Lymphoma, 49: 2042–2047.
32. Wiebe W.J., Smith B.R., DeGregorio M.W., Rappeport J.M. (1992) Pharmacology of agents used in bone marrow transplant conditioning regimens. Critical Reviews in Oncology/Hematology, 13 (3): 241–270.
Вторичные поражения ЦНС у больных диффузной В-крупноклеточной лимфомой: проблемы, достижения, перспективы
Национальный институт рака, Киев
Резюме. Вторичные поражения центральной нервной системы (ЦНС) являются нечастым (2–9%), но грозным осложнением диффузной В-крупноклеточной лимфомы. Во всем мире проводится поиск методик профилактики и повышения эффективности лечения таких пациентов. В статье представлен обзор литературы, посвященный проблеме диагностики и лечения вторичных поражений ЦНС, и приведен алгоритм диагностики и лечения вторичных поражений ЦНС.
диффузная В-крупноклеточная лимфома (ДВВКЛ), центральная нервная система (ЦНС), вторичные поражения, метотрексат, высокодозовая химиотерапия.
Адреса:
Філоненко Катерина Сергіївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: ksfilonenko@yahoo.com














Leave a comment