Комплексна променева діагностика в оцінці ускладнень у хворих на рак сечового міхура після радикальної цистектомії та ілеонеоцистопластики в ранній післяопераційний період
Головко Т.С., Гаврилюк О.М., Коровіна А.С., Войленко О.А.
Резюме. Проаналізовано результати комплексної променевої діагностики ранніх післяопераційних ускладнень у 75 хворих на рак сечового міхура після радикальної цистектомії та ілеонеоцистопластики, проведених у клініці Національного інституту раку. Шляхом вивчення закономірностей зміни МРТ-зображень (магнітно-резонансна томографія) нирок та сечовидільної системи визначено особливості уродинаміки у пацієнтів із раком сечового міхура після оперативних втручань та систематизовано МР-ознаки ранніх післяопераційних ускладнень, для яких характерним було додаткове об’ємне утворення в проекції оперативного втручання, збільшені та змінені лімфатичні вузли, норицевий хід, вільна та осумкована рідина в малому тазі.

Вступ
За наявності широкого вибору методів обстеження сечовивідних шляхів (СВШ) у променевій діагностиці їх стану існує низка невирішених проблем. Дослідження, проведені на основі аналізу великих інформаційних баз даних пацієнтів, показали, що при залученні всього арсеналу сучасних променевих методів: ультразвукової діагностики (УЗД), екскреторної урографії (ЕУ), комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ), — відмічається гіпер- і гіподіагностика [1–5]. Водночас у зв’язку з переглядом тактики лікування хворих на рак сечового міхура (РСМ) у провідних клініках світу, ширшим застосуванням радикальної цистектомії (РЦЕ) та ілеонеоцистопластики (ІНЦП) в останні роки підвищилася виживаність пацієнтів онкологічного профілю, а отже, анатомо-функціональні зміни реконструйованих СВШ потребують адекватного діагностичного трактування [6–8].
Нашою метою було визначення закономірностей зміни МРТ-зображень нирок і сечовидільної системи, особливостей уродинаміки у хворих на РСМ після РЦЕ та ІНЦП у ранній післяопераційний період та систематизація МР-ознак ускладнень.
Об’єкт і методи дослідження
В основу дослідження покладено результати комплексної променевої діагностики у 75 хворих на інвазивний РСМ до та після РЦЕ та ІНЦП, обстежених у відділенні променевої діагностики Національного інституту раку у 2010–2015 рр. Усі хворі на РСМ були чоловічої статі, віком 24–75 років, середній вік — 53,2±11,2 року, яким виконано оперативне втручання в обсязі РЦЕ з формуванням ілеального резервуара [9] у відділенні пластичної та реконструктивної онкоурології Національного інституту раку (табл. 1).
Таблиця 1. Розподіл хворих за віком
| Вікова група, років | Кількість хворих | |
| n | % | |
| І період зрілості (24–50) | 29 | 34,1 |
| ІІ період зрілості (51–60) | 33 | 38,8 |
| Похилий вік (61–75) | 23 | 27,1 |
| Усього | 85 | 100,0 |
Як свідчать дані табл. 1, найбільшу групу пацієнтів — 62 (72,9%) — становили особи працездатного віку (24–60 років), із них 29 (34,1%) пацієнтів I періоду зрілості (24–50 років), а 33 (38,8%) — II; 23 (27,1%) хворих похилого віку (61–75 років), більшість пацієнтів працездатного віку.
За стадіями РСМ: II стадію, що відповідає м’язово-інвазивному органообмеженому РСМ (pT2aN0M0, рТ2bN0М0), констатовано у більшості — 66 (77,6%) хворих; III стадію — м’язово-інвазивну органонеобмежену форму РСМ (pT3aN0M0, рТЗbN0М0, pT4aN0M0) — у 19 (22,4%), IV стадію — пухлинну інвазію стінки таза або черевної стінки та метастатичну форму — у 4 (4,7%) хворих. Метастазів у віддалені органи не виявлено в жодному випадку.
За рекомендованими Європейською асоціацією урологів стандартами обстеження хворих на РСМ та клінічними рекомендаціями вітчизняних фахівців [10], для визначення локалізації, кількості, форми, розмірів, структури та поширення процесу застосовували методи променевої діагностики — УЗД, ЕУ, КТ, МРТ; для визначення функціональних змін — ЕУ з діурезним навантаженням, МР-урографію з діурезним навантаженням [11].
Отримані дані опрацьовано за методами варіаційної статистики з обчисленням значень середнього арифметичного (М) і стандартної похибки (m). Для порівняння параметричних даних у двох групах використали t-критерій Стьюдента; при аналізі непараметричних показників двох залежних груп — критерій Вілкоксона, а незалежних груп — U-критерій Манна — Уїтні; для аналізу відносних даних — метод χ2. Достовірними вважали значення при р<0,05.
Усім 75 хворим після оперативного втручання на 7-й день проведено УЗД. МРТ-обстеження проводили з контрастним підсиленням гадолінієвими препаратами в стандартному дозуванні (0,2 мл/кг маси тіла хворого) на магнітно-резонансних томографах Signa Ovation 0,35T, General Еlektrik та Рhilips INTERA 1,5 Т (рис. 1).
Результати
Схема інтенсивної терапії хворих, яким виконана екстирпація сечового міхура з ІНЦП, включала антибіотикотерапію, відновлення об’єму циркулюючої крові, корекцію водно-електролітного та білкового балансу, кислотно-лужної рівноваги, функції шлунково-кишкового тракту, догляд за сформованим резервуаром, профілактику ускладнень з боку легень та серцево-судинної системи.
Ускладнення переважно були спричинені анатомо-функціональними змінами нирок та СВШ до оперативного втручання, травматичністю і тривалістю оперативного втручання, загостренням супутньої патології та метаболічними розладами. Зважаючи на складний післяопераційний стан хворих, на 7-й день після РЦЕ та ІНЦП ми використовували УЗД як найменш травматичний для пацієнта та доступний метод діагностики [12]. Дані УЗД наведено в табл. 2.
Таблиця 2. Анатомо-функціональні зміни верхніх СВШ за даними УЗД на 7-й день після операції (n=75)
| УЗ-ознаки анатомо-функціональних змін нирок та верхніх СВШ | Кількість хворих | |
| n | % | |
| Ступінь дилатації верхніх СВШ: | 19 | 25,3 |
|
10 | 13,3 |
|
5 | 6,7 |
|
4 | 5,3 |
| Об’єм ІСМ 140±27 мл | 50 | 66,7 |
Тут і далі: ІСМ — ілеальний сечовий міхур.
Ознаки ектазії верхніх СВШ виявлено у 19 (25,3%) хворих, із них І ступеня — у 10 (13,3%) пацієнтів, ІІ ступеня — у 5 (6,7%), а ІІІ ступеня — у 4 (5,3%). Об’єм ІСМ був у межах 140±27 мл у 50 (66,7%) пацієнтів, що пов’язано з недостатньою адаптацією ІСМ після пластики. Порівнявши зазначені показники до та після оперативного втручання, ми виявили зменшення ретенційних явищ у 14 (42,4%) пацієнтів. Пластика сечоводів в ІСМ та дренування верхніх СВШ у післяопераційний період покращили уродинаміку, що сприяло зменшенню ретенційних ознак у пацієнтів зі збереженою функцією нирок та СВШ. Незважаючи на проведення інтенсивної терапії та догляду за хворими, виникла низка ускладнень, пов’язаних з оперативним втручанням, частоту яких наведено в табл. 3.
Таблиця 3. Частота ускладнень після цистектомії з формуванням ІСМ в післяопераційний період (n=75)
| Ускладнення | Кількість хворих | |
| n | % | |
| Частота ускладнень | 30 | 40,0 |
| Повторні оперативні втручання | 9 | 12,0 |
Як свідчать дані табл. 3, післяопераційні ускладнення виявлено у 30 (40,0%) пацієнтів, у кожного четвертого — по кілька клінічних проявів у структурі ускладнень. Здебільшого це нетримання сечі — у 27 (90,0%) хворих, неспроможність швів — у 2 (6,7%), решта — інфекційно-запальні процеси — у 6 (20,0%), кровотечі — у 3 (10,0%) хворих. Варто наголосити, що ускладнення були усунені як хірургічно, так і за допомогою консервативної терапії. Післяопераційна летальність становила 3 (4,0%) випадки.
Перше комплексне променеве обстеження після РЦЕ та ІНЦП проводили через 3 міс після оперативного втручання. До закладу на контрольне обстеження звернулися 60 (80,0%) прооперованих хворих. Відповідно до розробленого алгоритму усіх пацієнтів обстежили за допомогою ЕУ з діурезним навантаженням та МР-урографії з діурезним навантаженням за розробленою власною методикою [11]. УЗД виконували ситуативно. Оцінювали анатомо-функціональний стан реконструйованої сечовидільної системи, звертали особливу увагу на місце імплантації сечоводів, визначали функціональну спроможність нирок та СВШ.
Рентгенологічне обстеження проводили в обсязі оглядової урографії, ЕУ з діурезним навантаженням та низхідною цистоуретрографією з визначенням кількості залишкової сечі. Результати ЕУ представлено в табл. 4.
Таблиця 4. Рентгенологічні ознаки анатомо-функціональних змін нирок та СВШ через 3 міс після РЦЕ та ІНЦП (n=60)
| Рентгенологічні ознаки | Кількість хворих | |
| n | % | |
| Дилатація порожнинної системи нирок та верхніх СВШ | 17 | 28,3 |
Ступінь уретерогідронефрозу (УГН):
|
10 4 3 |
16,7 6,7 5,0 |
Дилатація верхніх СВШ:
|
9 8 |
15,0 13,3 |
| Об’єм ІСМ 140±27 мл | 50 | 83,3 |
| Залишкова сеча 50±20) мл | 4 | 6,7 |
За даними табл. 4, при проведенні ЕУ у 17 (28,3%) хворих ми діагностували дилатацію СВШ. При цьому в 10 (16,7%) випадках виявлено променеві ознаки анатомо-функціональних змін, характерні для УГН І ступеня, у 4 (6,7%) — ІІ ступеня, у 3 (5,0%) — ІІІ ступеня. Правобічну дилатацію СВШ відмічено в 9 (15,0%) випадках, лівобічну — у 8 (13,3%), а двобічну — у 5 (8,3%) відповідно.
За алгоритмом обстеження усім 60 (100,0%) пацієнтам також провели МРТ за розробленим нами способом, який передбачав МР-урографію до та після діурезного навантаження. Кількість виявлених випадків дилатації порожнинної системи нирок та верхніх СВШ, співвідношення (%) за ступенем УГН та боці ураження за даними ЕУ та МР-урографії збігалися. Слід зазначити, що оцінювали не тільки рівень, а й причину обструкції, а також функціональну спроможність СВШ; стан суміжних органів черевної порожнини та малого таза. МР-ознаки анатомо-функціональних післяопераційних змін у ранній післяопераційний період наведено в табл. 5.
Таблиця 5. МР-ознаки анатомо-функціональних змін через 3 міс після РЦЕ та ІНЦП (n=60)
| МР-ознаки | Кількість хворих | |
| n | % | |
| Нерівномірне стоншення паренхіми нирки |
|
|
| Дилатація порожнинної системи нирок та верхніх СВШ |
|
|
Ступінь УГН:
|
|
|
Дилатація верхніх СВШ:
|
|
|
| Обструкція на рівні уретероілеальних анастомозів |
|
|
| Обструкція на рівні ілеоуретрального анастомозу |
|
|
Причина обструкції СВШ:
|
|
|
Як видно з табл. 5, у ранній післяопераційний період МР-ознаки нерівномірного стоншення паренхіми нирки виявлено в 6 (10,0%) пацієнтів. Обструкцію на рівні уретероілеальних анастомозів відмічено у 8 (13,3%), обструкцію на рівні ілеоуретрального анастомозу — в 4 (6,7%) випадках. Причиною обструкції у 12 (20,0%) пацієнтів були післяопераційні стани, скориговані хірургічно.
У ранній післяопераційний період даних про продовження хвороби не виявлено в жодному випадку. Оскільки після оперативного лікування змінилася анатомія СВШ та фізіологія сечовипускання, ускладнення переважно стосувалися анатомо-функціональних змін реконструйованих СВШ та безпосередньо операційних ускладнень (табл. 6).
Таблиця 6. МР-ознаки ускладнень у ранній післяопераційний період (n=60)
| МР-ознаки ускладнень | Кількість хворих | |
| n | % | |
| Лімфокісти | 6 | 10,0 |
| Локальне осумкування рідини | 1 | 1,7 |
| Неспроможність швів ілеального резервуара | 3 | 5,0 |
| Кишкова непрохідність | 1 | 1,7 |
| Норицевий хід | 4 | 6,7 |
Симптом додаткового об’ємного утворення в малому тазі виявлено у 7 (11,7%) пацієнтів, із них у 6 (10,0%) діагностовано післяопераційні лімфокісти, що регресували з часом самостійно, в 1 (1,7%) — осумкування рідини з утворенням норицевих ходів внаслідок неспроможності швів ілеального резервуара.
Ілеальний резервуар переважно візуалізувався у вигляді сфери — у 50 (83,3%) пацієнтів, ємністю 110–140 мл — у 53 (88,3%), з чіткими — 55 (91,7%) та рівними контурами — 49 (81,7%) хворих.
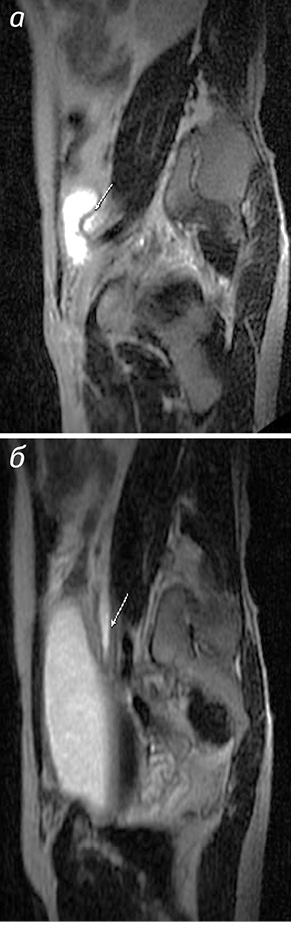
Після МР-обстеження з діурезним навантаженням, крім рівня обструкції та ступеня розширення чашечко-мискового комплексу, ми виявили і причину порушення пасажу сечі по СВШ. У 5 (8,3%) випадках діагностовано стриктуру сечоводу (рис. 2).
Під час першого контрольного обстеження на МРТ через 3 міс після оперативного втручання у 43 (71,7%) хворих констатовано задовільну функцію нирок та верхніх СВШ, а даних, що свідчили б про пієлоуретероектазію, не виявлено.
Проаналізувавши результати променевих методів дослідження в оцінці анатомо-функціональних змін нирок та СВШ у ранній післяопераційний період, ми змогли їх порівняти з передопераційними даними за аналогічними параметрами та відзначили закономірності виявлених динамічних змін.
У табл. 7 наведено розподіл УГН залежно від анатомо-функціональних змін за даними променевих методів до оперативного втручання та через 3 міс після РЦЕ з ІНЦП.
Таблиця 7. Анатомо-функціональні зміни верхніх СВШ до та після РЦЕ з ІНЦП за даними променевих методів
| Ступінь УГН | Термін обстеження, n (%) | |
| до операції (n=75) | через 3 міс після операції (n=60) | |
| І | 22 (29,3±4) | 10 (16,7±4) |
| ІІ | 8 (10,7±2) | 4 (6,6±2) |
| III | 3 (4,0±2) | 3 (5,0±2) |
| Усього | 33 (44,0±2) | 17 (28,3*) |
| Статистичний аналіз | χ2=8,04 (р<0,05) | |
*р<0,05 порівняно з групою хворих до операції.
Наведені в табл. 7 дані свідчать про статистично достовірне зменшення кількості виявлених змін верхніх СВШ в усіх хворих із УГН після оперативного втручання. У віддалений післяопераційний період відзначено таку динаміку змін: зменшення ознак дилатації СВШ на 16,0% (р<0,05); зменшення симптомів стійкого звуження уретероілеального анастомозу на 5,0% (р<0,05); ємність ілеального резервуара становить 450±50 мл. Зокрема, перед операцією до І ступеня було віднесено 22 (29,3±4%) випадки УГН, а вже через 3 міс після операції їх кількість зменшилася на 13,0%. Аналогічну динаміку відмічено у хворих з УГН II ступеня — зниження на 4,3%. Серед них були 2 пацієнти з діагностованим до операції ІІ ступенем з умовно втраченою функцією нирок та СВШ, що ми пов’язуємо з відновними процесами в реконструйованих СВШ та нирках. В 1 пацієнта функція нирки та СВШ не відновилася.
Висновок
У ранній післяопераційний період відмічали такі МР-ознаки змін нирок та СВШ: нерівномірне стоншення паренхіми нирок — у 6 (10,0%) хворих; дилатацію СВШ — у 17 (28,3%); звуження на рівні уретероілеальних анастомозів — у 8 (13,3%); ілеальний резервуар у вигляді сфери ємністю до 140±27 мл — у 53 (88,3%); звуження на рівні ілеоуретерального анастомозу — у 4 (6,7%) хворих.
Список використаної літератури
1. Hedgepeth R.C., Gilbert S.M., He C. et al. (2010) Body image and bladder cancer specific quality of life in patients with ileal conduit and neobladder urinary diversions. Urology, 76(3): 671–675.
2. Jinzaki M., Matsumoto K., Kikuchi E. et al. (2011) Comparison of CT urography and excretory urography in the detection and localization of urothelial carcinoma of the upper urinary tract. Am. J. Roentgenol., 196(5): 1102–1109.
3. Witjes J.A., Compérat E., Cowan N.C. et al. (2014) EAU Guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 Guidelines. Eur. Urol., 65(4): 778–792.
4. Babjuk M., Oosterlinck W., Sylvester R. et al. (2008) EAU Guidelines on non-muscle-invasive urothelial carcinoma of the bladder. Eur. Urol., 54(2): 303–314.
5. Witjes (Chair) J.A., Compérat E., Cowan N.C. et al. (2015) Guidelines on muscle-invasive and metastatic bladder cancer. European Association of Urology, 60 р.
6. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2015) Рак в Україні, 2012–2013. Захворюваність, смертність, показники діяльності онкологічної служби; гол. ред. О.О. Колеснік. Бюл. Нац. канцер-реєстру України, 16. Київ, 101 с.
7. Mayr R., May M., Martini T. et al. (2012) Predictive capacity of four comorbidity indices estimating perioperative mortality after radical cystectomy for urothelial carcinoma of the bladder. BJU Int., 110(6): E222–227.
8. Picozzi S., Ricci C., Gaeta M. et al. (2012) Upper urinary tract recurrence following radical cystectomy for bladder cancer: a meta-analysis on 13,185 patients. J. Urol., 188(6): 2046–2054.
9. Войленко О.А. (2003) Анатомо-функціональний стан сечовивідних шляхів після цистектомії та ілеонеоцистопластики: дис…. канд. мед. наук; Ін-т урології АМН України. Київ, 178 с.
10. Стаховський Е.О. (2011) Клінічні рекомендації з онкоурологічних захворювань. Спілка онкоурологів України. Заславський О.Ю., Донецьк, 296 с.
11. Гаврилюк О.М., Головко Т.С., Яцина О.І., Кононенко О.А. (2014) Пат. на корисну модель № 90003 Україна, МПК (2014.01) А 61 В 6/00. Спосіб діагностики анатомо-функціонального стану нирок та сечовивідних шляхів; Національний інститут раку. — № u201313860; заявл. 29.11.2013; опубл. 12.05.2014. — Бюл. № 9.
12. Абдуллаев Р.Я., Лесовой В.Н., Пилипенко Н.И., Головко Т.С. (2010) Ультрасонография в уронефрологии. Новое слово, Харьков, 132 с.
Комплексная лучевая диагностика в оценке осложнений у больных раком мочевого пузыря после радикальной цистэктомии и илеонеоцистопластики в ранний послеоперационный период
Национальный институт рака, Киев
Резюме. Проанализированы результаты комплексной лучевой диагностики ранних послеоперационных осложнений 75 больных раком мочевого пузыря после радикальной цистэктомии и илеонеоцистопластики, выполненных в клинике Национального института рака. Путем изучения закономерности изменений МР-изображений почек и мочевыделительной системы определены особенности уродинамики пациентов с раком мочевого пузыря после оперативных вмешательств и систематизированы МР-признаки ранних послеоперационных осложнений, для которых характерными были дополнительное объемное образование в проекции оперативного вмешательства, увеличенные и измененные лимфатические узлы, свищевой ход, локальное осумкование и свободная жидкость в малом тазу.
рак мочевого пузыря, мочевыводящие пути, ультразвуковая диагностика, компьютерная томография, экскреторная урография, магнитно-резонансная томография, радикальная цистэктомия, илеонеоцистопластика.
Адреса: Гаврилюк Оксана Миколаївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: Dr.Havryliuk@gmail.com














Leave a comment