Вплив алельного поліморфізму гена CCR5 на перебіг місцево-поширеного раку грудної залози
Сивак Л.А., Верьовкіна Н.О., Горовенко Н.Г. , Лялькін С.А., Россоха З.І. , Попова О.Ф.
Резюме. В аспекті вивчення проблем раку грудної залози (РГЗ) на сьогодні актуальними є дослідження, сфокусовані на з’ясуванні, чому ті чи інші його види можуть або не можуть індукувати протипухлинну імунну відповідь та яким чином системна терапія змінює мікрооточення пухлини імунокомпетентними клітинами. CCR5 (С-С рецептор хемокіну 5) — білок, який кодується відповідним геном і являє собою рецептор адгезії, — міститься на Т-лімфоцитах, макрофагах, дендритних клітинах. У процесі канцерогенезу онкогенна трансформація клітин індукує експресію CCR5 при багатьох типах солідних пухлин, таких як меланома шкіри, рак шлунка, колоректальний рак, рак передміхурової залози, рак яєчника та РГЗ. Один з механізмів, за допомогою яких CCL5 стимулює прогресію РГЗ, реалізується шляхом зміни рівноваги у імунному інфільтраті в тканині пухлини в бік домінування клітин із пропухлинною активністю, а не навпаки. Сигнальний шлях CCR5/CCL5 зміщує баланс між різними типами лімфоїдних клітин. У нашій роботі досліджували асоціацію поліморфізму гена С-С рецептора хемокіну 5 (CCR5 (del32)) з характером імунного інфільтрату в тканині пухлини та його вплив на ефективність неоад’ювантної хіміотерапії при місцево-поширеному РГЗ. Отримані результати свідчать про доцільність подальшого вивчення поліморфізму гена CCR5 при РГЗ.

Рак грудної залози (РГЗ) — найбільш поширений тип раку і найчастіша причина пов’язаної з раком смертності серед жінок у всьому світі. Згідно з даними International Agency for Research on Cancer, опублікованими у 2014 р., протягом 2012 р. у світі зареєстровано >1,6 млн нових випадків і 520 000 випадків смерті від РГЗ [1]. У Сполучених Штатах Америки Національний інститут раку прогнозував >246 660 нових випадків РГЗ та понад 40 000 смертей від нього у 2016 р. [2]. За даними Національного канцер-реєстру України, щорічний приріст цієї онкопатології перевищує 2%. Так, у 2014 р. в Україні зареєстровано 13 744 нових випадків захворювання, а загальна кількість померлих жінок від РГЗ становила 5926. Серед причин смертей жінок питома вага РГЗ найбільша і сягає 20,1% [3]. Незважаючи на успіхи в лікуванні пацієнтів із цим захворюванням, за даними метааналізу Early Breast Cancer Trialists Collaborative Group, у 20–30% пацієнтів з ранніми стадіями РГЗ буде розвиватися рецидив з віддаленим метастазуванням [4]. Крім того, в менш розвинених країнах відмічають гірші результати лікування раку і підвищення смертності, що є наслідком діагностики на більш розповсюдженій стадії.
Відповідно до сучасної теорії канцерогенезу індивідуальні особливості запальних процесів є важливою складовою злоякісних перебудов на клітинному рівні [5]. За наявності пухлинних клітин ризик онкологічного захворювання модифікується мікрооточенням, тобто залежить від особливостей імунологічних молекулярних процесів [6]. Саме пухлинне мікрооточення є одним із ключових факторів як пухлинної прогресії, так і резистентності до медикаментозної терапії [6, 7]. Пухлинне мікрооточення складається зі стромальних та запальних клітин, проліферація та диференціювання яких спричинені пухлиною або «перепрограмованими» нею клітинами, які в нормі присутні в тканині. Цей процес регулюється шляхом прямих міжклітинних контактів або опосередкований паракринними сигналами. Переважно ці сигнали передаються за допомогою цитокінів та хемокінів, які є основними медіаторами, що регулюють імунний гомеостаз та процеси міграції лейкоцитів, як під час запалення, так і в процесі виникнення та прогресування злоякісної пухлини [8].
Хемокіни — це група низькомолекулярних цитокінів, фізіологічною роллю яких є регуляція міграції імунокомпетентних клітин шляхом хемотаксису. Хемокіни продукуються Т-клітинами, макрофагами та дендритними клітинами. Під час канцерогенезу як пухлинні клітини, так і клітини мікрооточення синтезують різноманітні хемокіни, які виконують роль факторів росту, стимуляторів ангіогенезу та інвазивності, а також беруть участь у формуванні імуносупресивного мікрооточення. Імунна супресія виникає як за рахунок міграції та активації пухлиноасоційованих макрофагів (tumor-associated macrophages), супресорних клітин мієлоїдного походження (myeloid-derived suppressor cells), регуляторних Т-лімфоцитів або мезенхімальних стовбурових клітин, так і за рахунок пригнічення цитотоксичних Т-лімфоцитів. У відповідь на хемокіни, синтезовані у певному органі чи тканині, пухлини, які експресують відповідний хемокіновий рецептор, швидше прогресують та призводять до утворення віддалених метастазів [5, 7].
CCR5 (С-С рецептор хемокіну 5) — білок, який кодується відповідним геном і являє собою рецептор адгезії, — міститься на Т-лімфоцитах, макрофагах, дендритних клітинах. У процесі канцерогенезу онкогенна трансформація клітин індукує експресію CCR5 при багатьох типах солідних пухлин, таких як меланома шкіри, рак шлунка, колоректальний рак, рак передміхурової залози, рак яєчника та РГЗ [8].
Аналіз більш ніж 2250 патоморфологічних зразків пацієнток із РГЗ виявив гіперекспресію рецептора CCR5 та ліганда CCL5 (С-С ліганд хемокіну 5) при базальноподібному та HER-2 гіперекспресуючому типах РГЗ. Більше того, як клітини РГЗ, так і мезенхімальні клітини пухлинної строми експресують на своїй поверхні та секретують CCL5. CCL5 стимулює міграцію Т-регуляторних лімфоцитів, супресорних клітин мієлоїдного походження в пухлинне мікрооточення та перепрограмовує його в бік пригнічення протипухлинної імунної відповіді. Клітини базальноподібного та HER-2 типів РГЗ експресують рецептор CCR5, який контролює їх інвазивність та метастатичний потенціал [9].
CCL5 також бере участь у формуванні резистентності пухлини до терапії [10]. Нещодавно опубліковано дані, що свідчать про значну кореляцію між активністю сигнального шляху STAT3 — RANTES та набутою резистентністю до тамоксифену за рахунок активації антиапоптотичного сигналу: STAT3 та RANTES шляхи у клітинах, резистентних до тамоксифену, регулюють активність один одного каскадом аутокринних сигналів, що запускає антиапоптотичні сигнали та піддтримує резистентність до тамоксифену [10]. Можна говорити про доцільність дослідження сигнального шляху CCR5/CCL5 у процесі пошуку додаткових маркерів прогнозу при лікуванні хворих на РГЗ [11].
Мета дослідження — вивчити асоціацію поліморфізму гена С-С рецептора хемокіну 5 (CCR5(del32)) з характером імунного інфільтрату в тканині пухлини та його вплив на ефективність неоад’ювантної хіміотерапії при місцево-поширеному РГЗ.
Об’єкт і методи дослідження
У відділенні хіміотерапії солідних пухлин Національного інституту раку МОЗ України обстежено та проліковано 62 хворих на РГЗ T1–3N0–3M0 стадії віком 29–69 років. Усім пацієнткам проводили передопераційну хіміотерапію за схемою FAC (циклофосфамід 500 мг/м² — у 1-й день, доксорубіцин 50 мг/м² — у 1-й день, флуороурацил 500 мг/м² — 1-й день) згідно зі стандартами. Оцінку відповіді пухлини здійснювали після кожних двох курсів хіміотерапії (згідно з критеріями RECIST 2.0).
Обсяг операції відповідав радикальній резекції або радикальній мастектомії.
Проведено морфологічне дослідження післяопераційного матеріалу. Фіксацію виконували в 10% розчині нейтрального формаліну. Виготовлення гістологічних препаратів матеріалу проводили за стандартною методикою. Препарати забарвлювали гематоксиліном і еозином. Оцінку лікувального патоморфозу виконували шляхом визначення об’єму життєздатної залишкової пухлини (за класифікацією Miller — Payne), наявності раку in situ, а також кількості та розмірів уражених лімфовузлів. Інфільтрацію пухлинної тканини імунокомпетентними клітинами оцінювали в препаратах, пофарбованих гематоксиліном та еозином, та класифікували за ступенем вираженості: відсутня або слабо виражена (+), помірна (++) та значно виражена (+++). Імуногістохімічне дослідження виконували за стандартною методикою з використанням моноклональних антитіл фірми «Dako» до рецепторів естрогену, прогестерону, онкопротеїну c-erbB-2 та Ki-67, а також до рецепторів CD8, CD4, FOXP3. Морфологічне та імуногістохімічні дослідження проводили у науково-дослідному відділенні патологічної анатомії та гістології Національного інституту раку МОЗ України.
Молекулярно-генетичне дослідження виконували в молекулярно-генетичній лабораторії Державного закладу «Референс-центр з молекулярної діагностики МОЗ України». ДНК виділяли з периферичної крові за допомогою комерційної тест-системи innuPREP Blood DNA Mini Kit («Analytik Jena», Німеччина). Досліджувану ділянку гена ампліфікували за допомогою специфічних праймерів («Metabion», Німеччина) із використанням комерційного набору DreamTaq Green PCR Master Mix («Thermo Scientific», США). Стан ампліфікованих фрагментів гена аналізували в 3% агарозному гелі (агароза фірми «Cleaver Scientific», Великобританія) з додаванням бромистого етидію. Для оцінки розміру фрагментів вносили маркер молекулярної маси GeneRuler 50 bp DNA Ladder («Thermo Scientific», США), візуалізували розподіл фрагментів у гелі за допомогою трансілюмінатора. Обробку отриманого зображення проводили в комп’ютерній програмі Vitran.
Результати алельспецифічної полімеразної ланцюгової реакції ділянки гена ССR5 (del32) оцінювали залежно від довжини наявних ампліфікованих фрагментів — 172 п.н. та/або 140 п.н. За наявності ампліфікованого фрагмента розміром 172 п.н. реєстрували нормальний варіант гена ССR5 — N/N, фрагменти 172 п.н. та 140 п.н. одночасно свідчили про гетерозиготний стан — N/del32, а при довжині фрагмента 140 п.н. фіксували делеційний поліморфізм в гомозиготному стані — del32/del32 (рисунок).
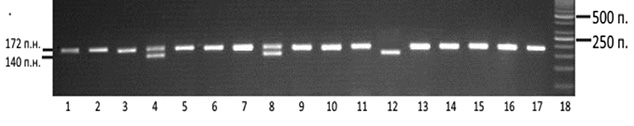
Обробку отриманих даних виконували з використанням пакета програм Statistica 10.0. Для оцінки розподілу варіантів використовували дисперсійний аналіз. Для проведення кореляційного аналізу та виявлення різниці між змінними застосовували t-критерій Стьюдента та критерій χ. Статистично значущими вважали дані з достовірністю різниці при р<0,05.
Отримані результати та їх обговорення
Середній вік пролікованих пацієнток становив 49±20 років. У 43 (69,3%) із них виявлено пухлини з наявністю рецепторів естрогену та прогестерону, натомість у 19 (30,6%) пацієнток діагностовано пухлини без експресії рецепторів стероїдних гормонів. Після закінчення передопераційної хіміотерапії у 31 (50%) хворої відмічено часткову відповідь пухлини на лікування, стабілізацію процесу — у 28 (45%) та у 3 (4,9%) пацієнток — прогресію захворювання згідно з критеріями RECIST 2.0.
При проведенні патогістологічного дослідження операційного матеріалу тільки у третини пацієнток (32,2%) не були уражені аксилярні лімфовузли, тоді як у 42 (67,8%) пацієнток розвинулися метастази у регіонарних лімфатичних вузлах. При оцінці лікувального патоморфозу за класифікацією Miller — Payne V ступінь (повна патоморфологічна відповідь) зареєстровано у 2 (3,3%) пацієнток, IV ступінь — у 7 (11,3%) хворих, III — у 50 (80,6%) пацієнток, II ступінь відмічено у 3 (4,8%) хворих, I ступеня лікувального патоморфозу не виявлено у жодної пацієнтки у нашому дослідженні. За результатами морфологічного дослідження пухлини визначено слабо виражену інфільтрацію пухлини лімфоїдними клітинами у 20 (32,25%) пацієнток, ще у 20 (32,25%) хворих — значно виражену інфільтрацію лімфоїдними клітинами та у 22 (35,5%) пацієнток виявлено помірну інфільтрацію.
Молекулярно-генетичне дослідження обстежуваної групи хворих із місцево-поширеним РГЗ виявило генотип N/N за геном CCR5 (del32) у 46 (73,8%) пацієнток, генотип N/del32 за геном CCR5 — у 15 (24,6%) та генотип del32/del32 за геном CCR5 — в 1 (1,6%) пацієнтки.
На сьогодні пухлинаінфільтруючі лімфоцити можна розглядати як достовірний прогностичний та предиктивний біомаркер, який доцільно включати в діагностичний алгоритм при РГЗ. Один із механізмів, за допомогою яких CCL5 стимулює прогресію РГЗ, реалізується шляхом зміни рівноваги в імунному інфільтраті в тканині пухлини в бік домінування клітин із пропухлинною активністю, а не навпаки. Насправді CCL5 зміщує баланс між різними типами лімфоїдних клітин за рахунок збільшення міграції та активації пухлиноасоційованих макрофагів [12], які продукують проангіогенні фактори, цитокіни, що пригнічують протипухлинну імунну відповідь та протипухлинну активність Т-лімфоцитів [13]. Експресія CCL5 клітинами РГЗ є цінним прогностичним фактором для виявлення пацієнтів з підвищеним ризиком рецидиву при ІІ стадії захворювання [14]. У хворих на РГЗ порівняно зі здоровими особами відзначають підвищення рівня експресії CCL5 у сироватці крові [15] та тенденцію до зростання частоти виявлення метастазів в аксилярних лімфатичних вузлах, збільшення розміру первинної пухлини, формування лімфоваскулярної інвазії та мультицентричного росту РГЗ при підвищенні експресії CCL5 у сироватці крові [16].
У нашому дослідженні при вивченні особливостей лімфогенного метастазування у пацієнток з місцево-поширеним РГЗ у носіїв генотипу N/N за геном CCR5 зростав ризик виявлення пухлини з відсутністю експресії рецепторів стероїдних гормонів (RR=3,27; 1,05–5,49; p<0,05). Так, в групі рецептор-негативних пухлин з наявністю метастазів в аксилярних лімфовузлах генотип N/N за геном CCR5 виявлено у 88,9% пацієнток, тоді як генотип N/del32 за геном CCR5 — лише у 11,1%. Натомість в групі гормонозалежних пухлин з ураженням лімфовузлів носіїв алеля N/N за геном CCR5 було лише 71,0% порівняно з 88,9% у пацієнток з рецептор-негативними пухлинами, а носіїв генотипу N/del32 за геном CCR5 зареєстровано більше — у 29% хворих порівняно з 11,1% пацієнток з рецептор-негативними пухлинами. У пацієнток без метастазів у регіонарних лімфатичних вузлах асоціації делеційного поліморфізму гена CCR5 із розповсюдженістю процесу та біологічними особливостями пухлини, такими як експресія рецепторів стероїдних гормонів, не виявлено.
У 2015 р. на щорічному Breast Cancer Symposium, який проводить Американська Асоціація клінічних онкологів (American Society of Clinical Oncology — ASCO), представлено дані дослідження ролі делеції гена CCR5 (del32) та її асоціації з РГЗ. Отримані результати дозволили дослідникам зробити висновок, що делеція гена CCR5 (del32), яка зумовлює синтез нефункціонального рецептора CCR5, призводить до хронізації запалення та стимуляції пухлинної прогресії [10]. При дослідженні імунного мікрооточення пухлини ми отримали цікаві результати. Так, в групі пухлин з відсутністю експресії рецепторів стероїдних гормонів виявлено асоціацію гена CCR5 з інфільтрацією пухлини CD4 лімфоцитами (р=0,007) та CD8 лімфоцитами (р=0,02). При цьому в групі пухлин із відсутньою або слабо вираженою інфільтрацією лімфоїдними клітинами також відмічено з’язок гена CCR5 із експресією CD4 (р=0,04).
У пацієнток із місцево-поширеним РГЗ у носіїв алеля N/del32 за геном CCR5 виявлено пряму кореляційну залежність проліферативної активності пухлини з її інфільтрацією CD4 лімфоцитами та регуляторними FOXP3 лімфоцитами. Зі збільшенням індексу проліферативної активності Кі-67 підвищувалася експресія CD4 лімфоцитів (r=0,98; р=0,001) та регуляторних FOXP3 лімфоцитів (r=0,89; р=0,001) в мікрооточенні пухлини.
В аспекті вивчення проблем РГЗ нині актуальними є дослідження, сфокусовані на виявленні причин можливості або неможливості тих чи інших його видів індукувати протипухлинну імунну відповідь та з’ясуванні, яким чином системна терапія змінює мікрооточення пухлини імунокомпетентними клітинами. Більшість наукових досліджень, в яких вивчали механізми дії хіміотерапевтичних засобів та променевої терапії, сфокусовані на внутрішньоклітинних механізмах реалізації протипухлинного ефекту. Але дані останніх фундаментальних та клінічних досліджень свідчать про важливість позаклітинних факторів, а особливо протипухлинної імунної відповіді, які опосередковують цитотоксичну дію хіміотерапевтичних агентів та променевої терапії [17−21]. Проведений дисперсійний аналіз у нашому дослідженні показав асоціацію гена CCR5 з ефективністю передопераційної хіміотерапії (р=0,02), без урахування впливу таких загальновідомих чинників, як розмір первинної пухлини та ураження лімфатичних вузлів, гістологічний тип інфільтративного протокового раку, індекс проліферативної активності Кі-67, негативний рецепторний статус стероїдних гормонів у пухлині. Також заслуговує уваги те, що вплив гена CCR5 на зменшення об’єму життєздатної залишкової пухлини був статистично достовірним при гормонозалежних пухлинах (р=0,03) і залишався на рівні тенденції при рецептор-негативних пухлинах (р=0,06). Крім того, об’єм життєздатної залишкової пухлини був достовірно меншим у носіїв генотипу N/del32 за геном CCR5 (р=0,04), також відмічено тенденцію до його зменшення у носіїв генотипу del32/del32 за геном CCR5 (р=0,05) порівняно з носіями генотипу N/N за геном CCR5.
Висновки
1. У носіїв генотипу N/N за геном CCR5 (del32) достовірно частіше виявляли пухлини без експресії рецепторів естрогену та прогестерону (RR=3,27; 1,05–5,49; p<0,05).
2. У носіїв генотипу N/del32 за геном CCR5 (del32) визначено прямий кореляційний зв’язок між проліферативною активністю пухлини та інфільтрацією строми пухлини CD4 лімфоцитами та регуляторними FOXP3 лімфоцитами. Зі збільшенням індексу проліферативної активності Кі-67 зростала експресія CD4 лімфоцитів (r=0,98; р=0,001) та регуляторних FOXP3 лімфоцитів (r=0,89; р=0,001).
3. Неоад’ювантна терапія була достовірно ефективнішою у пацієнток з генотипом N/del32 за геном CCR5 (del32) (р=0,04), що потребує подальшого дослідження з метою можливості його використання як прогностичного маркера.
Список використаної літератури
1. Forman D., Ferlay J. (2014) The global and regional burden of cancer. International Agency for Research on Cancer, Lyon, France: 64–185.
2. Howlader N., Noone A.M., Krapcho M. et al. (1975) SEER Cancer Statistics Review, 1975–2013. National Cancer Institute (http://seer.cancer.gov/csr/1975_2013/), based on November 2015 SEER data submission, posted to the SEER web site, April 2016.
3. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2016) Рак в Україні, 2014–2015. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 17: 46–47.
4. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) (2005) Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet, 365: 1687–717.
5. Hanahan D., Weinberg R.A. (2011) Hallmarks of cancer: the next generation. Cell, 144: 646–674.
6. Осинский С.П. (2012) Микроокружение опухолевых клеток и опухолевая прогрессия. Здоров’я України. Темат. номер: онкологія: 34–36.
7. Ming-Ju Tsai, Wei-An, Chang Ming-Shyan Huang, Po-Lin Kuo (2014) Tumor microenvironment: a new treatment target for cancer. ISRN Biochemistry, 2014, 8 р.
8. Aldinucci D., Colombatti1 A. (2014) Hindawi Publishing Corporation. Mediators of Inflammation; 2014: 12 p. (http://dx.doi.org/10.1155/2014/292376).
9. Velasco-Velazquez M., Jiao X., De La Fuente M. et al. (2012) CCR5 antagonist blocks metastasis of basal breast cancer cells. Cancer Res., 72: 3839–3850.
10. Azhar A., Fatima F., Hameed A., Saleem S. (2015) Delta 32 mutation in CCR5 gene and its association with breast cancer. J. Clin. Oncol., 33 (28S): 17.
11. Velasco-Velázquez M., Xolalpa W., Pestell R.G. (2014) The potential to target CCL5/CCR5 in breast cancer. Expert. Opin. Ther. Targets, 18(11): 1265–1275.
12. Soria G., Ben-Baruch A. (2008) The inflammatory chemokines CCL2 and CCL5 in breast cancer. Cancer Lett., 267(2): 271–285.
13. Azenshtein E., Luboshits G., Shina S. et al. (2002) The CC chemokine RANTES in breast carcinoma progression: regulation of expression and potential mechanisms of promalignant activity. Cancer Res., 62(4): 1093–1102.
14. Yaal-Hahoshen N., Shina S., Leider-Trejo L. et al. (2006) The chemokine CCL5 as a potential prognostic factor predicting disease progression in stage II breast cancer patients. Clin. Cancer Res., 12(15): 4474–4480.
15. Dehqanzada Z.A., Storrer C.E., Hueman M.T. et al. (2007) Assessing serum cytokine profiles in breast cancer patients receiving a HER2/neu vaccine using Luminex technology. Oncol. Rep., 17(3): 687–694.
16. Smeets A., Brouwers B., Hatse S. et al. (2013) Circulating CCL5 levels in patients with breast cancer: is there a correlation with lymph node metastasis? ISRN Immunol., 2013, 5 p.
17. Yi E.H., Lee C.S., Lee J.K. et al. (2013) STAT3-RANTES autocrine signaling is essential for tamoxifen resistance in human breast cancer cells. Mol. Cancer Res., 11(1): 31–42.
18. Andre F., Dieci M., Dubsky P. et al. (2012) Molecular pathways: involvement of immune pathways in the therapeutic response and outcome in breast cancer. Clin. Cancer Res., 19(1): 28–33.
19. Ruffell B., Au A., Rugo H.S. et al. (2012) Leukocyte composition of human breast cancer. Proc. Natl. Acad. Sci USA, 109: 2796–2801.
20. Stagg J., Allard B. (2013) Immunotherapeutic approaches in triple negative breast cancer: latest research and clinical prospects. Ther. Adv. Med. Oncol., 5(3): 169–181.
21. Zitvogel L., Kepp O., Kroemer G. (2011) Іmmune parameters affecting the efficacy of chemotherapeutic regimens. Nat. Rev. Clin. Oncol., 8: 151–160.
Влияние аллельного полиморфизма гена CCR5 на течение местно-распространенного рака грудной железы
Национальный институт рака, Киев
Резюме. В аспекте изучения проблем рака грудной железы (РГЖ) на сегодня актуальны исследования, сфокусированные на выяснении, почему те или иные его виды могут или не могут индуцировать противоопухолевый иммунный ответ и каким образом системная терапия меняет микроокружение опухоли иммунокомпетентными клетками. CCR5 (С-С рецептор хемокинов 5) — белок, кодируемый соответствующим геном и представляющий собой рецептор адгезии, — расположен на Т-лимфоцитах, макрофагах, дендритных клетках. В процессе канцерогенеза онкогенная трансформация клеток индуцирует экспрессию CCR5 при многих типах солидных опухолей, таких как меланома кожи, рак желудка, колоректальный рак, рак предстательной железы, рак яичника и РГЖ. Один из механизмов, с помощью которых CCL5 стимулирует прогрессию РГЖ, реализуется путем изменения равновесия в иммунном инфильтрате в ткани опухоли в сторону доминирования клеток с противоопухолевой активностью, а не наоборот. Сигнальный путь CCR5/CCL5 смещает баланс между различными типами лимфоидных клеток. В нашей работе исследовали ассоциацию полиморфизма гена С-С рецептора хемокинов 5 (CCR5 (del32)) с характером иммунного инфильтрата в ткани опухоли и его влияние на эффективность неоадъювантной химиотерапии при местно-распространенном РГЖ. Полученные результаты свидетельствуют о целесообразности дальнейшего изучения полиморфизма гена CCR5 при РГЖ.
рак грудной железы, химиотерапия, полиморфизм.
Адреса:
Верьовкіна Наталія Олегівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: 15a78nataliia@gmail.com














Leave a comment