Застосування метаболічної позитронно-емісійної томографії, об’єднаної з комп’ютерною томографією, в обстеженні пацієнтів з місцево-розповсюдженими інвазивними карциномами грудної залози
Резюме. У дослідженні ретроспективно проаналізовано результати проведення позитронно-емісійної томографії з комп’ютерною томографією (ПЕТ-КТ) у пацієнток з місцево-розповсюдженими протоковими карциномами грудної залози, в першу чергу, для оцінки віддаленого метастазування в когорті хворих без клінічних ознак такого ураження. Істотна кількість (близько 30%) таких пацієнтів мали в подальшому ознаки верифікованого віддаленого метастатичного ураження, виявленого при ПЕТ-КТ. Застосування цієї модальності візуалізації у зазначеній когорті впливає на менеджмент пацієнтів через змінні стадії хвороби та забезпечує базові дані метаболічної активності системного неопластичного процесу для подальшого моніторингу та оцінки ефективності терапії.

Вступ
Рак грудної залози — це найпоширеніша злоякісна пухлина серед жінок у світі й одна з головних причин онкологічної смертності жіночого населення із близько 1,38 млн нових випадків та близько 458 тис. смертей щорічно [1]. В Україні, за останніми даними Національного канцер-реєстру, захворюваність на рак грудної залози становить 63,7, а смертність — 24,6 на 100 тис. жіночого населення [2].
Відомо багато факторів ризику розвитку раку грудної залози, проте точна причина виникнення цих злоякісних пухлин залишається невстановленою. Сімейний анамнез, обтяжений за раком грудної залози, наприклад, є добре відомим чинником підвищення ризику розвитку захворювання у 2–3 рази. Також, як вважають, наявність гена BRCA (1 та 2), р53 мутацій асоційована з дуже високим ризиком виникнення злоякісних пухлин грудної залози [3].
Для виявлення та стадіювання злоякісних пухлин грудної залози в клінічній практиці найбільш широко застосовують структурні модальності радіологічної візуалізації, такі як рентгенівська мамографія, ультразвукове дослідження, комп’ютерна (КТ) та магнітно-резонансна томографія (МРТ). Проте розвиток технології візуалізації, як в рентгенівських, так і магнітно-резонансних томографічних методах (КТ та МРТ), та впровадження нових модальностей візуалізації грудної залози, в тому числі оптичної візуалізації, однофотонної емісійної томографії, позитронно-емісійної томографії (ПЕТ), пропонують отримання нового спектра анатомічної, функціональної, метаболічної інформації від макроскопічного до молекулярного рівня.
Точне стадіювання, або визначення розповсюдженості захворювання, важливе для прийняття рішення щодо тактики лікування пацієнта із раком грудної залози. У декількох дослідженнях фахівці вже звертали увагу на незначну користь ПЕТ-КТ з фтордезоксиглюкозою в стадіюванні хвороби за рано виявленими карциномами грудної залози — пухлинами розміром 2–3 см та без лімфатичних вузлів, що пальпуються (клінічна маніфестація більшості злоякісних новоутворень грудної залози) [4–8]. Добре відома низька чутливість метаболічної ПЕТ-КТ порівняно з біопсією сторожового лімфатичного вузла [4–6], а вірогідність наявності віддаленого метастазування карциноми грудної залози в ранніх стадіях вкрай низька [7, 8]. Ці фактори в комбінації з високою, проте обмеженою специфічністю метаболічної ПЕТ-КТ призводять до відносного переважання хибнопозитивних результатів та обмеженої кількості істинно позитивних знахідок, що зі свого боку зумовлює підвищення рівня занепокоєння пацієнтів та затримки початку лікування через необхідність дообстежень при рутинному застосуванні метаболічної ПЕТ-КТ у пацієнтів з ранніми стадіями раку грудної залози. І навпаки, у пацієнтів з високим ризиком, наприклад із запальними формами пухлинного ураження (T4d) або місцево-розповсюдженими формами [9, 10], у низці досліджень підкреслюють важливість застосування метаболічної ПЕТ-КТ [11–15]. Останнім часом у багатьох публікаціях також наголошують на цінності методу не тільки для пацієнтів з високим, але й «помірним/невизначеним» ризиком — з клінічними стадіями ІІІВ (T2N1/T3N0) та вище [16–18].
Метою цього ретроспективного дослідження є оцінка результатів проведення метаболічної ПЕТ-КТ для стадіювання у пацієнтів із вперше виявленими карциномами грудної залози, що маніфестували з клінічними ознаками місцево-розповсюдженої хвороби або клінічно «позитивним» ураженням аксилярних лімфатичних вузлів, за відсутності клінічних ознак або даних інших візуалізаційних методів, проведених на момент встановлення діагнозу на користь віддаленого розповсюдження хвороби.
Об’єкт і методи дослідження
Дослідження проводили на базі Лікарні ізраїльської онкології LISOD. Ретроспективно відібрано 32 пацієнти (усі жінки) середнім віком 48,5 року із вперше виявленими гістологічно верифікованими інвазивними протоковими карциномами грудної залози, без клінічних ознак віддаленого розповсюдження хвороби або наявних даних інших візуалізаційних методів обстежень на момент встановлення діагнозу, які б свідчили на користь віддаленого метастазування, але з ознаками місцево-розповсюдженої хвороби або клінічно «позитивним» ураженням лімфатичних вузлів аксилярної ділянки.
Усім цим пацієнткам, з метою визначення розповсюдження пухлинного процесу, в першу чергу, щодо наявності ознак віддаленого метастазування, проведено метаболічну ПЕТ-КТ. Обстеження виконували за допомогою комбінованого ПЕТ-КТ сканера Philips GEMINI 16. Протокол діагностичного обстеження сформований згідно з рекомендаціями Європейської асоціації ядерної медицини (European Association of Nuclear Medicine — EANM) щодо ПЕТ-КТ візуалізації із застосуванням фтордезоксиглюкози, міченої 18F, при дослідженні пацієнтів із онкологічною патологією [19].
Дослідження передбачає послідовне отримання даних ПЕТ- та КТ-сканувань приблизно через 1 год після внутрішньовенного введення 18F-фтордезоксиглюкози. Застосована активність розраховується залежно від маси тіла пацієнта та методу збору даних томографа. КТ-частина дослідження являла собою повноцінне діагностичне сканування із внутрішньовенним підсиленням та окремим скануванням на рівні грудної клітки із затримкою дихання до контрастування. Пацієнти не приймали їжу за 6 год до початку дослідження, перед введенням радіофармпрепарату перевіряли та задокументовували рівень глікемії.
Корекцію отриманих емісійних даних здійснювали на основі трансмісійної синограми КТ-частини дослідження. Для проведення кількісного аналізу отриманих емісійних даних розраховано стандартизовані показники накопичення (SUV), нормалізовані за масою тіла пацієнта. Аналіз та постобробку зображень, у тому числі з кількісним аналізом ПЕТ-даних, проводили за допомогою програмного забезпечення OsirixMD, з використанням мультипланарних реконструкцій та відображення повного масиву ПЕТ-даних за допомогою реконструкції проекції максимальних інтенсивностей (MIP).
Результати та їх обговорення
У 9 (28%) із 32 обстежених пацієнток виявлено ПЕТ-КТ-ознаки віддаленого метастатичного ураження (Mx → M1). У всіх цих хворих визначалися прояви ураження кісток скелета (у 3 випадках – склеротичного характеру, 6 — літичного або без явних ознак кісткової деструкції за даними структурної КТ частини дослідження — у 3 випадках, рис. 1), а в 4 — у поєднанні з ознаками метастатичного ураження легень та/або печінки чи нерегіонарних лімфатичних вузлів (рис. 2, 3).
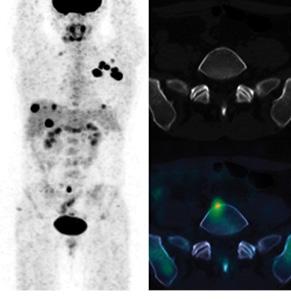
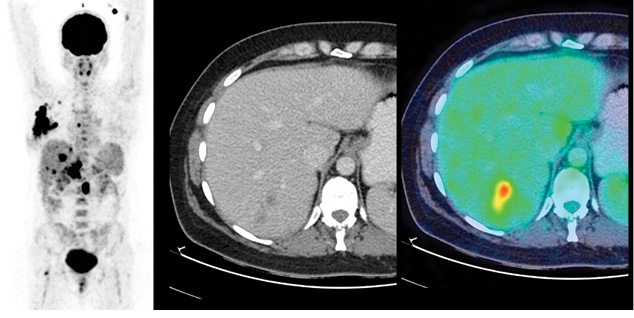
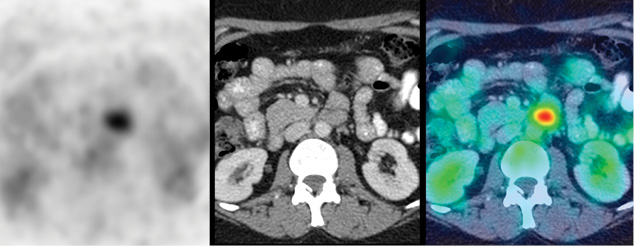
Характеристики пацієнтів з ознаками розповсюдженого неопластичного ураження наведено у таблиці.
Верифікацію віддаленого метастатичного ураження проводили шляхом гістологічного дослідження пункційного матеріалу, який отримували при аспіраційних чи трепан-біопсіях під контролем ультразвукової чи КТ-візуалізації, а при неможливості одержати морфологічну верифікацію — за наявності типових радіологічних ознак при контрольних обстеженнях або відповідних змінах чи прогресуванні після проведення спеціального системного лікування.
Серед пацієнток без ознак віддаленого метастатичного ураження за даними ПЕТ-КТ у 2 із 23 виявлено симптоми вторинного ураження лімфатичних вузлів аксилярної ділянки, що не мали попередніх клінічних проявів (сN0 → rN1) та в подальшому були підтверджені за даними гістологічного дослідження післяопераційного матеріалу.
Таблиця. Характеристики пацієнтів із ПЕТ-КТ-ознаками розповсюдженого неопластичного ураження
| № | Первинне стадіювання за даними клінічного та локального/ мамографічного обстеження |
Ступінь диференціації пухлини | Her2/neu статус | Локалізація віддаленого метастатичного ураження |
||||
| T | N | Кістки | Печінка | Легені | Нерегіонарні лімфатичні вузли та/або інші структури | |||
| 1 | 2 | 2 | G2 | +++ | Склеротичні | + | + | − |
| 2 | 2 | 1 | G3 | ++ | Літичні | − | − | + |
| 3 | 2 | 1 | G2 | +++ | Склеротичні | − | − | − |
| 4 | 2 | 3 | G3 | − | Літичні | – | − | − |
| 5 | 4b | 1 | G3 | − | Літичні | + | − | − |
| 6 | 4b | 3 | G2 | ++ | Літичні | − | − | + |
| 7 | 3 | 1 | G2 | − | Літичні | − | − | − |
| 8 | 2 | 1 | G2 | ++ | Склеротичні | − | − | − |
| 9 | 3 | 2 | G3 | +++ | Літичні | − | − | − |
У лікуванні пацієнтів з раком грудної залози точне первинне визначення розповсюдження захворювання важливе для вибору оптимальної тактики та прогнозування перебігу патологічного процесу. В останні роки декілька груп авторів проводили дослідження щодо клінічної ролі метаболічної ПЕТ-КТ в оцінці раку грудної залози перед початком лікування порівняно з конвенційними радіологічними модальностями. Ці дослідження продемонстрували, що ПЕТ-КТ є особливо корисною у виявленні екстрааксилярного (над-/підключичні та внутрішні мамарні вузли) лімфатичного розповсюдження та клінічно «мовчазних» віддалених метастазів порівняно з конвенційними модальностями, а саме у пацієнтів із запальними формами пухлинного ураження [12, 13] та з ІІ–ІІІ стадіями захворювання [20, 21].
Одним із найбільш надійних предикторів виживаності пацієнтів з раком грудної залози є метастазування в аксилярні лімфатичні вузли [22]. Інформація щодо статусу лімфатичних вузлів аксилярної ділянки впливає на прийняття рішення щодо тактики лікування. Декілька груп авторів [23–25] досліджували ПЕТ-КТ в оцінці аксилярних лімфатичних вузлів та довели, що метаболічна ПЕТ-КТ має в основному низьку чутливість (24–82%), але високу специфічність (80–100%) та високу позитивну предиктивну цінність (PPV), що перевищує 80%. Так, наприклад, в одному з оглядів [26], що в якому аналізували обстеження 472 пацієнтів, загальна чутливість була відносно низькою (60%), проте специфічність сягала 97%. Подібні дані свідчать про те, що пацієнтам із ПЕТ-позитивною аксилярною ділянкою слід проводити лімфодисекцію, а не біопсію сторожового лімфатичного вузла, в той час як низька чутливість свідчить та підтверджує необхідність біопсії сторожового вузла у пацієнтів з ПЕТ-негативною аксилярною ділянкою.
При оцінці віддаленого розповсюдження пухлинного процесу грудної залози, в першу чергу, мова йде про залучення кісткових структур, близько 65% пацієнтів із розповсюдженими пухлинами мають метастатичне ураження кісток [27]. Кісткова сцинтиграфія довгий час була стандартом пошуку метастатичного ураження кісткової тканини у пацієнтів з карциномами грудної залози. Проте багато груп дослідників дійшли висновку, що метаболічна ПЕТ більш ефективна, ніж КТ чи кісткова сцинтиграфія, у візуалізації літичних уражень та уражень змішаного характеру, уражень кісткового мозку. Декілька авторів [28, 29] резюмували, що ПЕТ, об’єднана з КТ, є більш точною, ніж сцинтиграфія, у виявленні метастатичного ураження кісток у цілому.
Висновки
Застосування метаболічної ПЕТ-КТ у пацієнтів із місцево-розповсюдженими формами злоякісних інвазивних пухлин грудної залози дає змогу виявити ознаки віддаленого метастатичного ураження в істотній частці цієї популяції. З огляду на те, що у проаналізованій когорті пацієнти не мали клінічних ознак віддаленого метастазування на момент виявлення, використання комбінованого методу радіологічної візуалізації здійснює вагомий вплив на процес стадіювання хвороби та вибору подальшої тактики лікування саме в цій групі хворих. Окрім цього, можливість об’єктивного кількісного аналізу метаболічних даних, отриманих при ПЕТ-КТ, слугують базовою лінією для подальшої оцінки ефективності системної терапії та моніторингу метаболічної активності розповсюдженого неопластичного процесу.
Список використаної літератури
1. GLOBOCAN 2012, Cancer Incidence and Mortality Worldwide: IARC Cancer Base (http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx).
2. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін. (2017) Рак в Україні, 2015–2016. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 8: 46–47.
3. Lacey J.V., Kreimer A.R., Buys S.S. et al. (2009) Breast cancer epidemiology according to recognized breast cancer risk factors in the prostate, lung, colorectal and ovarian (PLCO) cancer screening trial cohort. BMC Cancer, 9: 84.
4. Wahl R.L., Siegel B.A., Coleman R.E. et al. (2004) Prospective multicenter study of axillary nodal staging by positron emission tomography in breast cancer: a report of the Staging Breast Cancer with PET Study Group. J. Clin. Oncol., 22: 277–285.
5. Veronesi U., De Cicco C., Galimberti V.E. et al. (2007) A comparative study on the value of FDG-PET and sentinel node biopsy to identify occult axillary metastases. Ann. Oncol., 18: 473–478.
6. Cooper K.L., Harnan S., Meng Y. et al. (2011) Positron emission tomography (PET) for assessment of axillary lymph node status in early breast cancer: a systematic review and meta-analysis. Eur. J. Surg. Oncol., 37: 187–198.
7. Pritchard K.I., Julian J.A., Holloway C.M.B. et al. (2012) Prospective study of 2-[18F]fluorodeoxyglucose positron emission tomography in the assessment of regional nodal spread of disease in patients with breast cancer: an Ontario Clinical Oncology Group study. J. Clin. Oncol., 30: 1274–1279.
8. Jeong Y.J., Kang D.Y., Yoon H.J. et al. (2014) Additional value of F-18 FDG PET/CT for initial staging in breast cancer with clinically negative axillary nodes. Breast Cancer Res. Treat., 145: 137–142.
9. Edge S.B., Compton C.C. (2010) The American Joint Committee on Cancer: the 7th edition of the AJCC Cancer Staging Manual and the future of TNM. Ann. Surg. Oncol., 17: 1471–1474.
10. NCCN clinical practice guidelines in oncology. Breast cancer. National Comprehensive Cancer Network website (http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf).
11. van der Hoeven J.J., Krak N.C., Hoekstra O.S. et al. (2004) 18F-2-fluoro-2-deoxy-D-glucose positron emission tomography in staging of locally advanced breast cancer. J. Clin. Oncol., 22: 1253–1259.
12. Carkaci S., Macapinlac H.A., Cristofanilli M. et al. (2009) Retrospective study of 18F-FDG PET/CT in the diagnosis of inflammatory breast cancer: preliminary data. J. Nucl. Med., 50: 231–238.
13. Alberini J-L., Lerebours F., Wartski M. et al. (2009) 18F-fluorodeoxyglucose positron emission tomography/computed tomography (FDG-PET/CT) imaging in the staging and prognosis of inflammatory breast cancer. Cancer, 115: 5038–5047.
14. Walker G.V., Niikura N., Yang W. et al. (2012) Pretreatment staging positron emission tomography/computed tomography in patients with inflammatory breast cancer influences radiation treatment field designs. Int. J. Radiat. Oncol. Biol. Phys., 83: 1381–1386.
15. Groheux D., Giacchetti S., Delord M. et al. (2013) 18F-FDG PET/CT in staging patients with locally advanced or inflammatory breast cancer: comparison to conventional staging. J. Nucl. Med., 54: 5–11.
16. Cochet A., Dygai-Cochet I., Riedinger J.M. et al. (2014) 18F-FDG PET/CT provides powerful prognostic stratification in the primary staging of large breast cancer when compared with conventional explorations. Eur. J. Nucl. Med. Mol. Imaging, 41: 428–437.
17. Riedl C.C., Slobod E., Jochelson M. et al. (2014) Retrospective analysis of 18F-FDG PET/CT for staging asymptomatic breast cancer patients younger than 40 years. J. Nucl. Med., 55: 1578–1583.
18. Krammer J., Schnitzer A., Kaiser C.G. et al. (2015) 18F-FDG PET/CT for initial staging in breast cancer patients: is there a relevant impact on treatment planning compared to conventional staging modalities? Eur. Radiol., 25: 2460–2469.
19. Boellaard R., Delgado-Bolton R., Oyen W.J. et al. (2015) FDG PET/CT:EANM procedure guidelines for tumour imaging: version 2.0. Eur. J. Nucl. Med. Mol. Imaging, 42(2): 328–354.
20. Aukema T.S., Straver M.E., Peeters M.J. et al. (2010) Detection of extra-axillary lymph node involvement with FDG PET/CT in patients with stage II–III breast cancer. Eur. J. Cancer, 46: 3205–3210.
21. Gunalp B., Ince S., Karacalioglu A.O. et al. (2012) Clinical impact of 18F-FDG PET/CT on initial staging and therapy planning for breast cancer. Exp. Ther. Med., 4: 693–698.
22. Arriagada R., Le M.G., Dunant A. et al. (2006) Twenty-five years of follow-up in patients with operable breast carcinoma: correlation between clinicopathologic factors and the risk of death in each 5-year period. Cancer, 106: 743–750.
23. Koolen B.B., Valdés Olmos R.A., Elkhuizen P.H. et al. (2012) Locoregional lymph node involvement on 18F-FDG PET/CT in breast cancer patients scheduled for neoadjuvant chemotherapy. Breast Cancer Res. Treat., 135: 231–240.
24. Ahn J.H., Son E.J., Kim J.A. et al. (2010) The role of ultrasonography and FDG-PET in axillary lymph node staging of breast cancer. Acta Radiol., 51: 859–865.
25. Zhang X., Wu F., Han P. (2014) The role of 18F-FDG PET/CT in the diagnosis of breast cancer and lymph nodes metastases and micrometastases may be limited. Hell. J. Nucl. Med., 17: 177–183.
26. Robertson I.J., Hand F., Kell M.R. (2011) FDG-PET/CT in the staging of local/regional metastases in breast cancer. Breast, 20: 491–494.
27. Lee Y.T. (1983) Breast carcinoma: pattern of metastasis at autopsy. J. Surg. Oncol., 23: 175–180.
28. Morris P.G., Lynch C., Feeney J.N. et al. (2010) Integrated positron emission tomography/computed tomography may render bone scintigraphy unnecessary to investigate suspected metastatic breast cancer. J. Clin. Oncol., 28: 3154–3159.
29. Hahn S., Heusner T., Kümmel S. et al. (2011) Comparison of FDG-PET/CT and bone scintigraphy for detection of bone metastases in breast cancer. Acta Radiol., 52: 1009–1014.
Использование метаболической
позитронно-эмиссионной томографии, объединенной с компьютерной томографией, в обследовании пациентов
с местно-распространенными инвазивными карциномами грудной железы
Клиника израильской онкологии LISOD, Киевская обл.,
Обуховский р-н, с. Плюты
Резюме. В представленном исследовании ретроспективно проанализированы результаты проведения позитронно-эмиссионной томографии с компьютерной томографией (ПЭТ-КТ) у пациенток с местно-распространенными протоковыми карциномами грудной железы, в первую очередь, для оценки отдаленного метастазирования в когорте больных без клинических признаков такого поражения. Существенное количество (около 30%) таких пациентов имели признаки в дальнейшем верифицированного отдаленного метастатического поражения, выявленного при ПЭТ-КТ. Использование данной модальности визуализации в указанной когорте влияет на менеджмент пациентов из-за смены стадии заболевания и обеспечивает базовые данные метаболической активности системного неопластического процесса для дальнейшего мониторинга и оценки эффективности терапии.
Ключевые слова: злокачественные опухоли грудной железы, стадирование, позитронно-эмиссионная томография, отдаленное метастазирование, местно-распространенные формы карцином грудной железы.
Use of metabolic positron emission tomography/computed tomography in patients with locally advanced invasive breast carcinomas
Israeli Oncological Hospital LISOD,
Pliuty, Obukhivskyi dist., Kyiv region
Summary. Current study presents retrospective analysis of performing positron emission tomography/computed tomography (PET/CT) in patients with locally advanced invasive ductal breast carcinoma, first of all, in order to assess distant metastasis in patients without clinical evidence of systemic spread. Substantial amount of such patients (around 30%) showed PET/CT evidence of subsequently proven metastatic disease. Utilizing this imaging modality in abovementioned patient cohort impacts patient management due to upstaging and provides baseline metabolic data for monitoring and response assessment.
Key words: malignant breast tumors, staging, PET/CT, distant metastasis, locally advanced breast carcinomas.
Адреса:
Новіков Микола Євгенович
08720, Київська обл., Обухівський р-н,
с. Плюти, вул. А. Малишка, 27
Лікарня ізраїльської онкології LISOD
E-mail: nicknovi@gmail.com














Leave a comment