Низькодозовий циклофосфамід у лікуванні пацієнтів з лімфогенними метастазами меланоми шкіри
Коровин С.И., Остафийчук В.В., Кукушкина М.Н., Паливец А.Ю., Костюк В.Ю.
Резюме. У дослідження включено 86 хворих на меланому шкіри з синхронними та метахронними метастазами в регіонарних лімфатичних вузлах. Залежно від схеми лікування пацієнтів розподілено на основну та контрольну групи. Після гістологічного підтвердження діагнозу хворим обох груп був призначений курс середньодозової αальфа-2b-інтерферонотерапії. Пацієнти основної групи додатково, упродовж перших 6 міс, отримували низькодозовий циклофосфамід по 50 мг per os тричі на тиждень. Безрецидивна 5-річна виживаність у хворих основної групи становила 18,2%, контрольної — 16,8% (р=0,237). Загальна 5-річна виживаність в основній групі досягла 22,7%, у контрольній — 19,0% (р=0,263)

ВСТУП
Маніфестація метастазів у регіонарних лімфатичних вузлах вважається одним з основних несприятливих факторів для багатьох злоякісних пухлин, у тому числі й меланоми шкіри (МШ). Загальна 5-річна виживаність хворих після радикальних лімфаденектомій не перевищує 40% [1, 2].
Хірургічний метод дотепер лишається провідним у лікуванні хворих із метастазами МШ в регіонарних лімфовузлах. Лікувальна лімфодисекція полягає у видаленні усього скомпрометованого лімфоколектора. Проблема профілактики подальшої прогресії захворювання у цих пацієнтів залишається невирішеною.
Різні режими післяопераційної хіміотерапії не сприяли покращенню віддалених результатів. У деяких дослідженнях автори взагалі констатували погіршення показників виживаності [3]. Встановлено, що проведення опромінення ложа видаленого лімфоколектора достовірно підвищує рівень локального контролю, проте не впливає на тривалість життя пацієнтів.
Наприкінці 90-х років минулого сторіччя таки були досягнуті позивні результати в профілактичній терапії метастатичної меланоми. Це дослідження з використанням рекомбінантного інтерферону.
Інтерферони володіють різноманітними імуномоделюючими ефектами на пухлинні клітини, які включають пряму антипроліферативну дію, підвищення активності природних клітин-кілерів, а також позитивну регуляцію пухлинних антигенів та антигенів HLA I і II класів [4]. У клінічних дослідженнях з інтерфероном при метастатичній меланомі показано частоту об’єктивної відповіді в діапазоні 10–20% [5]. З усіх підвидів інтерферонів α2b-інтерферон був найбільш детально оцінений для використання в лікуванні меланоми. Позитивні результати мультицентрових клінічних досліджень сприяли введенню курсу α2b-інтерферонотерапії в стандарт лікування хворих для виконання регіонарної лімфодисекції [6].
Серед нових методів лікування при МШ має місце такий вид терапії, як біохіміотерапія (БХТ) — використання комбінації двох методів імуно- та хіміотерапії. У пілотних дослідженнях доведено ефективність застосування БХТ при пізніх стадіях меланоми [7]. Але переконливих даних щодо використання БХТ в ад’ювантному лікуванні хворих на меланому ІІІ стадії немає.
Деякі хіміопрепарати в нестандартних дозах і режимах здатні визначати імуномоделюючий ефект. Наприклад, циклофосфамід може ініціювати позитивний імуномоделюючий ефект, зумовлений такими механізмами [8], як:
- пригнічення функції Т-регуляторних клітин (CD4+ CD25+);
- індукція факторів росту Т-клітин;
- покращення передачі пухлині реактивних Т-клітин — ефектор зі створення імунологічної ніші.
Враховуючи зазначене, ми вирішили доповнити стандартну схему ад’ювантної інтерферонотерапії курсом низькодозового циклофосфаміду.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження включено 86 хворих із синхронними та метахронними метастазами МШ у регіонарних лімфовузлах, які перебували на лікуванні в Національному інституті раку в період з січня 2006 до квітня 2009 р.
Критеріями включення пацієнтів у групи були: наявність нелікованих метастазів МШ кінцівок та тулуба в регіонарних лімфатичних вузлах, вік хворих від 18 років, ECOG 0–1 бал, відсутність клінічних ознак метастатичного ураження, що підтверджено комп’ютерною томографією (КТ) та магнітно-резонансною томографією (МРТ).
У план обстеження хворих входили: КТ органів грудної порожнини (ОГП), органів черевної порожнини (ОЧП) та малого таза; МРТ головного мозку для виключення віддалених метастазів; лабораторні дослідження.
Хірургічний етап лікування включав регіонарну лімфодисекцію з видаленням первинної пухлини за її наявності. Операцію виконували під загальною анестезією. Шви знімали на 12–14-ту добу на момент повного загоєння післяопераційної рани.
Після гістологічного підтвердження діагнозу пацієнтам проводили ад’ювантну терапію. Залежно від методу, застосованого в ад’ювантному режимі лікування, пацієнтів було розподілено на 2 групи.
В основну групу увійшли 44 пацієнти, порівну чоловіків і жінок, середній вік хворих становив 50,7±14,4 року. У лікуванні хворих основної групи з 8–9-ї доби після операції застосовано курс ад’ювантної середньодозової α2b-інтерферонотерапії за схемою: α2b-інтерферон по 9•109 міжнародних одиниць (МО) підшкірно 1 раз на добу протягом 22 днів (індукційна фаза), потім по 3•109 МО підшкірно тричі на тиждень протягом наступних 12 міс. Додатково пацієнти отримували курс низькодозового циклофосфаміду по 50 мг per os тричі на тиждень упродовж перших 6 міс.
У контрольну групу потрапили 42 пацієнти, 22 (52,4%) чоловіки та 20 (47,6%) жінок, середній вік хворих становив 48,4±13,5 року. Усі учасники цієї групи отримували профілактичний курс ад’ювантної середньодозової α2b-інтерферонотерапії за схемою: α2b-інтерферон по 9•109 МО підшкірно 1 раз на добу протягом 22 днів (індукційна фаза), потім по 3•109 МО підшкірно тричі на тиждень протягом наступних 12 міс.
Порівняльний аналіз пацієнтів у групах представлено в таблиці.
Таблиця. Порівняльний аналіз груп пацієнтів
| Характеристика | Група хворих, n (%) | ||
| Основна (n=44) | Контрольна (n=42) | ||
| Стать | Чоловіки | 22 (50,0) | 22 (52,4) |
| Жінки | 22 (50,0) | 20 (47,6) | |
| Вік, років | 18–30 | 6 (13,6) | 3 (13,2) |
| 31–50 | 9 (20,5) | 19 (45,2) | |
| >50 | 29 (65,9) | 20 (41,6) | |
| Середній вік хворих, років | 50,7±14,4 | 48,4±13,5 | |
| Локалізація первинної пухлини | Кінцівки | 22 (50,0) | 20 (41,6) |
| Тулуб | 22 (50,0) | 22 (52,4) | |
| Локалізація метастазів, лімфовузли | Пахові | 20 (45,5) | 17 (40,4) |
| Пахвові | 24 (54,5) | 23 (54,8) | |
| Шийні | 0 (0) | 2 (4,8) | |
| Синхронні метастази (ІІІ стадія) | 6 (13,6) | 13 (30,9) | |
| Метахронні метастази | 38 (86,4) | 29 (69,1) | |
Під час дослідження та після завершення проводили моніторинг пацієнтів з обов’язковим фізикальним обстеженням і контролем лабораторних показників кожні 3 міс, рентгенографією ОГП та ультразвуковим дослідженням ОЧП кожні 6 міс, у разі необхідності проводили КТ ОГП, ОЧП, малого таза та МРТ головного мозку.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
При проведенні ад’ювантної терапії як в основній, так і в контрольній групі відмічено типові для інтерферонотерапії ускладнення, такі як: підвищення температури тіла (гіпертермія), озноб, міалгія, загальна слабкість, диспептичні прояви (нудота та блювання).
Найчастішим ускладненням при лікуванні була гіпертермія І–ІІ ступеня, яка відмічалася у 100% пацієнтів та виникала через 2–4 год після введення інтерферону. Ці прояви були купірувані за допомогою нестероїдних протизапальних препаратів і на 2–3-й тиждень після початку лікування повністю зникли або проявлялися субфебрильною температурою.
У 10 (22,7%) хворих основної групи зафіксовано нудоту, у 2 (4,5%) — блювання, які усунені за допомогою антиеметиків. У контрольній групі у 4 (9,1%) пацієнтів відмічалася нудота, блювання не зафіксовано у жодному випадку.
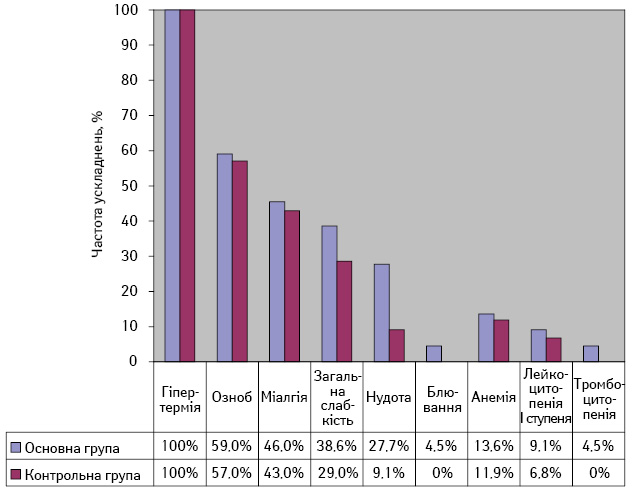
При проведенні лабораторного моніторингу у хворих основної групи анемію І–ІІ ступеня виявлено у 6 (13,6%) випадках, лейкопенію І ступеня — у 4 (9,1%), тромбоцитопенію — у 2 (4,5%) пацієнтів. У контрольній групі анемія не перевищувала І ступеня та розвинулася у 5 (11,9%) хворих, лейкопенія І ступеня виникла у 3 (6,8%) пацієнтів, тромбоцитопенії не зафіксовано в жодному випадку у пацієнтів цієї групи. З метою корекції анемії використовували препарати заліза, вираженість лейкоцитопенії та тромбоцитопенії не потребували корекції. Після закінчення лікування у хворих обох груп усі досліджувані гематологічні показники поступово нормалізувалися до фізіологічних значень. Частоту ускладнень ад’ювантної терапії наведено на рис. 1.
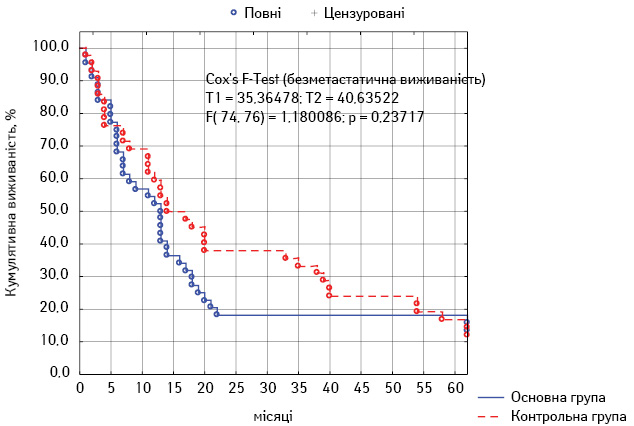
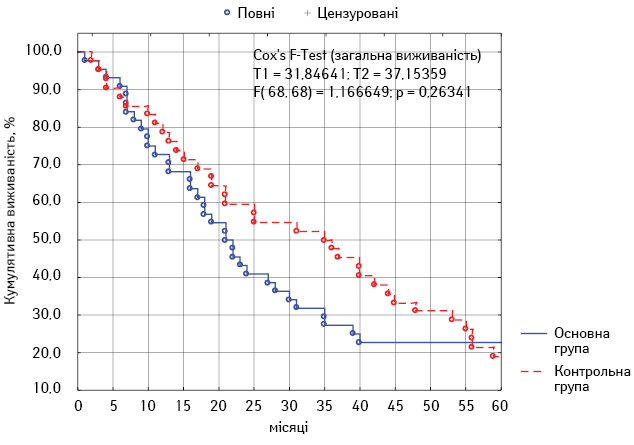
Для оцінки віддалених результатів лікування в групах ми провели порівняльний аналіз загальної та безметастатичної 5-річної виживаності.
В основній групі показник 5-річної загальної виживаності становив 18,4±5,8%, у контрольній — 16,8±5,7% (р>0,05). Безметастатична 5-річна виживаності в першій групі сягала 22,7±6,3%, у другій групі — 19,1±6,0% (р>0,05). Таким чином, обидва показники несуттєво відрізнялися в обох групах, а різниця між ними була статистично не достовірною.
Криві безметастатичної та загальної виживаності за Капланом — Мейєром представлено на рис. 2 та 3.
ВИСНОВКИ
Порівняльний аналіз безпосередніх і віддалених результатів лікування дозволив нам зробити такі висновки:
- застосування зазначених комбінацій лікування в обох групах не призводить до суттєвих ускладнень;
- доповнення профілактичної інтерферонотерапії низкодозовою метрономною хіміотерапією циклофосфамідом не зумовлює змін показників загальної та безрецидивної виживаності у хворих із метастазами в регіонарних лімфатичних вузлах.
Також ад’ювантну інтерферонотерапію при ІІІ стадії МШ із додаванням низькодозового циклофосфаміду задовільно переносять пацієнти, однак така комбінація не впливає на покращення віддалених результатів лікування хворих на МШ ІІІ стадії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Calabro A., Singletary S.E., Balch C.M. (1989) Patterns of relapse in 1001 consecutive patients with melanoma nodal metastases. Arch. Surg., 124: 1051–1055.
2. Morton D.L., Wanek L., Nizze J.A. et al. (1991) Improved long-term survival after lymphadenectomy of melanoma metastatic to regional nodes. Analysis of prognostic factors in 1134 patients from the John Wayne Cancer Clinic. Ann. Surg., 214: 491–499.
3. Dickler M.N., Coit D.G., Myers M.L. (1997) Adjuvant therapy of malignant melanoma. Surg. Oncol. Clin. N. Am., 6: 793–812.
4. Frank S.J., Meyers M. (1995) Interferon as adjuvant therapy for high risk melanoma. Melanoma Lett., 13: 1–4.
5. Legha S.S. (1989) Current therapy for malignant melanoma. Semin. Oncol., 16 (suppl. 1): 34–44.
6. Kirkwood J.M., Strawderman M.H., Ernstoff M.S. et al. (1996) Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J. Clin. Oncol., 14(1): 7–17.
7. Eton O., Legha S.S., Bedikian A.Y. et al. (2002) Sequential biochemotherapy versus chemotherapy for metastatic melanoma: Results from a phase III randomized trial. J. Clin. Oncol., 20: 2045–2052.
8. Sistigu A., Viaud S., Chaput N. et al. (2011) Immunomodulatory effects of cyclophosphamide and implementations for vaccine design. Semin. Immunopathol., 33(4): 369–383.
Низкодозовый циклофосфамид в лечении пациентов с лимфогенными метастазами меланомы кожи
Национальный институт рака, Киев
Резюме. В исследование включено 86 больных меланомой кожи с синхронными и метахронными метастазами в регионарных лимфатических узлах. В зависимости от схемы лечения пациенты распределены на основную и контрольную группы. После гистологического подтверждения диагноза больным обеих групп был назначен курс среднедозовой α2b-интерферонотерапии. Пациенты основной группы дополнительно, в течение первых 6 мес, получали низкодозовый циклофосфамид по 50 мг per os трижды в неделю. Безрецидивная 5-летняя выживаемость у больных основной группы составила 18,2%, контрольной — 16,8% (р=0,237). Общая 5-летняя выживаемость в основной группе достигла 22,7%, контрольной — 19,0% (р=0,263).
Ключевые слова: меланома кожи, метастазы, интерферон, циклофосфамид.
Low-dose cyclophosphamide in the treatment of patients with lymphogenous metastases of melanoma
National Cancer Institute, Kyiv
Summary. The study included 86 patients with skin melanoma with synchronous and metahronous metastases to the regional lymph nodes. Depending on the treatment regimen patients were divided into main and control groups. After histological confirmation of diagnosis, patients in both groups were intended course of the medium dose α2b interferon. Patients of the main group in addition, during the first 6 months, got low-dose cyclophosphamide 50 mg per os three times a week. Disease-free 5-year survival in patients of the main group was 18.2%, while the control group — 16.8% (p=0.237). Overall 5-year survival rate in the main group was 22.7%, in the control group was 19.0% (p=0.263).
Key words: skin melanoma, metastases, interferon, cyclophosphamide.
Адреса:
Остафійчук Василь Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-99-46
E-mail: lugnik2007@gmail.com














Leave a comment