Вивчення впливу гуморальних факторів крові хворих на гліоми головного мозку на субпопуляційний склад лімфоцитів у тесті реакції бласттрансформації лімфоцитів
Лисяный Н.И.1, Гнедкова И.А.2, Потапова А.Г.3, Бельська Л.М.3
- 1ГУ «Институт нейрохирургии НАМН Украины», Киев
- 2ГУ «Днепропетровская медицинская академия МЗ Украины»
- 3ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», Київ
Резюме. При злоякісних гліомах головного мозку визначаються різноспрямовані імунні порушення, а також синтез пухлинними клітинами імуносупресивних гуморальних факторів. Продукція та механізм дії гуморальних пухлинних факторів на імунні клітини вивчено недостатньо. Метою роботи було вивчення впливу сироватки периферичної крові хворих на гліоми головного мозку різного ступеня анаплазії на проліферативну активність лімфоцитів в тесті реакції бласттрансформації лімфоцитів (РБТЛ). Зразки сироватки крові 26 пацієнтів з гліомами головного мозку розподілили за ступенем анаплазії та гістологічною картиною пухлин на 4 групи і вивчали в тесті РБТЛ з фітогемаглютиніном. Облік РБТЛ проводили морфологічним методом, кількість субпопуляцій лімфоцитів визначали за допомогою моноклональних СD3, 4, 8, 16, 20 антитіл на проточному цитофлюориметрі Beckman Coulter Р-500. Встановлено, що сироватка крові хворих на гліоми III–IV ступеня анаплазії викликали статистично достовірне гальмування РБТЛ і проліферації CD4 та CD8 лімфоцитів. Вміст CD16 і CD20 субпопуляцій лімфоцитів не змінювався при дії цих зразків сироватки крові. Сироватка крові пацієнтів з гліомами I–II ступеня анаплазії не гальмувала РБТЛ і не впливала на проліферативну здатність лімфоцитів. У крові хворих на гліоми мозку III–IV ступеня анаплазії присутні фактори, які пригнічують в тесті РБТЛ активацію CD4 і CD8 субполяцій лімфоцитів, що відповідають за специфічний протипухлиний імунітет.
Резюме. При злокачественных глиомах головного мозга отмечаются разнонаправленные иммунные нарушения, а также синтез опухолевыми клетками иммуносупрессивных гуморальных факторов. Продукция и механизм действия гуморальных опухолевых факторов на иммунные клетки изучены недостаточно. Целью работы было исследование влияния сыворотки крови больных глиомами головного мозга разной степени анаплазии на пролиферативную активность лимфоцитов в тесте реакции бласттрансформации лимфоцитов (РБТЛ). Образцы сыворотки периферической крови 26 пациентов с глиомами головного мозга были разделены по степени анаплазии и гистологической картине глиом на 4 группы и изучались в тесте РБТЛ с фитогемагглютинином. Учет РБТЛ проводили морфологическим методом, количество субпопуляций лимфоцитов определяли с помощью моноклональных СD3, 4, 8, 16, 20 антител на проточном цитофлюориметре Beckman Coulter Р-500. Установлено, что сыворотка крови больных глиомами III–IV степени анаплазии вызывала статистически достоверные торможение РБТЛ и пролиферации CD4+ и CD8+ лимфоцитов. Содержание CD16+ и CD20+ субпопуляций лимфоцитов не изменялось при действии этих образцов сыворотки крови. Сыворотка крови пациентов с глиомами I–II степени анаплазии не тормозила реакцию РБТЛ и не влияла на пролиферативную способность лимфоцитов. В крови больных глиомами мозга III–IV степени анаплазии присутствуют факторы, подавляющие активацию CD4+ и CD8+ субполяций лимфоцитов, ответственных за специфический противоопухолевый иммунитет.
 Многими авторами показано, что при злокачественных глиомах головного мозга отмечаются сложные иммунные нарушения, характеризующиеся угнетением функции киллерных лимфоцитов, поляризацией макрофагов и нейтрофилов, активацией Т регуляторных супрессорных клеток и т.д. [1–5]. Причиной угнетения иммунных реакций при злокачественных опухолях является выделение клетками опухолей супрессивных факторов, в том числе интерлейкина (ИЛ)-10, β-трансформирующего фактора роста, простагландинов и др. [4–6]. Природа и механизм действия опухолевых иммуносупрессивных факторов изучены еще недостаточно, неизвестно также, выделяются ли они в циркуляцию или действуют преимущественно внутри опухоли. В периферической крови у больных глиомами мозга определяют высокие уровни как иммуносупрессивных (ИЛ-4, -10), так и провоспалительных (ИЛ-1, -6, -8) ИЛ [4, 7–9].
Многими авторами показано, что при злокачественных глиомах головного мозга отмечаются сложные иммунные нарушения, характеризующиеся угнетением функции киллерных лимфоцитов, поляризацией макрофагов и нейтрофилов, активацией Т регуляторных супрессорных клеток и т.д. [1–5]. Причиной угнетения иммунных реакций при злокачественных опухолях является выделение клетками опухолей супрессивных факторов, в том числе интерлейкина (ИЛ)-10, β-трансформирующего фактора роста, простагландинов и др. [4–6]. Природа и механизм действия опухолевых иммуносупрессивных факторов изучены еще недостаточно, неизвестно также, выделяются ли они в циркуляцию или действуют преимущественно внутри опухоли. В периферической крови у больных глиомами мозга определяют высокие уровни как иммуносупрессивных (ИЛ-4, -10), так и провоспалительных (ИЛ-1, -6, -8) ИЛ [4, 7–9].
Целью настоящей работы было изучение влияния на пролиферацию и субпопуляционный состав лимфоцитов крови в тесте реакции бласттрансформации лимфоцитов (РБТЛ) сыворотки крови пациентов с глиальными опухолями различной степени злокачественности.
Объект и методы исследования
Исследованы образцы сыворотки периферической крови 26 больных глиальными опухолями головного мозга различной степени злокачественности: глиобластомами (IV степень анаплазии) — 8, атипическими астроцитомами (III степень анаплазии) — 7, фибриллярно-протоплазматическими астроцитомами (I–II степень анаплазии) — 5, олигоастроцитомами (I–II степень анаплазии) — 6. Сыворотку получали из крови, взятой для гематологического планового обследования пациентов перед операцией, и хранили при t −20 °C. После установления гистологического типа опухоли, согласно принятой классификации [10], образцы сыворотки крови больных объединяли, а далее разделяли в зависимости от степени злокачественности новообразования на 4 группы: сыворотки глиобластом и атипических астроцитом, астроцитом и олигоастроцитом, которые использовали в дальнейших исследованиях в тесте пролиферации лимфоцитов крови в РБТЛ в присутствии фитогемагглютинина (ФГА). РБТЛ ставили с цельной кровью условно здоровых людей в микромодификации [11] с незначительными дополнениями [12] в объеме 1,0 мл среды с 10% эмбриональной телячьей сывороткой с антибиотиком гентамицином. В качестве стимулятора пролиферации использовали 100,0 мкл 0,1% раствора ФГА (фирмы Sigma). В опытные пробы добавляли по 100,0 мкл сыворотки крови больных глиомами мозга определенной гистоструктуры, в контрольный образец РБТЛ — 100,0 мкл сыворотки крови доноров.
Учет РБТЛ производили через 72 ч морфологическим методом, подсчет количества ядерных клеток в пробах после РБТЛ определяли в камере Горяева с 3% уксусной кислотой общепринятым методом. Субпопуляционный состав лимфоцитов после РБТЛ исследовали с помощью панели (CD3, 4, 8, 16, 20) моноклональных антител (Becton Diskinson), согласно рекомендациям, к антителам на проточном цитофлюориметре Beckman Coulter Р-500 [13].
Статистическую обработку данных проводили по программе статистики для Microsoft Excel 2007 г. с определением средней арифметической и стандартного статистического отклонения (m±ð) и показателя t-Стьюдента.
Результаты исследования
При исследовании количества ядросодержащих клеток после проведения РБТЛ с ФГА установлено, что изучаемые образцы сыворотки крови обладали способностью тормозить пролиферацию клеток (табл. 1). Так, в контроле РБТЛ с ФГА + сыворотка доноров количество ядросодержащих клеток составляло 1,57±0,21•106 клеток на 1,0 мл, а в пробах с исследуемой сывороткой больных концентрация клеток снижалась от 1,38±0,24 до 0,91±0,44•106 клеток/мл. Имеющиеся различия в содержании клеток после РБТЛ были статистически достоверными лишь при использовании сыворотки пациентов с атипическими астроцитомами и протоплазматическими астроцитомами (р<0,05). При морфологическом учете РБТЛ отмечено, что сыворотка крови больных глиобластомами и атипическими астроцитомами (IV и III степени анаплазии) обладала тормозящим действием на пролиферацию клеток. Так, при добавлении в РБТЛ сыворотки этих пациентов количество бластных клеток после реакции составляло 28,4±14,9 и 38,0±2,03%, тогда как в контроле — 53,3±1,2% (р<0,05). Сыворотка крови больных глиомами I и II степени анаплазии тормозила РБТЛ несущественно.
Следовательно, только сыворотка крови пациентов со злокачественными глиомами тормозит пролиферацию иммунных клеток крови при действии ФГА, что подтверждается достоверным снижением показателей РБТЛ в пробах с исследуемыми образцами (см. табл. 1).
Таблица 1. Влияние сыворотки крови больных глиомами мозга на РБТЛ
| Показатель | Контроль | Образцы сыворотки крови больных | |||
| ФГА + ГБ | ФГА + ААСТ | ФГА + АС | ФГА + ОАС | ||
| Количество образцов, n | 15 | 10 | 10 | 10 | 10 |
| Количество клеток после РБТЛ, •106 | 1,57±0,21 | 1,38±0,24 | 1,02±0,13* | 0,91±0,44* | 1,25±0,38 |
| РБТЛ, % | 53,30±0,21 | 28,4±14,94* | 38,0±20,3* | 47,7±13,4 | 42,9±21,5 |
*р<0,05 в сравнении с группой контроля. ГБ — глиобластомы; ААСТ — атипические астроцитомы; АС — астроцитомы; ОАС — олигоастроцитомы.
При исследовании субпопуляционного состава лимфоцитов после РБТЛ с ФГА с помощью панели моноклональных антител на проточном цитофлюориметре установлено, что клетки после реакции трудно гейтировать и разделять на регионы, нет четкого выделения лимфоцитарного региона, лимфоциты определяются в разных участках экрана монитора. Это потребовало подсчета содержания отдельных субпопуляций клеток после РБТЛ как в гейтированном, так и негейтированном (upgate) режиме. Содержание отдельных субпопуляций лимфоцитов после РБТЛ представлено в табл. 2, где видно, что при исследовании в негейтированном режиме анализа количество лимфоцитов каждой субпопуляции было значительно больше, чем в гейтированном лимфоцитарном регионе. Суммарно количество отдельных субпопуляций лимфоцитов независимо от метода исследования было значительно больше 100%, что указывает на то, что в процессе пролиферации лимфоидных клеток под действием ФГА может меняться экспрессия CD-молекул на клетках или появляются клетки, на которых экспрессируется несколько дифференцировочных CD-молекул.
Таблица 2. Содержание отдельных субпопуляций лимфоцитов после РБТЛ при разных режимах исследований
|
Режим исследования |
Значение | CD-субпопуляции лимфоцитов, % | ||||
| CD3 | CD4 | CD8 | CD16 | CD20 | ||
| Гейтированый | m±ð (n=9) | 44,7±9,96 | 37,5±5,57 | 25,28±9,031 | 32,3±10,81 | 35,0±7,75 |
| Негейтированный | m±ð (n=9) | 60,1±5,6 | 55,7±6,8 | 45,3±5,6 | 45,85±9,14 | 49,57±6,46 |
| р | – | 0,005 | 0,004 | 0,007 | 0,004 | 0,009 |
При анализе влияния сыворотки крови больных глиомами установлено ее различное воздействие на отдельные субпопуляции лимфоцитов (рисунок). Так, сыворотка крови пациентов с глиобластомами достоверно снижала экспрессию на лимфоцитах CD4+ и CD8+ молекул и практически не влияла на CD20+ и CD16+ субпопуляции лимфоцитов, что позволяет предполагать, что данные образцы тормозили пролиферацию этих субпопуляций клеток. Сыворотка крови больных атипическими астроцитомами III степени злокачественности угнетала пролиферацию CD8+ субпопуляций лимфоцитов. Наличие сыворотки пациентов с доброкачественными опухолями I–II степени анаплазии не вызывало достоверного угнетения ни одной из субпопуляций клеток в процессе РБТЛ, хотя отмечено незначительное снижение содержания клеток, экспрессирующих CD4+ и CD8+ молекулы после РБТЛ. Сыворотка крови больных астроцитомами головного мозга незначительно повышала содержание CD20+ и CD16+ клеток после реакции, что, вероятно, связано с наличием в сыворотке крови таких пациентов повышенного уровня провоспалительных цитокинов, способных стимулировать пролиферации и экспрессию рецепторов на отдельных субпопуляциях лимфоцитов [4, 7].
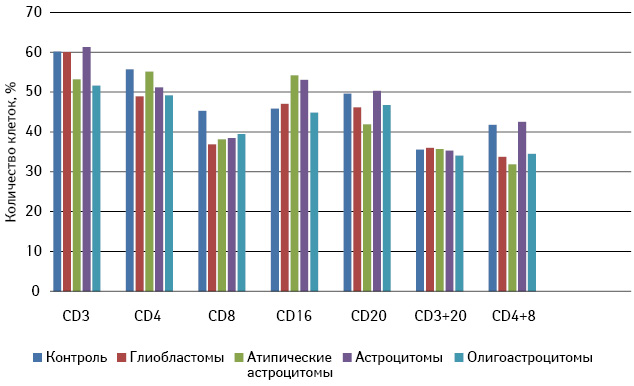
Таким образом, на основании полученных результатов можно сделать заключение, что лишь в образцах сыворотки крови больных со злокачественными глиальными опухолями определяются иммуносупрессивные факторы, тормозящие активацию CD4+ и CD8+ клеток в РБТЛ. Можно предположить, что иммуносупрессивные факторы, секретируемые клетками злокачественных глиом, в частности ИЛ-10 и простагландин Е-2 и другие [8, 9, 14], не только оказывают влияние на иммунные клетки, находящиеся в опухолевом очаге, но, поступая в периферическую кровь из него, способны избирательно тормозить активацию хелперных и цитотоксических субпопуляций Т-лимфоцитов, что подтверждено данными о снижении как уровня, так и функции Т-лимфоцитов в крови у пациентов со злокачественными образованиями мозга [4, 7, 15].
Выводы
1. В тесте пролиферации лимфоцитов в крови in vitro с ФГА (РБТЛ-тест) в течение 72 ч происходит увеличение количества как CD20+ и CD16+, так и CD3+ клеток, что свидетельствует о способности этого митогена стимулировать пролиферацию разных субпопуляций лимфоцитов.
2. Сыворотка крови больных глиомами головного мозга тормозит пролиферацию и бласттрансформацию лимфоцитов в тесте РБТЛ с ФГА в зависимости от степени анаплазии опухоли.
3. Сыворотка крови пациентов со злокачественными глиомами III–IV степени анаплазии оказывает в тесте РБТЛ с ФГА статистически достоверное тормозящее влияние на пролиферацию CD4+ и CD8+ лимфоцитов и не воздействует на CD16+ и CD20+ субпопуляции.
4. Сыворотка крови больных глиомами I–II степени анаплазии не оказывает существенного влияния на содержание разных субпопуляций лимфоцитов в крови после РБТЛ.
Список использованной литературы
1. Dunn G.P., Dunn I.F., Curry W.T. (2007) Focus on TILs: Prognostic significance of tumor infiltrating lymphocytes in human glioma. Cancer Immunity, 7(12): 1–24.
2. Humphries W., Wei J., Sampson J.H., Heimberger A.B. (2010) The role of tregs in glioma-mediated immunosuppression: potential target for intervention. Neurosurg. Clin. N. Am., 21(1): 125–137.
3. Лісяний М.І., Бєльська Л.М. (2007) Імуносупресуючий вплив злоякісних пухлин. Укр. нейрохірург. журн., 1: 4–9.
4. Nduom E.K., Weller M., Heimberger A.B. (2015) Immunosuppressive mechanisms in glioblastoma. Neuro. Oncol., 17(2): 213–218.
5. Komohara Y., Ohnishi K., Kuratsu J. et al. (2008) Possible involvement of the M2 anti-inflammatory macrophage phenotype in growth of human gliomas. J. Pathol., 216(1): 15–24.
6. Бережная Н.М., Чехун В.Ф. (2000) Система интерлейкинов и рак. К.: Диа, 224 с.
7. Лісяний М.І., Розуменко В.Д., Скітяк С.А. (2001) Особливості імунного цитокінового статусу у хворих з гліомами головного мозку. Укр. нейрохір. журн., 1: 24–31.
8. Hishii M., Nitta T., Ishida H. et al. (1995) Human glioma-derived interleukin-10 inhibits antitumor immune responses in vitro. Neurosurg., 37(6): 1160–1166.
9. Nakano Y., Kuroda E., Kito T. et al. (2006) Induction of macrophagic prostaglandin E2 synthesis by glioma cells. J. Neurosurg., 104(4): 574–582.
10. Качков И.А., Бактимиров Р.Г., Захаров А.В. и др. (2005) Глиальные опухоли головного мозга: классификация, иммунопатогенез, иммунодиагностика. Весник РАМН, 6: 36–41.
11. Копелян И.И., Григорьева М.П. (1972) Разработка микромодификации культивирования клеток крови человека. Бюлл. эксперим. биологии и медицины, 8: 119–122.
12. Лисяный Н.И., Гнедкова И.А., Потапова А.Г., Шмелева А.А. (2015) Характеристика субпопуляций лимфоцитов крови пролиферирующих в тесте бласттрансформации in vitro. Иммунология та аллергология, 3–4: 60–63.
13. Пинегин Б.В., Ярилин А.А., Симоноава А.В. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной стистемы. Метод. рекоменд., Москва, 65 с.
14. Dix A.R., Brooks W.H., Roszman T.L. et al. (1999) Immune defects observed in patients with primary malignant brain tumors. J. Neuroimmunol., 10: 216–232.
15. Jordan J.T., Sun W., Hussain S.F. et al. (2008) Preferential migration of regulatory T cells mediated by glioma-secreted chemokines can be blocked with chemotherapy. Cancer Immunol. Immunother., 57(1): 123–131.
Н.И. Лисяный, И.А. Гнедкова, А.И. Потапова, Л.Н. Бельская
Адрес:
Лисяный Николай Иванович
04050, Киев, ул. Платона Майбороды, 32
ГУ «Институт нейрохирургии им. акад. А.П. Ромоданова НАМН Украины»
Тел.: (044) 483-81-93
E-mail: nimun.neuro@gmail.com














Leave a comment