Протипухлинний та імуномодулюючий ефект дендритних клітин, навантажених магнітним нанокомплексом, у мишей з карциномою легені Льюїс
Храновська Н.М.1, Скачкова О.В.1, Іномістова М.В.1, Макеєнко О.Л.2, Орел В.Е.1
- 1Національний інститут раку, Київ
- 2Національний технічний університет України «Київський політехнічний інститут імені Ігоря Сікорського», Київ
Резюме. Досліджено протипухлинну, антиметастатичну та імуномодулюючу дію комбінованої терапії, що включає введення дендритних клітин (ДК), навантажених магнітним нанокомплексом (МНК), та вплив магнітного поля у мишей з карциномою легені Льюїс. Встановлено, що внутрішньошкірне введення ДК, навантажених МНК, та вплив магнітного поля зумовлювали значне зменшення кількості метастазів та їх об’єму у 2 рази у легенях мишей порівняно з контролем і деяке зменшення маси первинної пухлини за рахунок вагомого зменшення кількості S-фазних клітин. Комбінована терапія сприяла зниженню на рівні тенденції експресії мРНК TGF-ββ у селезінці та лімфатичних вузлах та значному зниженню рівня експресії мРНК транскрипційного фактора FoxP3 у клітинах селезінки і пахових лімфатичних вузлів. Одержані результати свідчать про перспективність створення нових нанотехнологій із застосуванням антигенпрезентуючих ДК та феромагнетиків для імунотерапії раку.
 На сьогодні імунотерапія на основі антигенпрезентуючих дендритних клітин (ДК) розглядається як один із сучасних та перспективних напрямків імунотерапії раку [1–4]. Відомо, що ДК відіграють визначальну роль у протипухлинному імунітеті, оскільки вони мають здатність активувати всі клітини, які належать до основних ефекторів протипухлинного імунітету, — CD8+ Т-клітини, Т-хелпери (Тх)-1, натуральні кілерні клітини (НКК) і НКК із властивостями Т-клітин, — індукують як первинну, так і вторинну імунну відповідь (переважно клітинну) та розвиток імунологічної пам’яті [5].
На сьогодні імунотерапія на основі антигенпрезентуючих дендритних клітин (ДК) розглядається як один із сучасних та перспективних напрямків імунотерапії раку [1–4]. Відомо, що ДК відіграють визначальну роль у протипухлинному імунітеті, оскільки вони мають здатність активувати всі клітини, які належать до основних ефекторів протипухлинного імунітету, — CD8+ Т-клітини, Т-хелпери (Тх)-1, натуральні кілерні клітини (НКК) і НКК із властивостями Т-клітин, — індукують як первинну, так і вторинну імунну відповідь (переважно клітинну) та розвиток імунологічної пам’яті [5].
Реалізація функцій ДК багато в чому визначається їх локалізацією в організмі та здатністю до міграції. ДК захоплюють пухлинні антигени на периферії та мігрують у вторинні лімфоїдні органи, де активують наївні та праймовані Т-клітини [6, 7]. З огляду на це для подолання дефіциту в презентації пухлинних антигенів Т-лімфоцитам та стимуляції імунної відповіді проти антигенів пухлини за участю ДК, одержаних in vitro, необхідною умовою є їхня успішна міграція до лімфоїдної тканини реципієнта. У середньому час міграції ДК в організмі реципієнта становить 24–48 год. Разом з тим відомо, що значна кількість введених ДК гине під час міграції, в тому числі й під дією НКК реципієнта. Встановлено, що дренуючих лімфатичних вузлів досягає близько 5% введених ДК [8]. При цьому збільшення цільової доставки ДК-вакцини до лімфоїдної тканини реципієнта може значно підвищити ефективність імунотерапії.
Є поодинокі роботи, в яких показано, що збільшення цільової доставки ДК до лімфоїдної тканини можна досягти за допомогою використання металевих наночастинок (НЧ) під дією магнітного поля [9]. Слід зазначити, що магнітні НЧ вже широко застосовуються для сортування клітин, розділення ДНК, у магнітно-резонансній томографії та генній терапії [10–13].
Останніми роками магнітні НЧ оксиду заліза привертають увагу онкологів як компоненти протипухлинного магнітного нанокомплексу (МНК) [14–16]. Одним із підходів, при якому використовуються МНК, є модуляція біологічних ефектів протипухлинних препаратів постійним магнітним полем (ПМП) як складовою протипухлинної наносистеми спрямованого транспорту. У роботі колективу авторів показано, що при поєднаній дії ПМП і НЧ феромагнетика спостерігається посилення ефекту ПМП, що проявляється у зростанні сумарного цито- та генотоксичного впливу цих чинників на пухлинні клітини [17].
З урахуванням вищезазначеного, метою нашої роботи є дослідження протипухлинної, антиметастатичної та імуномодулюючої дії ДК, навантажених МНК, під впливом магнітного поля у мишей з карциномою легені Льюїс.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
В експериментальних дослідженнях були використані 25 мишей лінії С57BL/6. Усі досліди проводили відповідно до вимог локальної комісії з етики роботи з лабораторними тваринами та принципів Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей.
В якості моделі експериментальної пухлини використовували карциному легені Льюїс, яку перещеплювали за загальноприйнятою методикою. Клітини пухлини тваринам вводили внутрішньом’язово у кількості 6•10 клітин на мишу.
Джерелом ДК були спленоцити сингенних мишей. ДК одержували шляхом центрифугування спленоцитів протягом 15 хв при 1000 об./хв у градієнті щільності 14,5% метризаміду [18]. ДК у кількості 10клітин/мл навантажували МНК шляхом інкубування протягом 24 год. МНК складається з НЧ оксиду заліза Fe3O4 (Sigma-Aldrich) у концентрації 8•10 мкг/мл та ліофілізованих пухлинних клітин (ЛФПК) карциноми легені Льюїс у концентрації 0,05 мг/мл. МНК одержували шляхом механічної обробки ЛФПК та НЧ у мікровібромлині ММVE-0,005 («Гефест», РФ). Для цього 1 мкг НЧ та ЛФПК масою 10 мг поміщали в камеру з кульками, що мелють. Тривалість обробки становила 5 хв, інтенсивність підводу механічної енергії — 20 Вт/г.
ДК, навантажені МНК, вводили мишам дослідної групи внутрішньошкірно 3 рази у кількості 2•10 на мишу з інтервалом в 3 дні, починаючи з 7-го дня після інокуляції карциноми легені Льюїс (рис. 1). Після введення ДК тварин піддавали дії магнітного поля протягом 1 год. Контрольній групі мишей перещеплювали лише карциному легені Льюїс.
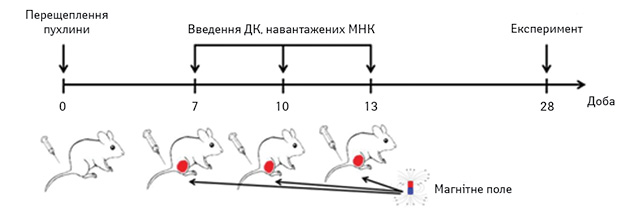
Рис. 1. Схема експерименту
Через 28 днів після інокуляції пухлини у тварин двох груп досліджували кількість, об’єм метастазів та масу пухлини. Одночасно визначали рівень експресії мРНК інтерферону (IFN)-γ, трансформуючого фактора росту (TGF)-β, інтерлейкіну (IL)-4, FoxP3 у селезінці та пахових лімфатичних вузлах за допомогою методу полімеразної ланцюгової реакції з детекцією результатів у режимі реального часу на приладі 7300/7500 Real-TimePCRSystems («Applied Bіosystems», США) з використанням специфічних праймерів та флюорохрома SYBR Green. Послідовності праймерів були підібрані з використанням програми Primer Express Software v3.0 фірми «Applied Bіosystems» (США) та синтезовані останньою. Облік одержаних результатів проводили згідно з рекомендаціями фірми — виробника приладу. Рівень експресії генів цитокінів оцінювали за допомогою методу ΔΔCt з нормуванням щодо експресії контрольного гена GAPDH.
Одержані результати обробляли статистично з використанням t-критерію Стьюдента. Вірогідними вважали значення при рівнях р≤0,05. Закон нормального розподілу вибірок перевіряли за допомогою статистичного тесту Колмогорова — Смирнова.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Відомо, що внутрішньошкірний шлях введення є найбільш ефективним для досягнення ДК лімфоїдної тканини реципієнта [19, 20]. Саме міграційною поведінкою може пояснюватися висока протипухлинна ефективність ДК, навантажених пухлинними антигенами, при цьому шляху їх введення. Разом з тим в організмі пухлиноносія міграційна активність ДК є значно зниженою. Тому пошук способів посилення доставки ДК, навантажених пухлинними антигенами, до лімфоїдної тканини реципієнта є обґрунтованим.
У нашому дослідженні внутрішньошкірне введення ДК, навантажених МНК, та вплив магнітного поля сприяли значному зменшенню кількості метастазів у легенях мишей та їх об’єму у 2 рази порівняно з контролем, хоча p>0,05 (рис. 2). У тварин дослідної групи спостерігалося і деяке зменшення маси первинної пухлини. Такий ефект реалізувався за рахунок значного зменшення кількості S-фазних клітин у пухлині порівняно з контролем.
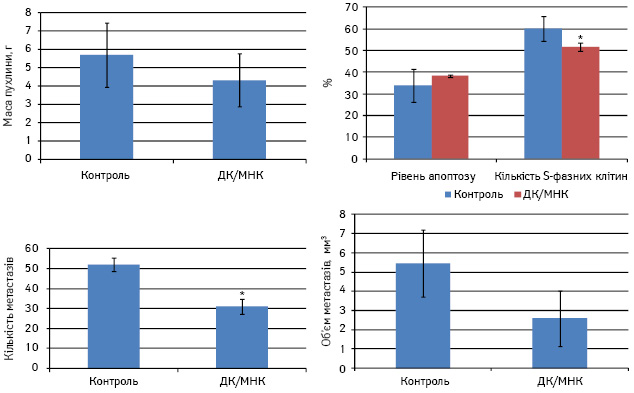
Рис. 2. Протипухлинний ефект ДК, навантажених МНК, у мишей з карциномою легені Льюїс. *p>0,05
Серед всіх антигенпрезентуючих клітин ДК вважаються найбільш потужними активаторами Т-клітин, що володіють унікальною здатністю до поляризації імунної відповіді [21]. Взаємодія зрілих ДК і Т-лімфоцитів відбувається в Т-клітинних зонах вторинних лімфоїдних органів (у паракортикальній зоні лімфатичних вузлів і меншою мірою в періартеріолярній зоні білої пульпи селезінки під модулюючим впливом цитокінів). Рівень продукції IL-4 і IFN-γ периферичними Т-лімфоцитами і їх співвідношення після контакту з ДК значною мірою визначає домінування певної субпопуляції Т-лімфоцитів: Тх1 або Тх2, від активації яких залежить характер імунної відповіді.
Як показали результати робіт, у тварин дослідної групи імунотерапевтичний вплив сприяв значному зниженню рівня мРНК IL-4 в селезінці та деякому підвищенню рівня мРНК IFN-γ, що може свідчити про поляризацію імунної відповіді за Тх1-типом (рис. 3). Така сама тенденція у зміні рівня експресії цитокінів спостерігалася і у пахових лімфатичних вузлах.
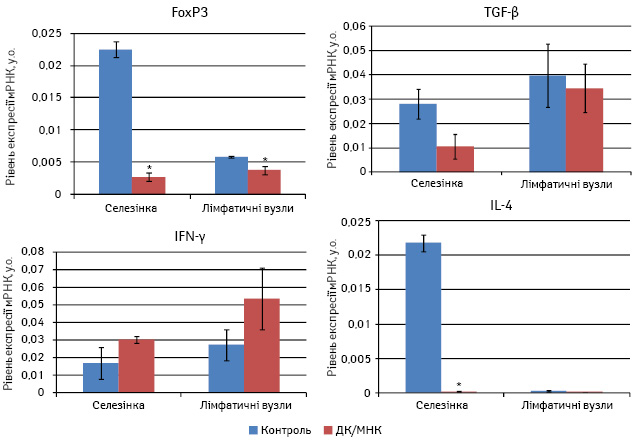
Рис. 3. Вплив ДК, навантажених МНК, на рівень експресії мРНК цитокінів та ядерного фактора FoxP3 у мишей з карциномою легені Льюїс. *p>0,05
Основними продуцентами цитокінів із супресорними властивостями (IL-10 та TGF-β) є регуляторні Т-клітини (Трег). IL-10 та TGF-β відіграють ключову роль у негативній регуляції протипухлинної імунної відповіді за рахунок пригнічення активації й ефекторних функцій Т-клітин та НКК. TGF-β є протизапальним супресорним цитокіном, який сприяє експансії Трег та підвищує в них продукцію транскрипційного фактора FoxP3, у результаті чого підвищується їх функціональна активність та розвивається пухлиноасоційована імуносупресія [22].
У нашому дослідженні комбінована терапія на основі ДК, навантажених МПК, та дії магнітного поля сприяла зниженню на рівні тенденції експресії мРНК TGF-β у селезінці та лімфатичних вузлах. Разом з тим, застосована терапія значно вплинула на рівень експресії мРНК транскрипційного фактора FoxP3. Так, його рівень помітно знижувався як у клітинах селезінки, так і у клітинах пахових лімфатичних вузлів.
У миші ядерний фактор FoxP3 експресується тільки Трег клітинами з фенотипом CD4+TCRαβ+, що володіють супресорною активністю [23, 24]. Зниження рівня експресії мРНК TGF-β та FoxP3 у тварин дослідної групи може бути результатом зменшення кількості Трег лімфоцитів у мишей або зміни їх функціонального потенціалу і свідчити про зниження негативного впливу Трег клітин на розвиток протипухлинної імунної відповіді. Таким чином, зниження рівня експресії мРНК цитокінів, що зумовлюють ріст пухлини, може розглядатися як один з механізмів, який забезпечує реалізацію протипухлинного ефекту імунотерапії на основі ДК, навантажених МНК.
Висновки
1. Комбінована терапія, що включає введення ДК, навантажених МНК, та вплив магнітного поля чинять виражений антиметастатичний ефект у мишей з карциномою легені Льюїс.
2. Імуномодулюючий ефект комбінованої терапії характеризується зміною балансу рівня експресії мРНК цитокінів IFN-γ та IL-4 в селезінці тварин у бік превалювання Тх1 поляризуючого потенціалу та зменшення пухлино-опосередкованої імуносупресії за рахунок зниження рівня експресії FoxP3 та TGF-β у селезінці та пахових лімфатичних вузлах.
3. Одержані результати свідчать про перспективність створення нових нанотехнологій із застосуванням антигенпрезентуючих ДК та феромагнетиків для імунотерапії раку.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Храновская Н.Н., Гриневич Ю.А., Потебня Г.П. и др. (2012) Влияние дендритноклеточной аутовакцины на эффективность лечения больных раком яичника. Вопр. онкол., 6: 781–786.
2. Храновская Н.Н., Крячок И.А., Ганул В.Л. и др. (2014) Разработка, обоснование и оценка эффективности противоопухолевой вакцинотерапии на основе дендритных клеток у больных со злокачественными новообразованиями. Клин. онкол., 2(14): 62–70.
3. Palucka K., Ueno H., Fay J., Banchereau J. (2011) Dendritic cells and immunity against cancer. J. Intern. Med., 269(1): 64–73.
4. Kantoff P.W., Higano C.S., Shore N.D. et al. (2010) Sipuleucel T immunotherapy for castration-resistant prostate cancer. N. Engl. J. Med., 363: 411–422.
5. Toubai T., Mathewson N., Reddy P. (2013) The role of dendritic cells in graft-versus-tumor effect. Front. Immunol., 4: 141–153.
6. Талаев В.Ю., Плеханова М.В. (2014) Исследование миграции дендритных клеток и трафика антигенов в целях совершенствования средств иммунопрофилактики (аналитический обзор). Медиаль, 2(12): 154–171.
7. Granucci F., Zanoni I., Ricciardi-Castagnoli P. (2008) Central role of dendritic cells in the regulation and deregulation of immune responses. Cell. Mol. Life Sci., 65(11): 1683–1697.
8. Martín-Fontecha A., Lanzavecchia A., Sallusto F. (2009) Dendritic cell migration to peripheral lymph nodes. Handb. Exp. Pharmacol., 188: 31–49.
9. Honglin J., Yuan Q., Yanfeng D. et. al. (2016) Magnetic enrichment of dendritic cell vaccine in lymph node with fluorescent-magnetic nanoparticles enhanced cancer immunotherapy. Theranostics, 6 (11): 2000–2014.
10. Goya G.F., Marcos-Campos I., Fernández-Pacheco R. et al. (2008) Dendritic cell uptake of iron-based magnetic nanoparticles. Cell. Biol. Int., 32: 1001–1005.
11. Mulens V., Morales M., Barber D.F. (2013) Development of magnetic nanoparticles for cancer gene therapy: a comprehensive review. ISRN Nanomaterials, 2013 (ID 646284): 1–14.
12. Uthaman S., Maya S., Jayakumar R. et. al. (2014) Carbohydrate-based nanogels as drug and gene delivery systems. J. Nanosci. Nanotechnol.,14(1): 694–704.
13. Estelrich J., Sánchez-Martín M.J., Busquets M.A. (2015) Nanoparticles in magnetic resonance imaging: from simple to dual contrast agents. Int. J. Nanomedicine, 10: 1727–1741.
14. Налєскіна Л.А., Бородай Н.В., Чехун В.Ф. (2003) Сьогодення та перспективи створення наносистем спрямованої доставки лікарських препаратів до пухлинних клітин. Онкология, 11(3): 166–173.
15. Чехун В.Ф. (2008) Нанотехнології в онкології: від теорії до молекулярної візуалізації та керованої терапії. Онкология, 10(4): 414–419.
16. Бездєнєжних Н.О., Орел В.Е., Семесюк Н.І. та ін. (2016) Особливості життєздатності, експресії білків адгезії та клітинного цитоскелета клітин ліній ракулегені А-549 і грудної залози T47D при використанні технології магнітної нанотерапії. Клин. онкол., 4 (24): 72–77.
17. Чехун В.Ф., Лозовська Ю.В., Лук’янова Н.Ю. та ін. (2013) Оцінка цито- та генотоксичної дії наноферомагнетика та постійного магнітного поля в системі in vivo. Цитология и генетика, 47(3): 60–70.
18. Dendritic Cell Protocols (2010) Ed. by Shalin H. Naik. Humana Press: 446 p.
19. Балдуева И.А. (2003) Противоопухолевые вакцины. Практическая онкология, 4(3): 157–166.
20. Скачкова О.В., Швець Ю.В., Храновська Н.Н. (2010) Особливості міграції дендритних клітин у мишей лінії СВА. Вісник Київського національного університету імені Тараса Шевченка, 10: 52–54.
21. De Jong E.C., Smits H.H., Kapsenberg M.L. (2005) Dendritic cell-mediated T cell polarization. Semin. Immun., 26: 289–307.
22. Trotta R., Dal Col J., Yu J. et al. (2008) TGF-beta utilizes SMAD3 to inhibit CD16-mediated IFN-gamma production and antibody-dependent cellular cytotoxicity in human NK cells. J. Immunol., 181(6): 3784–3792.
23. Mayer C.T., Kuhl A.A., Loddenkemper C. et al. (2012) Lack of Foxp3+ macrophages in both untreated and B16 melanoma-bearing mice. Blood, 119: 1314–1315.
24. Miyao T., Floess S., Setoguchi R. et al. (2012) Plasticity of foxp3(+) T cells reflects promiscuous foxp3 expression in conventional T cells but not reprogramming of regulatory T cells. Immunity, 36: 262–275.
Противоопухолевый и иммуномодулирующий эффект дендритных клеток, нагруженных магнитным нанокомплексом, у мышей с карциномой легкого Льюис
Национальный институт рака, Киев
Национальный технический университет Украины
«Киевский политехнический институт имени Игоря Сикорского», Киев
Резюме. Исследовано противоопухолевое, антиметастатическое и иммуномодулирующее действие комбинированной терапии, включающей введение дендритных клеток (ДК), нагруженных магнитным нанокомплексом (МНК), и влияние магнитного поля у мышей с карциномой легкого Льюис. Установлено, что внутрикожное введение ДК, нагруженных МНК, и влияние магнитного поля обусловливали значительное сокращение количества метастазов и их объема в 2 раза в легких мышей по сравнению с контролем и некоторое уменьшение массы первичной опухоли за счет значительного уменьшения количества S-фазных клеток. Комбинированная терапия способствовала снижению на уровне тенденции экспрессии мРНК TGF-β в селезенке и лимфатических узлах и значительному снижению уровня экспрессии мРНК транскрипционного фактора FoxP3 в клетках селезенки и паховых лимфатических узлов. Полученные результаты свидетельствуют о перспективности создания новых нанотехнологий с применением антигенпрезентирующих ДК и ферромагнетиков для иммунотерапии рака.
дендритные клетки, магнитный нанокомплекс, иммунотерапия, карцинома легкого Льюис.
Адреса:
Храновська Наталія Миколаївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: nkhranovska@ukr.net














Leave a comment