Імунна відповідь іn situ після неоад’ювантної хіміотерапії у хворих на місцево-поширений рак грудної залози
Верьовкіна Н.О., Сивак Л.А., Лялькін С.А., Кротевич М.С.
Резюме. Рак грудної залози (РГЗ) — одне з найпоширеніших онкологічних захворювань серед жінок у світі. На сьогодні актуальними є роботи, присвячені пошукам нових підходів до лікування, які базуються на сучасних знаннях у галузях експериментальної та клінічної онкології. Мета дослідження полягала у вивченні особливостей імунного інфільтрату в тканині пухлини та його вплив на ефективність неоад’ювантної хіміотерапії при різних молекулярних підтипах місцево-поширеного РГЗ. Нами встановлено, що інфільтрація лімфоїдними клітинами пухлинної тканини частіше виникала у хворих з місцево-поширеним РГЗ без експресії рецепторів стероїдних гормонів порівняно з пацієнтами з гормонозалежними пухлинами (33,33% проти 13,63%; р=0,00002). Також досліджено, що збільшення кількості CD4+ лімфоцитів у резидуальній пухлині підвищує ризик рецидиву захворювання (HR=2,1; 95% ДІ 1,0–4,7; р=0,03). З урахуванням отриманих результатів необхідне подальше вивчення предиктивного та прогностичного значення параметрів лімфоїдної інфільтрації при різних молекулярних підтипах РГЗ з метою включення їх у діагностичні та терапевтичні алгоритми при цьому захворюванні.
 В Україні щорічно виявляють близько 16–17 тис. хворих на рак грудної залози (РГЗ), а показник захворюваності займає перше місце серед усіх онкологічних нозологічних одиниць і коливається в межах 66–72 випадків на 100 тис. жіночого населення [1].
В Україні щорічно виявляють близько 16–17 тис. хворих на рак грудної залози (РГЗ), а показник захворюваності займає перше місце серед усіх онкологічних нозологічних одиниць і коливається в межах 66–72 випадків на 100 тис. жіночого населення [1].
Впровадження в рутинну практику неоад’ювантної хіміотерапії (НАХТ)місцево-поширеного РГЗ диктує необхідність вивчення терапевтичного патоморфозу як показника чутливості пухлини до цього виду лікування та важливого прогностичного фактора. Терапевтичний патоморфоз — це типові стійкі ознаки зворотного розвитку клінічних та морфологічних проявів пухлини, викликаних специфічною терапією [2]. На сьогодні існує багато різних систем оцінки відповіді пухлини на лікування, наприклад класифікація терапевтичного патоморфозу за Г.А. Лавніковою, Е.Ф. Лушниковим, Н.А. Краєвським [2], I.D. Miller, S. Payne [3], E.R. Fisher, R.M. Warren, B. Chevallier та ін. [4].
З метою більш системної та ґрунтовної оцінки такого важливого прогностичного показника, як повний терапевтичний патоморфоз (pathologic complete response — рСR), група експертів Early Breast Cancer Trialists Collaborative Group провела метааналіз 12 багатоцентрових рандомізованих досліджень за участю 11 955 жінок, які отримували різні режими НАХТ. Метою цього метааналізу була оцінка рСR як сурогатного маркера показників виживаності. Загальний рівень рСR відзначено у 18% випадків. Як і очікувалося, частота рСR була найнижчою у пацієнток з високодиференційованими гормонозалежними пухлинами (7–9%) та зростала більше ніж у 2 рази у підгрупі низькодиференційованих горомонозалежних злоякісних новоутворень (14–20%). У групі хворих із більш агресивними підтипами РГЗ, такими як тричі негативний та HER2-neu гіперекспресуючий, рСR фіксували частіше (32–39%) порівняно з гормонозалежними пухлинами. У підгрупі пухлин з експресією HER2-neu рСR частіше досягався у пацієнток з гормононезалежними пухлинами (25–35%) порівняно з РГЗ люмінального типу В з експресією HER2-neu (15–25%). Також частота рСR зростала при застосуванні трастузумабу як в групі гормононезалежних (45–65%), так і гормонозалежних(25–35%) пухлин.
Проте зростання частоти рСR у різних підгрупах хворих з РГЗ не завжди прогнозує покращення показників безрецидивної (БРВ) та загальної виживаності (ЗВ). Найбільше прогностичне значення показник рСR має у пацієнтів з агресивними підтипами РГЗ [5].
Підвищення ефективності протипухлинного лікування залишається одним з найбільш актуальних завдань сучасної онкології. Однак необхідно відзначити, що сучасні терапевтичні стратегії, спрямовані на максимальне видалення пухлинних клітин, пов’язані з високим ризиком серйозних побічних ефектів для пацієнта, при цьому розвиток резистентності ракових клітин, які вижили, фактично забезпечує неможливість досягнення повної регресії [6–11]. Крім того, злоякісні пухлини ускладнюють протиракову імунну відповідь численними імуносупресивними механізмами. Пухлини зумовлюють накопичення імуносупресивних Т-регуляторних клітин (Treg) [12]. Актуальними на сьогодні є роботи, присвячені ролі окремих підтипів лімфоїдних клітин, які входять до складу імунного інфільтрату при різних молекулярних підтипах РГЗ [7–9, 13–20].
Мета дослідження — вивчити роль CD8 та CD4 лімфоцитів, що інфільтрують пухлину, в прогнозі та виборі подальшої тактики лікування хворих на РГЗ.
Об’єкт і методи дослідження
У відділенні хіміотерапії солідних пухлин Національного інституту раку обстежено та проліковано 111 хворих віком від 29 до 69 років з РГЗ T1–3N0–3M0 стадії. Усі пацієнтки, згідно зі стандартами, отримали передопераційну хіміотерапію за схемою FAC (циклофосфамід 500 мг/м² у 1-й день, доксорубіцин 50 мг/м² у 1-й день, флуороурацил 500 мг/м² у 1-й день). Оцінку відповіді пухлини проводили після кожних двох курсів хіміотерапії (відповідно до критеріїв RECIST 2.0). Об’єм операції відповідав радикальній резекції або радикальній мастектомії.
Морфологічне дослідження післяопераційного матеріалу виконували за стандартною методикою. Препарати забарвлювали гематоксиліном та еозином. Оцінку лікувального патоморфозу виконували на основі визначення об’єму життєздатної залишкової пухлини, наявності раку in situ, а також кількості та розмірів уражених лімфовузлів (за класифікацією Miller — Payne). Інфільтрацію пухлинної тканини імунокомпетентними клітинами оцінювали в препаратах, пофарбованих гематоксиліном та еозином, аналізували у 10 полях зору і обчислювали у відсотках таким чином: відсутня або слабо виражена (+) <10%, помірна (++) — 10–50% та значно виражена (+++) — >50%. Імуногістохімічне (ІГХ) дослідження біомолекулярних маркерів здійснювали на депарафінізованих зрізах пухлин РГЗ з використанням таких МкАТ: Estrogen Receptor α (Dako IS657 Monoclonal Mouse Anti-HumanClone 1D5), Progesterone Receptor (Dako IS068 Monoclonal Mouse Anti-Human Clone PgR 636), c-erbB-2 Oncoprotein (DBS DS-PDR003-A Rabbit Polyclonal Antibody to Human), маркер проліферуючих клітин Ki-67 (Dako IS626, Monoclonal Mouse Anti-Human Ki-67 Antigen Clone MIB-1), CD4-лімфоцити та CD8-лімфоцити — MoHu anti CD4 T-Cell- Clone MT310 та MoHu anti-CD8, T-Cell Clone C8/144B («Dako», Данія). Для виявлення зазначених білків застосовували систему візуалізації з використанням системи детекції EnVisionTM FLEX («Dako», Данія). Результати ІГХ реакції оцінювали напівкількісним методом шляхом підрахунку кількості позитивно забарвлених клітин — індекс мітки (ІМ) — у відсотках. Експресію маркерів визначали у 1000 пухлинних клітинах. Кількість CD4 та CD8 лімфоцитів аналізували у 10 полях зору та визначали у відсотках.
У нашому дослідженні кількість стромальних CD4 лімфоцитів у резидуальній пухлині ≥15,71% є межею, відповідно до якої всі значення вище вважаються «високим» рівнем, а нижче — «низьким». Для стромальних CD8+ лімфоцитів в імунному інфільтраті після НАХТ межею визначено рівень 23,56%, для індексу проліферативної активності Кі-67 — 37,00%. Морфологічні та ІГХ дослідження проводили у патологоанатомічному відділенні Національного інституту раку Міністерства охорони здоров’я України.
Обробку отриманих даних виконували з використанням пакета програм «Statistica 10.0». Імовірності ЗВ та БРВ були обчислені за допомогою методу Каплана — Мейєра та порівняні логарифмічним ранговим критерієм. Співвідношення ризиків з 95% довірчим інтервалом (ДІ) було вирахувано за допомогою моделі пропорційних ризиків Кокса. Статистично значущими вважалися дані з достовірністю різниці при р<0,05.
Отримані результати та їх обговорення
Середній вік пролікованих пацієнток становив 49±10 років. При оцінці менструальної функції в обстежених хворих на місцево-поширений РГЗ на момент встановлення діагнозу визначено, що у пременопаузі були 65 (58,55%) жінок, тоді як 46 (41,45%) пацієнток мали менопаузальний статус. За стадіями (TNM 6-те видання, 2002 р.) хворі розподілилися таким чином: ІIа стадія (T1N1M0, Т2N0М0) — 29 (26,12%), ІІb (T2N1M0, T3N0M0) — 34 (30,63%), ІІІа (T0–3N2M0, T3N1–2M0) — 32 (28,82%), ІІІb (T4N0–3M0, T0–4N3M0) 16 (14,41%) хворих. Пацієнток з І та ІV стадіями в дослідження не включали.
При проведенні ІГХ дослідження у 56 (50,45%) пацієнток у пухлинах визначали експресію рецепторів естрогенів (ER), у 52 (46,84%) — експресію рецепторів прогестерону (РR) та у 14 (12,61%) — позитивну експресію трансмембранного глікопротеїну (HER2/neu). Слід зазначити, що у 47 (42,00%) виявлено пухлини без експресії зазначених рецепторів (ER, РR та HER2/neu). Враховуючи прогностичне значення та широке використання в рутинній практиці, представлено розподіл хворих за чотирьохкомпонентним ІГХ алгоритмом в табл. 1.
|
Молекулярний підтип |
Кількість хворих |
|
|
n |
% |
|
|
Люмінальний А |
33 |
29,72 |
|
Люмінальний В HER2/neu |
17 |
15,31 |
|
Люмінальний В HER2/neu |
6 |
5,40 |
|
HER2/neu гіперекспресуючий |
8 |
7,20 |
|
Тричі негативний |
47 |
42,30 |
Оцінку терапевтичного патоморфозу проводили за класифікацією Miller — Payne, згідно з якою V ступінь лікувального патоморфозу (клітини інвазивного раку в зрізах первинної пухлини відсутні; наявна тільки фіброваскулярна строма; можуть спостерігатися поодинокі структури раку in situ) відмічено лише у 3 (3,15%) пацієнток, IV ступінь (зменшення кількості пухлинних клітин понад 90%; наявні лише невеликі розсіяні скупчення дистрофічно змінених клітин інвазивного раку) — у 10 (10,52%) пролікованих, III ступінь (зменшення кількості пухлинних клітин від 30 до 90%) — у 12 (12,63%) пацієнток, ІІ ступінь (виражені зміни в клітинах інвазивного раку до 30%; збереження значної кількісті клітин іншої частини інвазивного раку) — у 69 (72,63%) хворих, а І ступінь (зміни в пухлині відсутні або визначаються лише незначні дистрофічні зміни окремих пухлинних клітин, без зменшення кількості клітин в пухлині) — лише в 1 пацієнтки. При оцінці терапевтичного патоморфозу виявлено статистично значимі відмінності у групах пацієнток залежно від гормонального статусу пухлини. Так, у групі хворих з гормононезалежними злоякісними утвореннями середній об’єм залишкової життєздатної пухлинної тканини становив 38,20±27,57%, тоді як у групі пацієнток з гормонозалежними пухлинами цей показник сягав 50,02±25,86% (р=0,03). Водночас в групі хворих із гормононезалежними пухлинами середнє значення індексу Кі-67 після завершення НАХТ було вищим і становило 50,76±28,79% порівняно з групою пацієнток з люмінальними типами РГЗ (12,89±16,09%; р=0,000001).
При дослідженні післяопераційного матеріалу також виявлено, що у групі хворих з ER місцево-поширеним РГЗ частіше траплялися пухлини з вираженою інфільтрацією лімфоїдними клітинами (пухлино-інфільтруючі лімфоцити — ПІЛ) порівняно з хворими з ER пухлинами (р=0,00002) (табл. 2).
|
Рівень ПІЛ |
ER пухлини |
ER пухлини |
||
|
N |
% |
N |
% |
|
|
ПІЛ+ |
7 |
15,55 |
23 |
52,27 |
|
ПІЛ++ |
23 |
51,11 |
15 |
34,09 |
|
ПІЛ+++ |
15 |
33,33 |
6 |
13,63 |
При більш детальному вивченні складу перитуморального імунного інфільтрату визначено, що у групі хворих із гормононезалежними пухлинами частіше виявляли утворення з великою кількістю стромальних CD4 лімфоцитів (р=0,0001), стромальних CD8+ лімфоцитів (р=0,0007) та перитуморальних CD8 лімфоцитів (р=0,01) порівняно з групою пацієнтів з люмінальними підтипами РГЗ (табл. 3).
|
Фактор |
Кількість лімфоцитів |
||
|
Гормононезалежні пухлини ER (n=55) |
Гормонозалежні пухлини ЕR (n=56) |
p |
|
|
CD4 після НАХТ |
20,47±21,10 |
4,22±12,37 |
0,0001 |
|
CD4 після НАХТ |
1,69±3,97 |
1,14±4,46 |
0,5 |
|
CD8 після НАХТ |
28,39±22,70 |
12,88±17,81 |
0,0007 |
|
CD8 після НАХТ |
13,07±18,03 |
5,58±9,43 |
0,01 |
Аналіз показників ЗВ показав статистично значущі відмінності залежно від кількості CD4 лімфоцитів у резидуальній пухлині після завершення НАХТ (p=0,03 за логранговим критерієм). На рис. 1 представлено криві залежності ЗВ від рівня CD4 лімфоцитів (метод Каплана — Мейєра).
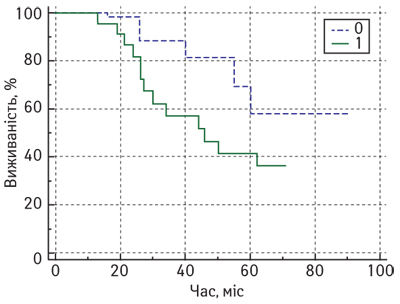
Так, медіана ЗВ у пацієнток з місцево-поширеним РГЗ з низьким рівнем CD4 лімфоцитів після завершення комплексного лікування становила 62 міс (95% ДІ 46–62), а у підгрупі пацієнток з високим рівнем — лише 46 міс (95% ДІ 27–62). Крім того, досліджено, що збільшення кількості CD4 лімфоцитів у резидуальній пухлині підвищує ризик смерті від РГЗ (hazard ratio (HR)=2,7; 95% ДІ 1,1–6,6; р=0,03). Аналіз показників БРВ також показав статистично значущі відмінності залежно від рівня CD4 лімфоцитів у резидуальній пухлині після завершення НАХТ. На рис. 2 представлено криві залежності БРВ від рівня CD4 лімфоцитів (метод Каплана — Мейєра).
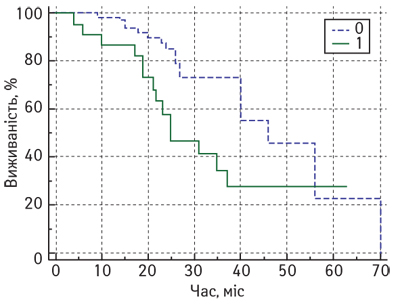
Медіана БРВ у пацієнток із місцево-поширеним РГЗ після завершення комплексного лікування становила 40 міс. У підгрупі пацієнток з низьким рівнем CD4 лімфоцитів медіана БРВ сягала 46 міс (95% ДІ 40–70), тоді як у підгрупі хворих з високим рівнем CD4 лімфоцитів у резидуальній пухлині — лише 25 міс (95% ДІ 21–37 міс). Нами визначено, що збільшення кількості CD4 лімфоцитів у резидуальній пухлині підвищує ризик рецидиву РГЗ (HR=2,1; 95% ДІ 1,0–4,7; р=0,03).
Статистично значущих відмінностей показників ЗВ та БРВ у хворих на місцево-поширений РГЗ залежно від рівня стромальних CD8 лімфоцитів у резидуальній пухлині після завершення НАХТ не виявлено. На рис. 3 та 4 представлено порівняльні графіки показників ЗВ та БРВ залежно від рівня стромальних CD8 лімфоцитів (метод Каплана — Мейєра).
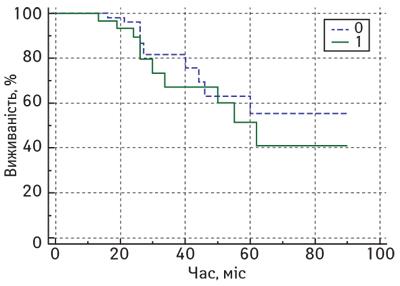
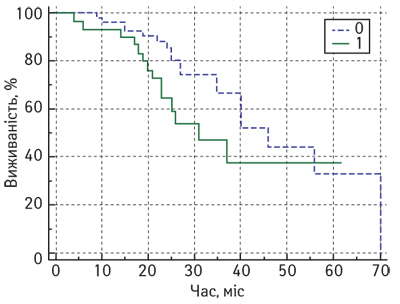
Крім того, за результатами нашого дослідження виявлено статистично значущі відмінності показників ЗВ у хворих на місцево-поширений РГЗ залежно від рівня Кі-67 після завершення НАХТ (рис. 5).
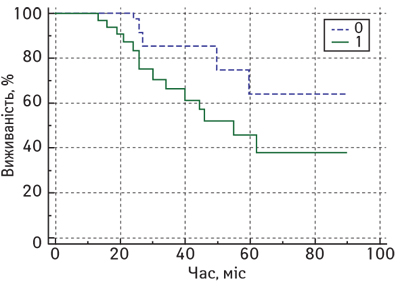
Так, медіана ЗВ у пацієнток із місцево-поширеним РГЗ після завершення комплексного лікування у нашому дослідженні у підгрупі з низьким рівнем Кі-67 не була досягнута, натомість у підгрупі хворих з високим рівнем Кі-67 після завершення НАХТ цей показник становив лише 55 міс (95% ДІ 34–62). Таким чином, у пацієнтів з місцево-поширеним РГЗ після завершення НАХТ виявлено, що підвищення показника проліферативної активності Кі-67 у резидуальній пухлині зумовлює зростання ризику смерті від РГЗ (HR=2,9; 95% ДІ 1,2–7,0; р=0,03).
Нами не виявлено статистично значущих відмінностей показників БРВ залежно від рівня Кі-67 у резидуальній пухлині у хворих на місцево-поширений РГЗ після завершення НАХТ. На рис. 6 представлено порівняльні графіки БРВ у пацієнток з місцево-поширеним РГЗ залежно від рівня Кі-67 після НАХТ.
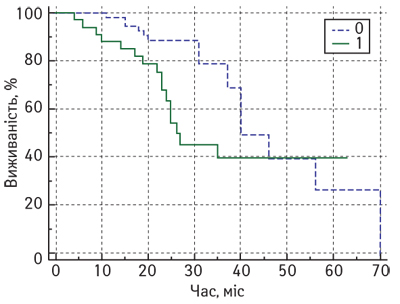
Медіана БРВ у пацієнток з місцево-поширеним РГЗ після завершення комплексного лікування у нашому дослідженні становила: у підгрупі з низьким рівнем Кі-67 — 40 міс (95% ДІ 37–70 міс), у підгрупі з високим рівнем Кі-67 у резидуальній пухлині — лише 26 міс (95% ДІ 24–35), але статистично значущої відмінності БРВ у пацієнток з місцево-поширеним РГЗ не виявлено (р=0,06).
Нами проведено аналіз ЗВ та БРВ залежно від співвідношення кількості стромальних CD4 та CD8 лімфоцитів в імунному інфільтраті навколо резидуальної пухлини грудної залози після завершення хіміотерапії.
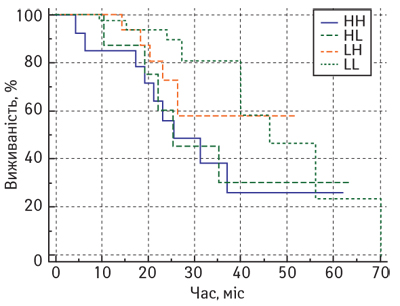
Виявлено статистично значущі відмінності в показниках ЗВ у хворих на місцево-поширений РГЗ залежно від співвідношення CD4/CD8 лімфоцитів у резидуальній пухлині після завершення НАХТ (рис. 7).

Так, медіана ЗВ у пацієнток із місцево-поширеним РГЗ після завершення комплексного лікування у підгрупі CD4/CD8 становила 34 міс (95% ДІ 26–62), у підгрупі CD4/CD8 — 46 міс (95% ДІ 27–46), тоді як у підгрупах з співвідношенням CD4/CD8 та CD4/CD8медіана не досягнута.
Аналіз показників БРВ у хворих на місцево-поширений РГЗ залежно від співвідношення кількості стромальних CD4 та CD8 лімфоцитів не показав статистично значущих відмінностей (рис. 8).
Співвідношення різних субпопуляцій лімфоїдних клітин в імунному інфільтраті навколо пухлини робить вагомий внесок в ефективність лікування. Розвиток імунної реакції I типу характеризується проліферацією CD8 Т-клітин, необхідних для знищення пухлини. Відбувається активація CD4 Т-хелперів I типу (Th1). Вони секретують низку цитокінів (фактор некрозу пухлини, інтерферон γ та ін.), необхідних для презентації антигену CD8 T-клітинам, які безпосередньо реалізують цитотоксичний вплив. При розвитку імунної реакції II типу відбувається активація CD4 Т-хелперів II типу (Th2) та секреція ними інтерлейкінів-5 і -6, які підтримують проліферацію В-лімфоцитів і розвиток гуморальної імунної відповіді. На сьогодні роль B-клітин менш чітко визначена, особливо з урахуванням того факту, що В-лімфоцити притаманні імуносупресивному мікрооточенню, яке стимулює пухлинний ріст [21–26]. До складу лімфоцитарного інфільтрату також входить субпопуляція Treg CD4 клітин, фізіологічна роль яких полягає у пригніченні надмірної імунної реакції та запобіганні аутоімунному пошкодженню нормальних тканин. CD4Treg клітини характеризуються вираженою експресією білка FOXP3 (forkhead box protein 3). Роль цих клітин не є такою однозначною, як CD8+ клітин. Так, ступінь інфільтрації FOXP3 клітинами мав позитивну кореляцію з підвищенням ступеня злоякісності пухлини та відсутністю експресії рецепторів естрогенів й експресією HER2 та асоціювався з несприятливим прогнозом РГЗ [27].
Отримані нами результати підтверджують, що більш детальне розуміння параметрів імунного мікрооточення пухлини, а також введення в клінічну практику методів якісного та кількісного їх визначення дозволить виділити групу пацієнтів, що потребують менш токсичної терапії, забезпечить можливість здійснювати відбір хворих для застосування нових видів лікування, таких як імунотерапія, і поєднувати її з класичними методами лікування (хіміотерапія, таргетна терапія, променева терапія та ін.).
Висновки
1. Встановлено, що інфільтрація лімфоїдними клітинами пухлинної тканини частіше виникала у хворих на місцево-поширений РГЗ без експресії рецепторів стероїдних гормонів порівняно з пацієнтами з гормонозалежними пухлинами (33,33% проти 13,63%; р=0,00002).
2. Досліджено, що збільшення кількості CD4 лімфоцитів у резидуальній пухлині підвищує ризик смерті від РГЗ (HR=2,7; 95% ДІ 1,1–6,6; р=0,03).
3. Досліджено, що збільшення кількості CD4 лімфоцитів у резидуальній пухлині підвищує ризик рецидиву захворювання (HR=2,1; 95% ДІ 1,0–4,7; р=0,03). Впливу кількості CD8 лімфоцитів на показники виживаності не виявлено.
4. Встановлено, що у пацієнтів з місцево-поширеним РГЗ після завершення НАХТ підвищення показника проліферативної активності Кі-67 у резидуальній пухлині зумовлює зростання ризику смерті від РГЗ (HR=2,9; 95% ДІ 1,2–7,0; р=0,03).
Список використаної літератури
- Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2015) Рак в Україні, 2012–2013. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 16: 101 с.
- Краевский Н.А., Смольянников А.В., Саркисов Д.С. (1993) Патологоанатомическая диагностика опухолей человека. Руководство для врачей. 4-е изд. М.: Медицина.
- Miller I.D., Payne S., Ogston K.N. (2002) A new gistological grading system to assess response of breast cancer to primary chemotherapy. Int J. Oncol., 20(4): 791–796.
- Fisher E.R., Wang J., Bryant J. (2002) Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18. Cancer, 95: 681–695.
- Cortazar P., Zhang L., Untch M. et al. (2014) Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. www.thelancet.com Published online February 14, 2014 (http://dx.doi.org/10.1016/S0140-6736(13) 62422-8).
- Zitvogel L., Apetoh L., Ghiringhelli F., Kroemer G. (2008) Immunological aspects of cancer chemotherapy Nature Reviews Immunol., 8: 59–73.
- Zitvogel L., Kepp O., Kroemer G. (2011) Іmmune parameters affecting the efficacy of chemotherapeutic regimens. Nat. Rev. Clin. Oncol., 8: 151–160.
- Andre F., Dieci M., Dubsky P. et al. (2012) Molecular Pathways: Involvement of Immune Pathways in the Therapeutic Response and Outcome in Breast Cancer. Clin. Cancer Res., 19(1): 28–33.
- Имянитов Е.Н. (2014) Спорные аспекты фундаментальной онкологии. Практическая онкология, 15(2).
- Bhatia S., Frangioni J.V., Hoffman R.M. et al. (2012) The challenges posed by cancer heterogeneity. Nat. Biotechnol., 30(7): 604–610.
- de Azambuja E., Holmes A.P., Piccart-Gebhart M. et al. (2014) Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): survival outcomes of a randomised, open-label, multicentre, phase 3 trial and their association with pathological complete response. Lancet Oncol., 15(10): 1137–1146.
- Fontenot J.D., Gavin M.A., Rudensky A.Y. (2003) Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol., 4: 330–336.
- Andre F., Dieci M., Dubsky P. et al. (2012) Molecular Pathways: Involvement of Immune Pathways in the Therapeutic Response and Outcome in Breast Cancer. Clin. Cancer Res., 19(1): 28–33.
- Shiao S., Ganesan A., Rugo H. et al. (2011) Immune microenvironments in solid tumors: new targets for therapy. Genes & Development, 25: 2559–2572.
- Ali H.R., Provenzano E., Dawson S.-J. et al. (2014) Association between CD8+ T-cell infiltration and breast cancer survival in 12 439 patients. Ann. Oncol., 25(8): 1536–1543.
- Stanton S.E., Adams S., Disis M.L. (2016) Variation in the Incidence and Magnitude of Tumor-Infiltrating Lymphocytes in Breast Cancer Subtypes. A Systematic Review. JAMA Oncol. doi:10.1001/
jamaoncol.2016.1061. - Baselga J., Bradbury I., Eidtmann H. et al. (2012) NeoALTTO Study Team: Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO): a randomised, open-label, multicentre, phase 3 trial. Lancet, 379(9816): 633–640.
- Kroemer G., Senovilla L., Galluzzi L. et al. (2015) Natural and therapy-induced immunosurveillance in breast cancer. Nat. Med., 21(10): 1128–1135.
- Loi Sh., Sirtaine N., Piette F. et al. (2013) Prognostic and Predictive Value of Tumor-Infiltrating Lymphocytes in a Phase III Randomized Adjuvant Breast Cancer Trial in Node-Positive Breast Cancer Comparing the Addition of Docetaxel to Doxorubicin With Doxorubicin-Based Chemotherapy: BIG 02-98. J. Clin. Oncol., 31(7): 860–867.
- Loi S., Michiels S., Salgado R. et al. (2014) Tumor infiltrating lymphocytes are prognostic in triple negative breast cancer and predictive for trastuzumab benefit in early breast cancer: results from the FinHER trial. Ann. Oncol., 25(8): 1544–1550.
- Schreiber R.D., Old L.J. (2011) Cancer immunoediting: intergrating immunity’s roles in cancer suppression and promotion. Science, 331: 1565–1570.
- Hanahan D., Weinberg R.А. (2011) Hallmarks of Cancer: The Next Generation. Cell, 144(5): 646–674.
- Осинский С.П. (2012) Микроокружение опухолевых клеток и опухолевая прогрессия. Здоров’я України, 34–35.
- Hua Fang, DeClerck Yves A. (2013) Targeting the Tumor Microenvironment: From Understanding Pathways to Effective Clinical Trials. Cancer Res., 73(16): 4965–4977.
- Ming-Ju Tsai, Wei-An Chang еt al. (2014) Tumor Microenvironment: A New Treatment Target for Cancer. ISRN Biochemistry, 2014: 8 р.
- De Nardo D., Brennan D., Rexhepaj E. et al. (2011) Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy. Cancer Discovery, 1(1): 54–67.
- Stanton S.E., Adams S., Disis M.L. (2016) Variation in the incidence and magnitude of tumor-infiltrating lymphocytes in breast cancer subtypes: A Systematic Review. JAMA Oncol., 2(10): 1354–1360.
Иммунный ответ in situ после неоадъювантной химиотерапии у больных местно-распространенным раком грудной железы
Национальный институт рака, Киев
Резюме. Рак грудной железы (РГЖ) — одно из самых распространенных онкологических заболеваний среди женщин в мире. На сегодня актуальными являются работы, посвященные поискам новых подходов к лечению, основанных на современных знаниях в области экспериментальной и клинической онкологии. Цель исследования заключалась в изучении особенностей иммунного инфильтрата в ткани опухоли и его влияния на эффективность неоадъювантной химиотерапии при различных молекулярных подтипах местно-распространенного РГЖ. Нами установлено, что инфильтрация лимфоидными клетками опухолевой ткани чаще возникала у больных местно-распространенным РГЖ без экспрессии рецепторов стероидных гормонов по сравнению с пациентами с гормонозависимыми опухолями (33,33% против 13,63%; р=0,00002). Также исследовано, что увеличение количества CD4 лимфоцитов в резидуальной опухоли повышает риск рецидива заболевания (HR=2,1; 95% ДИ 1,0–4,7; р=0,03). С учетом полученных результатов необходимо дальнейшее изучение предиктивного и прогностического значения параметров лимфоидной инфильтрации при различных молекулярных подтипах РГЖ с целью включения их в диагностические и терапевтические алгоритмы при этом заболевании.
рак грудной железы, химиотерапия.
Адреса:
Верьовкіна Наталія Олегівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: 15a78nataliia@gmail.com














Leave a comment