Зміни у показниках якості життя у хворих на дифузну В-великоклітинну лімфому із групи несприятливого прогнозу, які отримують лікування за режимом R-DA-EPOCH
Філоненко К.С., Крячок І.А., Степанішина Я.А., Мартинчик А.В., Титоренко І.Б.
Резюме. Інтенсифікація хіміотерапії (ХТ) може негативно впливати на показники якості життя. У рамках проспективного когортного багатоцентрового дослідження за участю хворих на дифузну В-великоклітинну лімфому групи несприятливого прогнозу оцінено якість життя пацієнтів, які отримували СНОР-подібні режими (І група), режими R-CHOP (ІІ група) та R-DA-EPOCH (ІІІ група). Проведено порівняння показників якості життя до та після лікування з використанням візуально-аналогової шкали опитувальника EQ-5D-3L. Ефективність терапії в усіх групах була зіставною. У І групі частіше відмічали анемію, в ІІІ — нейтропенію III–IV ступенів, нейропатію та підвищення рівня трансаміназ. Оцінку якості життя проведено у 40 хворих (у І групі — 3 хворих, у ІІ — 22, у ІІІ — 15). У І групі показник якості життя до початку лікування сягав 40%, у ІІ групі — 60%, у ІІІ — 70% (p=0,06). Після завершення терапії рівень якості життя сягав 60; 67,5 та 78% відповідно (p=0,32), тобто не виявлено статистично значущої різниці між групами хворих. Зміни якості життя до та після терапії в усіх групах були статистично значущими (p=0,02). Отже, застосування режиму ХТ R-DA-EPOCH не призводило до зниження якості життя у хворих на дифузну В-великоклітинну лімфому групи несприятливого прогнозу порівняно з іншими режимами ХТ.

Вступ
Найвища захворюваність серед різних підтипів неходжкінських лімфом припадає на дифузну B-великоклітинну лімфому (ДВВКЛ), її питома вага становить 30–58% [1]. ДВВКЛ належить до агресивних лімфом та є потенційно виліковним захворюванням. Результати лікування і відповідь на стандартну терапію у пацієнтів з ДВВКЛ значно відрізняються. Зважаючи на це, з кінця ХХ ст. триває пошук факторів ризику, які впливають на прогноз захворювання та відповідь на терапію. Найбільш визнаною наразі прогностичною моделлю стала клінічна модель прогнозу перебігу захворювання, створена дослідниками із США, — шкала міжнародного прогностичного індексу. Згідно з нею усіх пацієнтів з агресивними неходжкінськими лімфомами стратифіковано на 4 групи ризику: низького, низького проміжного, високого проміжного та високого [2]. У кожній з чотирьох груп показники 5-річної загальної виживаності достовірно відрізнялися. Так, у групі низького ризику 5-річна загальна виживаність становила 73%, а в групі високого ризику — 26% [2].
ДВВКЛ у хворих групи високого та високого проміжного ризику з огляду на незадовільну відповідь на стандартну терапію потребує поглибленого вивчення, в тому числі пошуку нових режимів хіміотерапії (ХТ). Для підвищення ефективності лікування в цій групі пацієнтів запропоновано такі стратегії: скорочення інтервалів між курсами ХТ (курси (R)-СНОР-14) [3]; додавання ще одного препарату (курси (R)-СНОЕР) [4]; подальше посилення інтенсивності лікування за рахунок підвищення доз препаратів (Mega-CHOEP) [5]; альтернативні СНОР-подібним курсам ХТ режими (R-ACVBP) [6]; консолідація терапії із застосуванням високодозової ХТ [7]; підтримуюча терапія ритуксимабом [8]. У частині досліджень показано переваги деяких із цих курсів, проте майже всі вони продемонстрували і більш високі рівні токсичності порівняно зі стандартними режимами терапії [4, 5]. Використання більш інтенсивних схем ХТ потенційно може впливати на якість життя пацієнтів та бути перепоною у застосуванні цих лікувальних підходів.
Якість життя — це інтегральна характеристика фізичного, соціального, психічного або емоційного стану людини, заснована на суб’єктивному сприйнятті (визначення Всесвітньої організації охорони здоров’я) [9]. Якість життя є невід’ємною складовою оцінки стану хворого, пов’язаного з впливом власне злоякісного новоутворення та його лікування. Як саме онкологічне захворювання, так і його лікування, а також їхні ускладнення та наслідки можуть чинити суттєвий вплив на самопочуття та подальше життя пацієнта. Навіть за умови успішного завершення лікування наслідки захворювання та лікування (психологічні зміни, інвалідизація, незворотні токсичні ускладнення) можуть знизити якість життя. Усе це може призвести до значних змін у звичному способі життя пацієнта, виконання ним соціальних, сімейних функцій. Дослідження якості життя визнається повноправним компонентом обстеження стану здоров’я хворого та є на сьогодні одним із ключових показників, на які орієнтуються при виборі терапії. При незначних показниках ефективності та токсичності різних терапевтичних підходів вибір буде зроблено на користь того, що має кращі показники якості життя. Безумовною перевагою оцінки якості життя є те, що пацієнт самостійно суб’єктивно оцінює власний стан здоров’я. Загальним критерієм вищої ефективності протипухлинної терапії при відсутності розбіжності показників виживаності є якість життя хворого. Це положення сформульовано на конференції Національного інституту раку США (US National Cancer Institute — NCI) та Американського товариства клінічної онкології (American Society of Clinical Oncology — ASCO) у 1996 р.
Вивчення якості життя виконується за допомогою спеціально розроблених опитувальників, спрямованих на виявлення симптомів, що цікавлять дослідника, встановлення параметрів функціонування організму хворого та з’ясування його загального стану [10–12]. Різні робочі групи, як загально-онкологічні (ASCO, Європейська організація з дослідження та лікування раку — European Organisation for Research and Treatment of Cancer — EORTC та ін.), так і окремі групи, які спеціалізуються виключно на оцінці та вивченні якості життя (Європейська група з оцінки якості життя — EuroQOL group), створюють зазначені опитувальники. Одним із найбільш популярних опитувальників є ЕQ-5D, розроблений групою EuroQOL. Його безумовна цінність полягає у зручності користування, простоті формулювань та наявності візуально-аналогової шкали, яка допомагає ще простіше та доступніше характеризувати стан здоров’я пацієнта. Цей опитувальник існує у декількох модифікаціях: 3-рівневий (кожне запитання має 3 ступені стверджень), 5-рівневий (кожне запитання має 5 ступенів стверджень), версія для дітей (3-рівневий опитувальник, доступний для розуміння дітям та підліткам), паперові варіанти та електронні версії для роботи на смартфоні, планшеті та ін.
У рамках українського проспективного когортного багатоцентрового дослідження «Порівняння ефективності та токсичності різних режимів хіміотерапії у хворих на дифузну В-великоклітинну лімфому з групи несприятливого прогнозу» оцінено показники якості життя та їх зміни до та після проведення ХТ. Дослідження проведено у відділенні онкогематології з сектором ад’ювантних методів лікування Національного інституту раку та чотирьох інших установах країни. Набір пацієнтів тривав з січня 2014 р. по грудень 2017 р.
Об’єкт і методи дослідження
У дослідження було включено 140 пацієнтів із вперше встановленим діагнозом ДВВКЛ, які належать до групи несприятливого прогнозу, віком 18 років і старше. Визначення режиму ХТ здійснювалося за вибором дослідників. До терапевтичних опцій належали такі режими: СНОР-подібні (І група, n=53), R-СНОР (ІІ група, n=60) або R-DA-EPOCH (ІІІ група, n=27). Заплановано проведення лікування до 6–8 курсів ХТ сумарно. У подальшому частині хворих проведено консолідуючу променеву терапію у дозі 30–36 Гр та профілактику ураження центральної нервової системи за стандартними показаннями. Алгоритм дослідження представлено на рис. 1.
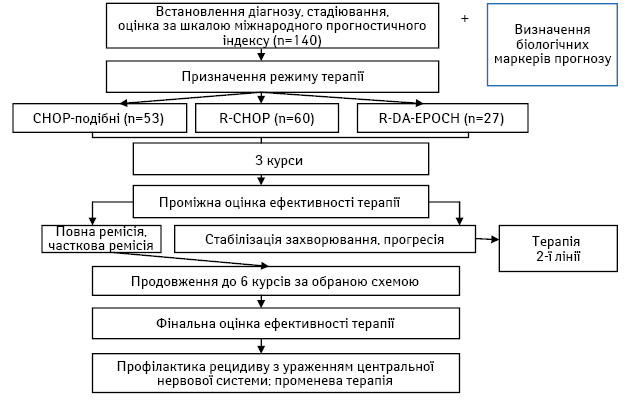
Один з фрагментів дослідження було присвячено оцінці якості життя. Потреба у такій роботі зумовлена тим, що режим ХТ R-DA-EPOCH вважається більш інтенсивним, оскільки окремі типи токсичності мають вищу частоту, потребує п’ятиденного перебування хворого у стаціонарі у зв’язку з 96-годинною інфузією цитостатиків, вимагає проведення більшого обсягу супровідної терапії.
Для оцінки якості життя використано 3-рівневий опитувальник для саморепортування респондентами EQ-5D-3L (на паперовому носії). Нами отримано офіційний дозвіл на використання опитувальника в рамках цього дослідження та його офіційний переклад українською та російською мовами для України (V. 1.0). Для підрахунків застосовано візуально-аналогову шкалу, дозволену для використання на всій території Європи. Для цього пацієнтам необхідно було вказати на шкалі, як вони оцінюють рівень свого здоров’я від 100% (як найліпший можливий рівень) до 0% (найгірший рівень — смерть пацієнта).
Опитувальники були видані хворим до початку лікування та після його завершення. У випадку смерті пацієнта результат оцінки якості життя після завершення лікування був врахований як «0». Середні показники якості життя були оцінені в загальній групі хворих на ДВВКЛ несприятливого прогнозу та в групах залежно від отримуваного типу ХТ у динаміці (до початку терапії та після її завершення).
При проведенні аналізу отриманих даних були використані методи біостатистики. Аналіз проводився в пакеті EZR v. 1.35 (Saitama Medical Center, Jichi Medical University, Saitama, Japan, 2017). Для представлення результатів дослідження застосовано методи описової статистики. У разі кількісних показників проведено оцінку відповідності даних нормальному розподілу за допомогою тесту Колмогорова — Смірнова. У випадку нормального закону розподілу даних розраховано середні арифметичні — (X), помилки середнього — SX, середньоквадратичного відхилення — σ. При відмінності розподілу даних від нормального визначено медіану, показники квартилів. Вiдмiнностi мiж вибiрками, що розподiлені за нормальним законом розподілу, оцiнювалися за параметричним критерiєм Стьюдента (дисперсійний аналіз при порівнянні більше двох груп), при відмінності закону розподілу даних від нормального хоча б в одній групі використано непараметричний критерій Вілкоксона (критерій Крускала — Уолліса при порівнянні більше двох груп) [1]. У всіх випадках критичний рівень значущості прийнято при 0,05. При аналізі якісних (дискретних, номінальних) показників порівняння між групами здійснювалося за допомогою побудови таблиць спряженості та застосуванням точного критерію Фішера або X2-Пiрсона. Попарний міжгруповий аналіз здійснено з використанням поправки Бонферроні.
Результати
У дослідження в цілому включено 140 хворих на ДВВКЛ. На етапі оцінки ефективності та токсичності ХТ отримано нижченаведені дані. У ІІІ групі пацієнтів спостерігали найвищі показники ефективності терапії. Так, позитивна відповідь на терапію була досягнута у 96,3% хворих ІІІ групи проти 73,6 та 81,7% пацієнтів І та ІІ груп відповідно (p=0,047). Повної ремісії досягнуто у 85,2% хворих ІІІ групи проти 41,5 та 60,0% пацієнтів І та ІІ груп відповідно (p=0,005). Показник 2-річної виживаності без прогресування пухлинного процесу у хворих ІІІ групи становив 81,5±8,7% проти 39,7±5,7% у пацієнтів І та 55,4±7,2% ІІ групи (p=0,0096). Дворічна загальна виживаність у ІІІ групі становила 91,2±6,0% проти 56,7±7,8% у І групі та 67,7±6,6% — у ІІ групі хворих (p=0,043). Загальна частота розвитку ускладнень ХТ була зіставною в усіх трьох групах. У І групі токсичні ускладнення супроводжували 266 курсів ХТ (86,6%), в ІІ групі — 271 курс ХТ (73,0%), в ІІІ групі — 139 (85,8%) (p=0,19). Однак у І групі пацієнтів частіше спостерігали анемію (72,3% проти 52,6% у ІІ групі та 67,9% — у ІІІ групі, p=0,03), у ІІІ групі пацієнтів — нейтропенію III–IV ступенів (30,2% проти 19,5% у І групі та 16,4% — в ІІ групі, p=0,048), нейропатію (18,5% проти 10,4% та 6,2% відповідно, p=0,048) та підвищення рівня трансаміназ (24% проти 12,4% та 16,7% відповідно, p=0,02). Незважаючи на вищий рівень розвитку нейтропенії, в тому числі тяжких ступенів, у ІІІ групі хворих не виявлено відмінностей за частотою інфекційних ускладнень, зокрема фебрильної нейтропенії.
Таким чином, курси ХТ за схемою R-DA-EPOCH мали кращі показники ефективності терапії, проте дещо вищі значення окремих типів токсичності, в тому числі негематологічної, що могло впливати на якість життя.
Опитувальники до початку терапії було видано 54 хворим, проте повторно дані були доступні у 40 пацієнтів, які отримували лікування у відділенні онкогематології з сектором ад’ювантних методів лікування Національного інституту раку і були включені в даний аналіз. Із них у І групі — 3 хворих, у ІІ — 22, у ІІІ — 15. При порівнянні цих груп пацієнтів за клінічними характеристиками не виявлено статистично значимих відмінностей.
Показник якості життя до лікування (QOL1) у загальній групі хворих сягав 49,9% [І квартиль 38,8; ІІІ квартиль 60], та 61,1% [І квартиль 50; ІІІ квартиль 81,5] — після лікування (QOL2) (рис. 2). Таким чином, після проведеної терапії відбулося підвищення якості життя на 11,2% (+22,4% від початкового рівня), що є статистично значущим результатом (р=0,03). Дані представлено на рис. 3.
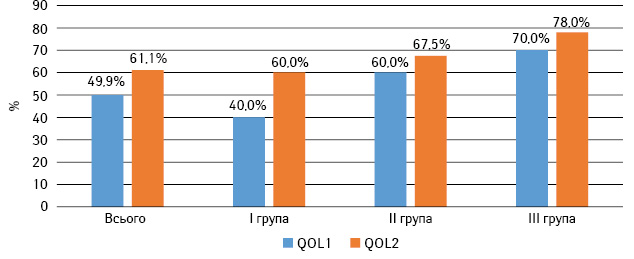
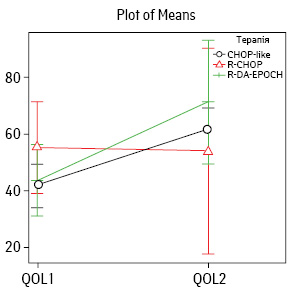
При аналізі в групах хворих залежно від призначеного режиму терапії отримано нижченаведені дані. У І групі показник якості життя до початку лікування QOL1 становив 40%, в ІІ групі — 60%, в ІІІ групі — 70%. Групи були зіставними між собою за вихідним рівнем якості життя (p=0,06). Після завершення терапії рівень якості життя QOL2 зріс до 60; 67,5 та 78% відповідно (p=0,32, тобто не було виявлено статистично значущої різниці між групами хворих). У кожній з груп відбулося підвищення якості життя: на 20% (50% від вихідного) — у І групі, на 11% (19,5% від вихідного) — у ІІ та на 33% (75% від вихідного) — у ІІІ. Зміни якості життя до та після терапії в групах, які отримували лікування, були статистично значущими (p=0,02). Графічне зображення представлено на рис. 4.
Висновки
Таким чином, в цілому у хворих на ДВВКЛ групи несприятливого прогнозу визначено, що рівень якості життя до терапії становив 49,9%. Після завершення лікування зареєстровано підвищення якості життя хворих до 61,1% (приріст на 11,2% або 22,4% від початкового рівня), що є статистично значущим результатом (р=0,03). Незалежно від отримуваного режиму ХТ відмічалася аналогічна тенденція — збільшення рівня якості життя на 20% (50% від вихідного) у І групі, на 11% (19,5% від вихідного) — у ІІ та на 33% (75% від вихідного) — у ІІІ (р=0,02). Не виявлено статистично значимих відмінностей у показниках якості життя між групами хворих залежно від отримуваного режиму ХТ (р=0,32).
Отже, застосування більш інтенсивного режиму ХТ R-DA-EPOCH із пролонгованою інфузією цитостатиків не призводило до зниження якості життя порівняно з іншими режимами ХТ, що одночасно з перевагами у ефективності цього терапевтичного режиму може свідчити на користь його застосування у хворих на ДВВКЛ групи несприятливого прогнозу.
Список використаної літератури
1. Tilly H., Gomes da Silva M., Vitolo U. et al. (2015) Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 26 (Suppl. 5): v116–125.
2. International Non-Hodgkin’s Lymphoma Prognostic Factors Project (1993) A predictive model for aggressive non-Hodgkin’s lymphoma. N. Engl. J. Med., 329(14): 987–994.
3. Cunningham D., Hawkes E.A., Jack A. et al. (2013) Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: a phase 3 comparison of dose intensification with 14-day versus 21-day cycles. Lancet, 381(9880): 1817–1826.
4. Gang A.O., Strøm C., Pedersen M. et al. (2012) R-CHOEP-14 improves overall survival in young high-risk patients with diffuse large B-cell lymphoma compared with R-CHOP-14. A population-based investigation from the Danish Lymphoma Group. Ann. Oncol., 23(1): 147–153.
5. Schmitz N., Nickelsen M., Ziepert M. et al. (2012) Conventional chemotherapy (CHOEP-14) with rituximab or high-dose chemotherapy (MegaCHOEP) with rituximab for young, high-risk patients with aggressive B-cell lymphoma: an open-label, randomised, phase 3 trial (DSHNHL 2002-1). Lancet Oncol., 13(12): 1250–1209.
6. Récher C., Coiffier B., Haioun C. et al. (2011) Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): an open-label randomised phase 3 trial. Lancet, 378(9806): 1858–1867.
7. Vitolo U., Chiappella A., Angelucci E. et al. (2009) Dose-dense and high-dose chemotherapy plus rituximab with autologous stem cell transplantation for primary treatment of diffuse large B-cell lymphoma with a poor prognosis: a phase II multicenter study. Haematologica, 94(9): 1250–1258.
8. Nannya Y., Goto N., Shimizu M. et al. (2015) Efficacy of rituximab maintenance therapy for aggressive B-cell lymphoma depends on use of rituximab in induction therapy: a meta-analysis of randomized controlled trials. Haematologica, 100(12): e519–e520.
9. WHOQOL: Measuring Quality of Life (http://www.who.int/healthinfo/survey/whoqol-qualityoflife/en.1).
10. Sprangers M.A., Cull A., Bjordal K. et al. (1993) The European Organization for Research and Treatment of Cancer. Approach to quality of life assessment: guidelines for developing questionnaire modules. EORTC Study Group on Quality of Life. Qual. Life Res., 2(4): 287–295.
11. Kemmler G., Holzner B., Kopp M. et al. (1999)Comparison of two quality-of-life instruments for cancer patients: the functional assessment of cancer therapy-general and the European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-C30. J. Clin. Oncol., 17(9): 2932–2940.
12. Greiner W., Weijnen T., Nieuwenhuizen M. et al. (2003) A single European currency for EQ-5D health states. Results from a six-country study. Eur. J. Health Econ., 4(3): 222–231.
Изменения в показателях качества жизни у больных диффузной В-крупноклеточной лимфомой из группы неблагоприятного прогноза, получающих лечение по режиму R-DA-EPOCH
Национальный институт рака, Киев
Резюме. Интенсификация химиотерапии (ХТ) может негативно влиять на показатели качества жизни. В рамках проспективного когортного многоцентрового исследования с участием больных диффузной В-крупноклеточной лимфомой группы неблагоприятного прогноза оценено качество жизни пациентов, получавших СНОР-подобные режимы (І группа), режимы R-CHOP (ІІ группа) и R-DA-EPOCH (ІІІ группа). Проведено сравнение показателей качества жизни до и после лечения с использованием визуально-аналоговой шкалы опросника EQ-5D-3L. Эффективность терапии во всех группах была сопоставимой. В І группе чаще отмечали анемию, в ІІІ — нейтропению III–IV степени, нейропатию и повышение уровня трансаминаз. Оценка качества жизни проведена у 40 больных (в І группе — 3 больных, во ІІ — 22, в ІІІ — 15). В І группе показатель качества жизни до начала лечения составил 40%, во ІІ — 60%, в ІІІ — 70% (р=0,06). После завершения терапии уровень качества жизни составил 60; 67,5 и 78% соответственно (р=0,32), то есть не выявлено статистически значимой разницы между группами больных. Изменения качества жизни до и после терапии во всех группах были статистически значимыми (р=0,02). Таким образом, использование режима ХТ R-DA-EPOCH не приводило к снижению качества жизни больных диффузной В-крупноклеточной лимфомой группы неблагоприятного прогноза в сравнении с другими режимами ХТ.
качество жизни, EQ-5D, диффузная В-крупноклеточная лимфома, опросник, R-DA-EPOCH.
Адреса:
Філоненко Катерина Сергіївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: ksfilonenko@yahoo.com














Leave a comment