Терапія пацієнтів з ДВККЛ: світовий досвід в українській медицині
Кущевой Е.В., Мартынчик А.В., Новосад И.О., Кадникова Т.В. , Титоренко И.Б., Алексик Е.М., Крячок И.А.
Резюме. Стаття присвячена огляду сучасних підходів до терапії пацієнтів з диффузною В-великлітинною лімфомою залежно від віку та груп ризику, а також дослідженню ефективності адаптації таких стратегій в умовах української медицини.
Резюме. Статья посвящена обзору современных подходов к лечению пациентов с диффузной В-крупноклеточной лимфомой в зависимости от возраста и групп риска, а также изучению эффективности адаптации таких стратегий к условиям украинской медицины
 В Украине, согласно данным Национального канцер-регистра, за период с 1999 по 2008 гг. состоялся прирост заболеваемости лимфомами среди населения на 4,3% у мужчин и 8,1% у женщин. В результате такого роста заболеваемость неходжкинскими лимфомами (НХЛ) в 2008 г. составила 4,2 на 100 тыс. населения, что отвечает западноевропейским показателям. В 2009 году было диагностировано свыше 2080 новых случаев заболевания НХЛ, большинство из них выявлены на поздних стадиях (ІІІ–IV). Количество больных НХЛ, которые находятся на учете, составляет около 11 252. Наиболее распространенным типом НХЛ является диффузная В-крупноклеточная лимфома (ДВККЛ), доля которой составляет около 30–40% всех видов НХЛ [1, 2, 30].
В Украине, согласно данным Национального канцер-регистра, за период с 1999 по 2008 гг. состоялся прирост заболеваемости лимфомами среди населения на 4,3% у мужчин и 8,1% у женщин. В результате такого роста заболеваемость неходжкинскими лимфомами (НХЛ) в 2008 г. составила 4,2 на 100 тыс. населения, что отвечает западноевропейским показателям. В 2009 году было диагностировано свыше 2080 новых случаев заболевания НХЛ, большинство из них выявлены на поздних стадиях (ІІІ–IV). Количество больных НХЛ, которые находятся на учете, составляет около 11 252. Наиболее распространенным типом НХЛ является диффузная В-крупноклеточная лимфома (ДВККЛ), доля которой составляет около 30–40% всех видов НХЛ [1, 2, 30].
Состояние диагностики и лечения больных НХЛ в Украине остается неудовлетворительным. Так, по данным того же Национального канцер-регистра Украины в 2009 г. не определена стадия у 68,2% больных, в то время как установление клинической стадии заболевания и стратификация по группам риска является фундаментальным этапом в определении лечебного плана. Первичное специфическое лечение получили лишь 80,7% больных, показатель летальности до года с момента установления диагноза составил 36,5% [1].
Особое место среди НХЛ занимает ДВККЛ. Данный подтип НХЛ характеризуется агрессивным течением. В связи с биологическими свойствами опухоли терапия пациентов, которые страдают данным типом лимфом, требует особенно тщательного и обдуманного подхода, который предусматривает как адекватность терапии (применение соответствующих схем терапии с соблюдением доз и интервалов между курсами), так и своевременную оценку эффективности лечения с целью выявления рефрактерности опухоли к назначенной терапии [2].
Около 25 лет (1975–2001 гг.) золотым стандартом в лечении ДВККЛ оставался курс полихимиотерапии (ПХТ) CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон). Применение данного режима позволяло достичь 50% 5-летней общей выживаемости (ОВ) [3, 6]. В последующие годы научный поиск путей повышения эффективности терапии пациентов с ДВККЛ осуществлялся в направлениях интенсификации терапии с помощью добавления цитостатиков к базовому курсу ПХТ СНОР (курс ПХТ по схеме СНОЕР, 2001–2003 гг.) или поиска новых комбинаций химиопрепаратов, а также определения роли лучевой терапии (ЛТ) в лечении пациентов с ДВККЛ [4, 5].
Невзирая на многообещающие результаты исследований II фазы, в сравнительных исследованиях курсов ПХТ M-BACOD, ProMACE-CytaBOM и MACOP-В не было выявлено существенной разницы 6-летней ОВ и бессобытийной выживаемости (БСВ), кроме того было установлено, что курс СНОР имеет меньший уровень токсичности (табл. 1) [6].
Таблица 1 Сравнение эффективности курсов ПХТ M-BACOD, ProMACE-CytaBOM
| Режим | N | 3-летняя ОВ |
|---|---|---|
| CHOP | 225 | 54% |
| M-BACOD | 223 | 52% |
| ProMACE-CytaBOM | 233 | 50% |
| MACOP-B | 218 | 50% |
Интенсификация доз СНОР-подобных режимов, применение высокодозовой терапии с аутологической трансплантацией гемопоэтических стволовых клеток периферической крови (ВДХТ+АТГСК) улучшает показатели выживаемости, однако эта терапия имеет ограниченные показания, принимая во внимание высокую токсичность, особенно для пациентов пожилого возраста [6–8].
Новая эра в лечении НХЛ, в том числе ДВККЛ, наступила со времени появления ритуксимаба — моноклонального антитела против CD20. Препарат зарегистрирован для лечения НХЛ в США в 2001 г. и в Украине в 2003 г. как стандарт в лечении индолентных НХЛ [9]. Дальнейшие исследования подтвердили значительное улучшение как непосредственных, так и отдаленных результатов терапии ДВККЛ с использованием ритуксимаба. Благодаря этим исследованиям с 2005 г. как стандарт терапии первой линии ДВККЛ внесен режим R-CНОР (СНОР + ритуксимаб) с или без использования ЛТ на очаги поражения. Стандартом терапии второй линии являются сальвадж-режимы ПХТ, также включающие ритуксимаб с дальнейшей ВДХТ + АТГСК. Такой подход позволяет достичь удовлетворительных результатов лечения, обеспечивая достаточно высокие показатели выживаемости пациентов с ДВККЛ [10, 11].
Исторически терапия пациентов с ДВККЛ изучалась и рассматривалась в контексте распределения пациентов согласно стадии заболевания и возраста в связи с особенностями терапии в каждой из этих групп. Наиболее часто выделяют следующие подгруппы: молодые пациенты с благоприятным, промежуточным и неблагоприятным прогнозом и пациенты пожилого возраста.
Лечение молодых пациентов с благоприятным прогнозом (< 60 лет, 0–1 балл по шкале Международного прогностического индекса (МПИ))
Данная группа больных составляет около 5% всех ДВККЛ [12].
Вопросу интенсификации курса ПХТ по схеме СНОР посвящено исследование NHL-B1, проведенное German High-Grade Non-Hodgkin’s Lymphoma Study Group (DSHNHL) при участии 710 пациентов [3]. В исследовании сравнивалась эффективность лечения за счет интенсификации базового курса СНОР как путем добавления этопозида (СНОЕР), так и путем сокращения интервалов между курсами ПХТ по схеме СНОР и СНОЕР с 3 до 2 нед. Медиана периода наблюдения составила 58 мес. У пациентов, которые получали ПХТ по схеме CHOEP (CHOP + этопозид) достигнут высший уровень полной ремиссии (ПР) (87,6% vs 79,4%; p=0,03) и 5-летней БСВ (69,2% vs 57,6%; p=0,004) сравнительно с пациентами, которые получали базовый курс ПХТ по схеме CHOP. При сравнении всех 3 интенсифицированных режимов с базовым режимом СНОР (CHOP-14, CHOEP-21 и CHOEP-14) было выявлено, что применение режима CHOEP-21 улучшает показатель БСВ, а CHOEP-14 улучшает показатели БСВ, ОВ и уровень достижения ПР, однако этот курс имеет более высокую токсичность (табл. 2). Таким образом, по результатам данного исследования, курс ПХТ по схеме CHOEP-21 был признан авторами наилучшим выбором лечения ДВККЛ у молодых пациентов из группы с благоприятным прогнозом.
Таблица 2 Результаты лечения пациентов с режимами CHOP-21, CHOP-14, CHOEP-21 и CHOEP-14 (NHL-B1 protocol)
| Показатель | CHOP-21, %N=176 | CHOP-14, % N=172 | CHOEP-21, % N=185 | CHOEP-14, %N=177 |
|---|---|---|---|---|
| ПР | 80,1 (73,4; 85,7) | 78,5 (71,6; 84,4) | 84,9 (78,9; 89,7) | 90,4 (85,1; 94,3) |
| ЧР | 3,4 (1,3; 7,3) | 6,4 (3,2; 11,2) | 3,2 (1,2; 6,9) | 2,8 (0,9; 6,5) |
| СЗ | 1,1 (0,1; 4,0) | 2,9 (1,0; 6,6) | 1,6 (0,3; 4,7) | 0,0 (0,0; 2,1) |
| Прогрессия | 10,2 (6,2; 15,7) | 5,8 (2,8; 10,4) | 7,0 (3,8; 11,7) | 3,4 (1,2; 7,2) |
| Летальность | 0,0 (0,0; 2,1) | 0,0 (0,0; 2,1) | 0,5 (0,0; 3,0) | 1,1 (0,1; 4,0) |
| 5-летняя БСВ | 54,7 (46,7; 62,6) | 60,8 (52,9; 68,6) | 69,2 (62,2; 76,1) | 69,4 (62,0; 76,8) |
| 5-летняя ОВ | 74,9 (67,8; 81,9) | 85,0 (79,3; 90,6) | 83,3 (77,6; 88,9) | 85,1 (79,3; 90,9) |
Изучению роли моноклональных антител в этой группе пациентов посвящено исследование Mabthera International Trial (MInT), в которое было включено 824 пациента младше 60 лет со стадиями I bulky и II–IV ДВККЛ с 1 и менее фактором риска [13]. Пациенты были рандомизированы для проведения 6 курсов ПХТ по схемам CHOP-like с или без применения ритуксимаба. При медиане наблюдения 3 года пациенты, которые получали лечение с ритуксимабом, имели достоверно более высокие показатели БСВ (79% vs 59%; р<0,0001) и ОВ (93% vs 84%; р=0,0001). При дополнительном анализе эффективности применения консолидирующей ЛТ не выявлено улучшения результатов лечения. При сравнении в группах пациентов, которые получали терапию по схемам ПХТ CHOEP и R-СНОР, выявлена сопоставимая эффективность терапии. Также выявлена тенденция относительно преимуществ применения схемы R-CHOP над схемой R-CHOEP.
С 2005 г. начался период изучения вопроса о целесообразности интенсификации курсов химиотерапии по схеме R-СНОР путем уменьшения промежутков между курсами ПХТ (R-СНОР-14).
J.L. Halaas и соавторами [14] был проведен ретроспективный анализ эффективности лечения 49 пациентов, которым было проведено 6–8 курсов лечения по данному протоколу. ПР была достигнута в 82,2% случаев. При медиане наблюдения 24 мес БСВ составила 80%, а ОВ — 90%. Основными проявлениями токсичности были гематологическая и неврологическая, при этом пациенты получили 90% интенсивности протокола. На основании данного исследования был сделан вывод, что режим ПХТ R-CHOP-14 эффективный при лечении пациентов с ДВККЛ, что стало основанием для дальнейшего изучения данного протокола.
В проспективное исследование, инициированное группой GOTEL, было включено 80 пациентов младше 70 лет, 58 — младше 60 лет. Уровень достижения ПР составил 75%. При медиане наблюдения 26 мес БСВ и ОВ составили 72 и 86% соответственно. Токсичность была аналогичной предыдущему исследованию. Данное исследование также подтвердило эффективность и безопасность данной схемы [15].
Окончательный ответ на вопрос относительно целесообразности интенсификации терапии в группе молодых пациентов с благоприятным прогнозом призвано дать исследование UNFOLDER. Пациенты получали 6 курсов ПХТ по схемам R-CHOP-21 или R-CHOP-14. Набор пациентов был завершен в конце 2010 г., следовательно, результаты исследования еще не известны. Однако ожидается, что редукция интервалов между курсами ПХТ приведет к усилению эффективности терапии.
The Southwest Oncology Group (SWOG) провела исследование SWOG 8736, включившее 401 пациента, которые были рандомизированы для проведения 3 курсов ПХТ по схеме CHOP с дальнейшей ЛТ на пораженные зоны СВД 40–50 Гр (І группа) или 8 курсов ПХТ по схеме CHOP без ЛТ (ІІ группа) [16]. Пациенты первой группы сравнительно с пациентами второй группы имели лучшие показатели ОВ (77% vs 64%; p=0,03) и выживаемости, свободной от прогрессирования заболевания (80% vs 72%; p=0,02). Aналогичное исследование II фазы the British Columbia Cancer Agency подтвердило результаты исследования SWOG [17].
Исследование Groupe d’Etude des Lymphomes de l’Adulte (GELA) также были посвящены роли ЛТ в группе молодых пациентов с благоприятным прогнозом. В исследовании сравнивали эффективность терапии 3 курсами ПХТ по схеме CHOP с дальнейшей ЛТ на пораженные зоны с 6 курсами ПХТ по схеме ACVBP (доксорубицин, циклофосфамид, виндезин, блеомицин и преднизолон) без ЛТ [18]. При медиане периода наблюдения 7,7 лет ОВ и выживаемость, свободная от прогрессирования заболевания были значительно лучшими в группе больных, которые получали лечение с режимом ACVBP. Однако применение схемы ACVBP продемонстрировало высший уровень токсичности, что требовало госпитализации пациентов. К тому же препарат виндезин не зарегистрирован во многих странах (в том числе, в Украине).
Таким образом, вышеупомянутые исследования продемонстрировали более высокую эффективность курсов ПХТ с применением ритуксимаба, чем курсов без включения данного препарата. Общей же тенденцией в исследованиях в данной группе пациентов стало усиление интенсивности терапии без значительного усиления токсичности.
Лечение молодых пациентов с неблагоприятным прогнозом (младше 60 лет, 2–3 балла по шкале МПИ)
С 2005 г. стандартом терапии данной группы больных является проведение 8 курсов ПХТ по схеме R-CHOP-14 [14, 15].
У данной группы пациентов активно изучается вопрос эффективности применения ВДХТ в первой линии терапии, чему посвящено существенное количество исследований (табл. 3). Однако до сих пор актуально суждение Леонского консенсуса 1997 г., что применение ВДХТ в первой линии терапии не оправдано вне пределов клинических исследований [19–22].
Таблица 3 Сравнение эффективности ВДХТ+АТГСК в первой линии терапии ДВККЛ у молодых пациентов с неблагоприятным прогнозом
| Автор | Популяция пациентов |
Рандомизация | БСВ | ОВ |
|---|---|---|---|---|
| Haioun et al., 1994 | ≥1 ФР | ПР | Не достоверно | Не достоверно |
| Haioun et al., 2000 | ≥2 ФР | ПР | 0,02 | 0,04 |
| Verdonck et al., 1994 | ІІ–IV стадия | <ПР | Не достоверно | Не достоверно |
| Gianni et al., 1997 | І/ІІ bulky, ІІІ/IV | Все больные | 0,004 | Не достоверно |
| Santini et al., 1998 | II bulky, ІІІ/IV | Все больные | Не достоверно | Не достоверно |
| ≥2 ФР | 0,008 | Не достоверно | ||
| Kluin-N. et al., 2001 | Все больные | ПР | Не достоверно | Не достоверно |
| Kaiser et al., 2002 | ЛДГ выше нормы | ПР, ЧР | Не достоверно | Не достоверно |
| Gisselbrecht et al., 2002 | ≥ФР | Все больные | –0,01 | –0,009 |
| Vitolo et al., 2005 | ≥2 ФР | ПР, ЧР | Не достоверно | Не достоверно |
| Oliveri et al., 2005 | II bulky, ІІІ/IV | Все больные | Не достоверно | Не достоверно |
| Betticher et al., 2005 | МПИ>2 | Все больные | Не достоверно | Не достоверно |
Дальнейшая интенсификация режима СНОЕР изучалась в исследовании High-CHOEP (DSHNHL-2002-1) и не продемонстрировала достоверного повышения эффективности такого лечения [23]. 389 больных получали терапию с помощью максимально интенсифицированного курса ПХТ по схеме CHOEP-21 (High-CHOEP-21: циклофосфамид 1200 мг/м2, доксорубицин 65 мг/м2, винкристин 2 мг, этопозид 175 мг/м2, преднизолон 100 мг) или стандартным курсом ПХТ CHOEP-21. Результаты исследования продемонстрировали сопоставимые показатели ОВ: 86% в группе High-CHOEP-21 vs 83% в группе СНОЕР-21; p=0,849). На основании результатов исследования установлено, что дальнейшая интенсификация терапии оказалась не оправданной.
Таким образом, в данной группе пациентов исследователи стремятся к максимальной интенсификации лечения.
Лечение пациентов пожилого возраста (старше 60 лет, любое количество баллов по шкале МПИ)
В исследовании Eastern Cooperative Oncology Group (ECOG) 352 пациента в возрасте страше 60 лет с I–II стадией заболевания и bulky (опухолевая масса свыше 10 см) получали 6 курсов ПХТ по схеме СНОР. Пациенты, которые достигли ПР, были рандомизированы в группы для проведения ЛТ на пораженные зоны или наблюдения. После 6 лет наблюдения не выявлено существенной разницы между ОВ и ВСП [24].
В исследовании NHL-B2, проведенном DSHNHL, сравнивали эффективность CHOP-21 и CHOEP-21 с поддержкой гранулоцитарными колониестимулирующими факторами (Г-КСФ) и их базовых модификаций (CHOP-14 и CHOEP-14). Оказалось, что добавление этопозида к курсу СНОР не влияло на эффективность терапии, но значительно повышало токсичность в группе пациентов пожилого возраста, что приводило к необходимости задержки введения курсов и редукции доз препаратов. CHOP-14 с поддержкой Г-КСФ имел такой же уровень токсичности, как и CHOP-21, однако имел более высокие показатели ПР, БСВ (53,3% vs 43,8%; р=0,003) и ОВ (40,6% vs 32,5%; р<0,001) [25].
Исследование RICOVER [26] включало 1222 пациента пожилого возраста, которые были рандомизированы на 4 группы для проведения 6 или 8 курсов ПХТ по схеме CHOP-14 с редукцией доз с или без добавления ритуксимаба. ЛТ проводили на зоны экстранодального поражения и очага с большой опухолевой массой (>10 см). Выявлено, что уровень БСВ был выше в группе пациентов, которые получили 8 циклов CHOP-14 без ритуксимаба, чем в группе, получившей 6 таких циклов ПХТ. Однако при проведении ПХТ по схеме R-CHOP-14 не выявлено преимуществ при проведении 2 дополнительных курсов. При сравнении эффективности курсов с или без добавления ритуксимаба, достоверное улучшение БСВ было выявлено лишь в группе пациентов, которые получили 6 R-CHOP-14 vs группы, в которой пациенты получили 6 СНОР. При 3-летнем периоде наблюдения в группе пациентов, которые получили 6 СНОР-14, уровень БСВ составил 47,2%, а ОВ — 67% сравнительно с группой, в которой пациенты получили 6 R-CHOP-14. В данной группе уровень БСВ составил 66,5%, ОВ — 78,1% соответственно. В группе пациентов, которые получили 8 курсов СНОР-14 уровень БСВ составил 53,0%, a ОВ — 66% сравнительно с группой, в которой пациенты получили R-CHOP-14, где уровень БСВ составил 63,1%, a ОВ — 72,5%. По результатам исследования установлено, что для данной группы пациентов терапией выбора являются 8 курсов по схеме СНОР-14 или 6 курсов по схеме R-CHOP-14.
GELA инициировала фундаментальное исследование III фазы LNH-98,5 для сравнения эффективности 8 курсов ПХТ по схемам R-CHOP (1-я группа) и СНОР (2-я группа) у пациентов старше 60 лет с любой стадией заболевания [27]. У пациентов 1-й группы достигнут высший уровень общего ответа на терапию (83 и 69% соответственно; р=0,005). Анализ результатов исследования при сроке наблюдения 10 лет продемонстрировал безоговорочные преимущества курса R-CHOP: уровень ВСП составил 4,8 года в группе R-CHOP и 1,2 года в группе СНОР, а уровень ОВ — 8,4 и 3,5 лет соответственно (р<0,0001). Уровень токсичности во время терапии был сопоставимым, что свидетельствует о достоверно более высокой эффективности и аналогичной переносимости курса R-CHOP у пожилых пациентов.
Еще одно исследовании GELA было посвящено сравнению эффективности и токсичности режимов ACVBP и CHOP-21 у 635 пациентов пожилого возраста с распространенными стадиями ДВККЛ и, по крайней мере, 1 фактором риска по шкале МПИ [28]. Уровень ПР в обеих группах был аналогичным (58% vs 56%), БСВ и ОВ были значительно лучшими в группе пациентов, которая получала ACVBP. При 5-летнем сроке наблюдения уровень БСВ составил 39% в группе ACVBP и 29% в группе CHOP-21 соответственно (р=0,014). Уровень ОВ был достоверно выше в группе ACVBP vs группы СHOP-21 (46% vs 38% соответственно; р=0,036). В группе CHOP-21 достоверно выше была частота поражения ЦНС при прогрессии заболевания или рецидиве (р=0,004).
Целью исследования ECOG4944 было подтверждение результатов предыдущего исследования LNH-98,5, проведенного GELA. Пациенты получали лечение по схемам R-CHOP или CHOP. Больные, достигнувшие позитивного ответа на терапию, были рандомизированы для дальнейшего наблюдения или проведения поддерживающей терапии ритуксимабом. Исследование продемонстрировало, что добавление ритуксимаба к индукционной или поддерживающей терапии улучшает результаты терапии [29].
Результаты второго промежуточного анализа рандомизированного исследования ІІІ фазы LNH03-6B GELA, которая сравнивала интенсификацию ПХТ по схеме R-CHOP у пациентов пожилого возраста, опубликованные в 2011 г., не подтвердили преимущества курса R-CHOP-14 у пожилых пациентов с ДВККЛ. В исследование было включено 602 пациента, средний возраст которых составил 70 лет. Терапию проводили по схемам R-CHOP-14 (296 пациентам) и R-CHOP-21 (304 пациентам). Уровень общего ответа составил 72 и 75% соответственно (р=0,42). 3-летняя БСВ составила 57 и 60% (р=0,81) соответственно. Токсичность была сравнимой в обеих группах.
Таким образом, на сегодняшний момент окончательно определенно, что терапия с использованием базового курса ПХТ по схеме СНОР не позволяет достичь высокой эффективности в лечении пациентов с ДВККЛ. В мире золотым стандартом лечения пациентов с ДВККЛ любого возраста, с любой стадией и прогнозом заболевания являются курсы ПХТ с добавлением ритуксимаба. К сожалению, при отсутствии страховой медицины и государственной поддержки данный вид лечения в Украине доступен лишь небольшой части больных. Именно по этим причинам, исходя из мирового опыта и собственных исследований, необходимы адаптация мировых стандартов лечения к внутренним условиям нашего государства и поиск наиболее приемлемых комбинаций химиопрепаратов для лечения этого вида лимфом.
Наиболее распространенными вариантами интенсификации курса ПХТ по схеме СНОР-21 являются или добавление этопозида (СНОЕР), или сокращение интервалов между курсами ПХТ (СНОР-14). Для пациентов пожилого возраста, с учетом результатов исследований RICOVER-60 и NHL-B2, единственной опцией является проведение ПХТ по схеме СНОР-14. Для молодых пациентов фундаментальных исследований сравнения эффективности и токсичности этих модификаций курса СНОР не проводили. Единственным исследованием по изучению данного вопроса является исследование NHL-B1 [3], проведенное DSHNHL, в котором определены преимущества курса ПХТ по схеме СНОЕР.
В связи с этим нами проведен ретроспективный анализ результатов лечения 41 пациента с впервые выявленной ДВККЛ в возрасте 20–59 лет, которые находились на лечении в отделении онкогематологии Национального института рака (НИР) в течение 2008–2010 гг. и получали лечение по схемам ПХТ СНОР-14 или СНОЕР. Диагноз устанавливали на основании морфологического и иммуногистохимического исследования материала биопсии очага опухолевого поражения, стадирование заболевания проведено согласно международным стандартам.
В группу пациентов, которые получали лечение по схеме СНОР-14, включено 15 пациентов в возрасте 20–59 лет (медиана 42 года), из них 5 (33%) мужчин и 10 (67%) женщин. На момент установления диагноза ранние стадии заболевания (І–ІІ стадия) выявлены у 9 (60%) пациентов, поздние (III–IV стадия) — у 6 (40%) пациентов, В-симптомы выявлены у 6 (40%) пациентов. В группу больных, которые получали лечение по схеме СНОЕР, включено 26 пациентов в возрасте на момент установления диагноза 21–59 лет (медиана 39 лет), 13 (50%) мужчин и 13 (50%) женщин. На момент установления диагноза ранние стадии заболевания (І–ІІ стадия) выявлены у 11 (42%) пациентов, поздние (ІІІ–IV стадия) — у 15 (58%) пациентов, В-симптомы выявлены у 13 (50%) пациентов. Обе группы оказались сопоставимыми по половым, возрастным и клинико-лабораторным характеристикам.
В обеих группах по завершении 3 курсов ПХТ проводили оценку ответа на терапию по критериям B.D. Cheson (1999 и 2007) [30, 31]. При достижении позитивного ответа на лечение (ПР или частичная ремиссия (ЧР)) терапия продолжалась по избранной схеме с или без проведения консолидирующей ЛТ. При отсутствии позитивного ответа на терапию проводилось изменение тактики лечения. Больным назначали курсы сальвадж-терапии, часть больных получали ВДХТ+АТГСК в качестве консолидации терапии. Таким образом, в обеих группах пациенты получили от 3 до 8 курсов ПХТ по избранным схемам. Оценку токсичности проводили по шкале NCI-CTC V.3.0. Введение гранулоцитарных колониестимулирующих факторов проводили лишь при развитии нейтропении III–IV степени.
В среднем в группе пациентов, которые получали лечение по схеме СНОР-14, больные получили 5,6 курсов ПХТ. ЛТ проведена у 6 (40%) пациентов. В группе больных, которые получали лечение по схеме СНОЕР, пациенты получили 6,7 курсов ПХТ. ЛТ проведена 14 (54%) пациентам. Обе группы были аналогичными по количеству проведенных курсов ПХТ и наличию ЛТ (р>0,05). Медиана периода наблюдения составила 11 мес для группы СНОР-14 (3–24 мес) и 15 мес для группы СНОЕР (6–30 мес). Результаты непосредственного ответа на терапию и отдаленные результаты представлены в табл. 4, 5 и на рис. 1, 2.
Таблица 4 Результаты непосредственного
ответа на терапию
| Позитивный ответ на терапию |
СНОР-14 | СНОЕР | р | ||
|---|---|---|---|---|---|
| Абсолютные | % | Абсолютные | % | ||
| Достигнут | 9 | 60 | 20 | 77 | >0,05 |
| ПР | 7 | 47 | 14 | 54 | |
| ЧР | 2 | 13 | 6 | 23 | |
| Не дотигнут | 6 | 40 | 6 | 23 | |
| СЗ | 2 | 13 | 0 | 0 | |
| Прогрессия | 4 | 27 | 6 | 23 | |
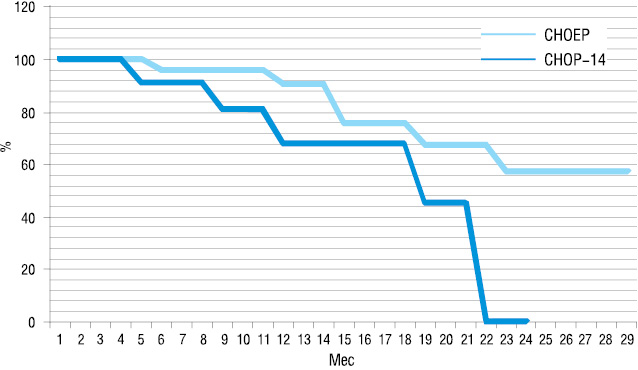
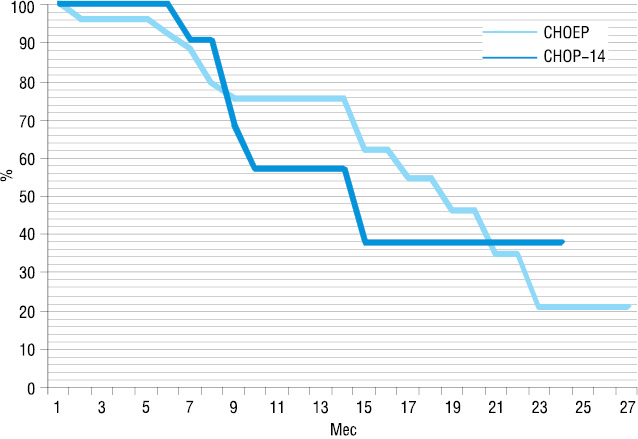
При оценке непосредственных результатов терапии не выявлено достоверной разницы в обеих сравниваемых группах. Впрочем, показатели как общего ответа на терапию, так и количества достигнутых ПР были выше в группе пациентов, которые получали лечение по схеме СНОЕР (общий позитивный ответ на терапию в группе, получавшей терапию по схеме СНОЕР, достигнут в 77% vs 60% больных в группе, получавшей терапию по схеме СНОР-14, количество ПР 54% vs 47% соответственно; р>0,05) (см. табл. 4). При оценке БСВ преимущества лечения по схеме СНОЕР не были выявлены, в отличие от показателя ОВ. Достоверно высший уровень 1-летней ОВ был достигнут в группе, которая получала лечение по схеме СНОЕР (90,4±6,4% vs 67,6±14,5% соответственно; р<0,05). Медиана ОВ в данной группе не была достигнута, сравнительно с 19 мес в группе больных, которые были пролечены с применением схемы СНОР-14 (см. табл. 5).
Таблица 5 Отдаленные результаты лечения
| Курс ПХТ | ОВ, р<0,05 | БСВ, р>0,05 | ||
|---|---|---|---|---|
| 1-летняя, % | Медиана, мес | 1-летняя, % | Медиана, мес | |
| СНОР-14 | 67,6±14,5 | 19 | 56,8±14,35 | 15 |
| СНОЕР | 90,4±6,4 | Не достигнута | 75,1±8,5 | 18,5 |
Показатели токсичности (как гематологической, так и негематологической) были несколько выше в группе больных, которые получали лечение по схеме СНОР-14, однако разница в большинстве случаев также оказалась недостоверной. Развитие лейкопении/нейтропении III–IV степени, а также тошноты и рвоты чаще случалось при лечении по схеме СНОЕР. У 1 пациентки из группы СНОЕР наблюдалась тошнота и рвота III степени, что требовало проведения длительной антиэметической терапии. Развитие фебрильной нейтропении и других инфекционных осложнений чаще наблюдалось при лечении по схеме СНОР-14. Достоверно выше оказался уровень кардиологической токсичности в группе пациентов, пролеченных по схеме СНОР-14: 53% vs 16% в группе СНОЕР (р<0,05). Проведение следующего курса ПХТ было задержано в группе СНОР-14 у 5 больных (у 3 — на 1–3 дня, у 2 — на период до 2 нед). В группе СНОЕР задержано проведение следующего курса ПХТ у 1 больного в связи с негематологической токсичностью (гепатотоксичность III степени) (табл. 6).
Таблица 6 Сравнение токсичности терапии
| Показатель токсичности | СНОР-14 | СНОЕР | р | ||
|---|---|---|---|---|---|
| Абсолютные | Относительные, % | Абсолютные | Относительные, % | ||
| Гематологическая | 13 | 87 | 19 | 85 | >0,05 |
| Негематологическая | 12 | 80 | 15 | 67 | |
| Задержка курса | 5 | 33 | 1 | 4 | <0,05 |
| Лейкопения III–IV степени | 10 | 67 | 17 | 76 | >0,05 |
| Нейтропения III–IV степени | 10 | 67 | 18 | 80 | |
| Фебрильная нейтропения | 6 | 40 | 2 | 8 | |
| Лихорадка не связанная с нейтропенией | 5 | 33 | 4 | 16 | |
| Анемия I–II степени | 9 | 60 | 12 | 45 | |
| Анемия III–IV степени | 1 | 7 | 2 | 8 | |
| Тромбоцитопения I–II степени | 1 | 7 | 1 | 4 | |
| Тромбоцитопения III–IV степени | 0 | 0 | 1 | 4 | |
| Кардиотоксичность | 8 | 53 | 4 | 16 | <0,05 |
| Гепатотоксичность | 2 | 14 | 4 | 16 | >0,05 |
| Мукозит I–II степени | 5 | 33 | 7 | 30 | |
| Мукозит III–IV степени | 1 | 7 | 0 | 0 | |
| Тошнота | 5 | 33 | 12 | 45 | |
| Рвота | 2 | 14 | 8 | 35 | |
| Диарея I–II степени | 2 | 14 | 1 | 4 | |
| Нейропатия I–II степени | 1 | 7 | 2 | 8 | |
| Тромбоз | 1 | 7 | 0 | 0 | |
Представленные данные анализа непосредственных и отдаленных результатов терапии демонстрируют определенные преимущества лечения молодых пациентов с ДВККЛ с помощью курсов ПХТ по схеме СНОЕР. Впрочем, достоверно более высоким является лишь показатель ОВ. В первую очередь это связано с небольшой выборкой пациентов в каждой группе и недлительным периодом наблюдения. Кроме того, приведенные в табл. 6 результаты сравнения токсичности курсов ПХТ по схемам СНОР-14 и СНОЕР демонстрируют, что у 5 больных из группы СНОР-14 следующие курсы были задержаны на период до 2 нед. Во всех случаях это было связано с развитием лейкопении/нейтропении III–IV степени и инфекционными осложнениями, которые развились на фоне нейтропении. Таким образом, в этой группе при отсутствии адекватной поддержки Г-КСФ не была соблюдена интенсивность режима, что могло повлиять на результаты терапии.
Выводы
Повышение эффективности лечения ДВККЛ требует интенсификации базового курса ПХТ по схеме СНОР во всех группах пациентов. Возможными путями улучшения эффективности терапии является сокращение интервалов между курсами ПХТ, использование режимов, которые усилены за счет добавления цитостатиков или моноклональных антител к базовому курсу ПХТ по схеме СНОР-21. Наилучшим решением терапевтической проблемы ДВККЛ является применение курса ПХТ по схеме R-СНОР-21(14). Однако при невозможности использования ритуксимаба в протоколе лечения пациентов с ДВККЛ следует оказать предпочтение применению режима СНОР-14 у пожилых пациентов и режима СНОЕР у молодых больных.
Собственное ретроспективное исследование, проведенное на базе отделения онкогематологии НИР относительно сравнения эффективности и токсичности применения режимов СНОР-14 и СНОЕР у молодых пациентов (<60 лет) с впервые установленным диагнозом ДВККЛ, продемонстрировало преимущества проведения лечения пациентов данной группы с использованием курсов ПХТ по схеме СНОЕР. В группе пациентов, которые получали лечение по схеме СНОР-14 достоверно чаще проведение следующего курса ПХТ было задержано по причине развития лейкопении/нейтропении III–IV степени и инфекционных осложнений. Несоблюдение интенсивности курса СНОР-14 в связи с развитием таких осложнений могло повлиять на результаты эффективности данного режима, следовательно, проведение данных курсов требует профилактического введения Г-КСФ. Погрешности при проведении анализа данных и недостоверность некоторых результатов вероятно связаны с небольшим количеством пациентов, включенных в каждую группу, и коротким периодом наблюдения. Таким образом, для получения более достоверных результатов необходимо проведение дальнейшего наблюдения за данной группой пациентов и привлечение к исследованию большего количества больных.
Литература
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О. и др. (2009) Рак в Україні. Бюлетень національного канцер-реєстру України.10. Київ.
2. Jaffe E.S., Harris N.L., Stein H., Vardiman J.W. (2001) Pathology and Genetics of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press. WHO Classifications of Tumours.
3. Pfreundschuh M., Trümper L., Kloess M. et al. (2004) Two-weekly or 3-weekly CHOP chemotherapy with or without etopоside for the treatment of young patients with good-prognosis (normal LDH) aggressive lymphomas: results of the NHL-B1 trial of the DSHNHL. Blood,104(3): 626–633.
4. Persky D.O., Miller T.P. (2009) Localized large cell lymphoma: is there any need for radiation therapy? Curr Opin Oncol., 21(5): 401–406.
5. Bonnet C., Fillet G., Mounier N. et al. (2007) CHOP alone compared with CHOP plus radiotherapy for localized aggressive lymphoma in elderly patients: a study by the Groupe d’Etude des Lymphomes de l’Adulte.J Clin Oncol., 25(7): 787–792.
6. Fisher R.I., Gaynor E.R., Dahlberg S. et al. (1993) Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin’s lymphoma. N Engl J Med., 328(14): 1002–1006.
7. Blay J., Gomez F., Sebban C. et al. (1998) The International Prognostic Index correlates to survival with aggressive lymphoma in relapse: analysis of the PARMA trial. Parma Group. Blood, 92(10): 3562–3568.
8. Shipp M.A., Abeloff M.D., Antman K.H. et al. (1999) International Consensus Conference on High-Dose Therapy With Hematopoietic Stem Cell Transplantation in Aggressive Non-Hodgkin’s Lymphomas: report of the jury. J Clin Oncol.,17(1): 423–429.
9. Coiffier B., Haioun C., Ketterer N. et al. (1998) Rituximab (anti-CD20 monoclonal antibody) for the treatment of patients with relapsing or refractory aggressive lymphoma: a multicenter phase II study. Blood, 92(6): 1927–1932.
10. Voss J.M., Link B.K., Grossbard M.L. et al. (2001) Phase II study of rituximab in combination with CHOP chemotherapy in patients with previously untreated, aggressive non-Hodgkin’s lymphoma. J Clin Oncol.,19(2): 389–397.
11. Feugier P., van Hoof A., Sebban C. et al. (2005) Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the Groupe d’Etude des Lymphomes de l’Adulte. J Clin Oncol., 23(18): 4117–4126.
12. Armitage J.O. (2007) How I treat patients with diffuse large B-cell lymphoma. Blood,110(1): 29–36.
13. Pfreundschuh M., Trümper L., Оsterborg A. et al. (2006) CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group.Lancet Oncol., 7(5): 379–391.
14. Halaas J.L., Moskowitz C.H., Horwitz S. et al. (2005) R-CHOP-14 in patients with diffuse large B-cell lymphoma: feasibility and preliminary efficacy. Leuk Lymphoma, 46(4): 541–7.
15. Rueda A., Sabin P., Rifá J. et al. (2008 Mar) R-CHOP-14 in patients with diffuse large B-cell lymphoma younger than 70 years: a multicentre, prospective study. Grupo Oncologico para el Tratamiento y Estudio de los Linfomas (GOTEL). Hematol Oncol., 26(1): 27–32.
16. Miller T.P., Dahlberg S., Cassady J.R. et al. (1998) Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin’s lymphoma.N Engl J Med., 339(1): 21–26.
17. Shenkier T.N., Voss N., Fairey R. et al. (2002) Brief chemotherapy and involved-region irradiation for limited-stage diffuse large-cell lymphoma: an 18-year experience from the British Columbia Cancer Agency.J Clin Oncol., 20(1): 197–204.
18. Reyes F., Lepage E., Ganem G. et al. (2005) ACVBP versus CHOP plus radiotherapy for localized aggressive lymphoma.N Engl J Med., 352(12): 1197–1205.
19. Milpied N., Deconinck E., Gaillard F. et al. (2004) Initial treatment of aggressive lymphoma with high-dose chemotherapy and autologous stem-cell support. N Engl J Med., 350(13): 1287–1295.
20. Vitolo U., Chiappella A., Angelucci E. et al. (2009) Dose-dense and high-dose chemotherapy plus rituximab with autologous stem cell transplantation for primary treatment of diffuse large B-cell lymphoma at poor prognosis: a phase II multicenter study. Haematologica., 94(9): 1250–1258.
21. Haioun C., Mounier N., Emile J.F. et al. (2009) Rituximab versus observation after high-dose consolidative first-line chemotherapy with autologous stem-cell transplantation in patients with poor-risk diffuse large B-cell lymphoma. Ann Oncol., 20(12): 1985–1992.
22. Philip T., Guglielmi C., Hagenbeek A. et al. (1995) Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J Med., 333(23): 1540–1545.
23. Vitolo U., Liberati A.M., Cabras M.G. et al. (2005) High dose sequential chemotherapy with autologous transplantation versus dose-dense chemotherapy MegaCEOP as first line treatment in poor-prognosis diffuse large cell lymphoma: an «Intergruppo Italiano Linfomi» randomized trial.Haematologica., 90(6): 793–801.
24. Horning S.J., Weller E., Kim K. et al. (2004) Chemotherapy with or without radiotherapy in limited-stage diffuse aggressive non-Hodgkin’s lymphoma: Eastern Cooperative Oncology Group study 1484.J Clin Oncol., 22(15): 3032–3038.
25. Pfreundschuh M., Trümper L., Kloess M. et al. (2004) Two-weekly or 3-weekly CHOP chemotherapy with or without etoposide for the treatment of elderly patients with aggressive lymphomas: results of the NHL-B2 trial of the DSHNHL. Blood.,104(3): 634–641.
26. Pfreundschuh M., Schubert J., Ziepert M. et al. (2008) Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomized controlled trial (RICOVER-60). Lancet Oncol., 9(2): 105–116.
27. Coiffier B., Lepage E., Briere J. et al. (2007) CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma.N [Coiffier B, et al. Blood 2010; June 14 J Clin Oncol., 25: Abstract 8009.
28. Tilly H., Lepage E., Coiffier B. et al. (2003) Intensive conventional chemotherapy (ACVBP regimen) compared with standard CHOP for poor-prognosis aggressive non-Hodgkin lymphoma.Blood.,102(13): 4284–4289.
29. Morrison V.A., Weller E.A., Habermann T.M. et al. (2007) Maintenance rituximab (MR) compared to observation (OBS) after R-CHOP or CHOP in older patients (pts) with diffuse large B-cell lymphoma (DLBCL): an intergroup E4494/C9793 update. J Clin Oncol., 25(18), 443.
30. Cheson B.D., Horning S.J., Coiffier B. et al. (1999) Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas. J Clin Oncol., 17: 1244–1253.
31. Cheson BD, Pfistner B. et al. (2007) Revised Response CHITERIA for MALIGNANT LYMPHOMA. jclin Oncol., 25 (5): 579-586.














Leave a comment