Результати лікування злоякісних новоутворень м’яких тканин у дітей із застосуванням нових програм поліхіміотерапії з підтримкою гемопоезу стовбуровими клітинами периферичної крові
Шайда Е.В., Климнюк Г.І., Павлик С.В.
Резюме. Розроблені схеми хіміотерапії з використанням топотекану у комбінації з карбоплатином або циклофосфамідом у середньовисоких та високих дозах проявили високу ефективність при лікуванні дітей з прогностично несприятливими злоякісними новоутвореннями м’′яких тканин. Повну та часткову ремісії було досягнуто у 57,6% хворих основної групи дослідження, що збігається з результатами, отриманими при лікуванні даної патології в провідних країнах світу, і майже вдвічі перевищує результати лікування групи контролю (27,3%). Загальна 3-річна виживаність хворих основної групи становить 44,1%, безрецидивна — 34,4%, а в групі контролю відповідно 15,4 та 12,2%. Підтримка гемопоезу автологічними стовбуровими клітинами периферичної крові після застосування високомієлосупресивних режимів розробленої інтенсивної хіміотерапії (топотекан у комбінації з карбоплатином або високодозовим циклофосфамідом) вдвічі скорочує тривалість лейкопенії та тромбоцитопенії IV ступеня, знижує частоту ускладнень, пов’язаних з мієлосупресією.
Вступ

Незважаючи на успіхи, досягнуті в лікуванні злоякісних новоутворень м’яких тканин (ЗНМТ) у дітей (рівні загальної та безрецидивної виживаності становлять 73 та 65% відповідно) завдяки застосуванню сучасних програм комплексного лікування, прогноз для хворих з прогностично несприятливими та рецидивними формами захворювання залишається незадовільним. Рівень виживаності пацієнтів даних груп досягає лише 30–35% та 15–25% відповідно [1, 2, 3]. Слід зазначити, що до ЗНМТ з несприятливим прогнозом (групи високого та дуже високого ризику) належать більш ніж 60% пацієнтів з даною онкопатологією. До вказаних груп входять усі пацієнти з альвеолярною формою рабдоміосаркоми (РМС) та пухлинами нерабдоїдної природи, а також діти з IV стадією захворювання.
Згідно з сучасними уявленнями підвищення рівня виживаності дітей з прогностично несприятливими формами ЗНМТ пов’язують перш за все з розробкою та впровадженням в клінічну практику нових, більш інтенсивних програм цитостатичної терапії [4, 5, 6, 7]. Одним з основних принципів даних програм є рання оцінка ефекту від лікування та перехід на більш «жорсткі» схеми поліхіміотерапії (ПХТ) вже на етапі неоад’ювантної терапії. Прикладом найбільш перспективних режимів, ефективність яких підтверджена пілотними дослідженнями та продовжує активно вивчатися, зокрема Європейською педіатричною групою з лікування сарком м’яких тканин (EpSSG), слід вважати схеми з топотеканом у дозі від 0,75 до 2 мг/м в якості монотерапії та в комбінації з карбоплатином або циклофосфамідом у високих та середньовисоких дозах. Останні застосовують в якості ПХТ другої лінії при лікуванні рефрактерних та рецидивних форм ЗНМТ у дітей [8, 9, 10]. Комбінація топотекан/циклофосфамід продемонструвала високу ефективність при лікуванні рецидивних форм РМС (66% позитивних відповідей) [9, 10].
Незважаючи на те що за рекомендаціями Європейського товариства дитячої трансплантології мегадозова консолідуюча ПХТ з трансплантацією стовбурових клітин периферичної крові (СКПК) або кісткового мозку (КМ) вважається «методом вибору» для дітей з IV стадією захворювання ембріональної РМС, позитивна роль даного методу при лікуванні інших гістологічних субтипів сарком м’яких тканин не вважається доведеним фактом [12, 13, 14]. Так, за даними деяких авторів, проведення мегадозової ПХТ на етапі консолідації суттєво не підвищує виживаність дітей з альвеолярною РМС та саркомами нерабдоїдної природи [11, 15, 16].
Менш опрацьованим є питання клінічної та економічної доцільності застосування методу підтримки гемопоезу СКПК при проведенні інтенсивної ПХТ другої лінії у дітей з прогностично несприятливими формами ЗНМТ. Актуальність проблеми обумовлена наступними факторами. Висока мієлосупресивність вищезгаданих режимів ПХТ та необхідність їх проведення у дітей зі зниженими резервами кровотворення внаслідок попередньої хіміотерапії значно підвищує ризики усіх типів ускладнень, пов’язаних із тривалою мієлосупресією. Остання негативно впливає на кінцевий результат лікування, оскільки призводить до подовження інтервалів між курсами ПХТ, тобто зниження «щільності» останньої. У деяких надто передлікованих пацієнтів виснаження резервів гемопоезу взагалі не дозволяє провести адекватне протирецидивне лікування. Суттєвим є те, що призначення препаратів, які стимулюють лейкопоез, тобто колонієстимулюючих факторів (КСФ), не вирішує зазначених проблем, зокрема проблеми зниження тривалості глибокої тромбоцитопенії. Ефективність методу підтримки гемопоезу СКПК підтверджена багаторічним досвідом його застосування в трансплантології. Введення автологічних СКПК забезпечує швидке відновлення власного гемопоезу, веде до скорочення періоду лейко- та тромбоцитопенії і, таким чином, опосередковано позитивно впливає на кінцевий результат лікування [ 12, 13, 14]. Разом з тим проблема визначення оптимальних строків забору СКПК, а також чітких показань до використання даного методу при проведенні протирецидивної ПХТ або терапії другої лінії у дітей з прогностично несприятливими формами ЗНМТ цілеспрямовано не досліджувалася і залишається не вирішеною.
Метою роботи було визначити ефективність інтенсивної ПХТ з використанням нових цитостатиків та підтримкою гемопоезу СКПК при лікуванні дітей з прогностично несприятливими формами ЗНМТ.
Матеріали та методи дослідження
За період з 2007 по 2009 рр. у відділенні дитячої онкології Національного інституту раку отримували лікування 74 хворих з прогностично несприятливими ЗНМТ. До основної групи дослідження ввійшли 34 дитини: з первинно-резистентними пухлинами, у яких на етапі неоад’ювантної ПХТ не виявлено достатньої відповіді на проведене лікування (11 дітей); з первинно-розповсюдженими пухлинами (ІІІ та ІV стадія — 5 хворих); з рецидивами захворювання (18 пацієнтів).
Слід зазначити, що 64,8% (22/34) хворих основної групи дослідження на момент встановлення діагнозу мали розповсюджений пухлинний процес, тобто ІІІ–ІV стадію захворювання. У 73,5% пацієнтів було діагностовано ЗНМТ несприятливого гістологічного варіанту (альвеолярну рабдоміосаркому та не рабдоміосаркоми).
Усі діти з прогностично несприятливими ЗНМТ отримували ПХТ першої лінії згідно з клінічними протоколами лікування сарком м’яких тканин із використанням цитостатиків в середньовисоких дозах (вінкристин, іфосфамід, доксорубіцин та дактиноміцин).
В якості лікувальної програми другої лінії терапії для хворих основної групи було обрано схему хіміотерапії з використанням топотекану у комбінації з карбоплатином або циклофосфамідом у середньовисоких та високих дозах (табл. 1).
Таблиця 1. Схема терапії другої лінії, яку застосовували при лікуванні прогностично несприятливих ЗНМТ у дітей основної групи
| Схема ПХТ | Topo Carbo | Topo Carbo | Оцінка відповіді пухлини |
Topo Cyclo | VP16 Carbo | Topo Cyclo | VP16 Carbo |
|---|---|---|---|---|---|---|---|
| Час (тижні) | 1 | 4 | 7 | 10 | 13 | 16 | |
| Препарат Topo | вводиться в дозі 2 мг/м² в/в у 1–3-й день | ||||||
| Препарат Carbo | вводиться в дозі 250 мг/м² в/в у 4–5-й день | ||||||
| Препарат Cyclo | вводиться в дозі 1500 мг/м² в/в у 1–2-й день | ||||||
| Препарат VP16 | вводиться в дозі 100 мг/м² в/в у 1–3-й день | ||||||
Двоє дітей з другим рецидивом ангіосаркоми та ембріональної РМС, враховуючи передлікованість пацієнтів, що підвищує вірогідність можливих токсичних ускладнень, отримували терапію другої лінії з меншими дозами топотекану та циклофосфаміду (курсова доза 4 мг/м² та 1 г/м² відповідно).
Відповідь пухлини на проведену терапію оцінювали згідно з наступними критеріями клінічного протоколу:
- повна відповідь: зникнення всіх ознак первинної пухлини;
- дуже добра часткова відповідь: зменшення пухлини ≥90%, але <100% її ініціального об’єму;
- часткова відповідь: зменшення пухлини ≥66%, але <89% її ініціального об’єму;
- мінімальна часткова відповідь: зменшення пухлини >33%, але <66% її ініціального об’єму;
- стабілізація процесу: зменшення пухлини <33% її ініціального об’єму;
- прогресування: збільшення об’єму пухлини більше ніж на 40% усіх вимірюваних осередків ураження або поява нових уражень.
Побічні ефекти від ПХТ оцінювали за загальноприйнятою шкалою токсичності ВООЗ.
До контрольної групи було обрано 33 хворих з прогностично несприятливими ЗНМТ, що отримували лікування у відділенні дитячої онкології за період з 2000 по 2006 рр. Так як і група спостереження, контрольна група складалася переважно з хворих зі ЗНМТ прогностично несприятливих гістологічних субтипів (72,7%), що на момент встановлення діагнозу мали розповсюджений пухлинний процес (85%).
В якості терапії другої лінії використовували загальновідомі протокол CWS-96 (CEVAIA) та схему ICE.
Підтримку гемопоезу автологічними СКПК здійснено у 14 дітей з прогностично несприятливими ЗНМТ. 11 з 14 дітей мали прогностично несприятливі гістологічні субтипи ЗНМТ (9 пацієнтів — пухлини нерабдоїдної природи, 2 хворих — альвеолярні РМС). За характером відповіді пухлини на ПХТ першої лінії у 6 з 14 пацієнтів ЗНМТ було віднесено до первинно-рефрактерних форм захворювання. П’ятеро дітей мали пізні (3 хворих) або ранні (2 пацієнти) рецидиви хвороби. В 4 випадках рецидив мав локальний характер, у 3 дітей проявлявся у вигляді метастатичного ураження легенів. Усі діти отримували ПХТ першої лінії за стандартизованими програмами і мали в анамнезі від 4 до 14 курсів інтенсивної цитостатичної терапії (режими VAIA, CEVAIA, IVADo, ICE) із використанням цитостатиків у середньовисоких дозах, а також препаратів КСФ у зв’язку з розвитком нейтропенії IV ступеня. Таким чином, проведення ПХТ другої лінії у даних хворих було пов’язано з високим ризиком важкого перебігу періоду мієлосупресії.
До умов, що забезпечували можливість використання даного методу належали:
- відсутність метастатичного ураження КМ;
- отримання позитивного результату після одного або двох перших курсів протирецидивної терапіїї, що забезпечує зниження вірогідності канцеремії.
Дотримання зазначених умов вважається необхідним з метою запобігання контамінації лейкоконцентрату клітинами пухлини. При ефективності ПХТ наступний протирецидивний блок може бути використаний в якості мобілізаційного.
У дітей з рецидивами захворювання як мобілізаційний найчастіше використовувався режим ІСЕ або схеми, що включали високодозовий циклофосфамід. Режим ІСЕ, що довів свою ефективність при лікуванні рефрактерних форм солідних новоутворень у дітей, передбачає введення іфосфаміду в дозі 1800 мг/м в 1–5-й день, карбоплатину в дозі 400 мг/м в 1–2-й день, етопозиду в дозі 100 мг/м 1–5-й день. Режим Тopo/HD-Сyclo наведено у табл. 1. При мобілізації СКПК використовувався даний режим з редукцією дози циклофосфаміду на 30%. У подальшому, з підтримкою гемопоезу СКПК, цитостатики застосовувалися в повній дозі.
СКПК отримували шляхом лейкоцитаферезу на сепараторі Fresenius AS-104 та Fresenius ТЕС-204 фірми «Fresenius» (Німеччина). За 1 процедуру піддавали обробці 3–4 об’єми циркулюючої крові. Мобілізацію СКПК, тобто підвищення рівня СД-34-позитивних клітин в ПК досягали шляхом призначення КСФ (граноцит, нейпоген) у дозі 7–10 мкг/кг маси на добу підшкірно протягом 5–9 діб. Стимуляцію КМ починали на 7–8-й день після закінчення мобілізаційних режимів ПХТ на фоні гранулоцитопенії IV ступеня. У 4 хворих була використана методика стимуляції КМ до початку ПХТ. Опосередковано на достатнє підвищення концентрації СД-34-позитивних клітин в ПК і можливість проведення лейкоферезу вказувало стрімке зростання кількості лейкоцитів у ПК, коли за 1 добу їх рівень збільшувався у декілька разів. Точним методом є визначення кількості стовбурових клітин в ПК. Достатньою вважається концентрація 10–20 СД-34-позитивних клітин в 1 мкл крові.
Концентрація СКПК в лейкоконцентраті та в ПК методом протокової цитофлюорометрії за протоколом ISHAGE на апараті FACScan фірми «Becton Diсkіnson» (США). Ефективність процедури колекції оцінювали, враховуючи той факт, що при проведенні інтенсивної, але не мієлоаблятивної ПХТ достатньою вважається реінфузія (0,5–1,0) × 10 СД-34-позитивних клітин на 1 кг маси хворого. Кріоконсервацію СКПК здійснювали низькотемпературним методом (-80°С). В якості кріопротектора використовували диметилсульфоксид. Реінфузію СКПК здійснювали через 48 год після закінчення ПХТ внутрішньовенно крапельно через інфузійну систему без фільтра або повільно струминно шприцем.
Результати дослідження
Рівень загальної виживаності хворих з прогностично несприятливими ЗНМТ складає 66,7% (див. рис. 1).
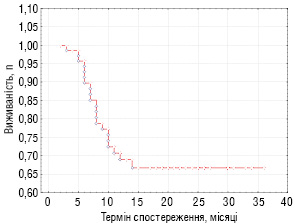
Безпосередня ефективність режимів ПХТ із застосуванням інтенсивної ПХТ (топотекан у комбінації з карбоплатином або високодозовим циклофосфамідом) могла бути оцінена лише у 26 пацієнтів основної групи, тому що 8 хворих отримували терапію з використанням топотекану у різних комбінаціях після проведення оперативного втручання типу R0 (радикальна операція) або типу R1 (елементи пухлини визначалися тільки при гістологічному дослідженні країв резекції). Згідно з вимогами клінічних протоколів позитивною вважали повну, дуже добру часткову або часткову відповіді пухлини на цитостатичну терапію. Отримані дані подано у табл. 2.
Таблиця 2. Ефективність терапії другої лінії при лікуванні дітей з прогностично несприятливими ЗНМТ
| Ефективність ПХТ | Основна група | Група контролю | ||
|---|---|---|---|---|
| n | % | n | % | |
| Загальна ефективність ПХТ | 15 | 57,6 | 9 | 27,3 |
| Повна відповідь | 6 | 23,0 | 9 | 27,3 |
| Дуже добра часткова відповідь | 5 | 19,2 | – | – |
| Часткова відповідь | 4 | 15,4 | – | – |
|
Мінімальна часткова відповідь |
4 | 15,4 | 7 | 21,2 |
| Стабілізація процесу | 5 | 19,2 | 17 | 51,5 |
| Прогресування хвороби | 2 | 7,8 | – | – |
| Всього | 26 | 100,0 | 33 | 100,0 |
Примітка. Загальна ефективність ПХТ: ПВ + ДДЧВ + ЧВ (р<0,05 ).
Виходячи з отриманих даних, схеми хіміотерапії з використанням топотекану у комбінації з карбоплатином або циклофосфамідом у середньовисоких та високих дозах виявили ефективність при лікуванні хворих на ЗНМТ у 57,6% (15/26) випадків, у той час як у групі контролю до позитивних можна віднести тільки 27,3% (9/33) відповідей на проведене лікування.
Побічні ефекти при безпосередньому введенні топотекану не спостерігалися. У подальшому у всіх пацієнтів основної групи головним побічним ефектом виявився розвиток мієлосупресії. Проаналізовано частоту ускладнень після 74 блоків ПХТ, що включали топотекан у комбінації з карбоплатином або циклофосфамідом, у 34 хворих. Нейтропенія ІІІ–ІV ступеня була зафіксована у 84,6% випадків, у третини хворих вона носила фебрильний характер. В усіх випадках використання топотекану в комбінації з високодозовим циклофосфамідом або карбоплатином спостерігалася тромбоцитопенія ІV ступеня, в 85,7% — анемія ІV ступеня, що зумовило необхідність у середньому 2–5 переливань компонентів крові на 1 курс лікування. Тільки в 5 випадках спостерігався оральний мукозит І–ІІ ступеня, в 1 — гепатотоксичність І ступеня. Одна дитина, яка отримувала терапію за даною програмою, померла від септичних ускладнень на фоні агранулоуцитозу тривалої лейкопенії IV ступеня після блоку, що включав топотекан та високодозовий циклофосфамід у повній дозі.
Всього підтримку гемопоезу СКПК здійснено при проведенні 20 курсів ПХТ у 14 хворих на ЗНМТ. Даний метод було застосовано при проведенні режиму ІСЕ (5 випадків) та режимів Тopo/HD-Cyclo та Тopo/Carbo (5 та 4 курси відповідно), а також схеми Carbo/VP-16 у 1 хворого. Крім того, до 2007 р. методику було застосовано у дітей з рецидивами ЗНМТ при проведенні монохіміотерапії з використанням високодозових циклофосфаміду (2 хворих), вепезиду та карбоплатину (1 та 2 хворих відповідно).
Важливо, що з 16 процедур лейкоферезу, які було проведено у 14 хворих, в 10 випадках кількість СКПК, отриманих за 1 процедуру, була достатньою для забезпечення підтримки гемопоезу під час проведення 3 або навіть 4 наступних курсів ПХТ. У 2 хворих необхідну кількість СКПК отримано після 2 процедур лейкоферезу.
З метою оцінки ефективності методу підтримки гемопоезу СКПК вивчали деякі показники, що характеризують перебіг мієлосупресії після цитостатичної терапії. При цьому вищезгадані показники було зіставлено у хворих, які отримували той самий режим ПХТ як з підтримкою СКПК, так і без використання даного методу, що підвищує доказовість результатів проведеного аналізу. У наших дослідженнях такий аналіз було проведено на прикладі режиму ІСЕ та Тopo/HD-Cyclo. Отримані результати представлено в табл. 3, 4.
Таблиця 3. Показники перебігу мієлосупресії у дітей із ЗНМТ, що отримували терапію за схемою ІСЕ
| Показники перебігу мієлосупресії | Режим ПХТ | |
|---|---|---|
| ІСЕ (n=6) | ІСЕ з підтримкою СКПК (n=4) | |
| Середня тивалість лейкопенії IV ступеня (дні) | 9,2 (6–12) | 4,75 (2–6) |
| Середня тривалість тромбоцитопенії IV ступеня (дні) | 7,5 (7–10) | 5 (3–7) |
| Кількість трансфузій тромбоконцентрату (на 1курс ПХТ) | 2,3 (14/6) | 0,75 (3/4) |
| Частота виникнення геморагічного синдрому (на 1 курс ПХТ) | 0,83 (5/6) | 0,25 (1/4) |
| Частота виникнення фебрильної нейтропенії (на 1 курс ПХТ) | 0,76 (6/5) | 0,5 (2/4) |
| Середня тривалість призначення КСФ (дні) | 10,82 | 8,25 |
Примітка: n — кількість блоків ПХТ.
Наведені дані свідчать, що підтримка гемопоезу СКПК забезпечує значне (майже вдвічі) скорочення періоду нейтропенії IV ступеня, а також зменшення кількості епізодів фебрильної нейтропенії у пацієнтів обох груп. Так, навіть при редукції дози циклофосфаміду на 30% тривалість нейтропенії становила в середньому 9,8 дня, а при реінфузії СКПК та застосуванні цитостатика в повній дозі — 5,2 дня (див. табл. 4). Тривалість призначення препаратів КСФ при проведенні режимів ПХТ, що порівнюються, значно не відрізнялася внаслідок того, що метод підтримки гемопоезу СКПК передбачає введення КСФ в день реінфузії лейкоконцентрату, тобто до розвитку лейкопенії. Тривалість тромбоцитопенії IV ступеня в разі підтримки гемопоезу СКПК скорочувалася в середньому на 2 дні. Разом з тим зменшення частоти розвитку геморагічного синдрому та трансфузій тромбоконцентрату свідчить, що при застосуванні вищезгаданого методу тромбоцитопенія була менш глибокою, тобто кількість тромбоцитів у більшості випадків не досягала критичного рівня <10×10/л (див. табл. 3, 4). Слід зазначити, що зменшення кількості трансфузій тромбоконцентрату (процедур, що мають високу собівартість), а також скорочення періоду лейкопенії IV ступеня і, відповідно, строків призначення високовартісних антибіотиків при проведенні ПХТ з підтримкою гемопоезу СКПК, свідчать про економічну доцільність застосування даного методу.
Таблиця 4. Показники перебігу мієлосупресії у дітей із ЗНМТ, що отримували терапію із застосуванням режиму топотекан/циклофосфамід
| Показники перебігу мієлосупресії | Режим ПХТ | |
|---|---|---|
| Topo/HD-Cyclo з редукцією 30% (n=5) | Topo/HD-Cyclo з підтримкою СКПК (n=4) | |
| Середня тривалість лейкопенії IV ступеня (дні) | 9,8 (3–12) | 5,2 (4–7) |
| Середня тривалість тромбоцитопенії IV ступеня (дні) | 7,2 (2–12) | 4,5 (2–6) |
| Кількість трансфузій тромбоконцентрату на 1 курс | 2,4 (12/5) | 0,75 (3/4) |
| Частота виникнення геморагічногосиндрому (на 1 курс ПХТ) | 0,2 (1/5) | – |
| Частота виникнення фебрильної нейтропенії (на 1 курс ПХТ) | 0,40 (2/5) | 0,2 (1/4) |
| Тривалість призначення КСФ в середньому (дні) | 7,8 | 8,7 |
Примітка: n — кількість блоків ПХТ.
На даний час закінчили лікування та знаходяться в ремісії 4 з 14 хворих, що отримували інтенсивну хіміотерапію з підтримкою автологічними СКПК (28,6%), у тому числі 3 дитини з локальними рецидивами ембріональної РМС та 1 хворий з метастатичним рецидивом синовіальної саркоми (рис. 2). Строки спостереження від 23 до 34 місяців.
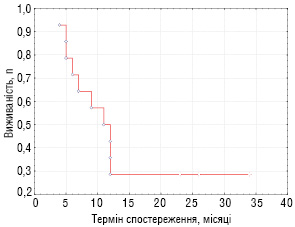
Простежено віддалені результати лікування хворих з прогностично несприятливими ЗНМТ (основна група), які представлено на рис. 3, 4 (виживаність хворих оцінювалося за статистичним методом Каплан — Мейєра).
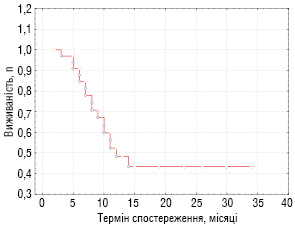
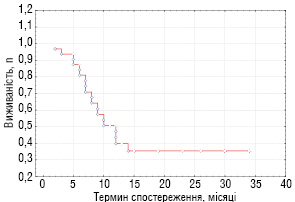
Таким чином, підсумовуючи отримані результати, на даний час закінчили лікування та знаходяться в ремісії 6 з 34 хворих основної групи (17,7%), у тому числі 4 дитини з локальними рецидивами ембріональної РМС та 2 хворих із ЗНМТ «дорослого типу» (синовіальна саркома, злоякісна мезенхімома). Строки спостереження від 23 до 34 міс. Продовжують отримувати лікування без ознак прогресування хвороби 5 хворих. У 3 пацієнтів з раннім рецидивом альвеолярної РМС після проведеного лікування була досягнута тільки стабілізація процесу. На даний час ці діти мають прогресування хвороби і отримують симптоматичне лікування. Даних щодо 2 пацієнтів немає в зв’язку з відмовою батьків від подальшого спостереження. Від прогресування хвороби померли 17 хворих і 1 дитина — від інфекційних ускладнень після проведеної ПХТ. Загальна 3-річна виживаність хворих групи спостереження становить 44,1%, безрецидивна — 34,4%.
У контрольній групі на даний час живі та знаходяться в повній довгостроковій ремісії 4 з 33 хворих (12,2%) зі строками спостереження від 38 до 54 міс.
Висновки
Розроблені схеми хіміотерапії з використанням топотекану у комбінації з карбоплатином або циклофосфамідом у середньовисоких та високих дозах виявили високу ефективність при лікуванні хворих з прогностично несприятливими ЗНМТ. Повна та часткова ремісії зафіксовані у 57,6%. Загальна 3-річна виживаність хворих становить 44,1%, безрецидивна — 34,4%.
Підтримка гемопоезу аутологічними СКПК після проведення високомієлосупресивних режимів інтенсивної ПХТ (топотекан в комбінації з карбоплатином або високодозовим циклофосфамідом) забезпечує значне скорочення періоду лейкопенії IV ступеня, вдвічі зменшує частоту розвитку інфекційних та геморагічних ускладнень. Розроблено показання до застосування методу підтримки гемопоезу СКПК: 1) висока інтенсивність лікувальної програми; 2) тривалі та глибокі лейко- та тромбоцитопенії, інфекційні та геморагічні ускладнення в анамнезі.
Література
1. Koscielniak E., Hrms D., Henze G. et al. (1999) Results of treatment for soft tissue sarcoma in childhood and adolescence: a final report of german Co-operative Soft Tissue sarcoma Study CWS-86. J. Clin. Oncol.,17: 3706−3719.
2. Breneman J.C., Lyden E., Pappo A.S. et al. (2003) Prognostic factors and clinical outcomes in children and adolescence with metastatic rhabdomyosarcoma — a report from the Intergroup Rhabdomyosarcoma Study IV. J. Clin. Oncol., 21 (1): 78−84.
3. Meyer W.H., Spunt S.L. (2004) Soft tissue sarcoma of childhood. Cancer Treat. Rev., 30: 269−280.
4. Paulino A.C. (2004) Treatment options for children with nonrhabdomyosarcoma soft tissue sarcoma. Expert Rev. Anticancer Ther., 4: 247−256.
5. Ferrari A., Casanova M. (2005) Current chemotherapeutic strategies for rhabdomyoarcoma. Expert Rev. Anticancer Ther., 5 (2): 283−294.
6. Ferrari A., Casanova M. (2005) New concepts for the treatment of pediatric nonrhabdomyosarcoma soft tissue sarcomas. Expert Rev. Anticancer Ther., 5 (2): 307−318.
7. Bisongo G., Riccardi R. (2006) Phase II study of a protracted schedule in children with refractory or recurrent soft tissue sarcoma. Expert Rev. Anticancer Ther., 106 (3): 703−707.
8. Bisongo G., Ferrari A. (2005) The IVADo regimen — a pilot study with Ifosfamide, Vincristine, Actinomicin D, and Doxorubicin in children with metastatic soft tissue sarcoma. Expert Rev. Anticancer Ther., 103 (8): 1719−1724.
9. Saylor R.L., Stine K.C., Sallivan J. et al. (2001) Cyclophosphamide plus topotecan in children with recurrent or refractory solid tumors: a pediatric Oncology Group Phase II study. J. Clin. Oncol., 19 (15): 3463−3469.
10. Waterhouse D.O., Lyder E.R., Breitfeld P.P. et al. (2004) Efficacy of topotecan and cyclophosphamide given as a Phase II window in children with newly diagnosed metastatic rhabdomyosarcoma: a report from the Soft Tissue Sarcoma Committee of the Children’s Oncology Group. J. Clin. Oncol., 22 (8): 1−7.
11. Koscielniak E., Beske F., Boos J. et al. (2003) High dose therapy versus oral maintenance: results of CWS 96 study for treatment of patients with metastasized soft tissue sarcoma (STS). Medical and Pediatric Oncology, 41 (4): 85.
12. Афанасьев Б.В., Зубаровская Л.С., Цисская К.О. и др. (1997) Результаты трансплантации гемопоэтических предшественников у детей в России и Белоруссии по данным отчета рабочей группы по трансплантации у детей. Педиатрия; 4: 12−17.
13. Долгополов И.С., Янкелевич Н.Я., Мхеидзе Д.М. и др. (1998) Высокодозная химиотерапия с последующей реинфузией периферических стволовых клеток у детей с солидными опухолями из групп высокого риска. Российский онкологический журнал, 2: 56−59.
14. Tang S., Huang D., Wang J. et al. (2001) Application of autologous peripheral blood stem cell transplantation in children with malignant tumor. Chin. Med., 114(10): 1098−1101.
15. Kushner B.H., Cheung N.K., Kramer K. et al. (2001) Topotecan combined with myeloablative doses of thiotepa and carboplatin for neuroblastoma, brain tumors, and other poor-risk solid tumors in children and young adults. Bone Marrow Transplant., 28 (6): 551–556.
16. Weigel B.J., Bteitfeld P.P., Hawkins D. et al. (2001) Role of high-dose chemotherapy with hematopoietic stem cell rescue in the treatment of metastatic or recurrent rhabdomyosarcoma. J. Pediatr. Hematol. Oncol., 23 (5): 272−276.
Результаты лечения злокачественных новообразований мягких тканей у детей с использованием программ интенсивной полихимиотерапии с поддержкой гемопоэза стволовыми клетками периферической крови
Национальный институт рака, Киев
Резюме. Разработаны схемы полихимиотерапии с использованием топотекана в комбинации с карбоплатином или циклофосфамидом в средневысоких и высоких дозах высокоэффективны при лечении детей с прогностически неблагоприятными злокачественными новообразованиями мягких тканей. Полная и частичная ремиссии были достигнуты у 57,6% больных основной группы исследования, что совпадает с результатами, полученными при лечении данной патологии в ведущих странах мира, и почти вдвое превышает результаты лечения группы контроля (27,3%). Общая 3-летняя выживаемость больных основной группы исследования составила 44,1%, безрецидивная — 34,4%, а в группе контроля соответственно 15,4 и 12,2%. Поддержка гемопоэза аутологичными стволовыми клетками периферической крови после проведения высокомиелосупрессивных режимов разработанной интенсивной химиотерапии (топотекан в комбинации с карбоплатином или высокодозовым циклофосфамидом) вдвое сокращает продолжительность лейкопении и тромбоцитопении IV степени, уменьшает частоту осложнений, связанных с миелосупрессией.
солидные новообразования у детей, интенсивная химиотерапия, стволовые клетки периферической крови.














Leave a comment