Рак шлунка з високим ризиком інтраперитонеального прогресування: фактори ризику та результати хірургічного лікування
Резюме. Проаналізовано віддалені результати хірургічного лікування 57 хворих на рак шлунка з інвазією серозної оболонки. Встановлено несприятливий прогноз для пацієнтів даної категорії — медіана загальної та безрецидивної тривалості життя становлять 19 та 15 міс відповідно. Встановлено, що найчастішим шляхом метахронного метастазування «серозоінвазивного» раку шлунка є імплантаційна дисемінація, котру діагностовано у 47,4% хворих та у 81,8% хворих з прогресуванням захворювання. Локалізація пухлини, тип росту пухлини за Borrmann, гістологічна форма пухлини та площа ураження серозної оболонки шлунка пухлиною визначені як достовірні предиктивні фактори метахронного карциноматозу очеревини у хворих на «серозоінвазивний» рак шлунка.
…через два месяца у больной обнаружено сплошное просовидное обсеменение всей париетальной
брюшины и брыжеек, чего ни малейших следов я не видел при первой операции.
С.С. Юдин (1952)

ВСТУП
Місцево-поширений рак шлунка (РШ) характеризується несприятливим прогнозом, отже, навіть після радикальних хірургічних втручань більшість хворих гинуть внаслідок прогресування захворювання протягом перших двох років [1]. Превалюючим типом прогресування РШ є імплантаційне метастазування з розвитком карциноматозу очеревини (КО) [2], що ймовірно відбувається через наявність мікроскопічного пулу злоякісних клітин по очеревині на момент хірургічного втручання [3] чи перитонеальної дисемінації процесу інтраопераційно [4].
Згідно з сучасними літературними даними КО розвивається у 38–60% хворих після радикального хірургічного лікування РШ [5, 6]. Визначальними факторами ризику розвитку КО у таких хворих є: інвазія серозної оболонки шлунка пухлиною [7], наявність пухлинних клітин у змивах з очеревини [8], великий розмір пухлини з широким ураженням серозної оболонки [9], інфільтративний тип росту пухлини [10], гістологічні варіанти РШ, схильні до імплантаційного метастазування [11], а також метастатичне ураження регіонарних лімфатичних вузлів [12].
Інвазія серозної оболонки шлунка, без сумніву, є визначальним фактором метахронного імплантаційного метастазування, що визначає можливість дисемінації пухлинних клітин по черевній порожнині та швидкий фатальний прогноз. Так, метахронний КО розвивається після радикальної операції у 50% пацієнтів з пухлинною інвазією серозної оболонки шлунка [13]. Ризик інтраперитонеального рецидиву зростає зі збільшенням площі ураження «серози» шлунка — при тотальному циркулярному ураженні шлунка КО розвивається у 64,9% хворих [14].
Медіана виживаності хворих на РШ з позитивними змивами з очеревини становить 19 міс, тоді як у хворих з негативними змивами — 38 міс [15]. В редакції 7 перегляду TNM-класифікації (UICC) 2009 року, в рубрику РШ вперше за багато років введено категорію перитонеальних змивів, позитивний характер котрих відтепер розцінюють як ознаку віддаленого метастазування [16].
Інтраперитонеальний рецидив найчастіше розвивається при перснеподібноклітинному (65%), недиференційованому та низькодиференційованому (52–54%) раках, тоді як високо- та помірнодиференційована аденокарцинома рідко передує КО (17,3–27%) [17].
Враховуючи появу нових активних способів локорегіонарної внутрішньочеревної ад’ювантної хіміотерапії хворих на місцево-поширений РШ [18], проблема вивчення факторів ризику інтраперитонеального прогресування РШ набуває сьогодні нових аспектів актуальності.
Метою нашого дослідження було вивчення віддалених результатів хірургічного лікування хворих на РШ з високим ризиком інтраперитонеального прогресування, тобто, факторів ризику розвитку метахронного КО.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз результатів хірургічного лікування 57 хворих на РШ з пухлинною інвазією серозної оболонки шлунка та відповідно високим ризиком інтраперитонеального прогресування після радикальних хірургічних втручань, що знаходилися на стаціонарному лікуванні у Львівському державному онкологічному регіональному лікувально-діагностичному центрі у 2007–2010 рр. (проспективнй аналіз). Чоловіки становили 61,4% (35 хворих), жінки — 38,6% (22 хворі). Вік хворих становив від 26 до 79 років, середній вік — 61,1 ± 9,5 року. У всіх хворих під час гістологічного дослідження макропрепарату після хірургічного втручання виявлено інвазію серозної оболонки шлунка («серозоінвазивні» пухлини шлунка — Т4а, Т4b). Хворі з позитивними змивами з очеревини чи маніфестованим на момент втручання КО в дослідження не включалися.
У хворих переважали низько- та недиференційовані аденокарциноми, які в сумі становили 57,9% випадків, помірнодиференційована аденокарцинома зустрічалася у 19,3%, високодиференційована — у 8,8%, перснеподібноклітинна — у 12,3% та муцинозна — у 1,7% хворих.
Характеристика хворих в залежності від локалізації первинної пухлини шлунка відображена у табл. 1.
Таблиця 1. Розподіл хворих в залежності від локалізації первинної пухлини
| Локалізація первинної пухлини | Кількість хворих абс. (відн. %) |
|---|---|
| Проксимальний відділ (у тому числі з інвазією стравоходу) | 3 (5,3%) |
| Карцинома кукси шлунка з поширенням на нижню третину стравоходу | 1 (1,7%) |
| Тіло | 12 (21,1%) |
| Тіло + антральний відділ | 5 (8,8%) |
| Антральний відділ | 27 (47,4%) |
| Субтотальне та тотальне ураження | 9 (15,7%) |
| Всього | 57 |
Характеристика 57 хворих на «серозоінвазивний» РШ в залежності від макроскопового типу росту пухлини шлунка за класифікацією Borrmann відображена у табл. 2, у хворих переважали ІІІ та ІV тип за Borrmann.
Таблиця 2. Розподіл хворих відповідно до типу росту первинної пухлини за Borrmann
| Тип росту пухлини шлунка | Кількість хворих, абс. (відн. %) |
|---|---|
| І тип | 2 (3,5%) |
| ІІ тип | 14 (24,6%) |
| ІІІ тип | 27 (47,3%) |
| ІV тип | 14 (24,6%) |
| Всього | 57 |
Первинна пухлина шлунка у 53 (93%) пацієнтів була з інфільтрацією серозної оболонки (Т4а), та у 4 (7%) — з інвазією у сусідні органи (Т4b).
Розподіл 57 хворих на «серозоінвазивний» РШ залежно від площі пухлинної інфільтрації серозної оболонки шлунка був наступним: у 31 (54,4%) хворого площа ураження серозної оболонки була меншою 20 см2, у 17 (29,8%) — більшою 20 см2 та у 9 (15,8%) спостерігали субтотальне та тотальне ураження серозної оболонки шлунка.
Структура обсягу хірургічних втручань у 57 хворих була наступною: 22 (38,6%) хворим виконано гастректомію, 31 (54,4%) — дистальну субтотальну резекцію шлунка, та 4 (7%) — гастректомію з резекцією нижньої третини стравоходу. Комбінований обсяг операцій виконано у 10 (17,5%) пацієнтів. D1 лімфаденектомію виконано 33 (58%) хворим на «серозоінвазивний» РШ та D2 — 24 (42%) пацієнтам.
Постадійний розподіл 57 хворих на РШ з інвазією «серози» згідно з TNM-класифікацією (2009) представлено у табл. 3.
Системна ад’ювантна хіміотерапія у досліджуваних хворих не застосовувалася.
Таблиця 3. Розподіл хворих згідно зі стадіями TNM (UICC, 2009)
| Стадія | Кількість хворих абс. (відн. %) | |
|---|---|---|
| IIB | T4aN0M0 | 28 (49,1%) |
| IIIA | T4aN1M0 | 11 (19,3%) |
| IIIB | T4aN2M0 | 14 (24,6%) |
| T4bN0–1M0 | ||
| IIIC | T4aN3M0 | 4 (7%) |
| T4bN2–3M0 | ||
| Всього | 57 | |
Статистичну обробку первинних даних проводили з використанням програми Statistica. Таблиці частот та зв’язків аналізували за допомогою точного критерію Фішера, критерію χ2 та λ-критерію Вілкоксона. Для дослідження кумулятивної виживаності хворих використовували цензурований метод Каплана—Мейера. Визначення вірогідності у різниці рівнів виживаності в окремих групах здійснено за допомогою логарифмічного рангового коефіцієнта.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
Середній час перебування 57 хворих на «серозоінвазивний» РШ у стаціонарі становив 24,9 ± 9,5 доби (від 16 до 79 діб) та залежав від характеру хірургічного лікування, наявності ускладнень.
Після проведення радикальних хірургічних втручань рівень післяопераційних ускладнень у досліджуваних хворих становив 5 (8,8%) випадків, серед яких зафіксовано неспроможність швів кукси дванадцятипалої кишки, неспроможність швів езофагоєюноанастомозу, післяопераційний панкреатит, міжпетлевий абсцес та госпітальну пневмонію у кожного окремого хворого відповідно. Випадків післяопераційної летальності не зафіксовано.
Після проведеного хірургічного лікування усі хворі знаходилися на диспансерному спостереженні, що передбачало проведення клініко-інструментальних обстежень під час диспансерних візитів кожні 3–4 міс. За період спостереження з 2007 по 2011 роки прогресування пухлинного процесу після проведеного хірургічного лікування стало причиною смерті 33 (57,9%) із 57 хворих. 1-, 2- та 3-річна виживаність хворих становила 71,9; 47,4 та 43,9% відповідно. Медіана загальної тривалості життя (МеЗТЖ) та медіана безрецидивної тривалості життя (МеБТЖ) хворих становила 19 та 15 міс відповідно (рис. 1).
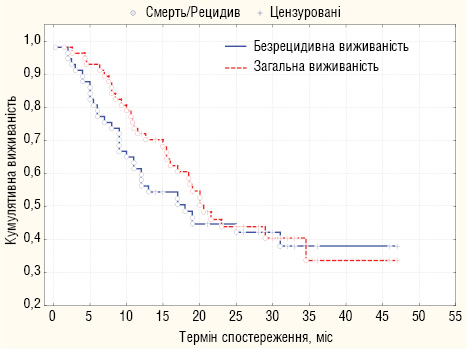
Найчастішим шляхом метастазування при прогресуванні «серозоінвазивного» РШ була дисемінація по очеревині в самостійному вигляді чи в комбінації з метастазами іншого характеру. Характеристика досліджуваних хворих залежно від шляхів прогресування РШ відображена у табл. 4.
Таблиця 4. Структура випадків прогресування «серозоінвазивного» РШ після хірургічного лікування
| Локалізація метастазів | Кількість хворих абс. (відн. %) |
|---|---|
| Очеревина | 13 (39,4%) |
| Очеревина + віддалені лімфатичні вузли | 6 (18,2%) |
| Печінка + віддалені лімфатичні вузли | 3 (9%) |
| Очеревина + печінка | 2 (6,1%) |
| Очеревина + плевра | 2 (6,1%) |
| Очеревина + рецидив в анастомозі | 2 (6,1%) |
| Віддалені лімфатичні вузли | 2 (6,1%) |
| Печінка | 1 (3%) |
| Очеревина + віддалені лімфатичні вузли + печінка | 1 (3%) |
| Очеревина + віддалені лімфатичні вузли + плевра | 1 (3%) |
| Всього | 33 |
Інтраперитонеальний рецидив (метахронний КО) після хірургічного лікування діагностовано у 27 (47,4%) хворих, що становить 81,8% серед 33 хворих з прогресуванням «серозоінвазивного» РШ. МеЗТЖ та МеБТЖ після хірургічного лікування у 27 хворих з інтраперитонеальним рецидивом становила 12,6 та 9 міс відповідно.
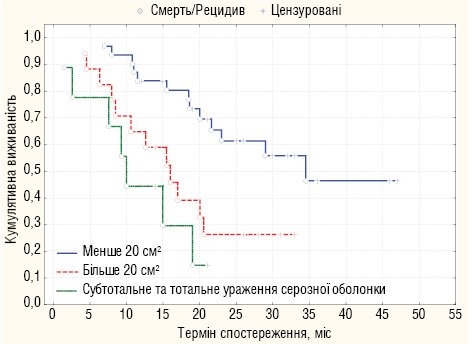
У результаті монофакторного аналізу встановлено чинники, що вірогідно корелюють з виживаністю хворих на РШ з інвазією серозної оболонки: тип росту пухлини за Borrmann, площа пухлинної інфільтрації серозної оболонки шлунка (рис. 2), інвазія пухлини в сусідні органи (Т4b), комбінований обсяг хірургічного втручання, статус регіонарних лімфатичних вузлів та стадія процесу.
Шляхом дискримінантного аналізу встановлено, що достовірний вплив на розвиток метахронного КО у хворих на «серозоінвазивний» РШ мають наступні предиктивні фактори: локалізація пухлини, тип росту пухлини за Borrmann, гістологічна форма пухлини та площа ураження серозної оболонки шлунка пухлиною (табл. 5).
Таблиця 5. Прогностичні фактори інтраперитонеального рецидиву у хворих на «серозоінвазивний» РШ після хірургічного лікування
| Фактор прогнозу | Лямбда Вілкоксона, λ | р |
|---|---|---|
| Вік | 0,907 | 0,061 |
| Стать | 0,999 | 0,822 |
| Локалізація пухлини | 0,832 | 0,002 |
| Тип росту пухлини за Borrmann | 0,807 | 0,001 |
| Гістологічна форма пухлини | 0,837 | 0,002 |
| Площа ураження серозної оболонки шлунка | 0,757 | 0 |
| Комбінована операція | 0,986 | 0,387 |
| Лімфодисекція (D1/D2) | 0,991 | 0,471 |
| Кількість видалених регіонарних лімфатичних вузлів | 0,987 | 0,4 |
| Кількість метастатично уражених регіонарних лімфатичних вузлів | 0,983 | 0,337 |
Інтраперитонеальний рецидив після хірургічного лікування хворих на РШ з інвазією серозної оболонки найчастіше розвивався при локалізації пухлини в тілі шлунка та тотальному ураженні шлунка — у 50 та 88,9% випадків відповідно, тоді як при локалізації пухлини в антральному відділі — у 29,6% хворих.
Високим ризиком інтраперитонеального прогресування характеризувалися хворі з пухлинами ІІІ та ІV типу за Borrmann, тоді як при І и ІІ типі такий ризик був мінімальним.
При низькодиференційованій, недиференційованій та перснеподібноклітинній карциномі метахронний КО розвивався у 58,3; 66,7 та 71,4% хворих, при диференційованих пухлинах — у поодиноких хворих.
Площа інфільтрації пухлиною серозної оболонки шлунка прямо пропорційно корелювала з інтраперитонеальним рецидивом, рівень котрого зростав з 25,8% при площі ураження меншій 20 см2 до 88,9% при субтотальному та тотальному ураженні серозної оболонки.
Отже, високим ризиком інтраперитонеального прогресування характеризувалися інфільтративного типу росту малодиференційовані та перснеподібноклітинні карциноми з локалізацією в тілі шлунка чи субтотальним ураженням серозної оболонки шлунка — метахронний КО розвивався у 88,9% таких хворих.
Таким чином, «серозоінвазивний» РШ у значної кількості хворих на момент діагностики супроводжується субклінічною перитонеальною дисемінацією, про що свідчить маніфестація КО вже протягом перших місяців чи років після лікування. Очевидно, що такі хворі потребують комбінованих методів лікування. Два метааналізи рандомізованих досліджень попередніх років не продемонстрували зростання виживаності при застосуванні системної ад’ювантної хіміотерапії у хворих на резектабельний РШ [19, 20].
У 2004 р. Кохрейнівським співтовариством проведено метааналіз рандомізованих досліджень ефективності застосування ад’ювантної внутрішньочеревної хіміотерапії у радикально оперованих хворих на місцево-поширений РШ, котрий засвідчив статистично вірогідну перевагу комбінованого лікування порівняно із групою хірургічного контролю. Найвищі результати загальної та безрецидивної виживаності отримано при проведенні внутрішньочеревної хіміотерапії в гіпертермічному режимі [21]. Отже, актуальність проблеми стратифікації групи хворих на РШ з високим ризиком інтраперитонеального прогресування сьогодні не викликає сумніву.
Отримані нами результати щодо таких достовірних факторів погнозу метахронного КО, як тип росту пухлини за Borrmann, гістологічна форма та локалізація пухлини є співзвучними з опублікованими результатами деяких інших авторів [22]. За результатами даного дослідження, до предиктивних факторів інтраперитонеального прогресування РШ можна віднести також такий об’єктивний та зручний для використання критерій як площа інфільтрації пухлиною серозної оболонки шлунка.
ВИСНОВКИ
РШ з інвазією серозної оболонки характеризується несприятливим прогнозом: МеЗТЖ таких хворих становить 19 міс, МеБТЖ — 15 міс.
Найчастішим шляхом метахронного метастазування «серозоінвазивного» РШ є перитонеальна дисемінація, котру діагностовано у 47,4% хворих та у 81,8% хворих з прогресуванням захворювання.
Достовірним впливом на розвиток метахронного КО у хворих на «серозоінвазивний» РШ характеризуються наступні предиктивні фактори: локалізація пухлини, тип росту пухлини за Borrmann, гістологічна форма пухлини та площа ураження серозної оболонки шлунка пухлиною.
Малодиференційовані та перснеподібноклітинні аденокарциноми інфільтративного типу росту з субтотальним характером інфільтрації серозної оболонки шлунка у 88,9% випадків супроводжуються метахронним КО, тому характеризуються субклінічною перитонеальною дисемінацією на момент хірургічного втручання та очевидно потребують комбінованих підходів до лікування.
ЛІТЕРАТУРА
1. Lim L., Michael M., Mann G.B. et al. (2005) Adjuvant therapy in gastric cancer. J. Clin. Oncol., 23: 6220–6232.
2. Yoo C.H., Noh S.H., Shin D.W. et al. (2000) Recurrence following curative resection for gastric carcinoma. Br. J. Surg., 87: 236–242.
3. Koga S., Kaibara N., Itsuka Y. et al. (1984) Prognostic significance of intraperitoneal free cancer cells in gastric cancer patients. J. Cancer Res. Clin. Oncol., 108: 236–238.
4. Zoetmulder F. Cancer cell seeding during abdominal surgery: experimental studies. In: Sugarbaker P.H.: Peritoneal carcinomatosis: principles of management. Boston, USA. Kluwer Academic publishers, 155–161.
5. Garofalo A., Ferramondo F. (2009) Radical resection and intraoperative hyperthermic chemoperfusion in gastric carcinoma patients at high risk of peritoneal recurrence. Randomized multicentric phase III study. The 8th international gastric cancer congress (IGCC): abstract book. — Krakow, Poland: 98–99.
6. Cunningam D., Allum W.H., Stenning S.P. et al. (2006) Perioperative chemotherapy versus surgery alone for resectable gastro-esophageal cancer. N. Engl. J. Med., 355: 11–20.
7. Wu C.W., Lo Wu S.S., Shen K.H. et al. (2003) Incidence and factors associated with recurrence patterns after intended curative surgery for gastric cancer. World J. Surg., 27: 153–158.
8. Bentrem D., Wilton A., Mazumdar M. et al. (2005) The value of peritoneal cytology as a preoperative predictor in patients with gastric carcinoma undergoing a curative resection. Ann. Surg. Oncol., 12: 347–353.
9. Неред С.Н., Клименков А.А. (2005) Хирургическое лечение рака желудка с высоким риском имплантационного метастазирования. Вопр. Онкол., 51 (1): 75–80.
10. Maehara Y., Hasuda S., Koga T. et al. (2000) Postoperative outcome and sites of recurrence in patients following curative resection of gastric cancer. Br. J. Surg., 87: 353–357.
11. Marrelli D., Roviello F., de Manzoni G. et al. (2002) Different patterns of recurrence in gastric cancer depending on Lauren’s histological type: longitudinal study. World J. Surg., 26: 1160–1165.
12. Roviello F., Marrelli D., de Manzoni G. et al. (2003) Prospective study of peritoneal recurrence after curative surgery for gastric cancer. Br. J. Surg., 90: 1113–1119.
13. Moriguchi S., Maehara Y., Korenaga D. et al. (1992) Risk factors which predict pattern of recurrence after curative surgery for patients with advanced gastric cancer. Surg. Oncol., 1: 341–346.
14. Неред С.Н. (2004) Хирургическое и комбинированное лечение рака желудка с высоким риском имплантационного метастазирования и рака резецированного желудка: автореф. дис. … доктора мед. наук: Москва. 21 с.
15. La Torre M., Ferri M., Giovagnoli M.R. et al. (2010) Peritoneal wash cytology in gastric carcinoma. Prognostic significance and therapeutic consequences. Eur. J. Surg. Oncol., 36: 982–986.
16. TNM: Классификация злокачественных опухолей (2011) Собина Л.Х. и др. (ред.); пер. с англ. и научн. ред. А.И. Щеголев, Е.А. Дубова, К.А. Павлов. — М.: Логосфера, 304 с. — Перевод изд. TNM Classification of Malignant Tumors, 7th ed. — ISBN 978-5-98657-025-9.
17. Скоропад В.Ю., Бердов Б.А. (2008) Закономерности развития рецидивов и метастазов у больных местнораспространенным раком желудка. ХII Российский онкологический конгресс: материалы конгресса, Москва: 94–96.
18. Yonemura Y., de Aretxabala X., Fujimura T. et al. (2001) Intraoperative chemohyperthermic peritoneal perfusion as an adjuvant to gastric cancer: final results of a randomized controlled study. Hepatogastroenterology, 48: 1776–1782.
19. Hermans J., Bonenkamp J.J., Boon M.C. et al. (1993) Adjuvant therapy after curative resection for gastric cancer: meta-analysis of randomized trials. J. Clin. Oncol., 11: 1441–1447.
20. Janunger K.G., Hafstrom L., Glimelius B. et al. (2002) Chemotherapy in gastric cancer: a review and updated meta-analysis. Eur. J. Surg., 168: 597–608.
21. Xu D.Z., Zhan Y.Q., Sun X.W. et al. (2004) Meta-analysis of intraperitoneal chemotherapy for gastric cancer. World J. Gastroenterol., 10: 2727–2730.
22. Скоропад В.Ю., Бердов Б.А. (2009) Влияние морфологического строения рака желудка на закономерности развития рецидивов и метастазов. Вопр. Онкол., 55(1): 60–65.
Рак желудка с высоким риском интраперитонеального прогрессирования: факторы риска и результаты хирургического лечения
Львовский национальный медицинский университет им. Данила Галицкого, Львов
Резюме. Проанализированы отдаленные результаты хирургического лечения 57 больных раком желудка с инфильтрацией серозной оболочки. Установлен неблагоприятный прогноз для пациентов даной категории — медиана общей и безрецидивной выживаемости составили 19 и 15 мес соответственно. Установлено, что наиболее частым путем метахронного метастазирования «серозоинвазивного» рака желудка была имплантационная диссеминация, которую диагностировано у 47,4% больных и у 81,8% больных с прогрессированием заболевания. Локализация опухоли, тип роста опухоли по Borrmann, гистологическая форма опухоли и площадь поражения серозной оболочки желудка опухолевым процессом определены как достоверные предиктивные факторы метахронного карциноматоза брюшины у больных с «серозоинвазивным» раком желудка.
Ключевые слова: рак желудка, инвазия серозной оболочки, метахронный карциноматоз брюшины, факторы риска.














Leave a comment