Сучасний підхід до хірургічного лікування гепатоцелюлярної карциноми з пухлинною інвазією воротної вени
Котенко О.Г., Гриненко А.В., Попов А.О., Коршак А.А., Гусев А.В., Федоров Д.А., Григорян М.С.
Резюме. Мета дослідження — покращання результатів лікування хворих гепатоцелюлярною карциномою з пухлинною інвазією воротної вени. У дослідження включені у складі основної групи — 21 хворий з гепатоцелюлярною карциномою з пухлинною інвазією воротної вени ІІ–ІІІ типу за Shu (2007), якому виконана резекція печінки з резекцією воротної вени і портопластика, в контрольній групі — 61 хворий з пухлинною інвазією воротної вени І типу за Shu, якому виконана лише резекція печінки. Смертність становила 9,5% в основній групі і 25,3% — у контрольній. Агресивна хірургічна тактика при гепатоцелюлярній карциномі з інвазією воротної вени дозволяє підвищити віддалену виживаність хворих.
Резюме. Цель исследования — улучшение результатов лечения больных гепатоцеллюлярной карциномой с опухолевой инвазией воротной вены. В исследование включены в составе основной группы — 21 больной с гепатоцеллюлярной карциномой с опухолевой инвазией воротной вены II–III типа по Shu (2007), которому выполены резекции печени с резекцией воротной вены и портопластика, в контрольной группе — 61 больной с опухолевой инвазией воротной вены I типа по Shu, которому выполены только резекции печени. Смертность составила 9,5% в основной и 8,1% — в контрольной группе. Отдаленная 5-летняя выживаемость составила 11,5% в основной и 25,3% — в контрольной группе. Агрессивная хирургическая тактика при гепатоцеллюлярной карциноме с инвазией воротной вены позволяет повысить отдаленную выживаемость больных.

Гепатоцеллюлярная карцинома (ГЦК) — самая распостраненная первичная злокачественная опухоль печени и один из наиболее частых и наиболее агрессивных видов рака [5]. По распространенности ГЦК занимает 5-е место у мужчин и 8-е — у женщин среди всех раковых опухолей [6]. Заболеваемость ГЦК широко варьирует в различных регионах земного шара. Так, в США и странах Западной Европы она составляет 2–7 случаев на 100 тыс. населения, а в странах Африки, Японии, Китае — в несколько раз больше — 23–40 случаев на 100 тыс. населения [4, 22]. В странах Восточной Европы заболеваемость ГЦК составляет 4,9 у мужчин и 2,2 — у женщин на 100 тыс. населения. Пятилетняя выживаемость при ГЦК составляет лишь 5%, ежегодно более 1 млн людей умирают вследствие этого вида рака [2].
В большинстве случаев ГЦК возникает на фоне различных диффузных заболеваний печени, как правило, в их конечной стадии. Гепатиты В и С являются основными причинами развития цирроза печени и как следствие — основными этиологическими факторами ГЦК [5, 21, 18]. Возбудитель гепатита В является ДНК-вирусом, внедряющим свои гены в ДНК гепатоцита, нарушая таким образом стабильность генетического аппарата клетки. В случае нарушения ДНК антионкогенов, к примеру р53, клетка становится способной к неконтролируемому размножению [11]. Вирус гепатита С — РНК-содержащий, поэтому он не способен напрямую изменять геном клетки хозяина. Однако в конечной стадии заболевания, при формировании цирроза печени, на гепатоциты воздействует ряд неблагоприятных факторов, которые могут способствовать их малигнизации [21]. При циррозе печени возникает резкий дефицит клеточной массы гепатоцитов, вследствие чего организм вырабатывает большое количество различных пролиферативных стимулов, способствующих развитию дисплазии и метаплазии. Находящиеся в условиях хронического воспалительного процесса, ишемии, дефицита питательных веществ гепатоциты накапливают различные мутации в своем геноме, которые рано или поздно затрагивают гены, отвечающие за стабильность генетического аппарата. В условиях цирроза печени гепатоциты находятся в регенеративных псевдодольках, окруженных соединительно-тканными фиброзными септами [8]. Они нарушают нормальную микроциркуляцию крови вокруг гепатоцитов и таким образом мешают доступу элементов иммунной системы, осуществляющих патрулирование и клиринг малигнизированных клеток [8]. Так на фоне цирроза печени, особенно протекающего с активной воспалительной реакцией, создаются необходимые условия для потери стабильности генома гепатоцитов и их малигнизации. Помимо вирусных гепатитов В и С, другие причины, приводящие к развитию цирроза печени, такие как алкоголь, гемохроматоз, недостаточность α1-антитрипсина, способствуют появлению ГЦК.
Различают три основных макроскопических типа ГЦК — узловой, массивный и диффузный [8]. Узловой тип, в свою очередь, подразделяется на три подтипа — простой узловой, узловой с внеузловым ростом и сливной мультиузловой. Также выделяют редкие гистологические варианты ГЦК — ГЦК с выраженной лимфоцитарной инфильтрацией, фиброламеллярную ГЦК, саркоматозную ГЦК и скиррозную ГЦК [8]. По степени дифференцирования опухолевых клеток различают высоко-, умеренно-, низко- и недифференцированную ГЦК [8]. Выделение различных типов роста опухоли и степеней дифференцирования важно с точки зрения определения прогноза заболевания и тактики лечения.
Гепатоцеллюлярная карцинома — опухоль, для которой характерно агрессивное биологическое поведение с ранним гематогенным метастазированием [12, 19]. Как правило, вновь возникшие ГЦК высокодифференцированы, имеют медленный темп роста и не формируют капсулу [8]. Однако вследствие быстрой пролиферации клеток на фоне их сниженной способности к репарации ДНК, они быстро накапливают мутации в различных генах, отвечающих за стабильность генома, и становятся низкодифференцированными. Такие опухолевые клетки приобретают черты эмбрионального поведения, становятся способными к миграции и инвазии в другие ткани, то есть к метастазированию [6]. Этот процесс происходит очень быстро и как результат даже вокруг маленькой ГЦК можно выявить метастатические саттелиты [6, 12]. Растущая опухоль продуцирует различные ангиогенные стимулы, к примеру сосудистый фактор роста (VGF), благодаря чему получает необходимую ей васкуляризацию [5]. Приток крови к ГЦК происходит из бассейна печеночной артерии, а отток, как правило, в систему воротной вены (ВВ) [1, 9, 23]. Печеночные вены могут являться путями оттока крови при начальных стадиях роста ГЦК, когда она не формирует капсулу [8]. С потерей опухолью дифференцирования и формированием капсулы тонкостенные ветви печеночных вен разрушаются и отток крови от опухоли переключается в ветви ВВ, которые находятся в плотных соединительно-тканных глиссоновых листках. Эта особенность микроархитектоники печени объясняет частое формирование опухолевого тромбоза ВВ и преимущественное распространение метастазов ГЦК через систему ВВ. Таким образом, именно печень становится основной мишенью для метастазов ГЦК. Кроме девиации внутрипеченочной гемодинамики, метастазированию ГЦК в другие участки печени способствует наличие в ткани печени необходимого для хоуминга опухолевых клеток микроокружения. Косвенно это подтверждает тот факт, что после пересадки печени по поводу ГЦК, именно трансплантат становится основным местом рецидива опухоли. Внепеченочные метастазы появляются на относительно поздних стадиях заболевания. Как правило, основными местами их локализации являются легкие (47,6%), надпочечники (8,3%), кости (5,6%), желудочно-кишечный тракт (4,7%), желчный пузырь (3,5%) и поджелудочная железа (3,0%) [8]. Несмотря на позднее появление внепеченочных метастазов, опухолевые микросаттелиты в 36% случаев циркулируют в периферической крови и костном мозгу. Лимфогенное метастазирование в целом не характерно для ГЦК, отмечается у 1,7% оперируемых больных, и как правило, свидетельствует о плохом прогнозе заболевания [19]. Наиболее часто поражаются лимфоузлы области ворот печени и гепатодуоденальной связки, перипанкреатические и периаортальные лимфоузлы [19].
На сегодняшний день предложено несколько различных методов лечения ГЦК. Золотым стандартом являются радикальные резекционные вмешательства [5, 16, 17, 20]. Учитывая влияние печеночной гемодинамики на распространение метастазов ГЦК, сформулировано понятие хирургического края после резекции печени, доказано, что его необходимая ширина составляет 1–2 см [9]. В то же время в связи с преимущественно дистальным распространением метастазов по отношению к портальному кровотоку, показано, что анатомические резекции печени предпочтительнее атипичных [9]. В современных хирургических центрах, занимающихся печеночной хирургией, смертность после стандартных резекций печени по поводу ГЦК не превышает 10%, а отдаленная 5-летняя выживаемость больных достигает 40–50% [11, 15, 16]. Однако вследствие значительной распространенности опухолевого процесса, наличия отдаленных метастазов и опухолевой инвазии магистральных сосудов брюшной полости, резекции печени выполнимы только у 30% больных [11, 15].
Опухолевая инвазия воротной вены является типичным осложнением ГЦК и отмечается в двух формах — в виде опухолевого тромбоза и прямого прорастания опухолью стенки сосуда. Опухолевый тромбоз ВВ является специфической особенностью ГЦК, которая не характерна для других типов как первичных, так и метастатических опухолей печени [14, 22]. По различным данным, он отмечается в 34–40% случаев. Преимущественное распространение опухолевых тромбов по портальной системе объясняется особенностями печеночной гемодинамики [14]. Растущая опухоль рано нарушает отток крови по перитуморозным ветвям печеночных вен, вследствие чего возникает реверс кровотока в ВВ [12]. Распространяющийся с ретроградным током крови опухолевый тромб может достигать ветвей ВВ первого порядка, ее конфлюенса и ствола (рис. 1). Нарушение притока крови по ВВ вследствие тромбоза приводит к резкой редукции печеночного кровотока, уменьшению поступления к печени гепатотрофических факторов и как результат — к нарастанию печеночной недостаточности, развитию синдрома портальной гипертензии, формированию и разрыву варикозно-расширенных вен пищевода с последующим их разрывом и кровотечением [23]. Даже при относительно небольшой ГЦК, опухолевый тромбоз ВВ может иметь распространенный характер [12].
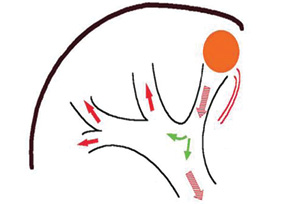
Если опухоль локализована в участках печени, прилежащих к конфлюенсу ВВ, к примеру в хвостатой доле, то возможна прямая инвазия ГЦК в вену. Прямая инвазия опухоли отмечается значительно реже, чем опухолевый тромбоз. Опухоль в таких случаях может быть как гигантской, распластывающей на себе конфлюенс и ствол ВВ, так и небольших размеров. В случае полной облитерации просвета ВВ также возможно развитие синдрома портальной гипертензии и вследствие этого — прогрессирующей атрофии печени. Любая форма опухолевого поражения ВВ при ГЦК по материалам большинства современных руководств и публикаций является противопоказанием к радикальному хирургическому лечению [3, 14, 22]. Более того, долгое время этим больным могли предложить только симптоматическую терапию, поскольку такие паллиативные методы лечения ГЦК, как химиоэмболизация печеночной артерии, микроволновая термоабляция, инъекции этанола в опухоль противопоказаны у данной категории больных [14, 22]. Трансплантацию печени при ГЦК с опухолевым поражением ВВ хотя и можно выполнить технически, биологически она не оправдана из-за быстрого рецидива опухоли в трансплантате на фоне иммуносупрессии [22]. Таким образом, вследствие ограниченности лечебных мероприятий при ГЦК с тромбозом или инвазией ВВ прогноз заболевания является крайне неблагоприятным. Если тромб распространяется на ветви ВВ первого порядка конфлюенс или ствол, то прогноз заболевания является крайне неблагоприятным с медианой выживаемости больных 2,7 мес, в то время как при ГЦК без тромбоза ВВ — 24,4 мес [13, 22].
Таким образом, возрастающая заболеваемость на ГЦК, преимущественно молодой и трудоспособный возраст больных, частая опухолевая инвазия ВВ и вследствие этого высокая частота неоперабельных случаев, очевидная неэффективность консервативных методов лечения и крайне плохой прогноз заболевания обусловливают высокую актуальность проблемы и диктуют необходимость проведения дальнейших исследований в данной области. Цель проведенного исследования — улучшение результатов хирургического лечения больных ГЦК с опухолевой инвазией ВВ путем разработки и внедрения новых способов резекции и пластики ВВ.
объект и методы исследования
В исследование включены 82 больных, которым в период с января 2003 г. по март 2010 г. выполнены радикальные резекции печени (R0) по поводу ГЦК. У всех пациентов имела место опухолевая инвазия ВВ или ее ветвей. Для оценки распространенности опухолевой инвазии ВВ нами использована классификация Shi (2007) (табл. 1) [7]. Пациенты с опухолевой инвазией ВВ II и III типа по Shi (n=21) составили основную группу. У 15 больных имел место опухолевый тромбоз ВВ, у 6 — прямая инвазия ГЦК в ВВ. Учитывая, что макроскопическое поражение ветвей ВВ при ГЦК является отдельным прогностическим фактором отдаленной выживаемости после резекции печени, для корректной оценки результатов лечения в основной группе, контрольную группу составил 61 больной с опухолевой инвазией ветвей ВВ I типа по Shi. Обе группы были сопоставимы по возрасту и полу.
тромбоза ВВ при ГЦК по Shi (2007)
| Тип поражения ВВ |
Распространенность опухолевого тромбоза ВВ |
|---|---|
| I0 | Опухолевый тромбоз ветвей ВВ, выявляемый при гистологическом исследовании |
| I | Опухолевый тромбоз сегментарных и выше ветвей ВВ |
| II | Опухолевый тромбоз долевых ветвей ВВ |
| III | Опухолевый тромбоз ствола ВВ |
| IV | Опухолевый тромбоз ствола ВВ с распространением в верхнюю брыжеечную вену |
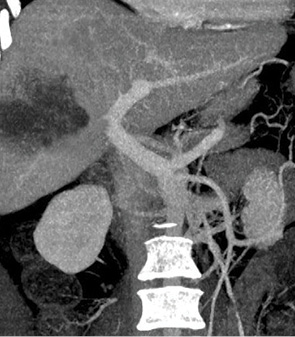
Помимо общеклинических лабораторных и инструментальных исследований, всем больным были выполнены: спиральная компьютерная томография брюшной полости и грудной клетки с волюметрией резецируемой и остающейся частей печени (рис. 2), исследование маркеров вирусного гепатита В и С, допплерография сосудов печени, тест клиренса индоциангрина, уровень α-фетопротеина. Общая характеристика больных в обеих группах приведена в табл. 2. ГЦК выявлена на фоне цирроза печени в 14 случаях контрольной и в 9 — основной группы. Средний диаметр опухоли в основной группе статистически значимо превышал диаметр в контрольной группе (9,2 и 5,7 см соответственно), что свидетельствует о более запущенном опухолевом процессе в основной группе. Наличие большей опухолевой массы у больных основной группы подтверждается и более высоким у них уровнем α-фетопротеина. Уровень α-фетопротеина >200 ng/ml имел место у всех больных основной и у 55% — контрольной группы. В целом эти показатели позволяли определить худший долговременный послеоперационный прогноз для пациентов основной группы. По различным параметрам, характеризующим функциональное состояние печени, обе группы были сопоставимы между собой.
| Показатель | Группа | |
|---|---|---|
| контрольная (n=61) |
основная (n=21) |
|
| Возраст, лет | 43,2±3,6 | 55,4±4,1 |
| Пол, муж./жен. | 27/34 | 8/13 |
| Количество больных HBsAg+ в сыворотке крови | 7 | 11 |
| Количество больных HСVAb+ в сыворотке крови | 5 | 8 |
| ICG R15, % | 10,9±2,5 | 12,5±8,0 |
| Общий билирубин, мкмоль/л | 18,4±5,1 | 22,3±10,2 |
| AсАT, U/L | 52,7±7,4 | 49,2±6,3 |
| AлАT, U/L | 57,6±6,3 | 45,4±8,1 |
| Протромбиновое время, с | 19,6±1,2 | 20,1±2,0 |
| Диаметр опухоли, см | 5,7±6,4 | 9,2±6,2 |
| Число больных с α-фетопротеином ≥200 ng/ml | 34 | 21 |
Нами определены следующие противопоказания к резекции печени при ГЦК:
а) отдаленные метастазы;
б) метастазы в парааортальные лимфоузлы;
в) паренхиматозная желтуха;
г) асцит.
Показаниями к выполнению резекции печени при ГЦК были:
а) функциональный класс А по Child-Pugh;
б) ICGR15 <30%;
в) объем остающейся части печеночной паренхимы >30% по данным компьютерной волюметрии;
г) уровень АлАт и АсАт ≤100 МЕ.
После резекции печени производили биопсию с резекционной поверхности остающейся части печени в 3 различных точках с целью выявления микроскопических опухолевых саттелитов для оценки полноты и радикальности выполненного вмешательства. В послеоперационный период проводили тщательное морфологическое исследование резецированных частей печени для определения патологоанатомических критериев, таких как характеристика резекционного края, мультицентричность опухоли, формирование капсулы опухоли, наличие саттелитных опухолевых узлов, вовлечение в опухолевый процесс внутрипеченочных сосудов. После проведения патологоанатомического исследования резецированного материала каждому больному уточняли диагноз согласно классификации TNM (2002). Контрольные наблюдения и исследования в послеоперационный период проводили каждые 3–4 мес в условиях клиники. Для выявления рецидива опухоли определяли уровень α-фетопротеина в сыворотке крови, проводили ультразвуковое исследование органов брюшной полости и компьютерную томографию.
Сравнительную оценку результатов общеклинических, биохимических, патологоанатомических и специальных методов исследования проводили между двумя группами больных с использованием ПО «MSExel 2008».
Хирургическая техника
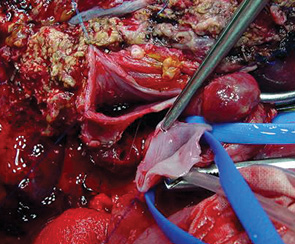
В контрольной группе больных выполнялись анатомические резекции печени по известным принципам. Хирургическая техника оперативных вмешательств в основной группе имела ряд особенностей. Во всех случаях использовался доступ типа «мерседес». После холецистэктомии осуществляли диссекцию элементов печеночно-двенадцатиперстной связки. Холедох, собственную печеночную артерию и ствол ВВ выделяли и брали на сосудистые держалки. Ствол ВВ препарировали из окружающих тканей максимально в проксимальном направлении (по току крови). Печеночную артерию и желчный проток удаляемой части печени выделяли, лигировали и пересекали. Во избежание фрагментирования тромбов ВВ с последующей их дислокацией и диссеминацией выделение элементов печеночно-двенадцатиперстной связки выполняли деликатно. При этом периодически использовали интраоперационное ультразвуковое исследование для осуществления контроля целостности тромба ВВ. Разделение паренхимы печени по намеченным линиям выполняли при помощи ультразвукового аспиратора. Для уменьшения кровопотери, а также для лучшей визуализации операционного поля использовали прием Прингля. Трансфиссурально выделяли бифуркацию холедоха, желчные протоки удаляемой части печени лигировали и пересекали. После этого появлялась возможность выделения ветви ВВ остающейся части печени, лежащей дистально по отношению к тромбу или опухолевой инвазии (рис. 3). После внутривенного введения 500 мг гидрокортизона одновременно отжимали ствол и контралатеральную ветвь ВВ, затем вскрывали просвет ВВ для идентификации истинной распространенности опухолевого тромба. Салфетками со спиртом обкладывали просветы вскрытых сосудов для предупреждения диссеминации канцероматозных клеток в свободную брюшную полость. Стенку ВВ и ее ветвей иссекали на расстоянии 2 мм от наиболее близко предлежащей части опухолевого тромба с целью онкологической безопасности (рис. 4).
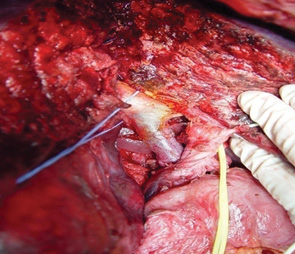
Поскольку портальные ветви, кровоснабжающие хвостатую долю печени, берут начало от ствола ВВ или ее конфлюенса, при опухолевом поражении этих участков ВВ тотальная каудальная лобэктомия являлась обязательным элементом оперативного вмешательства.
Способы восстановления портального тракта
После резекции ВВ и удаления препарата, выполнялся тот или иной вид портопластики. В исследуемой группе больных, в зависимости от протяженности опухолевой инвазии (по Shi), нами использовались следующие варианты резекции ВВ и портопластики (табл. 3): резекция конфлюенса с анастомозом «конец в конец» (рис. 5, 6), клинообразное иссечение стенки ВВ с последующим поперечным швом (рис. 7), иссечение стенки ВВ с аутовенозной пластикой сегментом овариальной вены (рис. 8).
| Способы восстановления портального тракта |
Протяженность опухолевой инвазии ВВ по Shi | Количество больных, n |
|---|---|---|
| Резекция конфлюенса ВВ с анастомозом «конец в конец» |
III | 16 |
| Иссечение стенки ВВ с последующей портопластикой поперечным швом | II | 3 |
| Аутовенозная пластика сегментом овариальной вены | II | 2 |
| Всего | 21 |
Результаты исследования
У больных основной группы выполнены 14 обширных (≥3 сегмента) и 7 расширенных (≥5 сегмента) резекций печени (табл. 4). Для достижения максимального радикализма операции, тотальная каудальная лобэктомия выполнялась во всех случаях.
| Операция | Количество больных, n |
|---|---|
| Левосторонняя трисекциоэктомия | 2 |
| Левосторонняя гемигепатэктомия | 3 |
| Правосторонняя гемигепатэктомия | 4 |
| Правосторонняя трисекциоэктомия | 12 |
| Всего | 21 |
В контрольной группе выполнены 42 обширных и 14 расширенных резекции печени, в остальных (5) случаях выполнены резекции 2 сегментов (табл. 5).
| Операция | Количество больных, n |
|---|---|
| Резекция левой латеральной секции | 3 |
| Левосторонняя гемигепатэктомия | 17 |
| Левосторонняя трисекциоэктомия | 4 |
| Левосторонняя трисекциоэктомия с тотальной каудальной лобэктомией | 1 |
| Резекция правой задней секции | 2 |
| Правосторонняя гемигепатэктомия | 21 |
| Правосторонняя трисекциоэктомия с тотальной каудальной лобэктомией | 2 |
| Правосторонняя трисекциоэктомия | 7 |
| Мезогепатэктомия | 4 |
| Всего | 61 |
В контрольной группе средняя продолжительность операции составила – (337±120) мин, время суммарной ишемии печени — (58±15) мин, интраоперационная кровопотеря — (1560±56) мл, объем гемотрансфузии — (775±25) мл. Разница с основной группой по продолжительности оперативного вмешательства (365±91) мин и по времени суммарной ишемии печени — (75±25) мин — по сравнению с контрольной группой не достигла статистической значимости. Время, необходимое для резекции и реконструкции ВВ, составило (20±3) мин. Интраоперационная кровопотеря (1792±70) мл и объем гемотрансфузии (886±15) мл оказались статистически значимо больше, чем в контрольной группе. Увеличение объема кровопотери в основной группе связываем с наличием у больных с опухолевым поражением ВВ синдрома портальной гипертензии с формированием множественных портокавальных и портопортальных коллатералей.
Характер послеоперационных осложнений представлен в табл. 6.
| Осложнение | Группа | |
|---|---|---|
| основная (n=21) | контрольная (n=61) | |
| Асцит | 4 | 7 |
| Плевральный выпот | 7 | 6 |
| Желчеистечение из паренхимы печени | 3 | 6 |
| Инфекция раны | 4 | 2 |
| Инфекция мочевого тракта | 3 | 1 |
| Пневмония | 2 | 2 |
| Синдром малой печени | 13 | 9 |
| Сепсис, полиорганная недостаточность |
1 | 3 |
| Тромбоз ВВ | 1 | – |
| Летальность | 2 (9,5%) | 5 (8,1%) |
Достоверно более часто в основной группе отмечался синдром малой печени, что объясняется большим количеством обширных и расширенных резекций печени. Синдром малой печени способствовал более высокой частоте инфекционных осложнений в основной группе (суммарно 13 (61,9%) случаев в основной группе и 9 (14,8%) — в контрольной группе). Послеоперационная летальность существенно не отличалась между двумя группами больных. В контрольной группе умерли 5 больных (2 — инфаркт миокаода, 1 — геморрагический инсульт, 1 — острые язвы толстой кишки, 1 — полиорганная недостаточность). В основной группе умерли 2 больных (1 — тромбоз ВВ, 1 — сепсис). Средняя продолжительность пребывания в стационаре была дольше у пациентов основной группы – (22±3) сут по сравнению с контрольной — (13±5) сут.
У больных основной группы опухоль соответствовала Т3 по классификации TNM в 17 (81%) случаях, T4 (прорастание в желчный пузырь) — в 4 (19%) случаях, в контрольной группе — в 10 (16,4%) случаях опухоль соответствовала Т2, в 45 (73,8%) — Т3 (несколько очагов >5 см) и в 6 (9,8%) случаях — Т4 (прорастание в желчный пузырь). Наличие капсулы у опухоли отмечено в 16 (76,2%) случаях в основной группе и в 39 (63,9%) — в контрольной группе. Таким образом, онкологическая стадийная характеристика опухоли больных контрольной группы была значительно лучше (меньшая распространенность и инвазия опухоли).
Для оценки отдаленных результатов хирургического лечения ГЦК с опухолевым поражением ВВ исследовали выживаемость в течение 1; 3 и 5 лет после операции. Результаты представлены на диаграмме (рис. 9). В основной группе в 20 случаях развились рецидивы заболевания. В 18 случаях отмечен внутрипеченочный рецидив ГЦК, в связи с чем больным проводили интраартериальную химиоэмболизацию. В 10 случаях отмечены внепеченочные рецидивы заболевания (легкие — 6, кости — 2, послеоперационный рубец — 1, кожа — 1). Различие показателя выживаемости среди двух групп больных является статистически значимым (р=0,33).
Обсуждение полученных результатов
Еще до недавнего времени опухолевая инвазия ВВ служила абсолютным противопоказанием к радикальному оперативному вмешательству. В последующем (в случаях обширных ГЦК с опухолевым тромбозом ВВ) отдельные хирурги выполняли резекцию печени с прямым удалением опухолевых тромбов из ствола ВВ для разрешения портальной гипертензии и увеличения продолжительности жизни больных. Авторы отметили, что данные вмешательства сопровождаются высоким хирургическим риском и летальностью. Неудовлетворенность выживаемостью в отдаленный период явилась стимулом к поиску новых путей улучшения результатов лечения инвазирующей портальный тракт ГЦК. Для повышения радикальности операции нами была предложена и успешно реализована на практике идея резекции тромбированного ствола ВВ с последующей его реконструкцией. Риск одновременной резекции паренхимы печени и ВВ до настоящего времени остается высоким. Анализ данных литературы, в которых приведен опыт резекций печени при ГЦК ведущих клиник мира, показал, что результаты зависят от характера больных, включенных в исследование. Так, если авторы исключают из наблюдения пациентов с тромбозом ствола или конфлюенса ВВ, то послеоперационная летальность соответствует идеальным показателям. Напротив, концентрация больных с тромбозом портального ствола обусловливает более высокий уровень летальности в ранний послеоперационный период. Однако в представленной нами работе после различных резекций печени без вмешательств на ВВ, выполненных у 61 больного, в ранний послеоперационный период умерли 5 (летальность — 8,1%). В основной группе (n=21) с опухолевым тромбозом ствола и конфлюенса ВВ умерли 2 (9,5%) больных. Учитывая, что в этой группе были выполнены только обширные и расширенные резекции печени, данный уровень летальности является приемлемым. Сравнительная оценка результатов показала, что разница послеоперационной летальности между основной и контрольной группами больных является статистически незначимой. Однако у больных основной группы объем резекции печеночной паренхимы значительно превышал таковой у больных контрольной группы. Травматичность оперативных вмешательств в основной группе больных была выше, чем в контрольной, но на показателе летальности это существенно не отразилось. Такой результат был достигнут благодаря тщательному планированию и выполнению оперативных вмешательств. Относительно невысокая послеоперационная летальность в данной группе больных является свидетельством того, что агрессивный подход и максимальный радикализм оправдан при лечении ГЦК с опухолевой инвазией ВВ. Резекция сегмента ствола и конфлюенса ВВ вместе с опухолевым тромбом обеспечивает максимальную радикальность. Для решения этой проблемы а также проблемы прямой инвазии ГЦК в ВВ нами предложено резецировать пораженный участок ВВ с последующей ее пластикой. Техника резекции ВВ при обширных резекциях печени была первоначально успешно применена нами при лечении внутрипеченочной холангиокарциномы. В дальнейшем принципиальные моменты резекции ВВ и ее ветвей получили развитие в резекционной хирургии ГЦК. Нами предложено три варианта резекции пораженного участка ВВ и восстановления проходимости портального тракта: резекция конфлюенса ВВ с портопластикой анастомозом «конец в конец», иссечение стенки ВВ с портопластикой поперечным швом и аутовенозная пластика сегментом овариальной вены. Резекция конфлюенса и ствола ВВ с последующей портопластикой анастомозом «конец в конец» — наиболее универсальная и радикальная операция, она применялась нами наиболее часто (16 (76,1%) больных).
Таким образом, агрессивная хирургическая тактика при гепатоцеллюлярной карциноме с опухолевым тромбозом ствола и конфлюенса ВВ обеспечивает максимальную радикальность оперативного вмешательства, при приемлемом количестве послеоперационных осложнений, позволяет существенно повысить отдаленную выживаемость больных.
ЛИТЕРАТУРА
- 1. Atsushi Sasaki, Yukio Iwashita, Kohei Shibata et al. (2006) Improved Long-term Survival after Liver Resection for Hepatocellular Carcinoma in the Modern Era: Retrospective Study from HCV-endemic Areas. World J. Surg., 30: 1567–1578.
- 2. Brian I. (2005) Carr. Hepatocellular cancer: diagnosis and treatment. Humana Press, p. 1–10.
- 3. Cheng-Chung Wu., Shih-Rong Hsieh, Jung-Ta Chen et al. (2000) An Appraisal of Liver and Portal Vein Resection for Hepatocellular Carcinoma With Tumor Thrombi Extending to Portal Bifurcation. Arch. Surg., 135: 1273–1279.
- 4. Chun-Nan Yeh, Wei-Chen Lee, Miin-Fu Chen M.D. (2005) Hepatic Resection and Prognosis for Patients With Hepatocellular Carcinoma Larger Than 10 cm: Two Decades of Experience at Chang Gung Memorial Hospital. Ann. Surgic. Oncol., 10(9): 1070–1076.
- 5. David Semela, Jean-Francois Dufour (2004) Angiogenesis and hepatocellular carcinoma. J. Hepatol., 41: 864–880.
- 6. Gianluigi Giannelli, Salvatore Antonaci (2006) Novel Concepts in Hepatocellular Carcinoma: From Molecular Research to Clinical Practice. J. Clin. Gastroenterol., 40: 842–846.
- 7. Jie Shi, Eric C.H. Lai, Nan Li (2011) A new classification for hepatocellular carcinoma with portal vein tumor thrombus. J. Hepatobiliary Pancreat. Sci, 18: 74–80.
- 8. Kojiro M. (2006) Pathology of Hepanocellular Carcinoma. Blackwellpublishing.
- 9. Masato Sakon, Hiroaki Nagano, Shoji Nakamori (2002) Intrahepatic Recurrences of Hepatocellular Carcinoma After Hepatectomy. Arch Surg., 137: 94–99.
- 10. Melanie B., Thomas Anderson (2005) Cancer Center Hepatocellular Carcinoma: The Need for Progress. J. Clinic. Oncol., 23(13): 2892–2899.
- 11. Miin-Fu Chen, Hsiu-Pei Tsai, Long-Bin et al. (2003) Prognostic Factors after Resection for Hepatocellular Carcinoma in Noncirrhotic Livers: Univariate and Multivariate Analysis. World J. Surg., 27: 443–447.
- 12. Ming Shi, Chang-Qing Zhang, Ya-Qi Zhang et al. (2004) Micrometastases of Solitary Hepatocellular Carcinoma and Appropriate Resection Margin. World J. Surg., 28: 376–381.
- 13. Naoto Gotohda, Taira Kinoshita, Masaru Konishi et al. (2006) New Indication for Reduction Surgery in Patients with Advanced Hepatocellular Carcinoma with Major Vascular Involvement. World J. Surg., 30: 431–438.
- 14. Li Q., Wang J., Sun Y. et al. (2006) Efficacy of Postoperative Transarterial Chemoembolization and Portal Vein Chemotherapy for Patients with Hepatocellular Carcinoma Complicated by Portal Vein Tumor Thrombosis — a Randomized Study. World J. Surg., 30: 2004–2011.
- 15. Ronnie Tung-Ping Poon, Irene Oi-Lin Ng, Sheung-Tat Fan et al. (2001) Clinicopathologic Features of Long-Term Survivors and Disease-Free Survivors After Resection of Hepatocellular Carcinoma: A Study of a Prospective Cohort. J. Clinic. Onc., 19(12): 3037–3044.
- 16. Ronnie Tung-Ping Poon, Sheung-Tat Fan, Flora Hau-Fung Tsang et al. (2002) Locoregional Therapies for Hepatocellular Carcinoma: A Critical Review From the Surgeon’s Perspective. Ann. Surg., 235(4): 466–486.
- 17. Seth J. Karpa, Yonson Kub, Scott Johnsona et al. (2006) Surgical and non-surgical approaches to hepatocellular cancer. Curr. Opin. Organ. Transplant., 11: 226–233.
- 18. Shoji Kubo, Tadashi Taukamoto, Kazuhiro Hirohashi et al. (2003) Appropriate Surgical Management of Small Hepatocellular Carcinomas in Patients Infected with Hepatitis C Virus. World J. Surg., 27: 437–442.
- 19. Tatsuya Abe, Junji Furuse, Masahiro Yoshino T. et al. (2002) Clinical Characteristics of Hepatocellular Carcinoma With an Extensive Lymph Node Metastasis at Diagnosis. Am. J. Clin. Oncol., 25(3): 318–323.
- 20. William S. Rilling, Alain Drooz (2002) Multidisciplinary Management of Hepatocellular Carcinoma. J. Vasc. Interv. Radiol., 13: S259–S263.
- 21. Yagil Barazani, Jonathan R. Hiatt, Myron J. Tong (2007) Busuttil Chronic Viral Hepatitis and Hepatocellular Carcinoma. World J. Surg., 31: 1243–1248.
- 22. Yasuhiko Nagano, Kuniya Tanaka, Shinji Togo et al. (2005) Efficacy of Hepatic Resection for Hepatocellular Carcinomas Larger than 10 cm. World J. Surg., 29: 66–71.
- 23. Yoshio Yamaoka, Kaoru Kumada, Keiichi Ino et al. (1992) Liver Resection for Hepatocellular Carcinoma (HCC) with Direct Removal of Tumor Thrombi in the Main Portal Vein. World J. Surg., 16: 1172–1177.














Leave a comment