Оцінка гематологічної токсичності хіміотерапії за схемою FAC у хворих зі злоякісними пухлинами грудної залози
Крячок И.А., Сивак Л.А., Алексик Е.М., Губарева А.А., Майданевич Н.Н., Филоненко Е.С., Лялькин С.А., Климанов М.Ю., Аскольский В.А.
Резюме. Проведено аналіз гематологічної токсичності стандартної схеми хіміотерапії FAC (фторурацил 500 мг/м в/в в 1-й день, доксорубіцин 50 мг/м в/в в 1-й день, циклофосфамід 500 мг/м в/в в 1-й день) з повторенням курсів кожні 3 тиж у хворих на злоякісні пухлини грудної залози, які отримували лікування у віддділі консервативних методів лікування Національного інституту раку. З’ясовано, що гематологічні ускладнення, які потребували б терапії супроводу, частіше розвиваються на 7-ту добу після лікування. У більшості хворих спостерігаються І та ІІ ступені гематологічної токсичності, що має пряму кореляційну залежність від попереднього лікування та кількості проведених курсів хіміотерапії. Хіміотерапія за схемою FAC має низьку гематологічну токсичність. У всіх хворих до чергового курсу хіміотерапії гемопоез відновлюється і не потребує відстрочки курсів лікування або редукції доз хіміопрепаратів.
Резюме. Проведен анализ гематологической токсичности стандартной схемы химиотерапии FAC (фторурацил 500 мг/м2 в/в в 1-й день, доксорубицин 50 мг/м2 в/в в 1-й день, циклофосфамид 500 мг/м2 в/в в 1-й день) с повторением курсов каждые 3 нед у больных со злокачественными опухолями грудной железы, получавших лечение в отделе консервативных методов лечения Национального института рака. Выяснено, что гематологические осложнения, требующие терапии сопровождения, чаще развиваются на 7-й день после лечения. У большинства больных наблюдаются І и ІІ степень гематологической токсичности, которая имеет прямую корреляционную зависимость от предыдущего лечения и количества проведенных курсов химиотерапии. Химиотерапия по схеме FAC имеет низкую гематологическую токсичность. У всех больных к очередному курсу химиотерапии гемопоэз восстанавливается, и не требуется отсрочки курсов лечения или редукции доз химиопрепаратов.
 Введение
Введение
Злокачественные опухоли грудной железы (ЗОГЖ) занимают первое место в структуре онкологической заболеваемости и смертности от онкопатологии женского населения во всем мире [1, 2]. Ежегодно регистрируют более 1 млн женщин с впервые выявленным ЗОГЖ, и каждый год более 600 тыс. больных погибают от этого заболевания [3]. Аналогичная тенденция наблюдается и в Европе [4].
В последние годы подходы к лечению ЗОГЖ существенно изменились. Эти изменения коснулись преимущественно ранней диагностики ЗОГЖ и более широкого использования химиотерапии (ХТ). Неудовлетворенность результатами расширенных и сверхрасширенных оперативных вмешательств при ЗОГЖ, зачастую приводящих женщин к инвалидизации и, в конце концов, рано или поздно заканчивающихся развитием отдаленных метастазов у 70–80% оперированных больных, подтолкнула исследователей к поиску дополнительных системных лечебных воздействий, в частности к использованию ХТ [5]. ЗОГЖ оказались чувствительными к большинству современных противоопухолевых препаратов, прежде всего, к доксорубицину (эффективен у 40% больных), циклофосфамиду (35%) и фторурацилу (25%) [6, 7]. По данным многих исследователей, включение ХТ в схему лечения больных со ЗОГЖ достоверно сокращает показатели рецидивирования заболевания на 23,8%, а смертности — на 15%. Особенно заметным сокращение рецидивирования и смертности при использовании в лечении ХТ оказалось у пациентов моложе 50 лет (на 34 и 27% соответственно) [8]. Как известно, ХТ при распространенных стадиях ЗОГЖ является одним из основных методов лечения, позволяя не только продлить жизнь больного, но и улучшить ее качество. Кроме этого, оказалось, что ее применение в лечении ранних, операбельных стадий ЗОГЖ, также положительно сказывается на результатах лечения [5]. Анализ протоколов рандомизированных клинических исследований показал, что адъювантная ХТ у молодых больных со ЗОГЖ или у больных со ЗОГЖ в пременопаузальном возрасте снижает ежегодную смертность на 25%. Аналогичный эффект отмечается у больных со ЗОГЖ в постменопаузальный период. Разница выживаемости больных, получавших и не получавших адъювантное лечение, составляет приблизительно 2 года [9].
ХТ — это метод лечения злокачественных новообразований с помощью цитотоксических, то есть токсичных для клеток, угнетающих их жизнедеятельность лекарственных веществ. Известно, что попытки использования лекарственных средств для лечения больных раком предпринимались очень давно, начиная с Парацельса, а возможно, и ранее. В одном из папирусов, датированных 1500 г. до н.э., сообщалось о применении мышьяка для лечения опухоли. Но все эти попытки носили эмпирический характер и были безуспешными. Признанным основоположником ХТ как науки является П. Эрлих — автор самого термина «химиотерапия», который вначале означал «лечение системных паразитарных заболеваний химическими веществами». Под паразитарными заболеваниями имелись в виду болезни, вызываемые глистами, грибами, простейшими, бактериями, риккетсиями и вирусами. Позже термин «химиотерапия» распространили на лечение опухолей. П. Эрлиху принадлежит также идея постоянного скрининга химических веществ на наличие у них необходимых для химиотерапевтических препаратов свойств и формирование методологии исследования химиотерапевтических агентов на соответствующих моделях.
Противоопухолевая ХТ как раздел медицинской науки, включающий разработку и изучение новых препаратов и их практическое применение в онкологии, имеет сравнительно короткую историю. До Второй мировой войны было известно очень немного соединений с противоопухолевой активностью. Это — соединения мышьяка, некоторые металлы, токсины, колхицин и другие митотические яды. Интерес к дальнейшим исследованиям был стимулирован классическими работами О. Варбурга, который впервые четко определил различия между опухолевыми и нормальными тканями. Последующие 60 лет были годами больших ожиданий, удачных прорывов, несбывшихся надежд и медленного постепенного продвижения к основной, все еще недостигнутой в полном объеме цели — созданию лекарств, с помощью которых можно было бы лечить больных со злокачественными опухолями с уверенностью в достижении полного излечения во всех случаях. Развитие ХТ в этот период происходило скачками — внедрение каждого нового лекарственного средства знаменовало новую, как правило, более высокую ступень развития этой науки, поскольку предоставляло новые возможности для терапии опухолей. Каждое новое лекарство и создаваемый на его основе новый класс препаратов открывали новую страницу в истории противоопухолевой ХТ, которая могла оставаться последней более или менее длительное время, но неизбежно через определенный период появлялся еще один класс противоопухолевых препаратов, и, как следствие, лекарственное лечение рака поднималось еще на одну ступень. Эффективные старые препараты при этом не теряли своего клинического значения, что приводило к возрастающему разнообразию арсенала лекарственных средств, находящихся в распоряжении онколога-химиотерапевта, и это значительно увеличивало его возможности в терапии больных.
Каждое десятилетие этого периода может быть названо именем той группы препаратов, к которой в это время было приковано наибольшее внимание химиотерапевтов и с которой связывали наибольшие надежды. Так, 50–60-е годы прошлого века были временем алкилирующих препаратов и антиметаболитов, в 70-е годы появились антрациклины, в 80-е — препараты платины, 90-е стали десятилетием таксанов и временем первого появления таргетных препаратов. Первое десятилетие нового столетия стало той вехой, когда наибольший интерес вызывали препараты, направленные на определенные молекулярные мишени в опухолевой клетке. Важно отметить, что с каждым десятилетием страницы истории противоопухолевой ХТ переворачивались все быстрее, и это позволяет надеяться, что в сравнительно недалеком будущем будут созданы препараты, которые позволят осуществить мечту как больных, так и здоровых людей — излечивать рак с помощью лекарств.
Но цитостатические препараты не выбирают по каким клеткам ударить. Они разрушают как больные, так и здоровые быстрорегенерирующие клетки. Прежде всего это клетки крови, что может привести к почти полной цитопении, то есть угнетению роста всех ростков кроветворения (лейкопоэз, тромбоцитопоэз и эритропоэз). Гематологические осложнения противоопухолевой ХТ разной степени выраженности встречаются у 88% больных онкологического профиля. Факторы, влияющие на глубину и частоту подавления гемопоэза, обусловлены:
1) резервом кроветворения, на который влияют предшествующие облучение или ХТ, наличием метастазов в костном мозгу, возрастом пациента, степенью истощения больного;
2) типом, дозами и методами введения используемых химиотерапевтических препаратов, интервалами между курсами ХТ и соматическим статусом пациента.
В структуре осложнений ХТ на одно из лидирующих мест, по данным разных авторов, выходят токсические эффекты, оказываемые на миелоидный росток кроветворения. Различные схемы ХТ в той или иной степени снижают содержание гранулоцитов (нейтрофилов) в периферической крови. Нейтропения — самое частое гематологическое осложнение ХТ у онкологических больных, обусловленное поражением гранулоцитарного ростка кроветворения. Наличие нейтропении сопряжено с высоким риском бактериальной инфекции. Появление лихорадки у этих пациентов прямо коррелирует с интенсивностью ХТ. У 10–40% пациентов с солидными опухолями и у 80–100% больных со злокачественными лимфопролиферативными заболеваниями, получавших ХТ в стандартных дозах, развивается так называемая фебрильная нейтропения [10]. Более чем у 20% пациентов с фебрильной нейтропенией регистрируется бактериемия при уменьшении количества нейтрофилов в крови до числа менее 1,0×10/л. Это состояние представляет угрозу для жизни пациентов, так как при неправильном лечении может привести к септическому шоку и летальному исходу.
Согласно критериям Американского общества инфекционных заболеваний фебрильную нейтропению определяют как однократное повышение температуры тела, измеренной в ротовой полости пациента, до более 38,3 °С при содержании нейтрофилов крови менее 1000 клеток в 1 мкл; или ее двукратное повышение до более 38,0 °С с интервалом в 1 ч при содержании нейтрофилов крови менее 500 клеток в 1 мкл или менее 1000 клеток с тенденцией к дальнейшему снижению [11]. Нейтропения III–IV степени является основным лимитирующим фактором, препятствующим началу ХТ и вызывающим необходимость снижения доз химиопрепаратов, задержку и/или отмену курсов лечения. Тромбоцитопения как осложнение ХТ также представляет клиническую проблему, наиболее грозными проявлениями которой являются геморрагии, нередко фатальные, особенно при наличии сопутствующей инфекции. Анемия может вызывать значительное ухудшение качества жизни и переносимости ХТ. Кроме того, переливания эритроцитарной массы, применяющиеся для коррекции анемии, несут опасность передачи многих вирусов, включая вирусы гепатита и иммунодефицита человека.
Таким образом, целью нашего исследования было определение гематологической токсичности основной схемы ХТ, которая применяется при лечении больных со ЗОГЖ.
Материалы и методы
В исследование включено 40 пациенток со ЗОГЖ, у которых в комплексном лечении использовалась ХТ по схеме FAC. Возраст пациенток колебался в диапазоне от 31 до 66 лет. Средний возраст составил 49,8±9,8 года. Среди них было 5 больных, возраст которых не превышал 35 лет. По стадиям патологического процесса больных разделили следующим образом: ІІа стадия (T2N0M0) — 13 женщин; ІІb стадия (T2N1M0) — 17; IIIа стадия (T3N1M0, T3N2M0, T4N1M0) — 6; IIIb стадия (T4N1Mх) — 2; ІV стадия (T4N1M1) — 2 пациентки. У 21 больной опухоль была расположена в правой грудной железе, у 17 — в левой, а у 2 пациенток имело место билатеральное поражение грудных желез. В большинстве случаев (34 больных) опухоль располагалась в верхненаружном квадранте грудной железы. Размер опухоли у всех больных не превышал 2,0 см. Регионарные метастазы диагностированы у 27 женщин. В подавляющем большинстве случаев (22 больных) были поражены подмышечные лимфоузлы, у 4 — шейные, а у 1 пациентки зарегистрировано одновременное поражение шейных и подмышечных лимфоузлов. Во всех вышеуказанных случаях регионарные лимфоузлы располагались на стороне пораженной грудной железы. Отдаленные метастазы были выявлены у 2 больных. У одной пациентки имело место поражение костей, у другой — поражение легких и лимфоузлов средостения.
До момента исследования у 38 больных проведены радикальные хирургические вмешательства, а 2 пациентки получили лучевую терапию и ХТ.
Результаты
Всем исследуемым больным проводили общий анализ крови с подсчетом формулы и количества тромбоцитов перед каждым курсом полихимиотерапии (ПХТ) по схеме FAC и на 7-й и 14-й дни курса.
Степень гематологической токсичности определялась согласно критериям ВОЗ по шкале токсичности Common Toxicity Criteria NCIC (таблица).
Таблица Степень гематологической токсичности согласно критериям ВОЗ по шкале токсичности Common Toxicity Criteria NCIC
| Степень токсичности | Количество лейкоцитов в 1 мкл крови | Количество нейтрофилов в 1 мкл крови | Уровень гемоглобина, г/л |
Количество тромбоцитов, ×10/л |
|---|---|---|---|---|
| I | 3900–3000 | 2000–1500 | N — 100 г/л | 75–99 |
| II | 2900–2000 | 1500–1000 | 100–80 г/л; | 50–74 |
| III | 1900–1000 | 1000–500 | 80–65 г/л; | 25–49 |
| IV | <1000 | <500 | <65 г/л | <25 |
Перед началом лечения у 1 больной наблюдалась I степень лейкопении, а нейтропения не была диагностирова ни у одной больной. На 7-й день после I курса ХТ лейкопения I степени развилась у 1 больной, II степени — у 4 больных и III степени — еще у 1 больной. Нейтропения I степени была диагностирована у 3 больных, II степени — еще у 3 и III степени — у 1 пациентки. На 14-й день после І курса ХТ у 7 больных развилась лейкопения І степени и у 3 — нейтропения ІІ степени. Перед началом ІІ курса у 1 больной диагностирована І степень лейкопении, нейтропения не наблюдалась. У 3 больных на 7-й день после ІІ курса ХТ наблюдалась лейкопения І степени, у 2 — ІІ степени и у 1 пациентки — ІІІ степени. Нейтропения ІІ степени развилась у 1 больной и ІІІ степени — у 2. На 14-й день после ІІ курса ХТ у 7 больных развилась лейкопения І степени и у 3 пациенток — нейтропения ІІ степени. ІІІ курс ХТ по схеме FAC 3 пациенток со ЗОГЖ начали с І степенью лейкопении. У 3 больных на 7-й день после ІІІ курса ХТ наблюдалась лейкопения І степени, еще у 3 — ІІ степени и у 1 больной — ІІІ степени. Нейтропения І степени развилась у 1 больной и ІІІ степени — также у 1 пациентки. На 14-й день после ІІІ курса ХТ у 4 больных развилась лейкопения І степени, у 2 больных — ІІ степени и у 1 пациентки — нейтропения ІV степени. Перед началом ІV курса лечения у 2 больных диагностирована І степень лейкопении и у 1 больной — нейтропения І степени. У 5 больных на 7-й день после ІV курса ХТ наблюдалась лейкопения І степени. Нейтропения І степени развилась у 2 больных. На 14-й день после ІV курса ХТ у 1 больной развилась лейкопения І степени и еще у 1 — ІІ степени. Только у 1 больной диагностирована нейтропения, которая оказалась І степени. V курс ХТ по схеме FAC 2 больных со ЗОГЖ начали с лейкопенией І степени и 1 больная — с нейтропенией І степени. У 1 больной на 7-й день после V курса ХТ наблюдалась лейкопения І степени и у 1 — нейтропения также І степени. На 14-й день после V курса ХТ у 2 больных развилась лейкопения І степени, у 3 — ІІ степени и у 1 — нейтропения ІV степени. Перед началом VІ курса лечения у 3 больных диагностована І степень лейкопении, у 2 пациенток — ІІ степень. Нейтропения І степени встречалась у 4 больных, а ІІ степени — у 2. У 4 больных на 7-й день после VІ курса ХТ наблюдалась лейкопения І степени и у 2 — ІІ степени. Нейтропения І степени развилась у 3 больных и ІІ степени —у 1. На 14-й день после VІ курса ХТ у 2 больных развилась лейкопения І степени и еще у 2 — нейтропения І степени. Динамика уровня лейкоцитов и нейтрофилов периферической крови в процессе ХТ у больных со ЗОГЖ представлена на рис. 1 и 2.
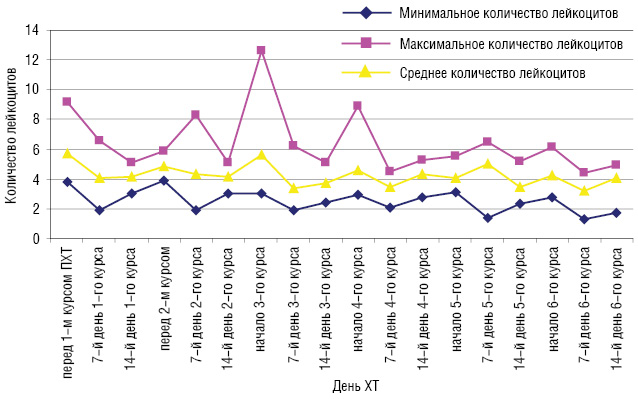
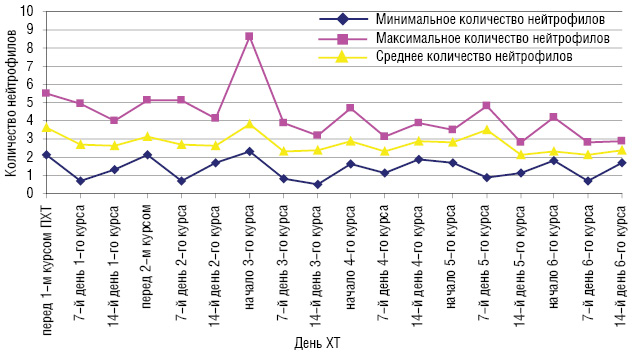
Перед началом лечения у 5 больных наблюдалась анемия І степени. Анемия ІІ, ІІІ, ІV степени перед началом лечения не встречалась ни у одной больной. На 7-й день терапии у 7 больных развилась анемия І степени и у 2 больных — ІІ степени. У 10 больных на 14-й день после І курса ХТ по схеме FAC развилась анемия І степени и у 1 больной — ІІ степени. Анемия І степени перед ІІ курсом ХТ диагностирована у 8 больных и ІІ степени — у 1 больной. У 9 больных на 7-й день после ІІ курса ХТ по схеме FAC развилась анемия І степени и у 1 больной — ІІ степени. На 14-й день после ІІ курса ХТ у 12 больных диагностирована анемия І степени и у 1 больной — ІІ степени. Перед ІІІ курсом ХТ у 2 больных развилась анемия І степени и у 4 — ІІ степени. На 7-й день после ІІІ курса ХТ 3 больных имели анемию І степени и 3 больных — ІІ степени. На 14-й день после ІІІ курса ХТ у 5 больных диагностирована анемия І степени и у 1 больной — ІІ степени. Анемия І степени перед ІV курсом ХТ диагностирована у 6 больных и ІІ степени — у 2 пациенток. У 8 больных на 7-й день после ІV курса ХТ по схеме FAC развилась анемия І степени и у 2 — ІІ степени. На 14-й день после ІV курса ХТ у 9 больных диагностирована анемия І степени и у 1 пациентки — ІІ степени. Перед V курсом ХТ у 5 больных развилась анемия І степени и у 3 — ІІ степени. На 7-й день после V курса ХТ 7 больных имели анемию І степени и 3 пациентки — ІІ степени. На 14-й день после V курса ХТ у 6 больных диагностирована анемия І степени и у 2 больных — ІІ степени. Перед VІ курсом ХТ у 7 больных развилась анемия І степени и у 4 — ІІ степени. На 7-й день после V курса ХТ 6 больных имели анемию І степени и 2 пациентки — ІІ степени. На 14-й день после V курса ХТ у 5 больных диагностирована анемия І степени и у 3 — ІІ степени. Динамика уровня гемоглобина периферической крови в процессе ХТ у больных со ЗОГЖ представлена на рис. 3.
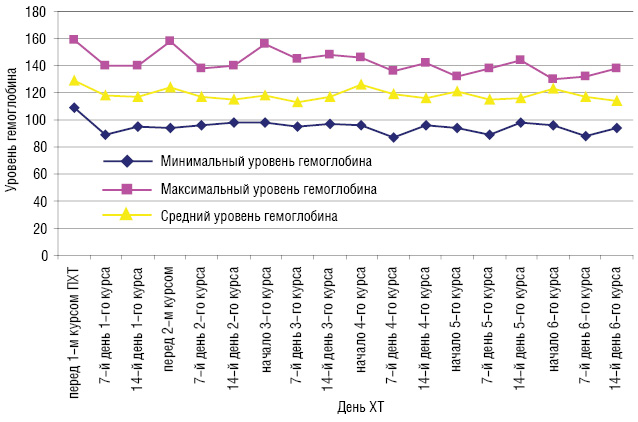
Перед началом лечения ни у одной пациентки не было тромбоцитопении. На 7-й день после І курса ХТ по схеме FAC у 2 больных со ЗОГЖ развилась тромбоцитопения І степени и у 1 пациентки — ІІ степени. На 14-й день после І курса ХТ только у 1 больной была диагностирована тромбоцитопения І степени. Ни у одной больной со ЗОГЖ тромбоцитопения перед ІІ курсом ПХТ не была зарегистрирована. У 2 больных развилась тромбоцитопения І степени на 7-й день после ІІ курса лечения. На 14-й день после ІІ курса ХТ по схеме FAC тромбоцитопения не была зарегистрирована ни у одной пациентки. ІІІ курс лечения все больные со ЗОГЖ начали без тромбоцитопении. У 2 больных развилась тромбоцитопения І степени на 7-й день после ІІІ курса ХТ и у 1 — на 14-й день. Перед IV курсом ХТ также ни у одной больной не наблюдалось тромбоцитопении. На 7-й день после IV курса ХТ по схеме FAC у 3 больных со ЗОГЖ развилась тромбоцитопения І степени и у 1 пациентки — ІІ степени. На 14-й день после IV курса ХТ только у 1 больной была диагностирована тромбоцитопения І степени. Ни у одной больной со ЗОГЖ тромбоцитопения перед V курсом ХТ не была зарегистрирована. У 3 больных развилась тромбоцитопения І степени на 7-й день после V курса лечения. На 14-й день после V курса ХТ по схеме FAC тромбоцитопения не была зарегистрирована. VI курс лечения все больные со ЗОГЖ начали без тромбоцитопении любой степени. У 2 больных развилась тромбоцитопения І степени на 7-й день после VI курса ПХТ и у 1 — на 14-й день. Динамика уровня тромбоцитов периферической крови в процессе ХТ у больных со ЗОГЖ представлена на рис. 4.
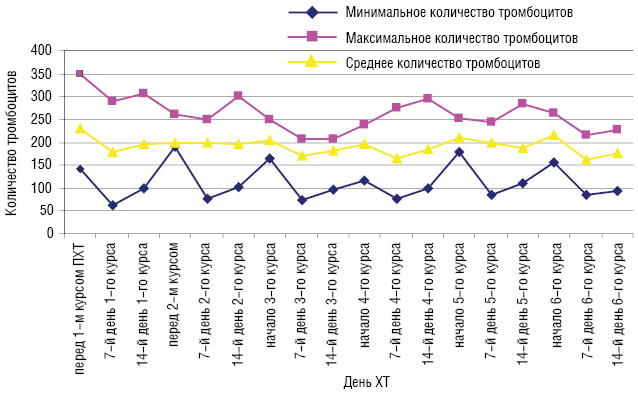
Выводы
Гематологические осложнения ХТ по схеме FAC, требующие терапии сопровождения, у больных со ЗОГЖ чаще развивались на 7-й день после лечения. У большинства больных наблюдались І и ІІ степень гематологической токсичности, которая имела прямую корреляционную зависимость от предыдущего лечения (операция, облучение, ХТ) и количества проведенных курсов ХТ (r=0,34, p<0,05).
Таким образом, можно сделать заключение, что курс ХТ по схеме FAC у больных со ЗОГЖ имеет низкую гематологическую токсичность. У всех больных лейкопения, нейтропения, анемия, тромбоцитопения III–IV степени к очередному курсу ХТ по схеме FAC не определялась, что не требовало отсрочки курсов лечения и редукции доз химиопрепаратов.
Литература
1. Иванов П.М., Иванова Ф.Г. (2003) Злокачественные новообразования на Крайнем Севере и их социально-экономические последствия, Якутск: 4–16, 76–84.
2. Иванов П.М., Томский М.И., Каратаев П.Д. (2008) Злокачественные новообразования в Якутии на рубеже веков, Якутск: 9–12, 110–116.
3. Рак в Україні, 2008–2009. Захворюваність, смертність, показники діяльності онкологічної служби (2010) Бюл. Національного канцер-реєстру України, 11: 50–51.
4. Чиссов В.И., Дарьялова С.Л. (ред.) (2008) Онкология: Клинические рекомендации, М.: ГЭОТАР-Медиа: 269–314.
5. Иванова Ф.Г., Николаева Т.Н., Горбунова В.А. (2009) Изучение эффективности и токсичности стандартной схемы химиотерапии при раке молочной железы. Сиб. онкол. журн., 5(35): 54–57.
6. Переводчикова Н.И. (2001) Место химиотерапии в системе лечения онкологических больных и выбор терапевтической тактики. Современная онкология, 3(2): 51–55.
7. Переводчикова Н.И. (2005) Руководство по химиотерапии опухолевых заболеваний, М.: 254–267.
8. Семиглазов В.Ф., Семиглазов В.В., Божок А.А., Мельникова О.А. (2004) Вопросы онкологии, 50(2): 243–249.
9. Henderson, Craig I. (1994) Cancer (Suppl.), 74 (1):
401–409.
10. Klastersky J. (1998) Current Attitudes for Therapy of Febrile Neutropenia with Consideration to Cost–Effectiveness. Curr. Op. In Oncol., 10: 284–290.
11. Подольцева Э.И. (2000) Профилактика и лечение гематологических осложнений химиотерапии у онкологических больных. Практическая онкология, 2: 31–37.














Leave a comment