Хіміотерапія в лікуванні хворих на рак шийки матки ІІB стадії
Резюме. Представлено дані клінічних досліджень, які обґрунтовують застосування хіміотерапії в комбінованому лікуванні хворих на рак шийки матки ІІВ стадії. Застосування на першому етапі лікування платиновмісних схем хіміотерапії дозволяє перевести первинно нерезектабельні форми в резектабельні та покращити 3-річну безрецидивну виживаність до 77,4% при використанні передопераційної хіміопроменевої терапії та до 86,1% — із застосуванням неоад’ювантних курсів хіміотерапії у порівнянні з поєднано-променевою терапією, виживаність при використанні якої становила 58%.
 Вступ
Вступ
В Україні рак шийки матки (РШМ) займає одне з провідних місць у структурі онкологічної захворюваності. За даними Національного канцер-реєстру, РШМ посідає 2-ге місце серед онкогінекологічної патології та становить 19,8 на 100 тис. жіночого населення України (2010 р.) і 6-е — у структурі смертності від злоякісних новоутворень [1].
Стандартним методом лікування інвазивного РШМ є комбінований, але досі існують розбіжності в лікуванні ІІВ стадії. Згідно з клінічною класифікацією РШМ FIGO (2006) критерієм ІІВ стадії є інфільтрація параметріїв, що не доходить до стінок таза, стадія РШМ визначається на основі клінічних даних. Застосування ультразвукового дослідження (УЗД), комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ) чи позитронно-емісійної томографії (ПЕТ) впливає на план лікування, але не є основою для зміни клінічної стадії. Це пов’язано з тим, що дані методи дослідження не завжди доступні, а інтерпретація їх результатів варіабельна [5]. При порівнянні даних клінічного стадіювання, МРТ і КТ, які були проведені перед хірургічним втручанням у хворих з місцево-поширеним РШМ (стадія ІІВ і вище), з даними патогістологічного дослідження було виявлено, що чутливість була низькою як при клінічному стадіюванні за FIGO, так і КТ (42%), і МРТ (53%) (H. Hricak et al., 2005), збіг клінічного і хірургічного діагнозів у хворих на РШМ простежується в 62–67,7% випадків (B. Obrzut et al., 2006; A.S. Faysal, 2009).
У літературі є дані про хірургічне лікування хворих на РШМ ІІВ стадії, в основному японських (P. Suprasert, J. Srisomboon, T. Kasamatsu, 2005), а також деяких європейських авторів. За їх даними, дійсне залучення в процес параметріїв при цій стадії є лише в 21–55% випадків, тобто у ½–⁴/₅ пацієнток має місце завищення клінічної стадії. Розбіжність між клінічною і хірургічною стадіями пов’язано з неможливістю клінічно відрізнити інвазію в параметрій від запальних, злукових змін, ендометріозу, а отже, 50–80% хворих РШМ ІІВ стадії можуть бути радикально прооперовані [7, 12].
При застосуванні променевої терапії (ПТ) як самостійного методу лікування серед хворих на РШМ ІІВ стадії 5-річна виживаність становить від 42 до 64,2%, а при комбінованому лікуванні — від 55,2 до 76,9% [4, 6, 13]. Збільшення кількості хворих на РШМ молодого віку спонукає до перегляду традиційних схем лікування, тобто застосування ПТ на передопераційному етапі, яка викликає передчасну інволюцію тканини яєчника та супроводжується численними ускладненнями, які відстрочують проведення операції, погіршують її технічне виконання і, як наслідок, збільшують тривалість лікування [6, 13].
Роль неод’ювантної хіміотерапії (ХТ) в лікуванні РШМ активно обговорюється протягом останніх двох десятиліть. Поряд з хіміопроменевим лікуванням вивчається можливість застосування при місцево-поширеному РШМ неод’ювантної ХТ з наступною радикальною операцією [7–15], проводяться численні рандомізовані дослідження з порівняння ефективності різних схем ХТ.
Слід зазначити, що віддалені результати, перебіг захворювання, пухлинна прогресія, відповідь на ХТ, ПТ у хворих на РШМ з однією стадією і гістологічним типом пухлин досить варіабельні [2, 10–12]. В останні роки увага дослідників спрямована на виявлення додаткових прогностичних ознак, які дозволяють з’ясувати причини різної поведінки пухлин при однаковій клінічній стадії і ступеневі диференціювання [3].
Отже, до теперішнього часу остаточно не визначена тактика лікування хворих на РШМ ІІ стадії, а в стандартах діагностики і лікування існують різні варіанти лікування даної патології, вибір найбільш оптимального, як правило, залежить від суб’єктивної думки лікаря. В Україні залишаються невиправдано низькі показники комбінованого чи комплексного лікування РШМ ІІ стадії, при застосуванні яких можливо покращити 5-річну виживаність, що вказує на актуальність проведеного дослідження.
Мета дослідження — підвищити ефективність лікування хворих на РШМ ІІВ стадії шляхом застосування неод’ювантної ХТ у комплексному лікуванні.
Матеріали та методи
Проаналізовано результати лікування 103 хворих на РШМ ІІВ стадії, які отримали радикальне лікування в Івано-Франківському ООД з 2003 по 2010 р. Критерієм відбору хворих був плоскоклітинний РШМ ІІВ стадії, верифікований у всіх хворих при морфологічному дослідженні пухлини шийки матки. Діагноз РШМ вcтановлювали, враховуючи клінічну картину, результати гінекологічного огляду (розміри первинної пухлини, стан склепінь та параметріїв), дані цитологічного і гістологічного досліджень прицільної біопсії пухлини та результати додаткових методів обстеження (цистоскопія, ректороманоскопія, рентгенографія органів грудної клітки, УЗД та МРТ органів черевної порожнини і малого таза).
За схемами лікування пацієнтки розподілені на 3 групи:
- І група (31 пацієнтка) — передопераційний курс дистанційної ПТ по 2 Гр до сумарної дози 30 Гр з потенціюванням цисплатином 40 мг/м щотижня, оперативне втручання в обсязі пангістеректомії ІІІ типу, післяопераційний курс ПТ при необхідності;
- ІІ група (36 пацієнток) — неоад’ювантна системна ХТ за схемою FР (цисплатин 75 мг/м, 5-фторурацил 1000 мг/м з 1-го по 4-й день) 2–3 курси кожні 3 тиж, хірургічне втручання в обсязі пангістеректомії ІІІ типу, при необхідності — післяопераційний курс ПТ;
- ІІІ група (36 пацієнток) — повний курс поєднано-променевої терапії до сумарної вогнищевої дози 80–100 Гр з потенціюванням цисплатином 40 мг/м щотижня (6 тиж).
Результати неоад’ювантного лікування оцінювали за ступенем регресії пухлини (зменшення її розмірів, зникнення симптомів перифокального запалення, некроз пухлинної тканини), УЗД- та МРТ-даними до і після кожного курсу ХТ, а також проводили оцінку хіміотоксичного впливу. Результати оцінювали згідно з класифікацією ВООЗ, до якої включені такі показники, як повна (ПР) та часткова регресія (ЧР) пухлини, стабілізація процесу (СП) та прогресування захворювання (ПЗ). Відповідь пухлини класифікували як ЧР при регресії більше ніж 50%, як СП — при регресії менше ніж 50% або за відсутності змін розмірів пухлини [7, 8].
Післяопераційну дистанційну ПТ (до сумарної вогнищевої дози 40 Гр) призначали після отримання результатів гістологічного дослідження препарату при наявності метастазів у лімфатичних вузлах, глибокій інвазії пухлини та лімфосудинній інвазії.
Статистичну обробку отриманих результатів проводили з використанням стандартного пакету програм Statistica 6.0.
Результати
Розподіл пацієнток за віком: І група — 48,1±8,1 року, ІІ група — 45,6±9,3 року, ІІІ група — 50,3±10,6 року.
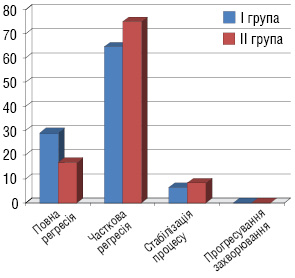
Після 3 курсів ХТ проведено оцінку ступеня регресії пухлини (рис. 1): ПР досягнуто у 9 (29%) хворих І групи та 6 (16,7%) ІІ групи, ЧР — у 20 (64,6%) та 27 (75%) хворих, СП — у 2 (6,4%) та 3 (8,3%) хворих відповідно І і ІІ груп.
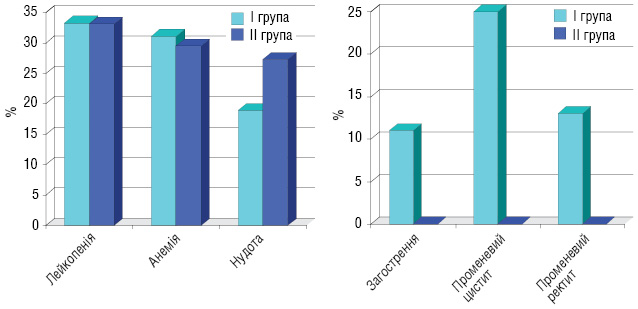
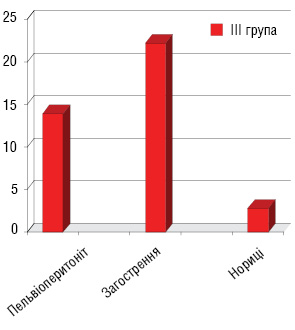
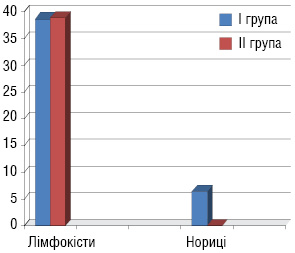
Характеристика ускладнень після першого етапу лікування (рис. 2): лейкопенія І–ІІ ступеня виникла у 33,3% пацієнтів І групи та 33,1% хворих ІІ групи, анемія І–ІІ ступеня — у 31,1 та 29,5% пацієнтів відповідно І і ІІ груп. Крім того, у пацієнтів І групи були ускладнення: загострення хронічних аднекситів — у 3 (11%) хворих, променевий цистит — у 8 (25%) та променевий ректит — у 4 (13%). У пацієнток ІІІ групи, які отримували повний курс хіміопроменевої терапії, виникли такі ускладнення: загострення хронічних аднекситів — у 8 (22,2%) хворих, пельвіоперитоніт — у 5 (13,8%), променевий цистит — у 10 (27,8%), променевий ректит — у 6 (16,7%) та у 1 (2,8%) хворої діагностовано ректовагінальну норицю (рис. 3). У пацієнток, у яких виникали загострення хронічних аднекситів, пельвіоперитоніт, променеві ректити і цистити, ПТ припиняли на час лікування даних ускладнень.
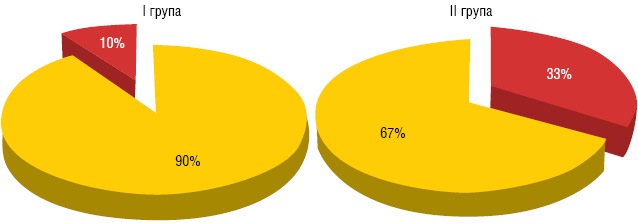
Через 3 тиж 29 (93,5%) хворим І групи та 33 (91,7%) ІІ групи проведено оперативне втручання в обсязі пангістеректомії ІІІ типу. У хворих досліджуваних груп метастатичне ураження регіонарних лімфатичних вузлів (рис. 4) виявлено у 3 (9,7%) випадках у І групі та 12 (33%) — у ІІ.
Проаналізовано ступінь лікувального патоморфозу (рис. 5): патоморфоз ІІ ступеня виявлено у 14 (48,4%) хворих І групи і у 25 (75%) ІІ групи, ІІІ ступеня — у 6 (22,6%) та 3 (8,3%) і ІV ступеня — у 9 (29%) та 5 (16,7%) відповідно у І та ІІ групах хворих. З вищенаведених даних видно, що лікувальний патоморфоз був достовірно однаковий (р>0,05) у І та ІІ досліджуваних групах. Морфологічне і морфометричне дослідження операційного матеріалу показало, що лікувальний патоморфоз після застосування передопераційної ХТ дозволяє досягти девіталізації пухлини, що збігається з клінічним ефектом. Отже, при передопераційному застосуванні ХТ створюються об’єктивні умови для реалізації максимально можливого ефекту антибластомної дії, що відповідає принципам абластики хірургічних втручань.
Таким чином, попередні результати дослідження показали, що комбінований метод лікування РШМ ІІВ стадії з використанням неоад’ювантої ХТ дозволяє зменшити кількість ускладнень, які виникають при застосуванні на передопераційному етапі ПТ. За безпосередніми результатами лікування та лікувальним патоморфозом застосування ХТ на передопераційному етапі не поступається передопераційній хіміопроменевій терапії.
У 2 (6,4%) пацієнток І групи та 3 (8,3%) ІІ групи не вдалося перевести процес з неоперабельного в операбельний, було призначено повний курс поєднано-променевої терапії.
Інтраопераційні ускладнення не спостерігали в обох групах. Основними післяопераційними ускладненнями були заочеревинні лімфатичні кісти. Як видно з рис. 6, частота виникнення післяопераційних ускладнень у досліджуваних групах становили: І група — 12 (38,7%) хворих, ІІ — 14 (38,9%). Отже, достовірної різниці в показниках післяопераційних ускладнень не відзначено. Післяопераційної летальності в обох групах не було.
Терміни спостереження за досліджуваними хворими дозволили визначити показники 3-річної безрецидивної виживаності. Оцінку виживаності проводили за методом Каплана — Мейєра. 3-річна безрецидивна виживаність (рис. 7) в І групі становила 77,4%, у ІІ групі — 86,1% та в ІІІ групі — 58%.

Як видно з рис. 8, кількість хворих, у яких виникли рецидиви РШМ, становить 9,7% у І групі, 8,3% — у ІІ та 16,7% — у ІІІ групі хворих. У І групі зареєстровано 3 хворих з латеральними тазовими рецидивами, у яких в післяопераційному матеріалі було виявлено метастатичне ураження лімфатичних вузлів (рТ2bN1Mo — ІІІ стадія захворювання). ІІ група — 3 хворих із рецидивами: 2 латеральні тазові рецидиви, які також виникли у хворих із рТ2bN1Mo (ІІІ стадія), 1 — з віддаленими метастази (в легені, парааортальні лімфатичні вузли). ІІІ група — 6 хворих із рецидивами: 4 — латеральні тазові рецидиви, 2 — віддалені метастази в поперековий відділ хребта та печінку.

Висновки
Застосування комбінованих методів лікування у хворих на РШМ ІІВ стадії покращило 3-річну безрецидивну виживаність у порівнянні з самостійною хіміопроменевою терапією. Так, при використанні передопераційної хіміопроменевої терапії 3-річна безрецидивна виживаність становила 77,4 і 86,1% із застосуванням неоад’ювантних курсів ХТ порівняно з хіміопроменевою терапією (58%).
Література
1. Рак в Україні, 2009–2010. Захворюваність, смертність, показники діяльності онкологічної служби (2011) Бюл. Нац. Канцер-реєстру України, № 12: 57–58.
2. Вінницька А.Б. (2004) Неоад’ювантна хіміотерапія як складова частина комбінованого лікування хворих на рак шийки матки. Укр. мед. часопис, 3 (41): 95–98.
3. Воробйова Л.І., Гончарук І.В., Лук’янова Н.Ю., Чехун В.Ф. (2008) Клініко-морфологічні та молекулярні-біологічні фактори прогнозу у хворих на рак шийки матки. Онкология, 10(4): 382–388.
4. Коломиец Л.А., Важенин А.В., Чуруксаева О.Н. и др. (2005) Местно-распространенный рак шейки матки: возможности химиолучевого лечения. Совр. онкология, 7 (4): 231–238.
5. Морхов К.Ю., Нечушкина В.М., Кузнецов В.В. (2009) Актуальные вопросы хирургического лечения рака шейки матки. Практ. онкология, 10(2): 93–100.
6. Сухіна О.М., Міхновський О.А., Сухін В.С. та ін. (2006) Порівняльний аналіз ефективності різних схем комбінованого лікування хворих на рак шийки матки. Ядерна медицина, променева терапія, 2: 71–74.
7. Тюляндин С.А., Марьина Л.А. (2003) Химиолучевая терапия местно-распространенного рака шейки матки. Тезисы VII рос. онколог. конфер., Москва: 86–92.
8. Gadducci A., Teti G., Barsotti C. et al. (2010) Clinicopathological variables predictive of clinical outcome in patients with FIGO stage Ib2-Iib cervical cancer treated with cisplatin-based neoadjuvant chemotherapy followed by radical hysterectomy. Anticancer research, 30: 201–208.
9. Gonzales-Martin A., Gonzalez-Cortijo L., Carballo N. et al. (2008) The current role of neoadjuvant chemotherapy in the management of cervical carcinoma. Gynecol. оncol. 110 (3 Suppl. 2): S36–40.
10. Lissoni A., Colombo N., Pellegrino A. et al. (2009)A phase II, randomized trial of neoadjuvant chemotherapy comparing a three-drug combination of paclitaxel, ifosfamide, and cisplatin (TIP) versus paclitaxel and cisplatin (TP) followed by radical surgery in patients with locally advanced squamous cell cervical carcinoma: the SNAP-02 Italian Collaborative Study. Ann. Oncol. 20: 660–665.
11. Peter G., Rose M., Brian N. et al. (1999) Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. New Engl. J. Med., 340(15): 1144–1153.
12. Rose P.G. (2006) Concurrent chemoradiation for locally advanced carcinoma of the cervix: where are we in 2006? Ann. Oncol., 17 (Suppl. 10): 224–229.
13. Vale C., Tierney J., Stewart L. et al. (2008) Chemoradiotherapy for Cervical Cancer Meta-Analysis. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J. Clin. Oncol., 26: 5802–5812.
14. Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC). (2010) Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: individual patient data meta-analysis. Cochrane Database of Systematic Reviews, Issue 1. Art. No.: CD008285. DOI: 10.1002/14651858.CD008285.
15. Neoadjuvant chemotherapy with paclitaxel and cisplantin or carboplatin for patients with locally advanced uterine cervical cancer. (2011) Zhonghua Zhong Liu Za Zhi., 33(8): 616–20.
Химиотерапия в лечении больных раком шейки матки ІІВ стадии
Резюме. Представлены данные клинических исследований, которые обосновывают применение химиотерапии в комбинированном лечении больных раком шейки матки ІІВ стадии. Применение на первом этапе лечения платиносодержащих схем химиотерапии позволяет перевести первично нерезектабельные формы в резектабельные и улучшить 3-летнюю безрецидивную выживаемость к 77,4% при использовании предоперационной лучевой терапии и к 86,1% — с применением неоадъювантных курсов химиотерапии в сравнении с сочетанно-лучевой терапией, выживаемость при использовании которой составила 58%.
рак шейки матки, химиотерапия, комбинированное лечение.














Leave a comment