Комбинированная интерферонотерапия при первично-локализованной меланоме кожи
Кукушкина М.Н., Коровин С.И., Кукушкина С.Н., Фильчаков Ф.В., Шумилина Е.С., Паливец А.Ю., Лён А.Д.
Резюме. Вопрос об адъювантной терапии первично-локализованной меланомы кожи остается открытым. Применение интерферона-αα (ИФН-α) увеличивает безрецидивную выживаемость пациентов и мало влияет на общую. Учитывая потенциальный синергический эффект, возникающий в результате взаимодействия ИФН-α αи ИФН-γγ с рецепторами разных классов, вызывает интерес их сочетанное применение. В исследование включены больные с меланомой кожи ІВ-ІІС стадии после широкого иссечения первичной опухоли, рандомизированые в две группы: первая получала комбинированную терапию ИФН-αα2b и ИФН-γγ, вторая — терапию ИФН-αα2b . В процессе лечения в обеих группах исследована токсичность и изменения иммунологических показателей. В результате изучения 2-летней общей и безрецидивной выживаемости отмечена тенденция к улучшению отдаленных результатов в группе, где применена комбинация интерферонов.

Введение
В 1957 году Isaacs и Lindenman открыли и описали интерферон (ИФН) как фактор, способный индуцировать резистентность клеток к широкому спектру вирусов. ИФН представляют собой ряд близкородственных белков (гликопротеинов) с молекулярной массой от 18 000 до 25 000 Да, характеризующихся антивирусной активностью и являющихся посредниками в межклеточных взаимоотношениях [1].
ИФН обладают противовирусной, антипролиферативной, антигенмодулирующей и иммуномодулирующей активностью.
Противоопухолевая активность ИФН стала известна в начале 70-х годов прошлого столетия, что положило начало исследованиям интерферонотерапии при различных онкологических заболеваниях. Противоопухолевая активность ИФН осуществляется за счет подавления пролиферации опухолевых клеток и неоангиогенеза, стимуляции специфического иммунного ответа и неспецифической иммунной резистентности организма, усиления апоптоза, регулирующего влияния на механизмы дифференцировки злокачественных клеток [2].
Клиническое использование ИФН стало возможным в конце 70-х — начале 80-х годов прошлого века после создания рекомбинантных интерферонов, синтезируемых бактериальными или дрожжевыми клетками, в которые встроен в составе плазмиды или бактериофага ген соответствующего ИФН.
В настоящее время ИФН разделяют на 3 типа в соответствии с их структурными и функциональными особенностями [3]. К интерферонам І типа, называемым вирусными, относятся ИФН-α (ранее называемый лейкоцитарным), ИФН-β (ранее называемый фибробластным), ИФН-δ, ИФН-ε, ИФН-κ, ИФН-τ, ИФН-ω. К интерферонам ІІ типа — ИФН-γ, ранее известный как иммунный, а к интерферонам ІІІ типа — 3 недавно открытых ИФН-λ1–3 (табл. 1).
Таблица 1 Типы интерферонов человека
| Тип ИФН | Виды ИФН | Локус хромосомы | Источник | Подтипы | Рецепторы |
|---|---|---|---|---|---|
| Тип І | α | 9p21 | Лейкоциты | 13 | ИФН-αβR |
| β | Фибробласты | 1 | |||
| ε | Головной мозг, легкие, почки, тонкий кишечник | 1 | |||
| κ | Кератиноциты | 1 | |||
| ω | Лейкоциты | 1 | |||
| Тип ІІ | γ | 12p24 | Т-лимфоциты, натуральные киллеры | 1 | ИФН-γR |
| Тип ІІІ | λ1–3 | 19p13 | ? | 3 | ИФН-λR |
Примечание: ИФН-δ встречается только у свиней, а ИФН-τ — только у жвачных животных.
Большинство клеток организма, кроме эритроцитов и тромбоцитов, под воздействием различных факторов обладают способностью продуцировать тот или иной вид ИФН. На клеточной поверхности существует 3 типа рецепторов к ИФН: один — к ИФН-γ, другой — к ИФН-λ, третий — ко всем остальным.
Одним из наиболее перспективных для иммунотерапевтического воздействия онкологических заболеваний является меланома кожи. Это связано с высокой иммуногенностью опухоли, что подтверждается высокой частотой спонтанных регрессий меланомы (рис. 1); возникновением паранеопластической депигментации, ассоциированной с продолжительным течением метастатического процесса; развитием витилиго на фоне иммунотерапии; наличием в гистопрепаратах удаленных диспластических невусов и первичной меланомы лимфоидной инфильтрации. Данные иммунологических исследований свидетельствуют о существовании гуморального и клеточного иммунитета против аутологичной меланомы; охарактеризованы опухолевые антигены меланомы на молекулярном уровне [4].
Клинические исследования интерферонотерапии при генерализованной меланоме кожи были начаты в 1978 году. В результате более 10 исследований по применению ИФН-α объективные ответы были зафиксированы у 16,3% больных с отдаленными метастазами, при этом у 5% наблюдалась полная регрессия опухоли [5, 6].
Эти обнадеживающие результаты положили начало дальнейшим исследованиям, посвященным применению ИФН-α в адъювантном режиме. В 2010 г. опубликован метаанализ 14 рандомизированных исследований, проведенных с 1998 по 2008 гг., по сравнению эффективности ИФН-α с другими методами лечения или наблюдением у 8122 пациентов. Анализ продемонстрировал снижение относительного риска смерти среди больных, получавших ИФН, на 11% (95% ДИ 0,83–0,96; р=0,002), а относительного риска прогрессирования заболевания — на 18% (95% ДИ 0,77–0,87; р<0,001). В нескольких проспективных многоцентровых рандомизированных исследованиях отмечено увеличение 5-летней безрецидивной выживаемости на фоне терапии ИФН-α по сравнению с наблюдением на 9–11%. В то же время влияние на общую выживаемость подтверждено данными только двух исследований и одного метаанализа [7].
Данные о применении ИФН-γ менее многочисленны, чем ИФН-α, однако его высокая иммуномодулирующая активность послужила основанием для клинических исследований.
В 1990-х гг. Eastern Coopertive Group (ECOG) проведено исследование, в котором 98 больных с метастатической меланомой получали ИФН-γ в дозе от 0,01 мг/м2 до 0,9 мг/м2 в виде внутривенной 1-часовой инфузии трижды в неделю на протяжении 8 нед. Объективный ответ был отмечен у 4 больных (5%): у 2 — при введении ИФН-γ в дозе 0,01 мг/м2, у 1 — в дозе 0,5 мг/м2 и еще у 1 — в дозе 0,9 мг/м2 [8]. Продолжительность ответа составила от 5 до 58 мес. По данным других исследований, объективный ответ при лечении метастатической меланомы составляет от 4 до 10%, что свидетельствует о невысокой эффективности ИФН-γ при генерализованной форме меланомы кожи.
В 1986–1989 гг. Southwest Oncology Group (SWOG) проведено исследование SWOG 8642 по изучению эффективности ИФН-γ в адъювантном режиме у больных с первично-локализованной меланомой (ПЛМ) кожи высокого риска. В ходе исследования больные после широкого иссечения первичной опухоли рандомизированы в 2 группы: пациенты первой (58 человек) получали ИФН-γ по 0,2 мг/сут подкожно на протяжении 12 мес, второй (66 больных) — подлежали наблюдению. Исследование было досрочно прекращено, так как в исследуемой группе прогрессия заболевания имела место у 34 пациентов при медиане до прогрессирования 9,5 мес, а в контрольной группе — у 25 больных при медиане до прогрессирования 15,3 мес [9]. Дальнейшие исследования по применению ИФН-γ были прекращены, и к данному виду терапии при меланоме кожи относились скептически.
Учитывая возможный синергический эффект, возникающий в результате взаимодействия ИФН-α и ИФН-γ с рецепторами разных классов, вызывает интерес их сочетанное применение. Обнадеживающие результаты получены при внутриочаговом использовании комбинации ИФН-α и γ в лечении пациентов с раком кожи. В пилотном исследовании, в которое вошли 16 больных с рецидивным и местно-распространенным базально-клеточным и плоскоклеточным раком кожи, у 47% наблюдалась полная регрессия опухоли, у 40% — частичная регрессия и у 13% — стабилизация заболевания. Медиана продолжительности объективного ответа составила 38 мес. Среди больных, у которых отмечена полная регрессия опухоли, рецидив заболевания при последующем наблюдении отмечен только в одном случае [10].
Клинические исследования эффективности комбинации ИФН-α и ИФН-γ проводились также при почечно-клеточном раке с использованием двух режимов введения цитокинов — одновременного и последовательного. При одновременном применении ИФН двух типов отмечено повышение токсичности без очевидного терапевтического преимущества. В то же время последовательное применение этих препаратов у больных почечно-клеточным раком продемонстрировало более высокий терапевтический и иммуномодулирующий эффект [11].
Учитывая результаты вышеизложенных исследований, мы сочли целесообразным изучение комбинированной адъювантной интерферонотерапии в последовательном режиме у больных ПЛМ кожи с высоким риском прогрессирования заболевания.
Целью исследования является сравнение эффективности и токсичности комбинированной терапии ИФН-α и ИНФ-γ и монотерапии ИФН-α у больных ПЛМ кожи, а также изучение субпопуляционного состава лимфоцитов периферической крови (ЛПК), их активационного фенотипа и функциональной активности в процессе интерферонотерапии.
Объект и методы исследования
В исследование включен 71 больной с ПЛМ кожи туловища и конечностей (стадия ІВ–ІІС (Т1в–4вN0M0) согласно классификации AJCC 2002 г.), находившийся на лечении в отделении опухолей кожи и мягких тканей Национального института рака в 2008–2009 гг.
До начала лечения для оценки распространенности заболевания пациентам выполняли рентгенографию органов грудной полости, УЗИ органов брюшной полости и регионарных лимфатических узлов.
Лечение начинали с широкого иссечения первичной опухоли кожи (без выполнения биопсии «сторожевого» лимфатического узла). После гистологического подтверждения диагноза меланомы кожи и при толщине опухоли по Breslow более 1 мм и/или ее изъязвлении, либо IV–V уровне инвазии по Кларку больные рандомизированы в основную и контрольную группы. Характеристика больных по полу, возрасту, локализации первичной опухоли, истадии заболевания представлена в табл. 2.
Таблица 2 Характеристика пациентов
| Характеристика | Основная группа (ИФН-α и ИФН-γ) | Контрольная группа(ИФН-α) | |
|---|---|---|---|
| Пол | Мужчины | 9 (27,3%) | 11 (28,9%) |
| Женщины | 24 (72,7%) | 27 (71,1%) | |
| Возраст | 18–30 лет | 2 (6,1%) | 0 (0%) |
| 31–50 лет | 11 (33,3%) | 10 (26,3%) | |
| > 50 лет | 20 (60,6%) | 28 (73,7%) | |
| Локализация опухоли | Конечности | 16 (48,5%) | 21 (55,3%) |
| Туловище | 17 (51,5%) | 17 (44,7%) | |
| Средняя толщина опухоли по Breslow, мм | 3,0± | 3,0± | |
| Стадия заболевания | ІВ | 6 (18,2%) | 14 (36,8%) |
| ІІА | 14 (42,4%) | 7 (18,4%) | |
| ІІВ | 9 (27,3%) | 10 (26,4%) | |
| ІІС | 4 (12,1%) | 7 (18,4%) | |
Больным основной группы (33 человека) через 8–10 дней после операции начинали терапию ИФН-γ, который вводили в 1, 3, 5, 7, 9-й дни лечения подкожно в область послеоперационного рубца по 500 тыс. ЕД. С 11-го дня лечения назначался ИФН-α2b подкожно по 3 млн МЕ трижды в неделю в течение12 мес.
Больным контрольной группы (38 человек) через 8–10 дней после операции назначали ИФН-α2b подкожно по 3 млн МЕ трижды в неделю в течение 12 мес.
Изучена токсичность лечения в основной и контрольной группах, а также 2-летняя общая и безрецидивная выживаемость.
Иммунологические исследования проведены у 40 пациентов (20 больных основной группы и 20 контрольной) на 4 этапах лечения: 1-й — перед хирургическим вмешательством; 2-й — через 8–10 дней после хирургического лечения и до начала интерферонотерапии; 3-й — после курса ИФН-γ (основная группа) или после 5 инъекций ИФН-α2b (контрольная группа); 4-й — через 3 мес от начала курса терапии ИФН-α2b.
Изучено содержание основных популяций ЛПК (CD3-, CD4-, CD8-, CD19-, CD16-антигены) и их активационный фенотип (CD95-, CD25-, CD69-, HLA-DR-антигены), естественных регуляторных Т-клеток (Трег, CD4+25high127low-neg), а также митоген-индуцированную пролиферацию и цитотоксическую активность ЛПК.
Функциональную активность ЛПК изучали в реакции бласттрансформации лимфоцитов (РБТЛ) и цитотоксическом тесте. РБТЛ выполняли морфологическим методом с использованием фитогемагглютинина (ФГА, «Sigma», Германия) в концентрациях 10 и 20 мкг/мл. Результаты выражали в процентах бласттрансфорованных клеток. Цитотоксическую активность ЛПК определяли методом проточной цитофлуориметрии с использованием клеток-мишеней линии К-562. Результат выражали цитотоксическим индексом (ЦИ) в процентах. Учет результатов цитотоксической активности и фенотипирования ЛПК проводили на проточном цитофлуориметре FACScan («BectonDickinson», США) с использованием программы «CellQuest».
Было обследовано 35 практически здоровых людей (ПЗЛ) в той же возрастной группе.
Статистическая обработка полученных данных проведена с использованием программ Excel (MS Office 2003, XP) и STATІSTІCA 6,0 (StatSoft Inc., США). Результаты иммунологических показателей представлены в виде среднего арифметического значения и его стандартной ошибки. Для определения достоверности расхождений (р) показателей независимых групп применены критерий Манна — Уитни, показателей группы в динамике лечения — одновыборочный критерий Уилкоксона. Показатели выживаемости рассчитывали по методу Каплана — Мейера.
Результаты и их обсуждение
В обеих группах имели место типичные для интерферонотерапии осложнения: гриппоподобный синдром (повышение температуры тела, озноб, головная боль, миалгия), местная эритематозная реакция и общая слабость (табл. 3).
Таблица 3 Основные проявления токсичности лечения в основной и контрольной группах
| Показатели | Основная группа | Контрольная группа | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Степень токсичности | Степень токсичности | |||||||||
| 0 | I | II | III | IV | 0 | I | II | III | IV | |
| Гемоглобин | 25 (75,8%) | 8 (24,2%) | – | – | – | 28 (73,7%) | 10 (26,3%) | – | – | – |
| Лейкоциты | 31 (93,9%) | 2 (6,1%) | – | – | – | 34 (89,5%) | 4 (10,5%) | – | – | – |
| Тромбоциты | 32 (97,0%) | 1 (3,0%) | – | – | – | 36 (94,7%) | 2 (5,3%) | – | – | – |
| Тошнота | 33 (100%) | – | – | – | – | 37 (97,4%) | 1 (2,6%) | – | – | – |
| Температура | 9 (27,3%) | 24 (72,7%) | – | – | – | – | 2 (5,3%) | 19 (50,0%) | 17 (44,7%) | – |
| Кожная реакция | 14 (42,4%) | 19 (57,6%) | – | – | – | 16 (42,1) | 22 (57,9%) | – | – | – |
Наиболее частым осложнением в обеих группах была гипертермия, возникающая через несколько часов после введения препарата и в большинстве случаев купирующаяся в течение 2 нед. Однако в основной группе гипертермия и озноб не превышали І степени как во время терапии ИФН-γ, так и при последующем назначении ИФН-α2b, и зафиксированы у 24 больных (72,7%). В контрольной группе гипертермия достигала II–III степени в 100% случаев и требовала применения жаропонижающих средств.
Гематологическая токсичность встречалась в обеих группах у небольшого числа больных в возрасте старше 60 лет, не превышала І–ІІ степени и не требовала прерывания лечения.
Изучение иммунного статуса у больных ПЛМ в процессе интерферонотерапии показало, что у больных контрольной группы после полного курса ИФН-α2b достоверно уменьшается абсолютное количество цитотоксических Т-лимфоцитов (CD8+-лимфоцитов) по сравнению с показателем у ПЗЛ (р<0,05), и снижается их процентное содержание по отношению к исходному уровню и физиологическим значениям (р<0,05). При последовательном применении ИФН-γ и ИФН-α2b содержание этих клеток не претерпевает существенных изменений.
В то же время количество других основных популяций ЛПК существенно не изменяется в процессе лечения как в основной, так и контрольной группах.
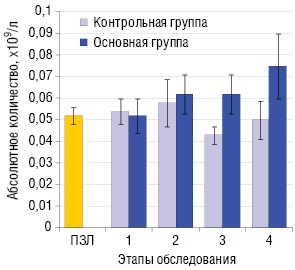
Определение абсолютного количества Трег в периферической крови больных ПЛМ показало, что в начале лечения этот показатель не выходит за пределы физиологических значений. В процессе интерферонотерапии в основной группе (последовательное введение ИФН-γ и ИФН-α2b) наблюдается тенденция к увеличению абсолютного количества Трег, а в контрольной (только ИФН-α2b) напротив — к снижению (рис. 2).
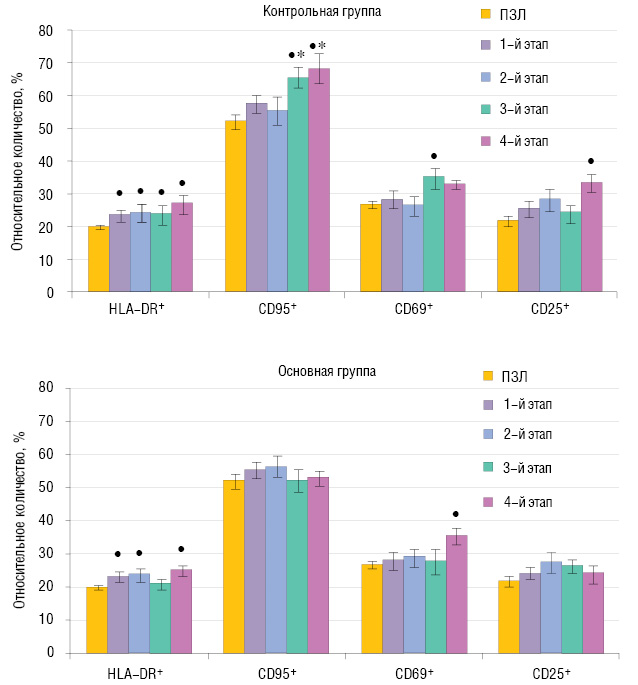
Анализ экспрессии маркеров активации на циркулирующих лимфоцитах показал, что до лечения у больных обеих исследуемых групп достоверно увеличено относительное количество клеток, экспрессирующих HLA-DR. Курс ИФН-α2b, проведенный больным контрольной группы (3–4 этапы), не влияет на содержание HLA-DR+-лимфоцитов. У больных основной группы после курса ИФН-γ количество HLA-DR+-лимфоцитов снижается до нормальных значений, однако после 3 мес терапии ИФН-α2b возвращается к исходному уровню. Относительное количество лимфоцитов, экспрессирующих CD69-, CD25- и CD95-антигены, до лечения практически не отличается от нормы. Повышение экспрессии маркера CD69 на лимфоцитах происходит у больных контрольной группы после 5 инъекций ИФН-α2b, а у больных основной группы — после 3-месячного курса ИФН-α2b. Содержание CD25+-лимфоцитов не изменяется в процессе интерферонотерапии у больных основной группы, в то время как у больных контрольной группы наблюдается достоверное увеличение этого показателя на 4-ом этапе обследования. Количество лимфоцитов, экспрессирующих CD95, у больных контрольной группы превышает физиологические значения после 5 инъекций ИФН-α2b и сохраняется на высоком уровне до конца наблюдения. Напротив, у больных основной группы относительное количество CD95+-лимфоцитов не изменяется в процессе интерферонотерапии, а на 3–4-ом этапе существенно снижено по сравнению с показателем у больных контрольной группы (рис. 3).
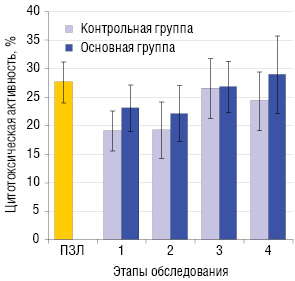
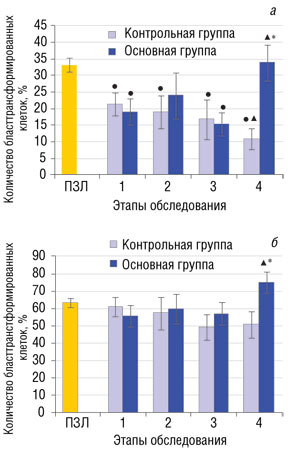
У больных ПЛМ до начала лечения регистрируется сниженная (р>0,05) цитотоксическая активность лимфоцитов. Применение обеих схем интерферонотерапии способствует улучшению этого показателя как в контрольной, так и основной группах (рис. 4).
До лечения у больных контрольной и основной групп пролиферативный ответ лимфоцитов на ФГА в концентрации 20 мкг/мл не отличается от нормы, в тоже время регистрируется достоверное снижение ответа на ФГА в концентрации 10 мкг/мл. Последовательное применение ИФН-γ в сочетании с ИФН-α2b у больных ПЛМ приводит к усилению пролиферации лимфоцитов в ответ на ФГА (в концентрациях 10 и 20 мкг/мл) по сравнению с таким до лечения и показателем у больных контрольной группы на 4-ом этапе обследования. У больных контрольной группы через 3 мес от начала курса ИФН-α2b (4-й этап) наблюдается существенное снижение ответа лимфоцитов на ФГА в концентрации 10 мкг/мл (рис. 5).
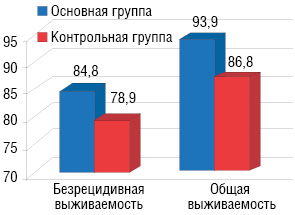
В обеих группах изучалась 2-летняя общая и безрецидивная выживаемость (рис. 6). Безрецидивная выживаемость больных основной группы составила 84,8±6,2% , контрольной — 78,9%±6,6%. Общая выживаемость в основной группе составила 93,9±4,1%, в контрольной — 86,8±5,4%. Различия между этими показателями статистически не достоверны (р>0,05).
Выводы
1. Обе схемы интерферонотерапии относительно хорошо переносятся пациентами. Наиболее частым проявлением токсичности является гипертермия, которая носит кратковременный характер, хорошо купируется приемом жаропонижающих средств и не требует прерывания лечения.
2. Представленные схемы интерферонотерапии по-разному влияют на иммунологические показатели у больных ПЛМ. Последовательное применение ИФН-γ и ИФН-α2b в адъювантном режиме у больных ПЛМ не оказывает существенного влияния на экспрессию активационных антигенов на лимфоцитах, в тоже время повышает их пролиферативный ответ на митоген in vitro и несколько увеличивает абсолютное количество циркулирующих Трег. Применение только ИФН-α2b существенно увеличивает экспрессию CD95-антигена на лимфоцитах, снижает митоген-индуцированную пролиферацию клеток и незначительно снижает абсолютное количество Трег в крови. Обе схемы интерферонотерапии способствуют улучшению цитотоксической активности лимфоцитов.
3. Изучение показателей общей и безрецидивной выживаемости позволяет сделать вывод о тенденции к улучшению отдаленных результатов в группе, где применена комбинация интерферонов.
Литература
1. Кузнецов В.П. (1998) Интерферон в каскаде цитокинов: исторические и современные аспекты. Антибиотики и химиотерапия, 5: 28–40.
2. Воронцова А.Л., Кудрявец Ю.И., Жильчук В.И. (2003) Интерфероны и их применение в клинической онкологии. Здоровье женщины, 4 (16): 8–12.
3. Шмелёв В.А. (2008) Интерферон-гамма, фактор некроза опухолей, тимозин-альфа1 — противоинфекционные и противоопухолевые цитокины и препараты. Москва, Медпрактика-М, 536с.
4. Биологические методы лечения онкологических заболеваний: принципы и практическое применение. Пер. с англ. / Под ред. В.Т. ДеВита, С. Хелманна, С.А. Розенберга. Москва, Медицина, 2002: 936с.
5. Kirkwood J.M., Ernstoff M.S., Davis S.A. et al. (1985) Comparison of intramuscular and intravenous of recombinant alpha-2 interferon in melanoma and other cancers. Ann. Intern. Med., 1 (103): 32–36.
6. Dorval T., Palangie T., Jouve M. et al. (1986) Clinical phase II trial of recombinant DNA interferon (interferon alpha-2b) in patients with metastatic malignant melanoma. Cancer, 2 (58): 215–218.
7. Mocellin S., Pasquali S., Rossi C.R. et al. (2010)Interferon alpha adjuvant therapy in patients with high risk melanoma: a system atic review and metaanalysis. J. Natl. Cancer Inst., 7 (102): 493–501.
8. Schiller J.H., Pugh M., Kirkwood J.M. et al. (1996) Eastern Cooperative Group Trial of interferon gamma in metastic melanoma: an innovative study design. Clin. Cancer. Res., 2: 29–36.
9. Meyskens F.L., Kopecky K., Samson S. et al. (1990) Recombinant human interferon-γ: adverse effects in high-risk stage I and II cutaneous malignant melanoma. J. Nat. Canc. Inst., 12 (82): 1071.
10. Anasanagasti L., Garcia Vega Y., Barcelona-Perez S. et al. (2009) Treatment of advanced, recurrent, resistant to previous treatments of basal squamous cell skin carcinomas with synergistic formulation of interferons. BMC Cancer., 9: 1–12.
11. Ernstoff M.S., Gooding W., Nair S. et al. (1992) Immunological effects of treatment with sequentical administration of recombinan tinterferon gamma and alpha in patients with metastatic renal cell carcinoma during a phase I trial. CancerRes., 52: 851–856.
Комбінована інтерферонотерапія при первинно-локалізованій меланомі шкіри
Резюме. Питання щодо ад’ювантної терапії первинно-локалізованої меланоми шкіри залишається відкритим. Застосування інтерферону-α (ІФН-α) збільшує безрецидивну виживаність хворих та несуттєво впливає на загальну. Враховуючи потенційний синергічний ефект, що виникає в результаті взаємодії ІФН-α та ІФН-γ з рецепторами різних класів, з’являється інтерес до їх сумісного застосування. У дослідження включені хворі на меланому шкіри ІВ–ІІС стадії після широкого висічення первинної пухлини, які рандомізовані в дві групи: перша отримувала комбіновану терапію ІФН-α2b та ІФН-γ, друга — терапію ІФН-α2b. У процесі лікування в обох групах досліджена токсичність та зміни імунологічних показників. У результаті вивчення 2-річної загальної та безрецидивної виживаності відзначена тенденція до покращення віддалених результатів в групі, де застосована комбінація інтерферонів.
Ключові слова: меланома шкіри, ад’ювантна терапія, інтерферон-α2b, інтерферон-γ.
Combined interferonotherapy for primary localized skin melanoma
Summary. The question about adjuvant therapy for localized skin melanoma remains open. The use of interferon-α (IFN-α) increases disease-free survival and has little effect on the overall survival. Given the potential synergies arising from the interaction of IFN-α and IFN-γ with different classes receptors, calls the interest of the combined use. The study included patients with melanoma stage IB–IIC after wide excision of the primary tumor, which were randomized into two groups: one received a combination therapy of IFN-α2b and IFN-γ, the second — therapy with IFN-α2b. In the course of treatment in both groups studied the toxicity and changes in immunological parameters. A study of 2-year overall and disease-free survival showed a tendency to improve long-term results in the group, which used a combination of interferon.
Key words: skin melanoma, adjuvant therapy, interferon-α2b, interferon-γ.














Leave a comment