Терапевтические стратегии при неоперабельном метастатическом колоректальном раке
B. Chibaudel, Tournigand C., André T., A. de Gramont
Резюме. В то время как хирургическое вмешательство является базовым лечением колоректального рака на ранней стадии, химиотерапия остается терапией первой линии для метастатического рака, когда хирургическим путем полностью удалить опухоль не представляется возможным. За последние 30 лет наблюдается четкая тенденция к снижению смертности от рака толстой кишки, однако также отмечается разная выживаемость, что можно объяснить различиями в характеристиках пациента и опухоли, стратегиями терапии и другими факторами, влияющими на клинический ответ. Ведение пациентов с неоперабельным метастатическим раком толстой кишки предполагает разработку глобальной терапевтической стратегии, которая может включать несколько линий терапии, симптоматические оперативные вмешательства, поддерживающее лечение и периоды, свободные от активной терапии. Индивидуализация противораковой терапии базируется на оценке прогностических факторов выживаемости (уровень лактадегидрогеназы, общая оценка состояния) и предикторных факторов для эффективности терапии (статус мутации гена KRAS). Одними из доступных на сегодняшний день методов лечения метастатического колоректального рака являются химиотерапия (фторпиримидин, оксалиплатин, иринотекан), антиангиогенные агенты (бевацизумаб) и антиэпидермальные факторы роста (цетуксимаб, панитумумаб). Увеличивающееся количество активных противораковых химических соединений побуждает ученых к проведению клинических исследований, направленных на оценку эффективности их использования как в комбинации с уже известными препаратами, так и в виде монотерапии на определенном этапе лечения. В то же время для уменьшения длительности и снижения стоимости таких исследований необходима постановка иных альтернативных конечных точек, которые могут быть измерены ранее, чем общая выживаемость.
Введение
Колоректальный рак является третьим по частоте заболеваемости и смертности видом злокачественных опухолей в странах Запада [25]. Основным параметром, который используется для прогнозирования выживаемости или рецидива, является стадия опухолевого процесса [2]. В то время как хирургическое вмешательство является базовым лечением для рака на ранней стадии (стадия I–III), химиотерапию принято считать основным видом терапии для метастатического рака (стадия IV) при отсутствии возможности полной резекции опухоли. Приблизительно у ⅓ пациентов с метастатическим колоректальным раком (МКРР) имеет место метахроническое течение заболевания, которое определяется как наличие промежутка времени более 1 года между возникновением первичной опухоли и метастазов. Смертность от рака толстой кишки за последние 30 лет значительно снизилась, что частично объясняется применением более эффективных методов лечения. Причинами разной выживаемости, скорее всего, являются характеристики пациента и опухоли, терапевтические стратегии (препараты, режим, хирургическое удаление метастазов) и другие факторы, влияющие на клинический ответ.
Данный обзор сфокусирован на ведении пациентов с нерезектабельным МКРР.
Прогностические факторы
Существуют несколько параметров, являющихся независимыми прогностическими факторами для МКРР. В первую очередь речь идет о таких характеристиках пациента, как общее состояние (ОС), определенное ВОЗ, возраст, пол, потеря массы тела, а также о биологических переменных — количестве лейкоцитов, уровне алкалинфосфатазы (АЛФ), лактатдегидрогеназы (ЛДГ), карциноэмбрионального антигена (КЭА) и таких характеристиках опухоли, как количество очагов метастазирования или вовлеченность печени в патологический процесс.
В зависимости от четырех базовых прогностических параметров (ОС, количество лейкоцитов, уровень АЛФ и количество очагов метастазирования) у пациентов с МКРР, получающих химиотерапию на основе 5-фторурацила (5-ФУ), выделяют 3 группы риска относительности смерти [46].
Также недавно мультидисциплинарная группа ученых из Франции разработала прогностическую шкалу (GERCOR prognostic scale) для пациентов, проходящих химиотерапию на основе оксалиплатина или иринотекана. Эта модель базируется на определении перед началом терапии 2 наиболее важных прогностических факторов, таких как уровень ЛДГ и ОС. Медиана выживаемости у пациентов с ОС0 и нормальным ЛДГ в два раза выше, чем у лиц с плохим прогнозом (ОС1 и ЛДГ>1N или ОС2) [8].
Противоопухолевые препараты
Химиотерапия
Для терапии МКРР доступны три цитотоксических препарата: фторпиримидин, оксалиплатин и иринотекан. Эти препараты применяются как в комбинации (фторпиримидин/оксалиплатин [16, 26, 17], 5-ФУ/иринотекан [66, 19, 23] 5-ФУ/оксалиплатин/иринотекан [22]), так и в виде монотерапии (фторпиримидин) [13, 72].
Молекулярные таргетные агенты
Антиангиогенные агенты. Ангиогенез, формирование новых кровеносных сосудов, задействован в пролиферации опухолевых клеток и, таким образом, является мишенью для противоопухолевой терапии. Васкулярный эндотелиальный фактор роста (VEGF), растворимый гликопротеин продуцируется нормальными и неопластическими клетками и является важным регуляторным фактором физиологического и патологического ангиогенеза. Повышенные уровни экспрессии VEGF обнаруживаются в большинстве видов человеческих злокачественных новообразований.
Бевацизумаб (Авастин) является рекомбинантным гуманизированным моноклональным lgG1 антителом, влияющим на активность VEGF. Добавление бевацизумаба к химиотерапии улучшает клинические исходы у пациентов с МКРР. При этом также наблюдаются нечастые специфические побочные эффекты, связанные с приемом этого препарата, такие как кровотечение, гипертензия, фистулы, гастроинтестинальная перфорация, артериальные тромбоэмболические события и протеинурия. Возникновения гипертензии и протеинурии, скорее всего, ассоциировано с дозой. В редких случаях регистрировался синдром задней лейкоэнцефалопатии.
Афлиберцепт является исследовательским (то есть не одобренным FDA) химерным белком, предназначенным для лечения рака (колоректального рака, рака легких и предстательной железы) и мокрой макулярной дегенерации. Этот препарат связывает циркулирующие в кровяном русле и экстраваскулярном пространстве VEGF-A, VEGF-B и плацентарный фактор роста с большей аффиностью, чем их нативные рецепторы.
Антиэпидермальный фактор роста (анти-ЭФР). Цетуксимаб является химерным человеческим-мышиным моноклональным антителом к рецепторам анти-ЭФР. Панитумумаб является полным человеческим анти-ЭФР моноклональным антителом. В исследованиях изучалась эффективность монотерапии этими двумя препаратами, а также их комбинированное использование с химиотерапией на основе оксалиплатина и иринотекана при паллиативной терапии. В этих работах продемонстрировано, что клинический ответ и увеличение беспрогрессивной выживаемости (БВ) при такой терапии выражен только у пациентов с KRAS опухолями [51]. Таким образом, наличие гена KRAS является негативным предикторным маркером для активности анти-ЭФР-агентов. Также с целью выявления категории пациентов, наиболее восприимчивых к этому виду терапии, можно провести дополнительное тестирование на наличие других раковых генов, таких как BRAF (serine/threonine-protein kinase B-RaF) и NRAS (neuroblastoma N-Rras) [18, 50, 43]. В отличие от антиангиогенных агентов, анти-АЭФ сохраняют или даже повышают свою эффективность при их использовании в терапии второй и третьей линии, что проявляется в виде увеличения выживаемости. Это предполагает, что если целью терапии является увеличение выживаемости, выбор будет в пользу анти-АЭФ-агентов.
Терапия первой линии
Химиотерапия на основе иринотекана или оксалиплатина
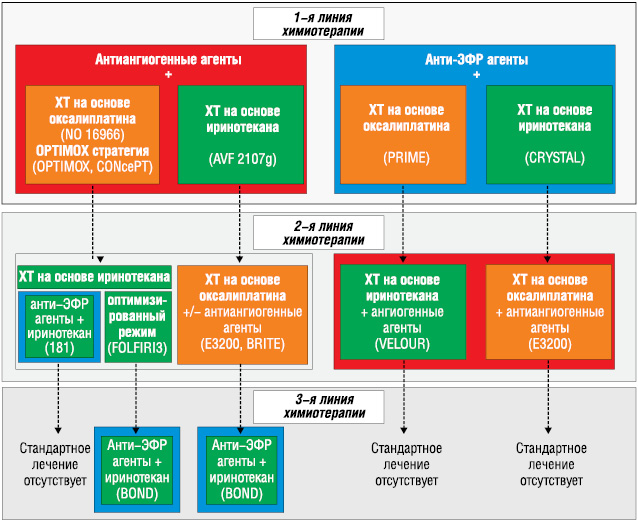
Выбор химиотерапии первой линии на основе иринотекана или оксалиплатина являлется предметом дискуссий. Так, исследование С97-3 было первой научной работой с прямым сравнением оксалиплатина или иринотекана с лейковорином/5-ФУ [66]. Его результаты не показали значимых различий между FOLFIRI (лейковорин/5-ФУ/иринотекан) и FOLFOX6 (лейковорин/5-ФУ/оксалиплатин) в качестве терапии первой линии по показателям уровня клинического ответа 54 и 56% и БВ 8,4 и 8,0. Эти результаты подтвердились и в другом исследовании [10]. Основным отличием этих двух комбинаций является профиль токсичности. Гастроинтестинальные побочные эффекты III и IV степени тяжести (тошнота, рвота, мукозит) и алопеция встречались значительно чаще в группе FOLFIRI, в то время как нейтропения и нейропатия — в группе FOLFOX.
Преимущества FOLFIRI в качестве терапии первой линии заключаются в меньшем количестве тяжелых побочных эффектов и лучшей активностью FOLFOX во второй линии терапии (клинический ответ 15 и 4% соответственно; БВ 4,9 и 2,3 мес соответственно), в то время как использование FOLFOX в первой линии даст меньшее количество тяжелых побочных эффектов, большее количество пациентов, которые смогут получить хирургическое лечение для удаления метастазов и меньшее количество циклов химиотерапии для достижения одинаковых результатов. Главной причиной отмены оксалиплатина была кумулятивная нейросенсорная токсичность у пациентов без прогрессирования заболевания. Таким образом, потенциал FOLFOX терапии может быть улучшен при лечении оксалиплатин-индуцированной нейропатии. Более того, различия в инцидентности в тяжелых побочных эффектах (G3–G4) возникли вследствие нейтропении, которая в большинстве случаев не является клинически значимой.
Антиангиогенные агенты или анти-ЭФР агенты в комбинации как терапия первой линии
Анти-ангиогенные агенты как терапия первой линии. Добавление бевацизумаба к химиотерапии на основе оксалиплатина (N016966) или иринотекана (AVF2107g) улучшает выживаемость [59, 36]. Следует отметить, что эти улучшения преимущественно наблюдались при диких типах и мутированных KRAS МКРР [58]. Таким образом, KRAS тестирование не обязательно для отбора пациентов с МКРР для прохождения терапии бевацизумабом. При этом больше преимуществ наблюдалось при использовании иринотекана (ОР=0,54), чем оксалиплатина (ОР=0,83). Это можно объяснить более выраженным синергическим действием иринотекана и бевацизумаба или более пролонгированным введением бевацизумаба в исследовании по иринотекану (AFG2107g). В клиническом испытании по оксалиплатину (N016966) большое число пациентов прекратили лечение, чем было разрешено по исследовательскому протоколу. Терапию прекратили вследствие прогрессии только у 29% пациентов из группы бевацизумаба и у 47% из группы плацебо. Преимущества бевацизумаба были более выражены в БВ анализе (ОР=0,63): если события возникали более 28 дней после прекращения терапии, регистрировалась последняя известная дата, когда прогрессирования не наблюдалось.
Добавление бевацизумаба к терапии фторпиримидином также значимо улучшало БВ. Исследование AVF2192g пополнило доказательную базу по высокой эффективности комбинации с 5-ФУ/лейковорином, хотя характеристики выборки отличались от таковой в AVF2107g (в исследование брали пациентов, которые не подходили для терапии первой линии иринотеканом) [41]. Медиана БВ увеличилась с 5,5 до 9,2 мес (ОР=0,50) и медиана ОВ — с 12,9 до 16,6 мес (ОР=0,79). В исследовании MAX бевацизумаб использовался в сочетании с капецитабином [63]. Согласно результатам медиана БВ увеличилась с 5,7 до 8,5 мес (ОР=0,63), однако медиана ОВ была одинаковой среди двух исследуемых групп (ОР=0,87).
Ваталаниб и цедираниб, тирозинкиназные ингибиторы рецепторов VEGF, неоднократно оценивались в качестве препаратов для терапии первой линии МКРР. В исследовании CONFIRM1 принимали участие 1168 пациентов, которые были рандомизированы на две группы с назначением FOLFOX4 в сочетании с ваталанибом или плацебо [31]. В целом, не было обнаружено значимых различий в уровне клинического ответа, БВ (ОР=0,88) и ОВ (ОР=1,08) у пациентов, принимавших ваталаниб, в сравнении с контролем. Однако БВ при приеме ваталаниба была более длительной у пациентов с изначально высоким уровнем ЛДГ (ОР=0,67) [60]. В клиническом испытании HORIZON III (1422 пациента) прямое сравнение цедираниба и бевацизумаба в сочетании с модифицированной схемой FOLFOX6 не показало значимых отличий между этими препаратами в плане эффективности (ОР=0,96; ОРБВ=1,10; ОРОВ=0,94). Кроме того, терапия на основе бевацизумаба имела более приемлемый профиль токсичности с менее выраженной диареей и нейтропенией.
Анти-ЭФР-агенты в качестве терапии первой линии
У пациентов с опухолями, имеющими дикий (не мутированный) тип гена KRAS, добавление цетуксимаба к FOLFIRI (CRYSTAL) или FOLFOX (OPUS) приводило к улучшению в БВ (ОР=0,68 и 0,54 соответственно) [69, 4]. Похожие результаты были получены при добавлении панитумумаба к FOLFOX (PRIME) [20]. В этой научной работе наряду с улучшением БВ в экспериментальной группе определялось также отсутствие значимого различия между группами в ОВ (ОР=0,83; р=0,07). В то же время в клиническом испытании CRYSTAL ученые зарегистрировали значимое улучшение ОВ (медиана увеличилась на 3,5 мес) при использовании указанной комбинации. Следует отметить, что в последнем случае данные были получены при помощи ретроспективного анализа, и информация о количестве пациентов в контрольной группе, принимавших цетуксимаб в качестве терапии первой линии, отсутствовала. Ограниченное количество переходных пациентов (принимавших цетуксимаб во второй и третьей линии) в контрольной группе может объяснить эти преимущества цетуксимаба при первой линии терапии (табл. 1).
Таблица 1 Рандомизированные исследования в первой линии терапии МКРР у пациентов с диким типом KRAS
| Исследование | ОКТ | Режим | N | KRAS тестирование (%) |
УКО (%) | БВ (месяцы) | ОВ (месяцы) |
|---|---|---|---|---|---|---|---|
| AVF2107g [36] | ОВ | IFL ± Бев | 67/85 | 28 | 37/60 (+23%) | 7,4/13,5 (ОР=0,44) | 17,6/22,7 (ОР=0,58) |
| PACCE [30] | БВ | Окс + Бев Ирин | 20358 | 82 | 5648 | 12,513,5 | 19,827,7 |
| CAIRO [64] | БВ | XELOX + Бев | 156 | 71 | 50 | 10,6 | 22,4 |
| CRYSTAL [69] | БВ | FOLFIRI ± ЦТК | 350/316 | 89 | 40/57 (+17%) | 8,4/9,9 (ОР=0,70) | 20,0/23,5 (ОР=0,80) |
| OPUS [4] | УКО | FOLFOX ± ЦТК | 73/61 | 69 | 37/61 (+24%) | 7,2/7,7 (ОР=0,57) | 18,5/22,8 (ОР=0,85) |
| PRIME [20] | БВ | FOLFOX ± Пмаб | 331/325 | 93 | 48/55 (+7%) | 8,0/9,6 (ОР=0,80) | 19,7/23,9 (ОР=0,83) |
| COIN [54] | ОВ | Окс ± ЦТК | 367/362 | 81 | 57/64 (+7%) | 8,6/8,6 (ОР=0,96) | 17,9/17,0 (ОР=1,38) |
| NORDIC VII [68] | БВ | FLOX ± ЦТК | 97/97 | 88 | 47/66 (-1%) | 8,7/7,9 (ОР=1,07) | 22,0/20,1 (ОР=1,14) |
Бев — бевацизумаб; ЦТК — цетуксимаб; ОКТ — основная конечная точка; ОР — относительный риск; KRAS — протоонкоген из семейства белков RAS; N — количество пациентов; БВ — беспрогрессивная выживаемость; ОВ — общая выживаемость; Пмаб — панитумумаб; УКО — уровень клинического ответа.
Иные данные были получены в двух других трехфазных клинических испытаниях [54, 68]. В исследовании COIN 1630 пациентов рандомизировали для получения химиотерапии на основе оксалиплатина [FOLFOX или XELOX (капецитабин + оксалиплатин)] или ее сочетания с цетуксимабом. Третьей группе назначили интермиттирующую химиотерапию. В клиническом испытании NORDIC VII 571 пациента случайным образом распределили с назначением FLOX терапии до прогрессирования заболевания или тяжелой токсичности или комбинации этой терапии с цетуксимабом. Третья группа пациентов получала интермиттирующую FLOX химиотерапию в комбинации с цетуксимабом. В этих двух научных работах БВ и ОВ у пациентов с диким типом KRAS опухолей значимо не отличались среди изучаемых групп (COIN: ОРБВ=0,96, ОРОВ=1,04; NORDIC VII: ОРБВ=1,07; ОРОВ=1,14). Следует отметить, что в исследовании NORDIC VII тип гена KRAS не влиял на эффективность терапии цетуксимабом.
Основываясь на этих данных, рано давать рекомендации о систематическом использовании анти-ЭФР антител в комбинации с оксалиплатином в виде терапии первой линии у пациентов с нерезектабельными метастазами с диким типом гена KRAS.
Добавление антиангиогенных и анти-ЭФР агентов к химиотерапии имеет негативное влияние на выживаемость в сравнении с химиотерапией в комбинации с бевацизумабом [30, 64].
Терапия второй линии
Большинству пациентов при прогрессировании или неприемлемой токсичности терапии первой линии следует рекомендовать терапию второй линии. Существует несколько эффективных видов такой терапии. Однако наличие знаний о наиболее активных препаратах второй линии не должно приводить к использованию субоптимальной терапии первой линии. В исследованиях показано, что воздействие на пациента всеми доступными агентами более важно, чем количество линий терапии [28]. Однако, основываясь на корреляции между процентом пациентов, которые получают все доступные препараты, и медианой выживаемости, если все пациенты получали все препараты, медиана выживаемости осталась бы лимитирована 22 мес. Новые стратегии, которые включают использование таргетных агентов или оксалиплатина в режиме stop-and-go, увеличивают медиану выживаемости до 22 мес и больше. В исследовании C97-3 применение FOLFIRI было менее эффективным при терапии второй линии у пациентов, которые ранее не ответили на терапию FOLFOX6, чем использование FOLFOX6 после FOLFIRI. Следует отметить, что в этом клиническом испытании 70% пациентов проходили терапию второй линии, а 13 и 7% из группы FOLFOX и FOLFIRI соответственно прошли радикальную (R0) резекцию метастазов.
Вторая линия терапии после химиотерапии на основе оксалиплатина
Химиотерапия. Препаратом выбора после недостаточного клинического ответа на терапию на основе оксалиплатина является иринотекан. Ожидаемый общий уровень клинического ответа и медиана БВ стандартной FOLFIRI терапии составляет 4–12% и 2,5–4,7 мес соответственно [66, 71, 55]. Эта схема была улучшена, основываясь на позитивном взаимодействии между иринотеканом и 5-ФУ, использовавшихся после инфузии 5-ФУ [37]. Как показано в нескольких исследованиях при использовании схемы FOLFIRI3 без применения таргетных агентов уровень клинического ответа составляет 20–25% и медиана БВ — 3,7–4,7 мес [52, 3]. Однако эти результаты не оценивались в рандомизированных клинических испытаниях.
Антиангиогенные агенты. В исследовании EFC10262-VELOUR изучалась эффективность добавления афлиберцепта к стандартной схеме FOLFIRI у 1226 пациентов, которые не ответили на химиотерапию на основе оксалиплатина. Эта новая комбинация значимо улучшила БВ (4,7–6,9 мес; ОР=0,76) и ОВ (12,1–13,5 мес; ОР=0,82). Данный эффект наблюдался независимо от приема бевацизумаба в первой линии терапии [71].
Анти-ЭФР агенты. В клиническом испытании EPIC добавление цетуксимаба к иринотекану после отсутствия ответа на 5-ФУ/оксалиплатин в сравнении со стандартной химиотерапией на основе иринотекана значимо улучшало БВ (4,0 и 2,6 соответственно; ОР=0,70) и уровень клинического ответа (16,4 и 4,2%) [61]. Отсутствие значимых различий в ОВ частично связано с перекрестной схемой лечения: половина пациентов из контрольной группы получали цетуксимаб после окончания исследования. Статус мутации KRAS ретроспективно оценили только у 23% рандомизированных пациентов. Среди пациентов с диким типом KRAS (15% от всей выборки) БВ значительно увеличивалась в случае добавления цетуксимаба к иринотекану, но клинический ответ и ОВ значимо не изменялись [49]. Комбинация панитумумаба и FOLFIRI продемонстрировала большую эффективность, чем только FOLFIRI, в отношении уровня клинического ответа и БВ, но не ОВ [55]. Причиной различий в ОВ и БВ скорее является перекрестная схема лечения в группе химиотерапии.
Вторая линия терапии после химиотерапии на основе иринотекана
Химиотерапия. Основным лечением после недостаточного клинического ответа на химиотерапию на основе иринотекана является назначение оксалиплатина. Ожидаемый общий уровень клинического ответа и медиана БВ при второй линии FOLFOX терапии составляет 9–15% и 4,2–4,7 мес соответственно [66, 24].
Антиангиогенные агенты. Добавление бевацизумаба к FOLFOX (E3200) после недостаточного ответа на 5-ФУ/иринотекан приводило к улучшению в уровне клинического ответа, БВ (4,7–7,3; ОР=0,61) и ОВ (10,8–12,9 мес; ОР=0,75) [24]. Как было продемонстрировано в проспективных исследованиях продолжение терапии бевацизумабом после прогрессирования при терапии первой линии также может пролонгировать выживаемость [27]. В клиническом испытании CONFIRM2 (855 пациентов) использование ваталаниба в комбинации с FOLFOX после терапии 5-ФУ/иринотеканом с недостаточным клиническим ответом значимо улучшало БВ (4,1–5,5 мес; ОР=0,83), но не ОВ (ОР=0,94) [45].
Анти-ЭФР агенты. Данные об эффективности применения в отношении клинического ответа и БВ анти-ЭФР препаратов в клинических испытаниях III фазы в качестве терапии второй линии отсутствуют.
Улучшение ОВ при второй линии терапии наблюдались при комбинировании анти-ЭФР агентов с FOLFIRI и FOLFOX [71, 24].
Третья линия терапии
После применения химиотерапии на основе оксалиплатина и иринотекана остается значительная часть пациентов, которые нуждаются в дополнительном лечении.
В исследовании BOND, в котором значительная часть пациентов была рефрактерна не только к терапии на основе иринотекана, но и оксалиплатину, было продемонстрировано синергичное действие иринотекана и цетуксимаба [11]. Уровень клинического ответа для иринотекана в сочетании с цетуксимабом был значительно выше, чем только при использовании моноклональных антител (23 и 11% соответственно), а ОР для прогрессирования заболевания в группе иринотекан + цеткусимаб в сравнении с группой монотерапии составил 0,54 (медиана БВ 4,1 и 1,5 мес соответственно). Более поздние исследования показали, что анти-ЭФР моноклональные антитела цетуксимаб и панитумумаб были более эффективны в терапии третьей линии в сравнении с поддерживающим лечением. Эти данные были получены у пациентов с опухолями с диким типом KRAS [40, 70]. Таким образом, существует неоспоримое преимущество в плане выживаемости при использовании анти-ЭФР в третьей линии терапии в указанной категории пациентов.
Известно, что бевацизумаб недостаточно эффективен в третьей линии терапии [6, 42]. Единственным активным видом лечения является терапия на основе анти-ЭФР моноклональных антител, при этом ее действенность прослеживается только у пациентов с диким типом KRAS опухолей. Соответственно, на сегодняшний день не существует стандартов для терапии третьей линии пациентов с мутированными KRAS опухолями и лиц с диким типом гена KRAS, которые получали анти-ЭФР препараты в качестве терапии первой или второй линии.
Стратегии
Общепринятой стандартной практикой лечения для прогрессирующего колоректального рака является терапия до прогрессирования или неприемлимой токсичности с последовательным или комбинированным использованием всех доступных препаратов. Различные терапевтические стратегии представлены на рис. 1 и 2.
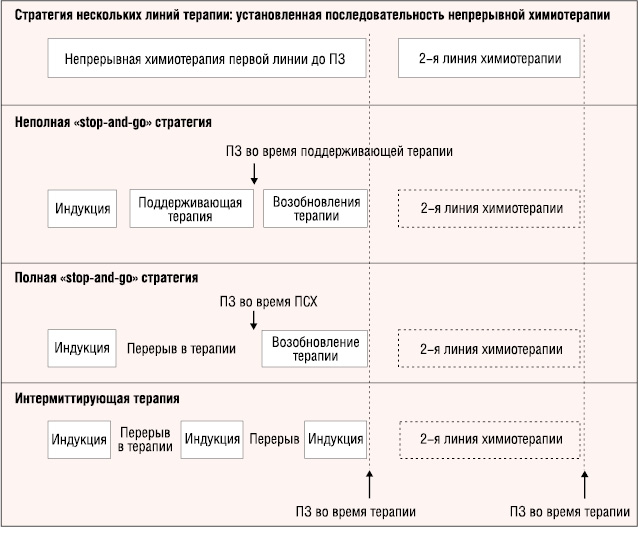
Стратегия «stop-and-go»
Стратегия «stop-and-go» преимущественно используется с режимами терапии, индуцирующими кумулятивную токсичность, например, на основе оксалиплатина, которую необходимо прекращать до прогрессирования заболевания. В случае обратимой токсичности (например нейропатия) можно рассмотреть вариант ее повторного назначения при прогрессировании.
Стратегия «stop-and-go» детально оценивалась в исследовании OPTIMOX1, в котором приняли участие 620 пациентов с неоперабельным колоректальным раком [12, 67]. Всех пациентов рандомизировали в группы с назначением FOLFOX4 или стратегии «stop-and-go», которая состояла из 6 циклов FOLFOX7 химиотерапии [53] и сопровождалась поддерживающей терапией с назначением LV5FU2 без оксалиплатина. После 12 циклов LV5FU2 химиотерапии пациенты с контролируемым заболеванием проходили терапию FOLFOX7. Это исследование показало, что такая стратегия терапии с оксалиплатином, сопровождающаяся поддерживающей терапией с 5-ФУ, лучше переносилась и имела одинаковую эффективность с продолжительным введением препаратов до прогрессирования или возникновения кумулятивной нейротоксичности.
Поддерживающая терапия с фторпиримидином и бевацизумабом оценивалась в исследовании CONcePT (Oxaliplatin Neuropathy Prevention Trial). В этом клиническом испытании сравнивалась непрерывная терапия FOLFOX c прерывистой восьмицикловой FOLFOX терапией + бевацизумаб, которая сопровождалась последующей восьмицикловой поддерживающей терапией LV/5FU + бевацизумаб и дополнительным использованием 8 циклов FOLFOX + бевацизумаб [29]. Согласно результатам исследования БВ при непрерывной терапии составила 7,3 мес, при использовании стратегии «stop-and-go» — 12,0 мес.
Поддерживающая терапия с таргетными агентами
В нескольких недавних клинических испытаниях оценивалась поддерживающая терапия без использования химиотерапии. Таргетные агенты блокируют критические пути для роста опухоли и могут задержать ее прогрессирование с меньшим количеством побочных эффектов, чем при применении химиотерапии.
Поддерживающая терапия цетуксимабом
Поддерживающая терапия с использованием цетуксимаба оценивалась в исследовании NORDIC VII [68]. Согласно его результатам у пациентов, проходивших непрерывную терапию цетуксимабом с периодами, свободными от химиотерапии, ОВ была схожей с таковой у пациентов из группы непрерывной химиотерапии с/без цетуксимаба.
Поддерживающая терапия бевацизумабом
В испанском исследовании MACRO сравнивались поддерживающая терапия бевацизумабом с непрерывной XELOX терапией в сочетании с бевацизумабом [62]. Первичной конечной точкой была медиана БВ с границей при проведении анализа по сопоставлению эффективности в 7,6 мес с допущением, что в контрольной группе медиана БВ составила 10 мес. Согласно результатам медиана БВ в контроле (непрерывная терапия) находилась на уровне 10,4 мес, в изучаемой группе (поддерживающая терапия) — 9,7 мес (ОР 1,11; 0,89–1,37). По мнению авторов исследования, полученные данные четко не продемонстрировали, что поддерживающая терапия менее эффективна, чем непрерывная терапия XELOX в сочетании с бевацизумабом. Более того, ученые не обнаружили значимой разницы в ОВ (22,4 и 21,7 соответственно) между двумя группами (ОР=1,04).
Поддерживающая терапия с ингибированием двух путей
В исследовании ACT-1 159 пациентов рандомизированы с назначением поддерживающей терапии бевацизумабом или его комбинации с эрлотинибом, оральным ингибитором тирозинкиназы рецепторов эпидермального фактора роста, после 4,5 мес химиотерапии на основе оксалиплатина или иринотекана в сочетании с бевацизумабом. Результаты этой научной работы показали тенденцию к удлинению БВ в группе комбинированной терапии (4,2–5,9 мес; ОР=0,81; р=0,24), однако статистическая мощность данных была слабой [39].
Интервалы, свободные от лечения
Медиана ОВ при колоректальной карциноме для разных типов терапии составляет 12 мес при использовании 5-ФУ, 20 мес — с оксалиплатином и иринотеканом и более 20 мес — в случае применения всех доступных на сегодняшний день препаратов. Периоды, свободные от химиотерапии (ПСХ), при прогрессирующем КРР часто используются по нескольким причинам, включая наличие длительного устойчивого ответа или стабилизации, токсичности или желания пациента прекратить терапию. Постепенная пролонгация медианы выживаемости у пациентов с метастатическим раком и трудности в длительном удержании пациентов на терапии привело к необходимости оценивания отмены химиотерапии в проспективных исследованиях.
В двух недавних клинических испытаниях оценивали полное прекращение терапии у пациентов, получающих комбинированную химиотерапию. В исследовании OPTIMOX2 сравнивали стратегию «stop-and-go» на основе оксалиплатина, представленную выше, с полным прекращением химиотерапии после 3 мес индуцированной FOLFOX7 терапии в первой линии лечения МКРР [9]. Результаты показали большую эффективность поддерживающей терапии. Медиана длительности контроля заболевания (первичная конечная точка) была значимо больше в поддерживающей группе, чем в группе с ПСХ (13,1 и 9,2 мес соответственно; ОР=0,71). Медиана БВ и ОВ также были длиннее в группе, получающей поддерживающее лечение. В исследовании MRC COIN (по 815 пациентов в каждой группе) сравнивалась непрерывная химиотерапия на основе оксалиплатина до прогрессирования заболевания со стратегией «stop-and-go» после 3 мес терапии на основе оксалиплатина, сопровождавшейся реинтродукцией терапии при прогрессировании заболевания [1]. Прерывистая химиотерапия была ассоциирована с улучшением качества жизни, редукцией продолжительности химиотерапии и меньшим количеством посещений больницы. Согласно результатам в группе непрерывной терапии наблюдались небольшие преимущества в ОВ, однако при этом в группе прерывистой терапии регистрировалась значительно меньшая токсичность.
Важным лимитирующим фактором в этих двух исследованиях (OPTIMOX2, COIN) было проведение рандомизации до индукции терапии, включая пациентов из группы прерывистой терапии, которым данная стратегия терапии не подошла. Наличие пациентов с прогрессией заболевания в начале терапии или лиц, получивших симптоматические оперативные вмешательства, также могло повлиять на объективность результатов. Мы предполагаем, что решения об использовании стратегии с ПСХ не могут приниматься до начала лечения. Однако, несмотря на результаты, использование этой стратегии может иметь преимущества для значительной части пациентов. Данные, полученные в исследованиях OPTIMOX1 и OPTIMOX2, показали, что пациенты с успешной ПСХ и пролонгированной выживаемостью имели нормальный уровень карцино-эмбриогенного антигена после 3 мес химиотерапии и применение химиотерапии длительностью 6 мес до ПСХ, что можно использовать в качестве критериев для отбора пациентов [56]. В исследовании COIN значимые позитивные эффекты от ПСХ имели также пациенты с нормальным уровнем тромбоцитов [1].
Реинтродукция и концепция резидуальной сенситивности
В экспериментальной группе исследования OPTIMOX1 оксалиплатин был повторно назначен только 40% пациентам, что способствовало достижению уровня контроля заболевания в 69%. Несмотря на тот факт, что большая часть пациентов не прошли запланированную реинтродукцию оксалиплатином или не получили оксалиплатин после второй линии терапии, реинтродукция оксалиплатина и процент пациентов с повторным назначением оксалиплатина на каждый исследовательский центр имели независимое и значимое влияние на ОВ [14]. В центрах, в которых оксалиплатин повторно назначали более чем 40% пациентам, стандартизированный ОР для ОВ в сравнении с центрами, в которых оксалиплатин не был реинтродуцирован ни одному пациенту, составил 0,59.
Определение сенситивности к оксалиплатину является важным фактором для выбора терапевтической стратегии в случае, если возможно возобновление терапии оскалиплатином. Так же, как и при использовании химиотерапии на основе платины при раке яичников, предикторами эффективности реинтродукции оксалиплатина являются пролонгированные интервалы между двумя периодами FOLFOX терапии и эффективность первой линии в режиме FOLFOX. Таким образом, реинтродукция оксалиплатина должна рассматриваться как вариант лечения пациентов, которые имеют изначальные преимущества применения FOLFOX терапии и хорошо ее переносят [15].
Интермиттирующая химиотерапия
В исследовании GISCAD 337 пациентов с МКРР, ранее не получавших лечение, рандомизировали в две группы с назначением непрерывной химиотерапии на основе иринотекана до прогрессирования или интермиттирующей химиотерапии на основе этого препарата (2 мес терапии, 2 мес без терапии) [48]. Результаты не показали существенной разницы в БВ (ОР=0,88) или ОВ (ОР=1,03).
Конечные точки исследований по терапии МРКК
В связи с увеличивающимся количеством активных субстанций, предназначенных для терапии МКРР возникает необходимость рациональной оценки их эффективности при комбинированном или последовательном использовании в клинических исследованиях.
ОВ
ОВ является общепризнанным конечным критерием оценки в клинических исследованиях по раку. ОВ довольно просто измерить, однако этот показатель имеет также и некоторые недостатки. Во-первых, смерть у большинства пациентов возникает через сравнительно долгое время. Во-вторых, клинические исследования, использующие ОВ в качестве основного конечного критерия оценки (первичной конечной точки), требуют большого количества пациентов и длительного периода наблюдения для демонстрации статистически значимой разницы между новой и стандартной терапией, что увеличивает длительность и стоимость этих клинических испытаний. Кроме того, вследствие кроссовера и последующей терапии влияние препарата на ОВ часто размывается. Следует отметить, что ОВ отображает общий эффект нескольких линий терапии. Соответственно, ОВ может оказаться недостаточно сенситивным конечным критерием оценки эффекта новой терапии первой линии или новой терапевтической стратегии.
Альтернативные конечные точки
Для уменьшения длительности и снижения стоимости клинических исследований необходима оценка альтернативных конечных точек, которые могут быть измерены ранее.
БВ демонстрирует время до первого прогрессирования или смерти от любой причины в случае, если не возникло прогрессирование заболевания. Это определение ограничивает БВ до прямого измерения времени до возникновения первого события. БВ не зависит от кроссовера, но с помощью этого показателя невозможно оценить стратегию терапии после первого прогрессирования. Показано, что при МКРР влияние терапии на ОВ, базирующейся на влиянии на БВ, можно предсказать с высокой точностью, когда пациент не получает эффективной терапии второй линии [5]. Однако в случае последующего прохождения пациентом активной терапии второй и третьей линии прогноз может быть неточным. Таким образом, преимущества БВ будут потеряны в ОВ, когда медиана постпрогрессивной выживаемости велика. Это, в частности, справедливо в отношении МКРР в связи с тем, что после первой линии терапии возможна реинтродукция и последующее применение второй и третьей линии терапии.
Основываясь на том, что БВ и ОВ не являются надежными конечными критериями оценки терапевтических стратегий, были предложены другие сочетанные конечные точки для оценки стратегий химиотерапии при МКРР: длительность контроля заболевания (duration of disease control, DCC), период времени до неэффективности стратегии терапии (time to failure of strategy, TFS) и выживаемость, свободная от неэффективности терапии (выживаемость, свободная от неудач лечения, strategy failure-free survival, SFFS). DDC рассматривается как прямое измерение лечебного эффекта терапевтической стратегии посредством исключения неконтролируемых периодов заболевания (времени от прогрессирования заболевания до реинициации химиотерапии) и неактивного второго курса терапии, что определяется как зарегистрированное прогрессирование заболевания при первой оценке опухолевого процесса после реинициации терапии. TFS направлен на оценку глобальной терапевтической стратегии. DDC и TFS имеют значительную корреляцию с ОС [7].
Показатель SFFS, схожий с TFS, недавно оценивался в исследовании MRC COIN. В группе интермиттирующей терапии SFFS событие возникало, когда пациент имел прогрессирующее заболевание во время запланированного периода терапии или в пределах 8 нед от начала ПСХ. В группе непрерывной терапии SFFS был схожим с TFS [1]. В противовес БВ эти конечные точки позволяют оценить длительность терапевтического эффекта до и после первого прогрессирования заболевания.
Исследования по терапевтическим стратегиям при МКРР (краткое описание представлено в табл. 2)
Таблица 2 Исследования III фазы по МКРР, которые проводятся на данный момент
| NCT No | Название исследования | Спонсор | N | Контрольная группа | Изучаемая группа | Ссылка |
|---|---|---|---|---|---|---|
| Бев и ЦТК в первой линии терапии | ||||||
| 00265850 | С80405 | CALGB | 760 | ХТ + Бев | ХТ + ЦТК | [73] |
| 00433927 | FIRE-3 | LM-UM | 568 | FOLFIRI + Бев | FOLFIRI + ЦТК | [33] |
| 01338558 | ML25686 | Roche | 825 | mFOLFOX6 | mFOLFOX6 + Бев | [34] |
| ЦТК в терапии второй или третьей линии | ||||||
| 01338558 | COMETS | GISCAD | 350 | L2: FOLFOX4L3: иринотекан + ЦТК | L2: иринотекан + ЦТКL3: FOLFOX4 | [48] |
| Поддерживающая терапия и/или наблюдение | ||||||
| 00544700 | SWS-SAKK-41/06 | SGCCR | 238 | Бев | ПСХ | [44] |
| 00442637 | CAIRO3 | DCCG | 635 | Кап + Бев | ПСХ | [57] |
| 00973609 | AIO-KRK-0207 | AIO | 760 | фторпиримидин + Бев | ПСХ или монотерапия Бев | [32] |
| 00265824 | DREAM | GERCOR | 700 | Бев | Бев + эрлотиниб | [65] |
| 01229813 | ACT-2 | LUH | 181 | Бев | ДТ-KRAS: Бев + эрлотинибМут-KRAS: Кап-Бев | [38] |
| Бев после прогрессирования | ||||||
| 00700102 | ML18147 | Roche | 822 | ХТ (без Бев) | ХТ + Бев | [35] |
| 00720512 | GONO-BEBYP-ASL607LIOM03 | GONO | 262 | ХТ (без Бев) | ХТ + Бев | [21] |
NCT No — идентификатор ClinicalTrials.gov; Бев — бевацизумаб; FOLFIRI — 5-ФУ/лейковорин/иринотекан; FOLFOX — 5-ФУ/лейковорин/оксалиплатин; Мут — мутированный; ДТ — дикий тип; ПСХ — период, свободный от химиотерапии.
Оптимальное время использования антиангиогенных и анти-ЭФР агентов
Одним из наиболее важных практических вопросов для большинства пациентов с неоперабельным МРКК, даже в случае уменьшения опухоли, является вопрос о том, когда следует использовать антиангиогенные и анти-ЭФР агенты.
В трех исследованиях III фазы, которые проводятся в настоящее время, сравнивается стандартный режим химиотерапии в комбинации с бевацизумабом или цетуксимабом [73, 33, 34]. Основными конечными точками являются ОВ в исследовании CALGB, уровень клинического ответа в исследовании FIRE-3 и БВ в клиническом испытании ML25686. Следует отметить, что последующие линии терапии в данных исследованиях не изучаются.
В исследовании GISCAD сравниваются две разные последовательности терапии (FOLFOX4 после прогрессии, сопровождающаяся иринотеканом/цетуксимабом или в обратном порядке) после неудачи лечения FOLFIRI/бевацизумабом в первой линии терапии [47]. Первичной конечной точкой является ОВ.
Поддерживающая терапия или ПСХ?
В трех исследованиях сравнивается поддерживающая терапия на основе бевацизумаба в качестве самостоятельного лечения (AIO-KRK-0207, SWS-SAKK-41/06) или в комбинации с фторпиримидином (AIO-KRK-0207, CAIRO-3) с полным прекращением терапии. В исследовании AIO пациентов случайным образом распределили на 3 группы: бевацизумаб + фторпиримидин (группа 1), бевацизумаб (группа 2) и наблюдение (группа 3) после 6 мес химиотерапии на основе оксалиплатина в комбинации с бевацизумабом [32]. Первичной конечной точкой в этом клиническом испытании является период времени до неудачи поддерживающей терапии или реинтродукции лечения. В SWS-SaKK-41/06 пациентов рандомизировали после первой линии терапии с назначением бевацизумаба в качестве поддерживающего лечения или в группу с полным прекращением противоопухолевой терапии [44]. Первичной конечной точкой в этом исследовании является период времени до прогрессирования. В клиническом испытании CAIRO-3 пациентов рандомизировали в группу бевацизумаба в сочетании с капецитабином или в группу наблюдения после 4,5 мес терапии оксалиплатином, капецитабином и бевацизумабом [57]. Первичной конечной точкой является БВ после реинтродукции химиотерапии и бевацизумаба.
Поддерживающая терапия: интерес в двойном пути ингибирования
На сегодняшний день продолжают проводиться исследования, направленные на оценку роли таргетной терапии в качестве самостоятельного метода лечения во время ПСХ. В клинических испытаниях DREAM и ACT-2 сравнивается поддерживающая терапия бевацизумабом с комбинацией бевацизумаб + эрлотиниб. В исследовании GERCOR-DREAM пациентов рандомизировали после 3–6 мес индукционной терапии (на основе оксалиплатина или иринотекана) в комбинации с бевацизумабом только в случае контролируемого заболевания или невозможности резекции метастазов в независимости от статуса мутации KRAS [65]. В исследовании ACT-2 сравнение было ограничено пацентами с диким типом KRAS. Активность бевацизумаба и низких доз метрономного капецитабина изучается в третьей группе пациентов с KRAS-мутированными опухолями [38].
Антиангиогенная терапия после прогрессирования
Должна ли антиангиогенная терапия проводиться после первой и второй линии терапии, после прогрессирования? На этот вопрос может помочь ответить Европейское ML18147 и Итальянское GONO исследования, которые изучают использование бевацизумаба после прогрессирования в комбинации с базовой химиотерапией прогрессирующего колоректального рака [35, 21]. Результаты исследования ML18147 будут доступны к концу 2012 года.
Выводы
Ведение пациентов с МКРР требует разработки глобальной стратегии лечения, которая включает несколько линий терапии, симптоматические хирургические вмешательства, поддерживающую терапию и периоды, свободные от терапии. Наши знания в этой области базируются на клинических испытаниях с участием пациентов более молодого возраста и меньшим числом коморбидных состояний, чем в общей популяции пациентов с МРКК. Это предполагает, что результаты данных научных работ следует интерпретировать с осторожностью.
Выбор терапии, доступной в клинической практике в отношении пациентов с неоперабельным МКРР с диким типом KRAS представлен на рис. 2. Для определения наиболее эффективной стратегии необходимо проведение рандомизированных клинических испытаний в дальнейшем.
Литература
1. Adams, R.A., Meade, A.M., Seymour, M.T. et al. (2011) Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advancedcolorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol 12: 642-653.
2. American Cancer Society (2010) American Joint Committee on Cancer (AJCC): Colon and Rectum Cancer Staging, 7th edition. Available at: http://www. cancerstaging.org/staging/index.html (accessed 12 September 2011).
3. Bidard F.C., Tournigand C., André T. et al. (2009) Efficacy of FOLFIRI-3 (irinotecan D1, D3 combined with LV5-FU) or other irinotecan based regimens in oxaliplatin-pretreated metastatic colorectal cancer in the GERCOR OPTIMOX1 study. Ann. Oncol., 20: 1042–1047.
4. Bokemeyer C., Bondarenko I., Makhson A. et al. (2009) Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J. Clin. Oncol., 27: 663–671.
5. Buyse M., Burzykowski T., Caroll K. et al. (2007) Progressionfree survival is a surrogate for survival in advanced colorectal cancer. J. Clin. Oncol., 25: 5218–5223.
6. Chen H.X., Mooney M., Boron M. et al. (2006) Phase II multicenter trial of bevacizumab plus fluorouracil and leucovorin in patients with advanced refractory colorectal cancer: an NCI Treatment Referral Center Trial TRC-0301. J. Clin. Oncol., 24: 3354–3360.
7. Chibaudel B., Bonnetain F., Shi Q. et al. (2011) Alternative endpoints to evaluate a therapeutic strategy in advanced colorectal cancer: evaluation of progressionfree survival (PFS), duration of disease control (DDC) and time to failure of strategy (TFS). An ARCAD Group Study. J. Clin. Oncol., 29: 4199–4204.
8. Chibaudel B., Bonnetain F., Tournigand C. et al. (2011) Simplified prognostic model in patients with oxaliplatin-based or irinotecan-based first-line chemotherapy for metastatic colorectal cancer: a GERCOR study. Oncologist, 16: 1228–1238.
9. Chibaudel B., Maindrault-Goebel F., Lledo G. et al. (2009) Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J. Clin. Oncol., 27: 5727–5733.
10. Colucci G., Gebbia V., Paoletti G. et al. (2005) Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell’Italia Meridionale. J. Clin. Oncol., 23: 4866–4875.
11. Cunningham D., Humblet Y., Siena S. et al. (2004) Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan refractory metastatic colorectal cancer. N. Engl. J. Med., 351: 337–345.
12. de Gramont A. (2008) Oxaliplatin stop-and-go treatment regimens. United States Patent Application Publication. Pub. No. 2008/0085881 A1.
13. de Gramont A., Bosset J.F., Milan C. et al. (1997) Randomized trial comparing monthly low-dose leucovorin and fluorouracil bolus with bimonthly high-dose leucovorin and fluorouracil bolus plus continuous infusion for advanced colorectal cancer: a French intergroup study. J. Clin. Oncol., 15: 808–815.
14. de Gramont A., Buyse M., Abrahantes J.C. et al. (2007) Reintroduction of oxaliplatin is associated with improved survival in advanced colorectal cancer. J. Clin. Oncol., 25: 3224–3229.
15. de Gramont A., Chibaudel B., Bourges O. et al. (2009) Definition of oxaliplatin sensitivity in patients with advanced colorectal cancer previously treated with oxaliplatin-based therapy. J. Clin. Oncol., 27(15 Suppl.): 4024.
16. de Gramont A., Figer A., Seymour M. et al. (2000) Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J. Clin. Oncol., 18: 2938–2947.
17. Díaz-Rubio E., Tabernero J., Gómez-España A. et al. (2007) Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J. Clin. Oncol., 25: 4224–4230.
18. Di Nicolantonio F., Martini M., Molinari F. et al. (2008) Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J. Clin. Oncol., 26: 5705–5712.
19. Douillard J.Y., Cunningham D., Roth A.D. et al. (2000) Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicenter randomised trial. Lancet 355: 1041–1047.
20. Douillard J.Y., Siena S., Cassidy J. et al. (2010) Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J. Clin. Oncol., 28: 4697–4705.
21. Falcone A. (2011) An open-label, multicenter randomized phase III study of second-line chemotherapy with orwithout bevacizumab in metastatic colorectal cancer patients who have received first-line chemotherapy plus bevacizumab (http://clinicaltrials. gov/ct2/show/ NCT00720512 (accessed 12 September 2011)).
22. Falcone A., Ricci S., Brunetti I. et al. (2007) Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first-line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J. Clin. Oncol., 25: 1670–1676.
23. Fuchs C.S., Marshal J.L., Mitchell E. et al. (2007) A randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C study. J. Clin. Oncol., 25: 4779–4786.
24. Giantonio B.J., Catalano P.J., Meropol N.J. et al. (2007) Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J. Clin. Oncol., 25: 1539–1544.
25. Globocan International Agency on Cancer Research (2008) Cancer Incidence and Mortality Worldwide in 2008. (http://globocan. iarc.fr/factsheets/ cancers/colorectal.asp) (accessed 12 September 2011).
26. Goldberg R.M., Sargent D.J., Morton R.F. et al. (2006) Randomized controlled trial of reduced-dose bolus fluorouracil plus leucovorin and irinotecan or infused fluorouracil plus leucovorin and oxaliplatin in patients with previously untreated metastatic colorectal cancer: a North American Intergroup Trial. J. Clin. Oncol., 24: 3347–3353.
27. Grothey A., Hart L., Rowland K. et al. (2008) Intermittent oxaliplatin administration improves time-to-treatment failure in metastatic colorectal cancer: final results of the phase III of the CONcePT Trial. J. Clin. Oncol., 26( Suppl.): 4010.
28. Grothey A., Sargent D., Goldberg R.M. and Schmoll H.J. (2004) Survival of patients with advanced colorectal cancer improves with the availability of fluorouracil-leucovorin, irinotecan, and oxaliplatin in the course of treatment. J. Clin. Oncol., 22: 1209–1214.
29. Grothey A., Sugrue M.M., Purdie D.M. et al. (2008) Bevacizumab beyond first progression is associated with prolonged overall survival in metastatic colorectal cancer: results from a large observational cohort study (BRiTE). J. Clin. Oncol., 26: 5326–5334.
30. Hecht J.R., Mitchell E., Chidiac T. et al. (2008) A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J. Clin. Oncol., 27: 672–680.
31. Hecht J.R., Trarbach T., Hainsworth J.D. et al. (2011) Randomized, placebo-controlled, phase III study of first-line oxaliplatin-based chemotherapy plus PTK787/ ZK 222584, an oral vascular endothelial growth factor receptor inhibitor, in patients with metastatic colorectal adenocarcinoma. J. Clin. Oncol., 29: 1997–2003.
32. Hegewisch-Becker S. (2011) Randomized three arm phase III trial on induction treatment with a fluoropyrimidine-, oxaliplatin- and bevacizumab-based chemotherapy for 24 weeks followed by maintenance treatment with a fluoropyrimidine and bevacizumab vs. bevacizumab alone vs. no maintenance treatment and reinduction in case of progression for first-line treatment of patients with metastatic colorectal cancer (http://clinicaltrials. gov/ ct2/show/NCT00973609) (accessed 12 September 2011).
33. Heinemann V. (2011) Multicenter randomized trial evaluating FOLFIRI plus cetuximab versus bevacizumab in first line treatment of metastatic colorectal cancer (http://clinicaltrials. gov/ct2/show/ NCT00433927) (accessed 12 September 2011).
34. Hoffman-La Roche (2011) A study of Avastin (bevacizumab) in combination with mFOLFOX6 in treatment-naïve patients with metastatic colorectal cancer with or without K-RAS mutations, and comparison to cetuximab (http://clinicaltrials. gov/ct2/ show/NCT01338558) (accessed 12 September 2011).
35. Hoffman-La Roche (2011) A study of Avastin (bevacizumab) plus crossover fluoropyrimidine-based chemotherapy in patients with metastatic colorectal cancer (http://clinicaltrials. gov/ct2/show/ NCT00700102) (accessed 12 September 2011).
36. Hurwitz H., Fehrenbacher L., Novotny W., Cartwright et al. (2004) Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N. Engl. J. Med., 350: 2335–2342.
37. Inoue Y., Miki C., Watanabe H. et al. (2006) Schedule-dependent cytotoxicity of 5-fluorouracil and irinotecan in a colon cancer cell line. J. Gastroenterol., 41: 1149–1157.
38. Johnsson A. (2011) Avastin and chemotherapy followed by a KRAS stratified randomization to maintenance treatment for first line treatment of metastatic colorectal cancer. (ACT-2) http:// clinicaltrials.gov/ct2/show/NCT01229813 (accessed 12 September 2011).
39. Johnsson A., Frodin J., Berglund A., et al. (2011) A randomized phase III trial on maintenance treatment with bevacizumab(bev) alone or in combination with erlotinib (erlo) after chemotherapy and bev in metastatic colorectal cancer (mCRC). J. Clin. Oncol., 29(Suppl.): 3526.
40. Jonker D.J., O’Callaghan C.J., Karapetis C.S. et al. (2007) Cetuximab for the treatment of colorectal cancer. N Engl J Med 357: 2040–2048.
41. Kabbinavar F.F., Schulz J., McCleod M., et al. (2005) Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer. Results of a randomized phase II trial. J. Clin. Oncol., 23: 3697–3705.
42. Kang B.W., Kim T.W., Lee J.L., et al. (2009) Bevacizumab plus FOLFIRI or FOLFOX as third-line or later treatment in patients with metastatic colorectal cancer after failure of 5-fluorouracil, irinotecan, and oxaliplatin: a retrospective analysis. Med. Oncol., 26: 32–37.
43. Khambata-Ford S., Garrett C.R., Meropol N.J. et al. (2007) Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J. Clin. Oncol., 25: 3230–3237.
44. Koeberle D. (2011) Bevacizumab maintenance versus no maintenance after stop of first-line chemotherapy in patients with metastatic colorectal cancer. A randomized multicenter phase III non-inferiority trial. http://clinicaltrials. gov/ct2/show/NCT00544700 (accessed 12 September 2011).
45. Kôhne C., Bajetta E., Lin E. et al. (2007) Final results of CONFIRM 2: a multinational, randomized, doubleblind, phase III study in 2nd line patients (pts) with metastatic colorectal cancer (mCRC) receiving FOLFOX4 and PTK787/ZK 222584 (PTK/ZK) or placebo. J. Clin. Oncol., 25(18 Suppl.): 4033.
46. Kôhne C.-H., Cunningham D., Di Costanzo F. et al. (2002) Clinical determinants of survival in patients with 5-fluorouracil- based treatment for metastatic colorectal cancer: results of a multivariate analysis of 3825 patients. Ann Oncol 13: 308–317.
47. Labianca R. (2011) Gruppo Italiano per lo studio dei Carcinomi dell’Apparato Digerente. Open-label randomized, parallel group, phase III, multicenter trial comparing two different sequences of therapy (irinotecan/cetuximab followed by fluorouracil/ leucovorin with oxaliplatin (FOLFOX-4) vs FOLFOX-4 followed by irinotecan/cetuximab) in metastatic colorectal patients treated with fluorouracil/ leucovorin with irinotecan FOLFIRI/bevacizumab as first line chemotherapy (COMETS). http:// clinicaltrials.gov/ct2/show/NCT01030042 (accessed 12 September 2011).
48. Labianca R., Sobrero A., Isa L. et al. (2011) Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised ‘GISCAD’ trial. Ann Oncol 22: 1236–1242.
49. Langer C., Kopit J., Awad, M. et al. (2008) Mutations in patients with metastatic colorectal cancer receiving cetuximab in combination with irinotecan: results from the EPIC trial. ESMO 2008, Abstract 385P. Ann Oncol 19(Suppl. 8): viii133.
50. Laurent-Puig P., Cayre A., Manceau G. et al. (2009) Analysis of PTEN, BRAF and EGFR status in determining benefit from cetuximab therapy in wild-type KRAS metastatic colon cancer. J. Clin. Oncol., 27: 5924–5930.
51. Lièvre A., Bachet J.B., Boige V. et al. (2008) KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J. Clin. Oncol., 26: 374–379.
52. Mabro M., Artru P., André T. et al. (2006) A phase II study of FOLFIRI-3 (double infusion of irinotecan combined with LV5FU) after FOLFOX in advanced colorectal cancer patients. Br. J. Cancer 94: 1287–1292.
53. Maindrault-Goebel F., de Gramont A., Louvet C. et al. (2001) High-dose intensity oxaliplatin added to the simplified bimonthly leucovorin and 5-fluorouracil regimen as second-line therapy for metastatic colorectal cancer (FOLFOX 7). Eur. J .Cancer 37: 1000–1005.
54. Maughan T.S., Adams R.A., Smith C.G. et al. (2011) Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 377: 2103–2114.
55. Peeters M., Price T.J., Cervantes A. et al. (2010) Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J. Clin. Oncol., 28: 4706–4713.
56. Perez-Staub N., Chibaudel B., Figer A. et al. (2008) Who can benefit from chemotherapy holidays after first-line therapy for advanced colorectal cancer? A GERCOR study. J. Clin. Oncol., 26 (Suppl.): 4037.
57. Punt C. (2011) Maintenance treatment with capecitabine and bevacizumab versus observation after induction treatment with chemotherapy andbevacizumab as first-line treatment in patients with advanced colorectal carcinoma (CAIRO3). http:// clinicaltrials.gov/ct2/show/NCT00442637 (accessed 12 September 2011).
58. Rosen O., Yi J., Hurwitz H. et al. (2008) Clinical benefit of bevacizumab in metastatic colorectal cancer is independent of K-RAS mutation status: analysis of a phase III study of bevacizumab with chemotherapy in previously untreated metastatic colorectal cancer. Ann. Oncol., 19(Suppl. 6): vi19; abstract 0–035.
59. Saltz L.B., Clarke S., Diaz-Rubio E. et al. (2008) Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J. Clin. Oncol., 26: 2013–2019.
60. Schmoll H.J., Cunningham D., Sobrero A. et al. (2010) mFOLFOX6 + cediranib vs mFOLFOX6 + bevacizumab in previously untreated metastatic colorectal cancer (mCRC): a randomized, doubleblind, phase II/III study (HORIZON III). Ann Oncol 21(Suppl. 8): viii188; abstract 580O.
61. Sobrero A.F., Maurel J., Fehrenbacher L. et al. (2008) EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J. Clin. Oncol., 26: 2311–2319.
62. Tabernero J., Aranda E., Gomez A. et al. (2010) Phase III study of first-line XELOX plus bevacizumab (BEV) for 6 cycles followed by XELOX plus BEV or singleagent BEV as maintenance therapy in patients with metastatic colorectal cancer: the MACRO trial (Spanish Cooperative Group for the Treatment of Digestive Tumors). J. Clin. Oncol., 28(Suppl. 15): 3501.
63. Tebbutt N.C., Wilson K., Gebski V.J. et al. (2010) Capecitabine, bevacizumab, and mitomycin in first-line treatment of metastatic colorectal cancer: results of the Australasian Gastrointestinal Trials Group Randomized Phase III MAX Study. J. Clin. Oncol., 28: 3191–3198.
64. Tol J., Koopman M., Cats A. et al. (2009) Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N. Engl. J. Med., 360: 563–572.
65. Tournigand C. (2011) Randomized phase III study of combination chemotherapy comprising oxaliplatin, leucovorin calcium, and fluorouracil (modified FOLFOX) or oxaliplatin and capecitabine (XELOX) in combination with bevacizumab with versus without erlotinib in patients with unresectable metastatic colorectal adenocarcinoma (clinicaltrials.gov/ct2/show/NCT00265824) (accessed 12 September 2011).
66. Tournigand C., Andre T., Achille E. et al. (2004) FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J. Clin. Oncol., 22: 229–237.
67. Tournigand C., Cervantes A., Figer A. et al. (2006) OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-go fashion in advanced colorectal cancer — a GERCOR study. J. Clin. Oncol., 24: 394–400.
68. Tveit K., Guren T., Glimelius B. et al. (2011) Randomized phase III study of 5-flurouracil/folinate/oxaliplatin given continuously or intermittently with or without cetuximab, as first-line therapy of metastatic colorectal cancer: the NORDIC VII study (NCT0014314), by the Nordic Colorectal Cancer Biomodulation Group. J. Clin. Oncol., 29(Suppl. 4): abstract 365.
69. Van Cutsem E., Köhne C.H., Hitre E. et al. (2009) Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N. Engl. J. Med., 360: 1408–1417.
70. Van Cutsem E., Peeters M., Siena S. et al. (2007) Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J. Clin. Oncol., 25: 1658–1664.
71. Van Cutsem E., Tabernero J., Lakomy R. et al. (2011) Intravenous (IV) aflibercept versus placebo in combination with irinotecan/5-FU (FOLFIRI) for second-line treatment of metastatic colorectal cancer (MCRC): results of a multinational phase III trial (EFC10262–VELOUR). Ann. Oncol., 22(Suppl. 5): v10–v18.
72. Van Cutsem E., Twelves C., Cassidy J. et al. (2001) Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J. Clin. Oncol.,
19: 4097–4106.
73. Venook A.P. and Blanke C.D. (2011) Randomized phase III study of cetuximab and/or bevacizumab in combination with either oxaliplatin, fluorouracil, and leucovorin calcium (FOLFOX) or irinotecan hydrochloride, fluorouracil and leucovorin calcium (FOLFIRI) in patients with previously untreated locally advanced or metastatic adenocarcinoma of the colon or rectum (http://clinicaltrials.gov/ct2/show/ NCT00265850) (accessed 12 September 2011).
Публикация подготовлена редакцией
по материалам статьи Chibaudel B.,
Tournigand C., André T., de Gramont A.
«Therapeutic strategy in unresectable metastatic
colorectal cancer» (Ther. Adv. Med. Oncol., 2012 March; 4(2): 75–89), предоставленной
ООО «Рош Украина»
Терапевтичні стратегії при неоперабельному метастатичному колоректальному раку
Резюме. У той час як хірургічне втручання є базовим лікуванням колоректального раку на ранній стадії, хіміотерапія залишається терапією першої лінії для метастатичного раку, коли хірургічним шляхом повністю видалити пухлину немає можливості. За останні 30 років спостерігається чітка тенденція до зниження смертності від раку товстої кишки, однак також відзначається різна виживаність, що можна пояснити відмінностями в характеристиках пацієнта і пухлини, стратегіями терапії та іншими факторами, які впливають на клінічну відповідь. Ведення пацієнтів з неоперабельним метастатичним раком товстої кишки передбачає розробку глобальної терапевтичної стратегії, котра може включати кілька ліній терапії, симптоматичні оперативні втручання, підтримуюче лікування і періоди, вільні від активної терапії. Індивідуалізація протиракової терапії базується на оцінці прогностичних факторів виживаності (рівень лактадегідрогенази, загальна оцінка стану) і предикторних факторів для ефективності терапії (статус мутації гена KRAS). Одними з доступних на сьогодні методів лікування метастатичного колоректального раку є хіміотерапія (фторпіримідин, оксаліплатин, іринотекан), антиангіогенні агенти (бевацизумаб) і антиепідермальні фактори росту (цетуксимаб, панітумумаб). Кількість активних протиракових хімічних сполук спонукає вчених до проведення клінічних досліджень, спрямованих на оцінку ефективності їх використання як в комбінації з уже відомими препаратами, так і у вигляді монотерапії на певному етапі лікування. Водночас для зменшення тривалості та зниження вартості таких досліджень необхідне встановлення інших альтернативних кінцевих точок, які можуть бути визначені раніше, ніж загальна виживаність.
Ключові слова: хіміотерапія, клінічне дослідження, колоректальний рак, молекулярна таргетна терапія.
Therapeutic strategy in unresectable metastatic colorectal cancer
Summary. While surgery is the cornerstone treatment for early-stage colorectal cancer, chemotherapy is the first treatment option for metastatic disease when tumor lesions are frequently not fully resectable at presentation. Mortality from colon cancer has decreased over the past 30 years, but there is still a huge heterogeneity in survival rates that can be mainly explained by patient and tumor characteristics, host response factors, and treatment modalities. The management of unresectable metastatic colorectal cancer is a global treatment strategy, which applies several lines of therapy, salvage surgery, maintenance, and treatment-free intervals. The individualization of cancer treatment is based on the evaluation of prognostic factors for survival (serum lactate dehydrogenase level, performance status), and predictive factors for treatment efficacy [Kirsten rat sarcoma viral oncogene homolog (KRAS) mutation status]. The available treatment modalities for metastatic colorectal cancer are chemotherapy (fluoropyrimidine, oxaliplatin, irinotecan), anti-angiogenic agents (e.g. bevacizumab), and anti-epidermal growth factor agents (cetuximab, panitumumab). The increasing number of active compounds dictates the strategy of trials evaluating these treatments either in combination or sequentially. Alternative outcomes that can be measured earlier than overall survival are needed to shorten the duration and reduce the size and cost of clinical trials.
Key words: chemotherapy, clinical trial, colorectal cancer, molecular targeted therapy
АВАСТИН (бевацизумаб)
Р.с. № 547/10-300200000 от 27.04.2010. Состав. 1 флакон с 4 мл концентрата для приготовления раствора для инфузий содержит 100 мг (25 мг/мл) бевацизумаба; 1 флакон с 16 мл концентрата для приготовления раствора для инфузий содержит 400 мг (25 мг/мл) бевацизумаба. Фармакотерапевтическая группа. Антинеопластические средства, моноклональные антитела. Код АТС. L01Х С07. Показания. Метастатический колоректальный рак. Местно-рецидивирующий или метастатический рак молочной железы. Распространенный нерезектабельный, метастатический или рецидивирующий неплоскоклеточный немелкоклеточный рак легкого. Распространенный и/или метастатический почечно-клеточный рак: в качестве первой линии терапии в комбинации с интерфероном альфа-2а. Злокачественная глиома (ІV стадия по ВОЗ) – глиобластома. Побочные действия. Крайне редко наблюдались такие наиболее серьезные побочные реакции: перфорация желудочно-кишечного тракта (ЖКТ), кровоизлияние, включая легочные кровотечения/кровохаркание (чаще встречается у пациентов с немелкоклеточным неплоскоклеточным раком легкого), артериальная тромбоэмболия. Повышение артериального давления и развитие протеинурии, вероятно, имеет дозозависимый характер. Наиболее часто наблюдаются: артериальная гипертензия, слабость или астения, диарея и боль в животе. А также побочные реакции любой степени тяжести, которые проявлялись у пациентов, получавших только Авастин или комбинированное лечение с химиотерапией: со стороны сердечно-сосудистой системы — артериальная гипертензия, артериальная тромбоэмболия (включая инфаркт миокарда, инсульт, транзиторную ишемическую атаку и другие артериальные эмболии), тромбоз глубоких вен, застойная сердечная недостаточность, суправентрикулярная тахикардия, кровотечение; со стороны системы кроветворения — лейкопения, нейтропения, фебрильная нейтропения, анемия, тромбоцитопения; со стороны ЖКТ — боль в животе, диарея, запор, ректальное кровотечение, стоматит, кровоточивость десен, перфорация ЖКТ, кишечная непроходимость, тошнота, рвота, желудочно-кишечные расстройства; со стороны органов дыхания — легочная тромбоэмболия, гипоксия, носовое кровотечение, одышка, ринит и другие. Противопоказания. Повышенная чувствительность к бевацизумабу или любому другому компоненту препарата, к препаратам на основе клеток яичников китайского хомячка или другим рекомбинантным человеческим или наближенным к человеческим антителам. Метастатическое поражение центральной нервной системы. Беременность и период кормления грудью. Детский возраст. Почечная и печеночная недостаточность (эффективность и безопасность применения не установлены). Условия хранения. Хранить при температуре 2–8 ˚С в защищенном от света и недоступном для детей месте. Готовый раствор хранить не более 24 ч при температуре 2–8 ˚С. Не замораживать. Не встряхивать. Неиспользованный раствор, оставшийся во флаконе, уничтожают, потому что он не содержит консервантов. Условия отпуска. По рецепту. Упаковка. Концентрат для приготовления раствора для инфузий по 100 мг/4 мл и 400 мг/16 мл в стеклянных флаконах, закупоренных пробкой из бутилкаучука, обжатые алюминиевыми колпачками и закрытые пластмассовой крышкой. 1 флакон вместе с инструкцией для медицинского применения в картонной упаковке. Производитель. Дженентек Инк., США для Ф.Хоффманн-Ля Рош Лтд, Швейцария, 1 ДНА Вей, юг Сан-Франциско CA 94080–4990, США; Ф.Хоффманн-Ля Рош Лтд, Швейцария, Грензахерштрассе 124, СН–4070 Базель, Швейцария.
Полная информация о препарате находится в инструкции для медицинского применения














Leave a comment