Ефективність похідних платини при «тричі негативному» раку грудної залози з мутацією гена BRCA1 (випадок з практики)
Шпарик Я.В. 1, Кіцера Н.І. 2, Олексяк О.О. 1, Володько Н.А. 3, Петрончак О.А. 4
- 1Львівський державний онкологічний регіональний лікувально-діагностичний центр
- 2ДУ «Інститут спадкової патології НАМН України», Львів
- 3Львівський національний медичний університет імені Данила Галицького
- 4Львівське обласне патологоанатомічне бюро
Резюме. В останні кілька років стало відомо, що приблизно 5–10% раку грудної залози зумовлено мутацією генів BRCA1/2. Більшість цих спадкових патологій належать до базального типу і є «тричі негативними» за рецепторним статусом. Описано випадок метахронного раку яєчника та раку грудної залози у пацієнтки Б. Зважаючи на «тричі негативний» статус пухлини, виражений генетичний компонент (діагностовано 6 випадків злоякісних пухлин по материнській лінії), а також дані молекулярно-генетичного аналізу (виявлено мутацію 185 delAG в гені BRCA1), рекомендовано провести неоад’ювантну терапію на основі препаратів платини. Пацієнтка отримала 5 циклів паліативної хіміотерапії карбоплатином (останній 13.02.2012 р.). За даними комп’ютерної томографії, після 3-го циклу хіміотерапії встановлено часткову регресію хвороби. На даний час (жовтень 2012 р.) пацієнтка перебуває під спостереженням онкологів.
Вступ
Рак грудної залози є гетерогенним захворюванням як за клінічним перебігом та прогнозом, так і за чутливістю до різних типів медикаментозного лікування. Дослідження останніх років дали клініцистам нові критерії для визначення підходів до ефективної терапії [4]. Зокрема, це стосується поділу раку грудної залози на 4 основні типи за даними імуногістохімічного та молекулярно-генетичного аналізів (таблиця). На основі цього поділу приймають рішення щодо оптимальних методів медикаментозної терапії.
Таблиця. Основні типи раку грудної залози за даними імуногістохімічного та молекулярно-генетичного аналізів
| Молекулярно-генетичний тип | Імуногістохімічні характеристики | Частота | Загальний прогноз |
|---|---|---|---|
| Люмінальний тип A (Luminal-like A) | ER+ і/або PgR+, HER2neu- | 60–65% | Сприятливий |
| Люмінальний тип B (Luminal-like B) | ER+ і/або PgR+, HER2 neu+ | 7–10% | Відносно сприятливий |
| Тип HER2 (HER2-like) | ER-, PgR-, HER2neu+ | 20–25% | Несприятливий |
| Базальний тип (Basal-like) | ER-, PgR-, HER2neu-, CK5/6+ і/або HER1+ | 15% | Украй несприятливий |
Так, при люмінальному типі A основним методом лікування є гормонотерапія, яка при люмінальному типі B доповнюється анти-HER2neu засобами (зокрема, трастузумабом). При типі HER2neu+ застосовують анти-HER2neu засоби і цитостатичну терапію (найчастіше на основі антрациклінів).
Значно менше відомо про ефективні методи медикаментозного лікування базального типу раку грудної залози. Незважаючи на відносну його рідкість (до 15%), він упродовж останніх років перебуває в центрі уваги досліджень клініцистів. Виявлено численні клінічні відмінності базального типу від інших типів раку грудної залози. Зокрема, відзначають такі клінічні ознаки базального типу [2, 8, 11]:
- ризик підвищений при молодшому віці перших пологів і більшій кількості вагітностей, тобто, фактори ризику протилежні гормонозалежним типам (люмінальному A i B);
- частіше хворіють молоді жінки;
- висока частота низькодиференційованих пухлин (G3/G4), а також стромальної перитуморальної лімфоцитарної інфільтрації;
- первинні хворі мають пухлини більших розмірів;
- частота регіонарного метастазування є вищою навіть при невеликих розмірах пухлини;
- відсутня кореляція між розмірами пухлини й ураженням регіонарних лімфатичних вузлів;
- частіше трапляються віддалені метастази у вісцеральні органи (зокрема, легені) і мозок, але рідше — в кістки і м’які тканини;
- висока чутливість до хіміотерапії (ХТ), але й висока частота рецидивів;
- коротша тривалість виживаності після появи ознак прогресування.
Ці особливості зумовлюють несприятливий прогноз базального типу раку грудної залози. З’ясовано, наприклад, що медіана часу від виявлення рецидиву до смерті становить 9 міс проти 22 міс при інших типах [6].
Важливим з клінічної точки зору є те, що більшість випадків базального типу являють собою, за результатами імуногістохімічного аналізу, так званий «тричі негативний» рак грудної залози (коли відсутні ER, PgR та HER2neu). Лише 10–30% «тричі негативних» раків грудної залози не належать до базального типу, та тільки 15–40% базальних раків не є «тричі негативними» (а мають експресію рецепторів ER/PR і/або HER2neu).
У багатьох клінічних дослідженнях доведено, що чутливість «тричі негативного» раку грудної залози до ХТ суттєво вища, ніж інших (особливо гормоночутливих) типів.
За даними R. Rouzier та співавторів [12], неоад’ювантна ХТ дає можливість досягнути повної морфологічної регресії у 45% хворих на «тричі негативний» рак грудної залози і лише у 7% — при люмінальному типі А. З іншого боку, аналіз великого обсягу матеріалів провідного онкологічного закладу світу M.D. Anderson Cancer Center підтвердив клінічний парадокс «тричі негативного» раку грудної залози — при дуже високій чутливості до ХТ прогноз є несприятливим. Аналіз результатів неоад’ювантної ХТ у понад 1100 хворих показав, що частота повних морфологічних регресій пухлини при вказаному типі принаймні удвічі вища, ніж при інших типах.
Віддалені результати у хворих з повною регресією пухлини суттєво кращі, ніж у групі пацієнток з резидуальними пухлинами (рис. 1). Це стосувалося всіх типів раку грудної залози. З іншого боку, у хворих з резидуальною пухлиною безрецидивна та загальна виживаність суттєво гірша саме у пацієнтів з «тричі негативним» раком грудної залози — 63% проти 76% та 74% проти 89% [10].
![Рис. 1. Загальна виживаність залежно від ефекту ХТ (повна морфологічна регресія (pCR) проти резидуального процесу (RD)) при «тричі негативному» типі (TNBC) проти інших типів (non-TNBC)) [10]](http://www.clinicaloncology.com.ua/uploads/2013/01/wpid-188_01_fmt.jpeg)
В останні кілька років з’ясовано, що приблизно 5–10% випадків раку грудної залози зумовлено мутацією генів BRCA1/2 [1, 9, 13]. Більшість цих спадкових раків належать до базального типу [7] і є «тричі негативними» за рецепторним статусом (рис. 2). Відомо, що продукти немутованого гена BRCA відновлюють двонитчасті розриви ДНК. При мутаціях гена BRCA його продукти не беруть участі у відновленні ДНК, цю функцію бере на себе PARP (полі-ADP-рибоза-полімераза), яка відповідає за відновлення однонитчастих розривів.
![Рис. 2. Відношення базального «тричі негативного» та BRCA1-залежного раку грудної залози [7]](http://www.clinicaloncology.com.ua/uploads/2013/01/wpid-188_02_fmt1.jpeg)
Ці теоретичні дані є підставою для пошуку нових підходів у лікуванні BRCA-залежного раку грудної залози базального типу. Зокрема, припускають, що оптимальними в таких випадках є цитостатики, що порушують синтез ДНК шляхом утворення міжнитчастих швів, а саме похідні платини. За новими даними польських онкологів, неоад’ювантна ХТ цисплатином у монорежимі при BRCA1-залежному раку грудної залози є дуже ефективною — повну морфологічну регресію пухлини відзначали в 10 з 12 хворих [3].
Останнім часом важливим завданням є пригнічення спеціальними засобами не лише BRCA, але й PARP-відновлення ДНК PARP-інгібіторами, наприклад олапарибом. При цьому нормальні клітини, які зберігають BRCA-залежний механізм репарації, можуть відновлюватися й виживати в період PARP-інгібування. За останні роки отримано обнадійливі результати щодо застосування олапарибу при «тричі негативному» раку грудної залози. Ці препарати, зокрема, сенсибілізують пухлинні клітини до похідних платини, які за механізмом дії є PARP-інгібіторами [5].
Опис випадку
Пацієнтці Б.Б. 1941 р.н. (педагог за фахом) у віці 54 роки (1995 р.) проведено радикальне оперативне втручання, а також післяопераційну ХТ (стандартний режим: цисплатин + циклофосфамід) з приводу раку яєчника ІІІС стадії. У віці 59 років (2000 р.) виявлено доброякісну пухлину щитоподібної залози.
На початку 2010 р. 69-річна пацієнтка виявила пухлину у правій грудній залозі. Пройшла обстеження у кількох приватних спеціалізованих онкологічних клініках. При огляді встановлено діагноз — рак правої грудної залози ІІІА стадії, сT3сN1M0. Ознак прогресування раку яєчника не виявлено (ІІІ клінічна група). Проведено біопсію пухлини. Гістологічний висновок № 253–255 від 24.03.2010 р.: карцинома грудної залози з інфільтруючим ростом, ступінь диференціації — G2.
За результатами імуногістохімічного дослідження від 30.03.2010 р.: ER — помірно позитивна реакція (2+), PR — негативна реакція (-), c-erbB2 — різко позитивна реакція (3+). Таким чином, констатовано люмінальний тип B і призначено в передопераційний період гормонотерапію інгібіторами ароматази (летрозол), які є оптимальними при такому типі раку грудної залози.
Однак, за словами хворої, упродовж короткого часу прийому препарату пухлина різко збільшилася. Через те гормонотерапію припинено. Під час консиліуму вирішено провести передопераційне лікування цитостатиками (капецитабін) в комбінації з анти-HER2neu таргетною терапією (трастузумаб).
Хвора продовжила обстеження у Львівському державному онкологічному регіональному лікувально-діагностичному центрі. Після аналізу особливостей анамнезу (перенесений 15 років перед тим рак яєчника ІІІС стадії з високою ефективністю медикаментозної терапії на основі препаратів платини, спадковий анамнез, неефективність гормонотерапії) вирішено повторно провести імуногістохімічне дослідження.
Гістологічний висновок від 13.04.2010 р.: інфільтруюча часточкова карцинома. Рецепторний статус від 16.04.2010 р.: ЕR — негативна реакція, PR — негативна реакція, c-erbB2 — негативна реакція.
При комп’ютерній томографії органів грудної клітки від 17.03.2010 р.: в легенях залишкові явища перенесеного туберкульозу; у правій грудній залозі у верхньому квадранті утворення 45×31×24 мм щільно прилягає до передньої грудної стінки; у правій аксилярній ділянці лімфатичні вузли 15×7 і 10×7 мм. Виявлено явища остеопорозу і остеохондрозу. У проекції правої надниркової залози утворення 7 мм, подібне до аденоми. Інші методи обстеження (ультразвукове дослідження черевної порожнини, серця, магнітно-резонансна томографія органів малого таза та остеосцинтіографія) не виявили ознак дисемінації.
Детально проаналізовано генетичний анамнез. На рис. 3 подано родовід пробанда Б.Б. зі злоякісними пухлинами в родині. Рак яєчників діагностовано, окрім пробанда, у матері (у 48 років) та бабусі (у 75 років). Від раку матки померли тітка у віці 62 років та двоюрідна сестра пробанда по лінії матері у 70 років. Рак яєчника діагностовано у напівсибса жіночої статі по лінії матері у 79 років. Від раку легені помер дядько у віці 60 років. У пробанда є 2 здорових дітей (донька віком 38 та син 45 років). З’ясувалося, що доньці, яка проживає за кордоном, за направленням сімейного лікаря та гінеколога, зважаючи на генетичний анамнез, проводили молекулярно-генетичне дослідження. Вона знала про те, що є носієм мутації гена BRCA1, але не пригадувала, якого саме типу.
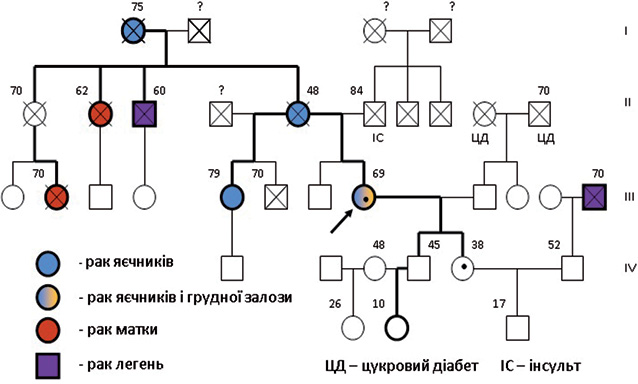
Враховуючи обтяженість анамнезу родоводу пробанда щодо злоякісних пухлин, запропоновано провести молекулярно-генетичне дослідження з метою виявлення мутацій в генах ВRCA1/2. Аналізуючи виділену ДНК, виявили мутацію 185 delAG (c.68_69 delAG) в гені ВRCA1. Через деякий час донька хворої надала результат свого молекулярно-генетичного аналізу — мутації збіглися.
Зважаючи на «тричі негативний» статус пухлини, виражений генетичний компонент, а також дані молекулярно-генетичного аналізу (виявлена мутація BRCA1), рекомендовано провести неоад’ювантну терапію на основі препаратів платини.
Проведено 2 цикли (23.04.2010 р. і 20.05.2010 р.) неоад’ювантної ХТ: перший — цисплатином у дозі 75 мг/м2, другий — карбоплатином у дозі AUC=6 (заміну проведено через дуже погану переносимість цисплатину). Досягнуто часткової регресії і рекомендовано оперативне втручання. Мастектомію за Мадденом з аксилярною дисекцією виконано 14.06.2010 р. Розміри пухлини, які зафіксував патоморфолог, — 1,5×2 см (таким чином, площа пухлини внаслідок ХТ зменшилася на 79%).
Гістологічний висновок № 25604 від 17.06.2010 р. — інфільтративна протокова карцинома з ділянками інфільтративної часточкової карциноми in situ з вогнищами склерозу та дистрофічного поліморфізму пухлинних клітин (ознаки лікувального патоморфозу). З 13 досліджених лімфовузлів у 2 знайдено метастази, причому в одному з них — мікрометастаз у вигляді поодиноких пухлинних клітин у крайовому синусі.
Після операції пацієнтка отримала 2 цикли ад’ювантної ХТ на основі карбоплатину (останній — 21.08.2010 р.). Через рік констатовано прогресування хвороби — збільшення контралатеральних лімфатичних вузлів. За допомогою позитронно-емісійної томографії (проведено 15.09.2011 р. в Ізраїлі) виявлено групу метастатично уражених контралатеральних аксилярних лімфатичних вузлів (максимальний розмір — 1,8×2,4 см). Починаючи з 05.10.2011 р. отримувала паліативну ХТ карбоплатином. Після 3-го циклу на комп’ютерній томограмі виявлено часткову регресію. Усього отримала 5 циклів (останній — 13.02.2012 р.), і через погану переносимість лікування припинено з констатуванням вираженої часткової регресії пухлинних утворень. На цей час (жовтень 2012 р.) пацієнтка перебуває під спостереженням онкологів.
Таким чином, описаний випадок ілюструє кілька важливих клінічних особливостей «тричі негативного» BRCA1-залежного раку грудної залози:
У хворих на рак грудної залози при вираженому сімейному онкологічному анамнезі (зокрема, накопиченні випадків раку грудної залози і яєчника) є висока ймовірність того, що морфологічно він буде так званого базального («тричі негативного») типу.
Наявність «тричі негативного» рецепторного статусу в комбінації з сімейним анамнезом є показанням до проведення молекулярно-генетичного аналізу на виявлення мутації гена BRCA.
У хворих на «тричі негативний» BRCA1-залежний рак грудної залози препаратами вибору для ХТ є похідні платини (цисплатин або карбоплатин).
Незважаючи на високу безпосередню ефективність ХТ, «тричі негативний» тип відрізняється несприятливим прогнозом (зокрема, швидким виникненням рецидивів й агресивним перебігом).
Список використаної літератури
1. Кіцера Н.І., Шпарик Я.В., Білинський Б.Т. та ін. (2012) Аналіз мутацій у генах BRCA1/2 у хворих на сімейний рак грудної залози, які проживають у Львівській області (Україна). Онкология, 14(1(51)): 44–49.
2. Amos K.D., Adamo B., Anders C.K.(2012) Triple-negative breast cancer: an update on neoadjuvant clinical trials. Int. J. Breast. Cancer. 385978.
3. Byrski T., Gronwald J., Huzarski T. et al (2010) Pathologic complete response rates in young women with BRCA1-positive breast cancers after neoadjuvant chemotherapy. J. Clin. Oncol., 28: 375–379.
4. Cardoso F., Harbeck N., Fallowfield L. et al (2012) Locally recurrent or metastatic breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 23 (suppl 7): vii11-vii19.
5. Curigliano G., Goldhirsch A. (2011) The triple-negative subtype: new ideas for the poorest prognosis breast cancer. J. Natl. Cancer Inst. Monogr., 43: 108–10.
6. Dent R., Trudeau M., Pritchard K. et al. (2007) Triple-negative breast cancer: clinical features and patterns of recurrence. Clinical Cancer Res.,13(15 Pt 1): 4429–34.
7. Diaz L.K., Cryns V.L., Symmans W.F., Sneige N. (2007) Triple negative breast carcinoma and the basal phenotype: from expression profiling to clinical practice. Adv. Anat. Pathol., 14(6): 419–430.
8. Isakoff S.J.(2010) Triple-negative breast cancer: role of specific chemotherapy agents. Cancer J., 16(1): 53–61.
9. Kumar B.V., Lakhotia S., Ankathil R. et al. (2002) Germline BRCA1 mutation analysis in Indian breast/ovarian cancer families. Сancer Biol. Ther., 1(1): 18–21.
10. Liedtke C., Mazouni C., Hess K.R. et al. (2008) Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J. Clin. Oncol., 26(8): 1275–81.
11. Millikan R.C., Newman B., Tse C.K. et al. (2008) Epidemiology of basal-like breast cancer. Breast Cancer Res. Treat., 109(1): 123–39.
12. Rouzier R., Perou C.M., Symmans W.F. et al. (2005) Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin. Cancer Res., 11(16): 5678–85.
13. Shiri-Sverdlov R., Gershoni-Baruch R., Ichezkel-Hirsch G. et al. (2001) The Tyr978X BRCA1 Mutation in Non-Ashkenazi Jews: Occurrence in High-Risk Families, General Population and Unselected Ovarian Cancer Patients. Community Genetic, 4(1): 50–55.
Эффективность производных платины при «трижды негативном» раке грудной железы с мутацией гена BRCA1 (случай из практики)
Резюме. В течение последних нескольких лет выяснилось, что примерно 5–10% рака грудной железы обусловлены мутацией генов BRCA1/2. Большинство этих наследственных раков относятся к базальному типу и являются «трижды негативными» по рецепторному статусу. Описан случай метахронного рака яичника и рака грудной железы у пациентки Б. Учитывая «трижды негативный» статус опухоли, выраженный генетический компонент (диагностировано 6 случаев злокачественных опухолей по материнской линии), а также данные молекулярно-генетического анализа (выявлена мутация 185 delAG в гене BRCA1), рекомендовано провести неоадъювантную терапию на основе препаратов платины. Пациентка получила 5 циклов паллиативной химиотерапии карбоплатином (последний — 13.02.2012 г.). По данным компьютерной томографии, после 3-го цикла химиотерапии установлено частичную регрессию болезни. В настоящее время (октябрь 2012 г.) пациентка находится под наблюдением онкологов.
Ключевые слова: рак грудной железы, родословная, ген BRCA1, препараты платины, лечение.
The effectiveness of platinum drugs in a «triple negative» breast cancer gene mutation in BRCA1 (сase of practice)
Summury. Over the last few years found that approximately 5–10% of breast cancer due to mutations in the genes BRCA1/2. Most of these hereditary cancers belong to the basal type is «triple negative» for receptor status. We describe a case ovarian cancer and breast cancer in patient B. Given the «triple negative» status tumors expressed genetic component (diagnosed 6 cases of malignant tumors of the maternal line), and molecular genetic data analysis (identified mutation in the gene 185 delAG BRCA1), it was recommended to neoadjuvant therapy based on platinum drugs. She received 5 cycles of palliative chemotherapy carboplatin (last 13.02.2012.) According to the CT scan after 3 cycles of chemotherapy found a partial regression of disease. At this time (October, 2012) the patient is under the supervision of oncologists.
Key words: breast cancer, family tree, gene BRCA1, platinum drugs, cancer treatment.














Leave a comment