Эффективность применения различных режимов химиотерапии темозоломидом у пациентов со злокачественными глиальными опухолями головного мозга
Главацкий А.Я. 1, Кардаш К.А. 2
- 1ГУ «Институт нейрохирургии им. акад. А.П. Ромоданова НАМН Украины», Киев
- 2Донецкий национальный медицинский университет им. Максима Горького
Резюме. Изучены результаты химиотерапии (ХТ) темозоломидом в схеме комбинированного лечения 121 пациента со злокачественными глиальными опухолями головного мозга. Больные разделены на 3 группы в зависимости от режима ХТ. Установлена более высокая эффективность конкомитантного режима применения темозоломида. Медиана выживаемости в случае конкомитантной ХТ при глиомах III и IV степени анаплазии превышает в 1,6 раза медиану при других режимах применения темозоломида.

В последние годы накоплен достаточный клинический опыт использования новых противоопухолевых агентов, которые в значительной степени соответствуют требованиям (проницаемость через гематоэнцефалический барьер (ГЭБ), липофильность и др.), предъявляемым к препаратам для лечения злокачественных глиальных опухолей головного мозга (ЗГОГМ) [1, 2]. Прежде всего это относится к алкилирующему препарату второго поколения, принадлежащему к классу имидазотетразинов, — темозоломиду (TMZ). На сегодня насчитывают более 2 тыс. научных публикаций, посвященных TMZ, проведены и проводятся десятки международных кооперированных исследований по изучению его эффективности при глиомах мозга. Он легко проникает через ГЭБ и накапливается в тканях опухоли в концентрациях, достаточных для реализации его противоопухолевой активности [3, 6].
За эти годы апробировали и продолжают изучать следующие режимы применения TMZ: 75 мг/м2 на фоне лучевой терапии (ЛТ) — непрерывно и с перерывом между циклами облучения (с переходом на последующий регламентирующий протокол); два 5-дневных цикла в дозе 150–200 мг/м2 соответственно двум этапам ЛТ с переходом на последующий регламентирующий протокол; 75 мг/м2 в течение 3 нед с 7-дневным перерывом (пролонгированный курс); 75 мг/м2 в течение 14 дней с 7-дневным интервалом; 5-дневный курсовой прием в стандартных дозах (200 мг/м2) с 23-дневным перерывом в адъювантном режиме; 5-дневный курсовой прием в стандартных дозах (150 мг/м2) с 23-дневным перерывом в адъювантном режиме; «облегченный» курсовой прием (при возникновении «допустимых» тромбоцитопении и нейтропении) — 100 мг/м2.
Особый интерес представляют исследования по применению TMZ в сочетании с ЛТ [5, 8]. Показано, что TMZ в 2,5–3 раза увеличивает гибель опухолевых клеток под воздействием ЛТ, элиминирует опухолевые элементы, находящиеся вне зоны облучения, повышает радиочувствительность опухолевых клеток. То есть TMZ является прямым радиосенсибилизатором, усиливающим эффективность ЛТ.
Полученные результаты инициировали проведение рандомизированных многоцентровых исследований по изучению TMZ в сочетании с ЛТ в качестве первой линии лечения при мультиформных глиобластомах. Эти исследования начаты в 2002 г. и продолжаются по сей день. С позиции доказательной медицины их результаты свидетельствуют о безусловных преимуществах конкомитантного режима применения TMZ [4, 7, 9].
Тем не менее в клинической практике мы часто сталкиваемся со случаями нарушения общеизвестного протокола назначения TMZ, которые в основном сводятся к занижению расчетной дозы препарата и изменению режима его применения. Эти ничем не обоснованные тенденции побудили авторов к проведению сравнительной оценки различных режимов химиотерапии TMZ ЗГОГМ на собственном клиническом опыте.
Цель исследования: проанализировать результаты лечения ЗГОГМ в зависимости от различных режимов применения TMZ; оценить общую и безрецидивную выживаемость и факторы, на них влияющие (методика Каплана — Мейера, регрессия Кокса).
Стратификация материала проведена по степени анаплазии опухоли, первичным и рецидивным глиомам, объему хирургического вмешательства.
Материалы и методы
Работа основана на анализе 121 случая ЗГОГМ. Этим пациентам в комбинированном лечении назначали TMZ в различных режимах.
Отбор больных проводили по следующим критериям:
1. Наличие у пациента злокачественной глиомы супратенториальной локализации.
2. Для каждого случая известно начало наблюдения.
3. Для каждого случая известен конец наблюдения, а также умер больной или выбыл (пациенты, которые умерли от причин, не связанных с изучаемым заболеванием, а также больные, которые по каким-либо причинам выбыли из исследования, — считались выбывшими).
4. Отсутствие у больных острой соматической патологии, которая ограничивала выбор метода лечения изучаемого заболевания.
5. Больной был выписан из стационара с результатом лечения: улучшение, без изменений, умер, — а не переведен в другое лечебное заведение для проведения лечения осложнений, не связанных с основным заболеванием, что также ограничивало выбор метода лечения злокачественной глиомы.
6. Выбор пациентов для исследования проводили в результате случайного отбора.
Мужчин было 46%, женщин — 54%. Средний возраст больных составлял 43,8 года. Соотношение мужчин и женщин — 0,86. Наибольшее количество больных — возрастная группа от 30 до 50 лет.
Учитывая, что исследование завершено до наступления исхода у всех больных, мы получили неполные данные о выживаемости, требующие цензурирования. Для учета выбывания (цензурирования) при построении таблиц выживаемости мы использовали моментный метод Каплана — Мейера:
Ŝ(t)=П(1-dti /nti),
где t — время; ti — определенный момент времени; Ŝ(t) — выживаемость больных на момент времени t; dti — количество умерших на момент ti; nti — числобольных, наблюдавшихся на момент ti; (1-dti/nti) — доля пациентов, переживших момент ti; П — символ произведения, который обозначает, что надо перемножить значения (1-dti/nti) для всех моментов, если произошла хотя бы одна смерть.
ЛТ, как правило, начинали через 2–4 недели после хирургического вмешательства. В большинстве случаев использовали режим традиционного фракционирования с разовой дозой 2 Гр и суммарной очаговой дозой 50–60 Гр. ЛТ проводили на гамма-терапевтических аппаратах «Тератрон 780С», «Агат-Р1» и «Рокус-М», а у части больных (41 случай) на линейных ускорителях Varian, Trilogy.
Изучены 3 наиболее часто применяемые на практике режима химиотерапии TMZ: конкомитантный (75 мг/м2 на фоне ЛТ непрерывно и с перерывом между циклами облучения — с переходом на последующий регламентирующий протокол), 5-дневный на фоне ЛТ (два 5-дневных цикла в дозе 150–200 мг/м2 соответственно 2 этапам ЛТ с переходом на последующий регламентирующий протокол) и адъювантный (5-дневный курсовой прием с 23-дневным перерывом в адъювантном режиме в стандартных дозах (200 мг/м2)) (табл. 1).
Таблица 1. Распределение больных с глиомами ІІІ–ІV степени анаплазии в зависимости от режима химиотерапии
| Режим химиотерапии | Количество больных | Прогрессирование опухолевого роста | Цензурирование | |
|---|---|---|---|---|
| n | % | |||
| Конкомитантный | 70 | 32 | 38 | 54,3 |
| 5-дневный на фоне ЛТ | 25 | 16 | 9 | 36,0 |
| Адъювантный | 26 | 13 | 13 | 50,0 |
| Всего | 121 | 61 | 60 | 49,6 |
По большинству основных показателей (пол, возраст, гистологический субтип глиом и степень их злокачественности, локализация и сторона поражения, радикальность удаления опухоли) группы больных между собой статистически значимо не различались.
В наших наблюдениях преобладали глиобластомы — 68,6% (83 случая). Из них 48 пациентов получили TMZ в конкомитантном режиме, 18 — в 5-дневном на фоне ЛТ и 17 — в адъювантном. При глиомах ІІІ степени анаплазии — 22; 7 и 9 соответственно.
Результаты и их обсуждение
Проанализирована средняя продолжительность жизни (СПЖ) и медиана общей выживаемости при различных режимах применения TMZ во всей исследуемой выборке (n=121).
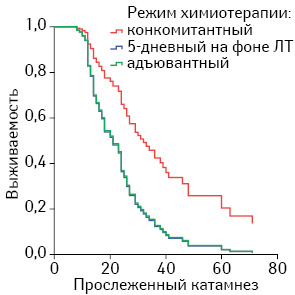
СПЖ в зависимости от режима химиотерапии при глиомах ІІІ и ІV степени анаплазии при конкомитантном применении TMZ составила 44,8±4,23 мес (95% доверительный интервал (ДИ) 36,5–53,1 мес), превышая таковую при 5-дневном на фоне ЛТ (39,6±7,7 мес, 95% ДИ 24,6–54,7), но статистически не отличалась от СПЖ при адъювантном режиме (45,6±4,0 мес, 95% ДИ 36,3–49,5 мес). В пользу конкомитантного режима применения TMZ более наглядно свидетельствует медиана выживаемости. Этот показатель при конкомитантном режиме превышает показатели при двух других в 1,6 раза (табл. 2, рис. 1).
Таблица 2. Медиана выживаемости в зависимости от режима химиотерапии при глиомах ІІІ–ІV степени анаплазии
| Режим химиотерапии | Медиана выживаемости | |||
|---|---|---|---|---|
| Значение, мес | Ст. отклонение, мес | 95% ДИ | ||
| Нижняя граница | Верхняя граница | |||
| Конкомитантный | 34,0 | 5,15 | 23,9 | 44,1 |
| 5-дневный на фоне ЛТ | 21,0 | 3,99 | 13,2 | 28,8 |
| Адъювантный | 21,0 | 4,83 | 12,4 | 29,6 |
| Общая в группе | 27,0 | 2,98 | 21,2 | 32,8 |
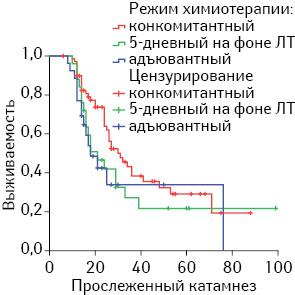
Безусловно, степень злокачественности опухоли значимо влияла на общую выживаемость. Общая СПЖ (при всех режимах TMZ) при глиомах ІІІ степени анаплазии составила 50,9±6,02 мес, 95% ДИ 39,1–62,7 мес, тогда как при глиомах IV степени анаплазии — 23,5±1,52 мес, 95% ДИ 20,5–26,5 мес. СПЖ при различной степени анаплазии опухоли имела свои особенности в зависимости от режима применения TMZ. Так, СПЖ при конкомитантном режиме в случае глиом ІІІ степени анаплазии почти в 2 раза превышала СПЖ при 5-дневном (54,0±5,90 мес, 95% ДИ 42,4–65,6 мес и 28,3±10,65 мес, 95% ДИ 7,4–49,2 мес соответственно), в то время как в адъювантном режиме статистически значимого различия не выявлено (46,1±10,81 мес, 95% ДИ 25,0–62,7 мес). При IV степени анаплазии в отличие от ІІІ показатели СПЖ при конкомитантном и 5-дневном режимах не имели различий: 25,8±2,14 мес, 95% ДИ 21,6–30,0 мес и 25,5±3,40, 95% ДИ 18,8–32,2 мес соответственно. СПЖ при адъювантном режиме был статистически значимо ниже: 14,8±1,25 мес, 95% ДИ 12,4–17,3 мес.
При анализе медианы общей выживаемости установлено, что общая медиана в подгруппе глиом ІІІ степени анаплазии в 2 раза превышала таковую в подгруппе глиом IV степени анаплазии, составляя 41,0±9,43 мес, 95% ДИ 22,5–59,5 мес и 21,0±2,28 мес, 95% ДИ 16,5–25,5 мес. Конкомитантный режим применения TMZ обеспечивал наибольшую медиану, независимо от степени анаплазии опухоли (табл. 3, рис. 2).
Таблица 3. Медиана выживаемости в подгруппах больных с глиомами ІІІ и ІV степени анаплазии в зависимости от режима химиотерапии
| Режим химиотерапии | Медиана выживаемости больных с глиомами ІІІ степени анаплазии | Медиана выживаемости больных с глиомами ІV степени анаплазии | ||||
|---|---|---|---|---|---|---|
| Медиана, Ме±m | 95% ДИ | Медиана, Ме±m | 95% ДИ | |||
| Нижняя граница | Верхняя граница | Нижняя граница | Верхняя граница | |||
| Конкомитантный | 60,0±9,52 | 41,3 | 78,6 | 24,0±1,02 | 22,0 | 26,0 |
| 5-дневный на фоне ЛТ | 17,0±3,93 | 9,3 | 24,7 | 21,0±5,30 | 10,6 | 31,4 |
| Адъювантный | 40,0±12,0 | 16,4 | 63,5 | 14,0±0,98 | 12,1 | 15,9 |
| Общая в подгруппе | 41,0±9,43 | 22,5 | 59,5 | 21,0±2,28 | 16,5 | 25,5 |
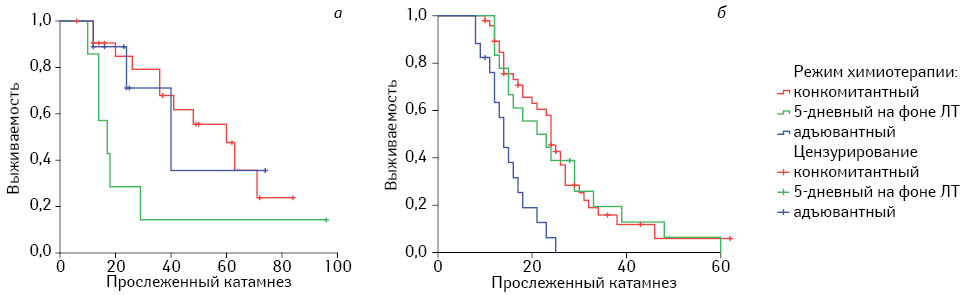
Помимо общей выживаемости пациентов, мы оценили и такой критерий, как продолжительность безрецидивного периода (БРП), что более объективно отражает эффективность проведенного комбинированного лечения глиом. Как правило, длительность БРП связана с высоким качеством жизни пациента, в то время как общая выживаемость включает и периоды суб- и декомпенсации при продолженном росте опухоли.
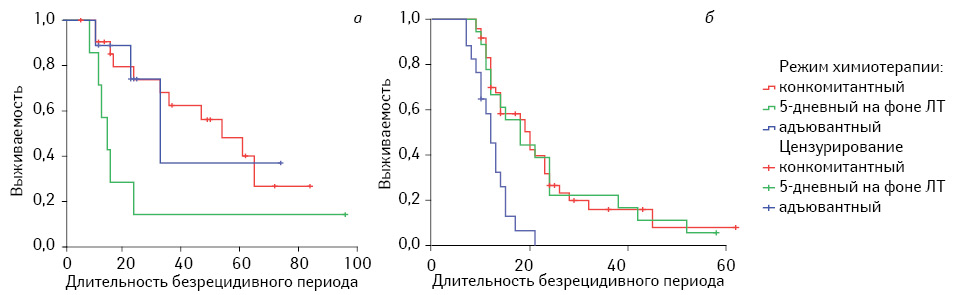
СПЖ и медиана БРП при глиомах ІІІ степени анаплазии, независимо от режима применения химиотерапии, также как и общая выживаемость, были значительно выше по сравнению с глиобластомами (глиомами IV степени анаплазии). Конкомитантный режим применения TMZ также обеспечивал наивысшие показатели БРП по сравнению с другими режимами его назначения (табл. 4). Особенно показательна высокая эффективность конкомитантной химиотерапии, независимо от степени анаплазии высокозлокачественных глиом, при анализе медианы БРП (см. табл. 4, рис. 3).
Таблица 4. Длительность БРП в зависимости от степени анаплазии и режима химиотерапии
| Режим химиотерапии | Глиомы ІІІ степени анаплазии | Глиомы IV степени анаплазии | ||
|---|---|---|---|---|
| СПЖ, M±m | Медиана, Mе±m | СПЖ, M±m | Медиана, Mе±m | |
| Конкомитантный | 51,5±6,38 | 54,0±10,94 | 23,2±2,52 | 20,0±1,16 |
| 5-дневный на фоне ЛТ | 26,4±10,86 | 15,0±2,62 | 22,9±3,40 | 18,0±3,16 |
| Адъювантный | 44,3±12,15 | 33,0±7,40 | 12,5±0,93 | 12,0±0,96 |
| Общая в группе | 49,8±6,29 | 36,0±13,26 | 21,0±1,68 | 15,0±1,61 |
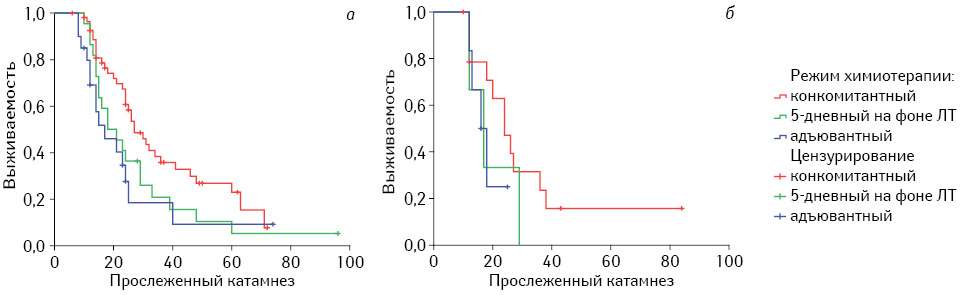
Мы получили возможность проанализировать результаты комбинированного лечения и при применении TMZ в различных режимах терапии первичных ЗГОГМ ІІІ и ІV степени анаплазии (97 наблюдений) и в случае их рецидивирования (24 наблюдения). Отмечена та же закономерность — наибольший лечебный эффект достигался при конкомитантной химиотерапии (табл. 5.). Эффективность химиотерапии, независимо от режима применения TMZ, была выше при первичных ЗГОГМ, хотя для окончательного подтверждения этого вывода необходимо большее количество наблюдений рецидивных глиом, о чем наглядно свидетельствуют результаты, полученные методом Каплана — Мейера (многократное пересечение кривых) (рис. 4).
Таблица 5. Общая выживаемость при первичных и рецидивных ЗГОГМ в зависимости от режима химиотерапии TMZ
| Режим химиотерапии | Первичные глиомы | Рецидивные глиомы | ||
|---|---|---|---|---|
| СПЖ, M±m | Медиана, Mе±m | СПЖ, M±m | Медиана, Mе±m | |
| Конкомитантный | 36,1±3,23 | 27,0±3,02 | 32,5±6,54 | 24,0±3,52 |
| 5-дневный на фоне ЛТ | 27,6±4,52 | 18,0±4,10 | 19,3±5,04 | 17,0±4,08 |
| Адъювантный | 23,6±4,80 | 17,0±4,76 | 17,6±2,08 | 16,0±2,45 |
| Общая в группе | 33,4±2,97 | 24,0±3,02 | 28,2±4,86 | 20,0±3,08 |
Эффективность конкомитантного режима химиотерапии TMZ у больных со злокачественными глиомами подтверждается уровнем общей выживаемости в многофакторном регрессионном анализе Кокса (рис. 5).
Выводы
В результате проведенных исследований продемонстрирована большая эффективность конкомитантного режима химиотерапии TMZ злокачественных глиом по сравнению с другими режимами его применения.
При глиомах как ІІІ, так и IV степени анаплазии статистически достоверная разница получена при оценке медианы общей (при ІІІ степени анаплазии — 60,0±9,52 мес при конкомитантном в сравнении с 17,0±3,93 мес — при 5-дневном и 40,0±12,0 мес — при адъювантном режимах; при IV степени анаплазии — 24,0±1,02, 21,0±5,30 и 14,0±0,98 мес соответственно) и безрецидивной (при ІІІ степени анаплазии — 51,5±6,38, 26,4±10,86 и 44,3±12,15 мес; при IV степени анаплазии — 23,2±2,52, 22,9±3,40 и 12,5±0,93 мес соответственно) выживаемости.
При глиомах ІІІ степени анаплазии режим адъювантной химиотерапии может быть альтернативой конкомитантному, о чем свидетельствуют данные о СПЖ (46,1±10,81 и 54,0±5,90 мес).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Зозуля Ю.А., Васильева И.Г., Главацкий А.Я. и др. (2007) Глиомы головного мозга (современное состояние проблемы и пути дальнейших поисков) / Под ред. Ю.А. Зозули. Киев: УИПК «ЕксОб», 630 c.
- Butrim A., Kozak O., Novopashinnaya V. et al. (2008) Analysis and response to chemotherapy and radiotherapy in newly diagnosed malignant glioma (153 patients). Material of conference «Perspectives in central nervous system malignancies (PCNSM 4)» (Berlin, 28–29 March 2008). 104 p.
- Easaw J.C., Mason W.P., Perry J. et al. (2011) Canadian recommendations for the treatment of recurrent or progressive glioblastoma multiforme. Current Oncology, 18(3): 126–136.
- Grossman S.A., Ye X., Piantadosi S. et al. (2010) Survival of patients with newly diagnosed glioblastoma treated with radiation and temozolomide in research studies in the Unated States. Clin. Cancer Res., 16: 2443–2449.
- Mirimanoff R.-O., Gorlia T., Mason W. et al. (2006) Radiotherapy and Temozolomide for Newly Diagnosed Glioblastoma: Recursive Partitioning Analysis of the EORTC 26981/22981-NCIC CE3 Phase III Randomized Trial. JCO, 24(16): 2563–2569.
- Nieder C., Adam M., Grosu A. L. (2006) Combined modality treatment of glioblastoma multiforme: the role of temozolomide. Rev. Recent. Clin. Trials, 1(1): 43–51.
- Panet-Raymond V., Souhami L., Roberge D. et al. (2009) Accelerated Hypofractionated Intensity-Modulated Radiotherapy With Concurrent and Adjuvant Temozolomide for Patients With Glioblastoma Multiforme: A Safety and Efficacy Analysis. Int. J. Radiat. Oncol. Biol. Phys., 73(2): 473–478.
- Stupp R., Mason W. P., van den Bent M. J. et al. (2005) Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N. Engl. J. Med., 352 (10): 987–996.
- Stupp R., Roila F. (2009) Malignant glioma: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann. Oncol., 20(suppl 4): iv126–iv128.
Ефективність застосування різних режимів хіміотерапії темозоломідом у пацієнтів зі злоякісними гліальними пухлинами головного мозку
Резюме. Вивчено результати хіміотерапії (ХТ) темозоломідом у схемі комбінованого лікування 121 пацієнта зі злоякісними гліальними пухлинами головного мозку. Хворих розділено на 3 групи залежно від режиму ХТ. Встановлено вищу ефективність конкомітантного режиму застосування темозоломіду. Медіана виживаності у випадку конкомітантної ХТ при гліомах III і IV ступеня анаплазії перевищує в 1,6 разу медіану при інших режимах застосування темозоломіду.
Ключові слова: темозоломід, конкомітантна хіміотерапія, злоякісні гліальні пухлини головного мозку супратенторіальної локалізації.
Efficacy of different regimes chemotherapy with temosolomide in patients with malignant brain gliomas
Summary. The results of chemotherapy with temozolomide of 121 patients with malignant brain gliomas were analyzed. The patients were divided in 3 groups depending from chemotherapy’s regime. We revealed higher effect of concomitant temozolomide’ chemotherapy. In concomitant group of patients with malignant gliomas III and IV grade of anaplasia the median survival was in 1.6 times higher than in groups of others regimes of temozolomide’ therapy.
Key words: temozolomide, concomitant chemotherapy, supratentorial localized malignant brain gliomas.














Leave a comment