Адъювантная терапия рака желудка: настало ли ее время?
Резюме. До настоящего времени хирургическое лечение остается главным методом терапии ранних стадий рака желудка, однако становится все более очевидным, что в большинстве случаев рак желудка представляет собой системное заболевание. Системность подтверждается неудовлетворительными результатами хирургических вмешательств у больных с I–III cтадией рака. Более чем у 50% из них после радикальной операции в последующем отмечают прогрессирование заболевания в основном за счет развития отдаленных метастазов.
Примерно у 30% больных раком желудка (РЖ) I–II стадии выявляют циркулирующие опухолевые клетки в периферической крови и/или микрометастазы в костном мозгу, наличие которых значимо повышает риск развития отдаленных метастазов после операции. Все это делает обоснованным желание применять системную терапию, в частности химиотерапию (ХТ), на предоперационном или послеоперационном этапах у пациентов с операбельным РЖ для улучшения отдаленных результатов лечения.
Для оценки эффективности адъювантной терапии РЖ в конце 1990-х — начале 2000-х гг. проведено несколько рандомизированных исследований, однако немногочисленность больных, включенных в эти исследования, и противоречивость результатов не позволили сделать однозначного заключения о клинической целесообразности подобного подхода. Вместе с тем проведенный метаанализ свидетельствовал о том, что применение адъювантной терапии с включением фторпиримидинов может увеличивать 5-летнюю общую выживаемость (ОВ) на 4,8% (с 49,5% в группе хирургического лечения до 55,3% в группе комбинированного лечения; относительный риск (ОР)=0,82; р<0,001) [1].
Однако адъювантная терапия на сегодня не является стандартным подходом в лечении больных РЖ. Есть несколько причин. Основной причиной является отсутствие эффективных препаратов и комбинаций для лечения РЖ. Сегодня ни одна из применяемых комбинаций для терапии метастатического РЖ не позволяет достигнуть медианы продолжительности жизни >12 мес, что ставит под сомнение эффективность этих же комбинаций при использовании их в адъювантном режиме (с целью повышения шанса на излечение).
Вследствие этого отсутствует единое мнение о стандарте проведения первой линии ХТ. В некоторых странах применяют комбинацию цисплатина и капецитабина или инфузий флуороурацила (ФУ), в других — режим ЕСF (эпирубицин, цисплатин, ФУ). Остается популярным назначение комбинации ТСF (доцетаксел, цисплатин, ФУ). Все большую популярность завоевывает режим САРОХ (капецитабин + оксалиплатин).
Другая важная причина непопулярности адъювантной ХТ (АХТ) — неудовлетворительное общее состояние больных после перенесенной гастрэктомии (ГЭ), часто или всегда сопровождаемой лимфодиссекцией в разном объеме. На момент начала лечения большинство подобных пациентов имеют серьезный дефицит массы тела, который продолжает расти после операции в связи с нарушениями всасывания и развитием у части больных демпинг-синдрома. Проведение ХТ на этом фоне сопровождается частым возникновением тяжелых осложнений, требующих снижения доз препаратов, увеличения интервалов или отказа от дальнейшего лечения. Все это приводит к уменьшению потенциальной пользы от проведения АХТ у больных РЖ.
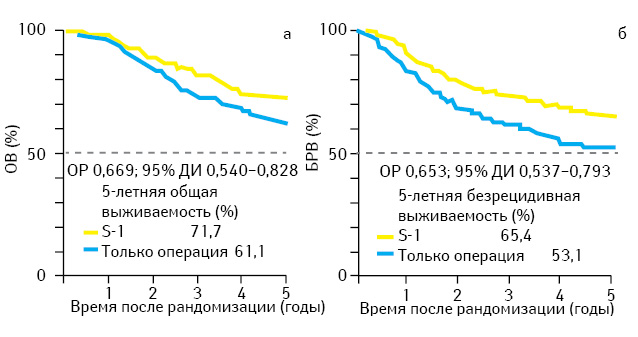
Однако результаты последних исследований заставляют по-новому оценить возможности АХТ при РЖ. В исследовании японских авторов пациентам с РЖ II–III стадии проводили ГЭ с лимфодиссекцией D2 с или без добавления в послеоперационный период препарата S-1 (комбинированный препарат, состоящий из тегафура и ингибитора дигидропиримидиндегидрогеназы, разрушающей фторпиримидины) в течение года [2]. В исследование включено 1059 больных, на сегодня известны результаты 5-летнего наблюдения. 5-летняя ОВ в группе пациентов, получивших только хирургическое лечение, составила 61,1%, а в группе АХТ — 71,7% (снижение ОР смерти на 33%; ОР=0,669; р<0,05), 5-летняя безрецидивная выживаемость (БРВ) составила 53,1 и 65,4% соответственно (снижение ОР прогрессирования заболевания на 35%; ОР=0,653; р<0,05) (рис. 1). Лечение S-1 переносилось хорошо, основным проявлением токсичности было снижение аппетита. Нежелательные явления III–IV степени выраженности наблюдали лишь у 5% больных. 12-месячный курс лечения завершили 66% пациентов, половине из них потребовалось снижение дозы. Подгрупповой анализ показал, что улучшение результатов лечения при назначении АХТ происходило вне зависимости от стадии заболевания, морфологии опухоли, возраста и пола пациентов. На основании этих данных авторы сделали вывод, что годичная АХТ пероральным фторпиримидином S-1 улучшает результаты лечения больных РЖ II–III стадии, подвергнутых ГЭ с лимфодиссекцией D2.
Другое исследование (CLASSIC) также проведено в странах Азии (Китае, Корее, Тайване) с участием больных РЖ после ГЭ и лимфодиссекции D2 [3]. В этом исследовании, в которое включено 1035 пациентов, в качестве адъювантной терапии применяли комбинацию CAPOX (оксалиплатин в дозе 130 мг/м2 в 1-й день и капецитабин в дозе 1000 мг/м2 внутрь 2 раза в день в течение 1–14-го дня каждые 3 нед, 8 курсов лечения). При среднем сроке наблюдения 34 мес 3-летняя БРВ составила 59% в группе только хирургического лечения и 74% в группе АХТ (снижение риска прогрессирования на 44%; ОР=0,56; р<0,0001) (рис. 2). Назначение ХТ сопровождалось развитием нежелательных явлений III–IV степени у 56% больных (наиболее часто наблюдали нейтропению — 22%, тромбоцитопению — 8%, тошноту — 8% и рвоту — 8%, общую слабость). Частота развития сенсорной нейропатии I–II степени составила 10%, и лишь у 3 пациентов это осложнение достигло III степени выраженности. Все 8 курсов терапии получили 67% больных, однако почти у всех потребовалось снижение дозы. Токсичность стала причиной прекращения терапии у 10% пациентов.
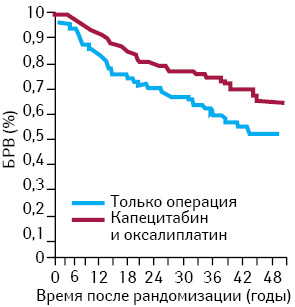
Подгрупповой анализ свидетельствует о пользе от проведения АХТ, отмеченной у больных мужского пола с опухолями N 1–2 и не зависящей от стадии заболевания и возраста. Авторы данного исследования также сделали вывод, что проведение АХТ после ГЭ с лимфодиссекцией D2 снижает риск прогрессирования заболевания у больных РЖ.
Картина адъювантных методов лечения РЖ будет неполной без упоминания химиолучевой терапии (ХЛТ). Американские ученые в исследовании SWOG-0116 показали, что введение ФУ и кальций фолината до, в процессе и после лучевой терапии (ЛТ) на верхний этаж брюшной полости (суммарная очаговая доза (СОД) 45 Гр) улучшает показатели ОВ и БРВ больных РЖ Т3–4 и N+ после ГЭ и лимфодиссекции D0–1 [4].
Данная методика стала стандартной в США, где ГЭ зачастую не сопровождается расширенной лимфодиссекцией. Большинство ученых пришли к заключению, что проведение ЛТ в данном случае компенсирует недостаточный объем оперативного вмешательства.
В исследовании ARTIST корейскими учеными предпринята попытка оценить целесообразность добавления ЛТ к АХТ CAPOX у больных РЖ после ГЭ и лимфодиссекции D2 [5]. Добавление ЛТ не улучшило результаты адъювантного лечения, хотя в группе больных с метастазами в регионарных лимфоузлах отмечена тенденция к улучшению БРВ. Осуществлена попытка повышения результатов ХЛТ за счет замены ФУ и кальций фолината на режим ECF [6]. Предварительный анализ показал отсутствие преимуществ при использовании более интенсивной ХТ.
В России проведение ХЛТ при РЖ в целом (включая местно-распространенные, неоперабельные опухоли) и в качестве адъювантной терапии в частности не пользуется популярностью. Во всяком случае, в практике автора не было ни одного больного, получившего данное лечение. Методика облучения верхнего этажа брюшной полости трудоемка, требует современных ускорителей и тщательного дозиметрического планирования. Кроме того, в РФ отмечается тенденция к увеличению количества пациентов, у которых ГЭ сопровождается лимфодиссекцией D2, после которой проведение ХЛТ не продемонстрировало преимуществ.
Еще одним подходом, исследуемым при операбельном РЖ, является проведение ХТ до и после операции. Cunnignam и соавторы оценивали эффективность добавления 3 курсов лечения в режиме ЕСF предоперационно и 3 курсов адъювантно [7]. Потенциальными преимуществами предоперационной системной терапии являлось ожидаемое повышение частоты R0-резекции вследствие уменьшения размеров опухоли, элиминация микрометастазов, уменьшение выраженности симптомов, обусловленных опухолевым процессом, и оценка чувствительности опухоли к проводимой ХТ. Комбинация ЕСF предусматривала введение каждые 3 нед эпирубицина в дозе 50 мг/м2, цисплатина — 60 мг/м2 и постоянную инфузию ФУ в суточной дозе 200 мг/м2 в течение 21 дня. В исследование включены 503 пациента с резектабельной аденокарциномой желудка и нижних отделов пищевода, которых рандомизировали на группы проведения радикальной операции с или без дополнительного лекарственного лечения. Больные, получившие предоперационную ХТ, продемонстрировали хорошую переносимость, меньшую опухолевую распространенность и одинаковую частоту послеоперационных осложнений. Из 250 пациентов, рандомизированных в группу ХТ, 215 (86%) получили 3 курса предоперационной и 104 (42%) закончили 6 курсов ХТ. По сравнению с больными, которым выполнено только операцию, проведение системной ХТ снизило ОР прогрессирования на 34% (ОР=0,66; р<0,001) и риск смерти на 25% (ОР=0,75; р=0,009), что позволило увеличить 5-летнюю выживаемость с 23 до 36%.
По мнению автора, предоперационная терапия РЖ в ближайшее время не будет востребована в России, поскольку потребует изменения психологии хирургов, к которым в первую очередь попадают больные операбельным РЖ и которые рассматривают это заболевание как чисто хирургическую проблему. Системность РЖ, как и всех других злокачественных опухолей, требует мультидисциплинарного подхода, обсуждения тактики лечения больного, в том числе и целесообразности выполнения операции или проведения системной терапии на первом этапе онкологами различных специальностей сразу после установления диагноза. Пока это не станет повседневной практикой в работе любого онкологического учреждения, предоперационная системная терапия у операбельных больных не будет популярной. Однако уже сегодня онкологи-химиотерапевты могли бы более активно использовать в своей практике назначение адъювантной системной ХТ. За последние годы получены убедительные свидетельства того, что ее проведение достоверно улучшает отдаленные результаты оперативного лечения РЖ, в том числе ГЭ с лимфодиссекцией D2. Комбинацию САРОХ широко используют для лечения колоректального рака, и большинство практикующих химиотерапевтов имеют личный опыт ее применения. С учетом 15% разницы в 3-летней БРВ нет оснований отказывать в проведении АХТ САРОХ пациентам с РЖ, имеющим удовлетворительное общее состояние после ГЭ и лимфодиссекции D2 (как минимум при наличии метастазов в удаленных лимфоузлах).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. GASTRIC Group, Paoletti X., Oba K., Burzykowsky T. et al. (2010) Benefit of Adjuvant chemotherapy for resectable gastric cancer: a meta-analysis. JAMA; 303: 1729–37.
2. Sasako M., Sakuromoto S., Katai H. et al. (2011) Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J. Clin. Oncol.; 29: 4387–93.
3. Bang Y.-J., Kim Y.-W., Yang H.-K. et al. (2012) Adjuvant capecitabine and oxali-platin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomized controlled trial. Lancet; 379: 315–21.
4. Smalley S.R., Benedetti J.K., Haller D.G. et al. (2012) Updated analysis of SWOG-directed Intergroup study 0116: A phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J. Clin. Oncol., 30: 2327–33.
5. Lee J., Lim do H., Kim S. et al. (2012) Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: The ARTIST trial. J. Clin. Oncol., 30: 268–73.
6. Fuchs C.S., Tepper J.E., Niedzwiecki D. et al. (2011) Postoperative adjuvant chemoradiation for gastric or gastroesophageal junction (GEJ) adenocarcinoma using epirubicin, cisplatin, and infusional (CI) 5-FU (ECF) before and after CI 5-FU and radiotherapy (CRT) compared with bolus 5-FU/LV before and after CRT: Intergroup trial CALGB 80101. J Clin Oncol; 29 (suppl): 256s, abstr 4003.
7. Cunningham D., Allum W.H., Stenning S.P. et al. (2006) Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N. Eng. J. Med., 355: 11–20.
Публикация подготовлена по материалам статьи С.А. Тюляндина «Адъювантная терапия рака желудка: настало ли ее время?» (Рос. онкол. портал профессионального общества онкологов-химиотерапевтов в составе проекта oncology.ru; www.rosoncoweb.ru/ news/oncology/2012/10/18/), предоставленной компанией «Рош Украина».
Ад’ювантна терапія раку шлунка: чи настав її час?
Резюме. Досі хірургічне лікування залишається головним методом терапії ранніх стадій раку шлунка, однак стає все більш очевидним, що у більшості випадків рак шлунка є системним захворюванням. Системність підтверджується незадовільними результатами хірургічних втручань у хворих із I–III cтадією раку. Більш ніж у 50% з них після радикальної операції надалі відзначають прогресування захворювання в основному за рахунок розвитку віддалених метастазів.
Ключові слова: рак шлунка, ад’ювантна хіміотерапія, ад’ювантна хіміопроменева терапія, неоад’ювантна терапія.
Adjuvant therapy of gastric cancer: now is the time?
Summary. Up to the present time surgical treatment remains the main method of treatment of the early stages of stomach cancer, but it is becoming increasingly evident that in most cases the stomach cancer is a systemic disease. This is confirmed by the unsatisfactory results of surgical interventions in patients with I–III stages of cancer. More than 50% of them after radical operation in the subsequent noted the progression of the disease is mainly due to the development of distant metastases.
Key words: stomach cancer, adjuvant chemotherapy, adjuvant radiochemotherapy, neoadjuvant therapy.














Leave a comment