Гормональный канцерогенез и обоснование применения гормональной терапии в лечении больных раком яичника (обзор литературы)
Воробьева Л.И., Свинцицкий В.С., Ткаля Ю.Г.
Резюме. Заболеваемость и смертность больных раком яичника в странах СНГ, Европы, США за последние 10 лет повышаются, несмотря на усовершенствование хирургических методик лечения и использование современных химиопрепаратов. Вопрос о применении гормонотерапии в лечении больных раком яичника на сегодня остается открытым. Данные зарубежных и отечественных исследований подтверждают гормонозависимость рака яичника наличием в опухолевой ткани рецепторов ко всем половым стероидным гормонам, однако сведения о факторах прогноза течения заболевания с учетом гормонального рецепторного статуса и распределения рецепторов стероидных гормонов в опухолевой ткани в зависимости от ее биологических свойств разноречивы. Цель работы — показать на основании литературных данных интерес ученых к изучению гормонального канцерогенеза, этиологии и патогенеза рака яичника, актуальность этого вопроса и необходимость дальнейших исследований в этом направлении.
Введение
Рак яичника (РЯ) является одной из самых сложных проблем онкогинекологии, занимает 7-е место в структуре заболеваемости и 4-е — среди причин смертности от всех злокачественных опухолей у женщин, а в структуре опухолей женской репродуктивной системы — соответственно 4-е (после рака грудной железы, тела и шейки матки) и 1-е места [10, 13, 31, 39, 63]. По данным Международного агентства по изучению рака, в мире ежегодно регистрируют около 225 тыс. новых случаев злокачественных опухолей яичника (ОЯ) и 140 тыс. женщин умирают от этого заболевания (рис. 1) [70]. За последние 10 лет в странах СНГ отмечают прирост заболеваемости РЯ на 8,5%. Наивысшие показатели заболеваемости фиксируют в развитых странах Европы (страны Северной Европы, Великобритания) и США (рис. 2, 3) [56].
![Рис. 1. Заболеваемость и смертность женского населения от РЯ в развитых странах [70]](http://www.clinicaloncology.com.ua/uploads/2013/04/wpid-239_01_fmt.jpeg)
![Рис. 2. Заболеваемость и смертность от РЯ на 100 тыс. населения в разных странах мира [70]](http://www.clinicaloncology.com.ua/uploads/2013/04/wpid-239_02_fmt.jpeg)
![Рис. 3. Заболеваемость РЯ на 100 тыс. населения в странах Европы [56]](http://www.clinicaloncology.com.ua/uploads/2013/04/wpid-239_03_fmt.jpeg)
По данным Национального канцер-регистра заболеваемость РЯ в Украине в 2010 г. составила — 17,0, а смертность — 8,7 случаев на 100 тыс. женского населения, а в 2011 г. — 16,6 и 9,6 соответственно [32].
За последние 10 лет смертность от РЯ в разных странах мира, в том числе и в Украине, имеет тенденцию к повышению (рис. 4) [32, 56, 70]. По данным популяционных канцер-регистров стран Европы, 1-летняя выживаемость больных РЯ составляет 63%; 3-летняя — 41%; 5-летняя — 35% [56].
![Рис. 4. Популяционный показатель смертности больных РЯ в странах Европы [56]](http://www.clinicaloncology.com.ua/uploads/2013/04/wpid-239_04_fmt.jpeg)
К основным причинам низкой выживаемости больных РЯ относятся: бессимптомное течение болезни в ранних стадиях, отсутствие патогномоничных симптомов, широкий возрастной диапазон заболевших женщин, вследствие чего у 75% больных РЯ диагностируют в III–IV стадии [13, 35, 42, 75].
Стратегия лечения больных РЯ включает хирургический компонент и химиотерапию (чувствительность ОЯ к цитостатикам составляет около 75%) [8, 10, 12, 13, 31, 63]. При некоторых ОЯ (дисгерминомы, андробластомы) применяют лучевую терапию [12, 13]. Возможность использования различных методов терапии создает предпосылки для длительного лечения больных и позволяет рассматривать данное заболевание как хронический процесс, требующий постоянного поэтапного лечения [7, 10, 31, 39, 63].
Несмотря на усовершенствование методик хирургического лечения и применение современных схем химиотерапии [28, 41, 50, 52, 64], отдаленные результаты терапии больных с распространенным РЯ остаются неудовлетворительными. По данным Национального канцер-регистра, 5-летняя выживаемость при II стадии составляет 55–67%, III стадии — 11–15%, IV стадии — 0–5% [32, 36].
Гормонозависимость РЯ остается дискутабельным вопросом в современной онкогинекологии. Его решение позволит не только уточнить патогенез развития РЯ, его прогноз, но и обосновать показания к проведению гормональной терапии (ГТ) в качестве компонента комплексного лечения.
Существует несколько гипотез, объясняющих злокачественную трансформацию эпителия яичников (таблица) [56], при которой не отмечают генетической предрасположенности к возникновению РЯ, обусловленной мутациями генов BRCA1 и BRCA2 [57, 66, 68].
Таблица. Возможные механизмы предрасположенности к возникновению РЯ
| Гипотеза | Предполагаемый механизм | Подтверждения |
|---|---|---|
| Постоянная овуляция | ПЭЯ повреждается во время овуляции, а восстановительные процессы повышают подверженность к мутациям | Риск РЯ снижается при уменьшении числа овуляторных циклов (при беременности, завершившейся родами, кормлении грудью, приеме ПК) |
| Стимуляция гонадотропинами | ФСГ и ЛГ стимулируют рост опухоли, клеточное деление и мутагенез | Повышение риска РЯ при бесплодии, СПКЯ; снижение риска при приеме прогестагенных препаратов; ФСГ повышает экспрессию многих онкогенов и стимулирует опухолевый рост (экспериментальные данные) |
| Гормональная стимуляция | Высокие концентрации андрогенов в микроокружении опухоли стимулируют канцерогенез, в то время как прогестагены снижают риск РЯ | Состояния, сопровождающиеся высоким уровнем циркулирующих андрогенов (СПКЯ), повышают риск РЯ, андрогены — превалирующие гормоны в инклюзионных кистах; применение прогестагенов снижает риск РЯ |
| Воспаление | Повреждение ПЭЯ при овуляции вызывает воспаление, которое стимулирует перестройку ткани и повышает подверженность к мутациям | Возможность снижения риска РЯ при приеме НПВС; высокое содержание воспалительных медиаторов в опухолевой ткани |
Сокращения: ПЭЯ — поверхностный эпителий яичников; ПК — пероральные контрацептивы; СПКЯ — синдром поликистозных яичников; НПВС — нестероидные противовоспалительные средства
Гипотеза гиперстимуляции яичников, предложенная M.F. Fathalla (1971) [65], основывается на повышении риска РЯ у женщин с большим числом овуляций. Предполагается, что во время овуляции происходит погружение и повреждение клеток поверхностного эпителия яичника, а последующие репаративные процессы в таких клетках повышают риск возникновения мутации с малигнизацией. В соответствии с этой гипотезой риск РЯ ниже у женщин, имевших много беременностей, завершившихся родами [61, 92, 93, 104], долго кормивших грудью [72] и применявших пероральные контрацептивы [85, 94, 104].
Имеются также экспериментальные подтверждения гипотезы гиперстимуляции яичников, полученные в опытах на приматах и других животных [67, 79]. Однако против данной гипотезы свидетельствует то, что прогестагенные препараты не подавляют овуляцию, но при этом не менее эффективны в профилактике РЯ, чем контрацептивы, подавляющие овуляцию [93].
Кроме того, при синдроме поликистозных яичников риск возникновения РЯ повышается, хотя число овуляторных циклов у этих женщин уменьшено [98]. Однако последнее утверждение дискутабельно, так как в последние годы установлено, что РЯ развивается чаще при трубном бесплодии, при котором сохраняется овуляция, в то время как у женщин с эндокринным бесплодием, имеющих ановуляторный цикл, а также у которых гормональные нарушения сочетаются с метаболическими изменениями, РЯ практически не развивается [43].
Гонадотропиновая гипотеза, согласно которой стимуляция поверхностного эпителия яичников фолликулостимулирующим и лютеинизирующим гормонами (ФСГ и ЛГ) может повышать риск его малигнизации. A.S. Whittemore и соавторы (1992) [104] провели исследования по типу случай — контроль, в которых показали, что у бесплодных женщин, получавших препараты, стимулирующие овуляцию, риск развития РЯ оказался выше в 2,8 раза, а пограничных опухолей — в 4 раза по сравнению с бесплодными женщинами, не получавшими препараты для повышения фертильности. Однако в последующих исследованиях (типа случай — контроль и когортных) выявлено непостоянство связи между применением гонадотропинов и РЯ [53 ].
Рецепторы к ФСГ и ЛГ выявляют у 100% нормальных клеток поверхностного эпителия яичников и у 60% злокачественных клеток [106]. Данные исследований показали, что ФСГ, ЛГ и хорионический гонадотропин человека могут стимулировать пролиферацию клеток РЯ и активировать митоген-активируемую протеинкиназу [60]. Индуцированная гиперэкспрессия рецептора к ФСГ ведет к повышению экспрессии рецептора эпидермального фактора роста (epidermal growth factor receptor — EGFR), рецептора типа 2 к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2 — HER2) [60]. К другим возможным онкогенам, экспрессия которых повышается при воздействии ФСГ и ЛГ in vitro, относятся β-катенин, Meis-1, циклин G2, инсулиноподобный фактор роста 1 и интегрин β-1 [77, 101].
Пока ни в одном исследовании не доказанно, что воздействие гонадотропинов способно индуцировать злокачественную трансформацию поверхностного эпителия яичников. Тем не менее в экспериментах с трансплантацией опухолей животным гонадотропные препараты ускоряют рост опухоли и ангиогенез [96], усиливают экспрессию фактора роста эндотелия (vascular endothelial growth factor — VEGF) [103] и адгезию клеток [97]. Эти данные свидетельствуют, что гонадотропные гормоны стимулируют прогрессию РЯ, но не подтверждают их этиологической роли.
Гипотеза гормональной стимуляции. Данные эпидемиологических исследований свидетельствуют, что прогестерон, его производные и комбинированные пероральные контрацептивы снижают риск РЯ [93, 95]. В состояниях, сопровождающихся повышенным уровнем андрогенов (синдром поликистозных яичников), возрастает риск развития РЯ [98]. Наивысшая концентрация андрогенов создается внутри растущих фолликулов, которые через рецепторный аппарат поверхностного эпителия яичников усиливают пролиферацию клеток [58].
Гипотеза воспаления. Авторами R.B. Ness, C. Cottreau (1999) [86] изучена этиологическая роль воспаления в канцерогенезе РЯ, которое сопровождает каждую овуляцию и приводит к высвобождению цитокинов, и как следствие — к тканевым перестройкам, что предрасполагает клетки поверхностного эпителия к генетическим повреждениям и злокачественной трансформации. Гипотеза подтверждается снижением риска развития РЯ у женщин, регулярно принимающих нестероидные противовоспалительные средства, в частности ацетилсалициловую кислоту и парацетамол [48]. Конечными мишенями сигнальной системы, запускаемой нестероидными противовоспалительными средствами, служат NO-синтаза, циклооксигеназа-2, VEGF и NF-кВ, которые вовлечены в механизмы канцерогенеза [48].
Теория гормонального канцерогенеза
Гормонозависимый рак — определенный парадокс для теории онкогена, поскольку предполагает механизм трансформации за счет генотоксического действия канцерогенов, а гормоны негенотоксичны и осуществляют нормальные регуляторные функции в организме [42].
Механизм гормонального канцерогенеза условно делится на две структуры: первая — нейрогормональная регуляция на уровне организма, нарушение которой приводит к избыточной хронической пролиферации в гормонозависимой ткани, что в настоящее время изучено [17]. Вопрос гормонозависимого рака в теории онкогена не выяснен и связан со второй структурой, которая следует за изменением пролиферативного режима в ткани и объясняет онкологический смысл гормональной стимуляции пролиферации [44]. Поддержание постоянства внутренней среды в организме осуществляется механизмом отрицательной обратной связи [14]. Интеграция действия гормонов происходит в гипофизе, который контролирует активность всех эндокринных желез [15]. Однако гипофиз воспринимает сигналы преимущественно гормонального характера. Вся информация, поступающая через вегетативную нервную систему, обрабатывается в гипоталамусе — координаторе вегетативной и эндокринной деятельности. Механизм отрицательной обратной связи проявляется в регуляции интегральной нейроэндокринной системы.
Гипоталамо-гипофизарный комплекс контролирует влияние на организм центральной нервной системы. Нарушение функции гормонозависимого органа вызывает изменение гормонального баланса многих систем [17, 42]. Как правило, происходит стимуляция и активация резервов компенсации, направленных на восстановление нарушенного равновесия. Возникают компенсаторные, хронические пролиферативные процессы в эндокриннозависимом органе [15, 16].
Развитие гормонозависимого рака происходит следующим образом: нарушение синтеза или инактивации гормона периферической эндокринной железы приводит к прекращению тормозящего действия на гипофиз, опосредуемому гипоталамусом; синтез гормонов гипофиза активируется, происходит гиперстимуляция периферической железы [42]. Таким образом, повышается содержание гормонов в крови, происходит стимуляция процессов пролиферации в ткани, которая претерпевает опухолевое превращение [44].
Анализируя роль пролиферативного эффекта гормонов, И.П. Терещенко и А.П. Кашулина (1983) [22] делают вывод, что все пролиферативно активные гормоны в определенных условиях и при достаточной настойчивости экспериментатора могут стать причиной нарушения регуляторных механизмов клеточного деления и дифференциации, приводящих к малигнизации ткани.
И.А. Алов (1964) [2], О.И. Епифанова (1965) [19], С.С. Лагучев (1970) [26], изучая механизм регуляции размножения клеток с помощью метода ауторадиографии, пришли к выводу, что гормоны являются митотическими регуляторами.
Е.М. Самунджан (1973) [34] на протяжении нескольких лет изучала роль пролиферации как фактора канцерогенеза и выявила следующие корреляции:
- развитие дисгормональных опухолей вызывают лишь те гормоны, которые стимулируют пролиферативные процессы в нормальных тканях;
- установлена связь между развитием рака грудной железы, рака тела матки и длительной гиперэстрогенизацией; между возникновением опухоли яичника и семенников и повышением уровня гонадотропных гормонов гипофиза; между образованием опухолей надпочечников и щитовидной железы и высоким содержанием адренокортикотропного и тиреотропного гормонов гипофиза;
- повышенная гормональная активность надпочечников, особенно секреция ими эстрогенов, вызывает усиленную пролиферацию в ткани грудной железы у кастрированных мышей, что создает условие для возникновения рака грудной железы.
В.С. Шапот (1975) [45] продемонстрировал результаты опытов, в которых под капсулу селезенки кастрированной самки крысы пересаживали яичники другого животного. Орган приживлялся и продуцировал эстрогены, которые попадали в воротную вену и сразу разрушались в печени, не достигая гипофиза. В результате нарушалась координация функций обеих желез по механизму обратной связи, что приводило к гиперпродукции гипофизом гонадотропных гормонов, а это, в свою очередь, — к постоянно стимулирующей пролиферации фолликулярного эпителия яичников. Уже через 157 дней в трансплантате появились неопластические клетки желтого тела, превращавшиеся в лютеому на протяжении 300 дней. Автор сделал вывод, что влияние гормонов на процессы клеточного деления зависит как от продолжительности действия, так и от их уровня.
Согласно точке зрения известного французского онколога Ж. Матэ (1983) [27], чрезмерная стимуляция гормонами размножения клеток является причиной канцерогенеза наряду с мутацией или вирусом, то есть играет роль промотора. Причем вначале опухолеобразование является обратимым и зависит от гормональной стимуляции уровня пролиферации. Характеризуя роль гормонов и других канцерогенов, он отмечает, что ДНК клетки должна находиться в состоянии удвоения, что может облегчить внедрение в нее вирусной ДНК. Этим объясняется не только роль канцерогенных факторов (в частности гормонов), действие которых основано на стимуляции размножения клеток чувствительной к ним ткани, но и некоторых воздействий, разрушающих клетки (например излучения), поскольку истощение, которое они вызывают, сопровождается компенсаторным размножением. Ученый объединяет митогенное и канцерогенное воздействия, вызывающие гибель клеток, поскольку ткань отвечает на эти воздействия однотипной реакцией — компенсаторной пролиферацией.
В процессе опухолевой прогрессии происходит повышение степени автономности опухоли, что связано с постепенной утратой чувствительности опухолевой ткани к гормонам в результате исчезновения рецепторов к ним в цитоплазме клетки. Это явление подтверждено в 1975 г. в Бетезде (США) на международном рабочем совещании по раку грудной железы [42]. Как показали данные многочисленных исследований, существует корреляция между концентрацией рецепторов к эстрогенам (РЭ) в опухолях грудной железы и ответом на гормональное лечение и прямая взаимосвязь между наличием рецепторов и степенью дифференциации [4].
С.В. Кузьмина, Ю.Б. Бахтин и соавторы (1987) [5, 25] в своих работах также отметили четкую корреляцию между степенью злокачественности опухолей и присутствием в них двух видов рецепторов: с увеличением клеточной анаплазии уменьшается количество РЭ+, РП+-опухолей (РП — рецепторы к прогестерону) и возрастает количество РЭ−, РП−, то есть процесс эмбрионализации ткани ведет к исчезновению рецепторов клеточной цитоплазмы. Структура тканевого гомеостаза и контроль пролиферации находятся в нормальном состоянии при условии постоянного воспроизводства, поэтому прогрессирующая эмбрионализация с течением времени, меняя соотношение между дифференцированными и клоногенными клетками, разрушает отрицательную обратную связь, которая контролирует размножение стволовых клоногенных клеток [20]. Нарушение обратной связи приводит к неконтролируемому опухолевому росту низкодифференцированных клоногенных клеток.
Схематически механизм гормонального канцерогенеза можно изобразить так [42]:
- гормональные нарушения, дисбалансы, повышенное митогенное воздействие;
- ускоренная пролиферация;
- обратимая блокировка дифференциации;
- прогрессирующая эмбрионализация ткани, исчезновение ряда рецепторов из цитоплазмы клеток;
- нарушение структуры и функции тканевого гомеостаза, нарушение контроля пролиферации;
- неконтролируемый злокачественный рост низкодифференцированных клоногенных клеток с активизированными онкогенами, инвазия, метастазирование.
Таким образом, в теории гормонозависимого рака учтена не только качественная сторона канцерогенного фактора, но и количественная — интенсивность и режим воздействия, сочетание которых должно вызывать такой уровень эмбрионализации, который превышает восстановительную способность тканевого гомеостаза.
Эндокринологические особенности постменопаузы в аспекте канцерогенеза
Согласно теории, выдвинутой В.М. Дильманом, в каждом организме есть 3 эндокринологических гомеостаза — репродуктивный, адаптационный, энергетический [14]. Онтогенетические изменения в этих системах создают предрасположенность к развитию гормонозависимых злокачественных опухолей, в основе чего лежит сочетанное нарушение на уровне «центра и периферии» [15]. Со стороны «центра» — возрастное снижение чувствительности гипоталамуса к ингибирующему действию периферических гормональных регуляторов, таких как ингибин [11, 29, 82], вследствие чего возникает компенсаторная продукция гонадотропинов по механизму обратной связи, что приводит к компенсаторному усилению функции яичников в течение определенного времени — со стороны «периферии». И чем более интенсивной будет компенсация, тем более выраженными будут побочные изменения, вызываемые избыточным действием половых гормонов на органы репродуктивной системы [15, 16]. Усиливается периферический синтез менопаузальных неклассических эстрогенов (фенолстероидов), которые обладают менее выраженным, чем классические эстрогены, ингибиторным действием на гипоталамо-гипофизарную систему [16, 17], а повышение продукции гонадотропинов обусловливает гиперплазию тека-ткани яичников [33, 11]. Строма яичников после менопаузы является основным местом гормонопродукции, она преимущественно андрогенная [11, 29]. Это подтверждают данные иммуногистохимического исследования с определением фермента стероидогенеза 3-b-стероиддегидрогеназы [33].
Неклассические фенолстероиды и эстрон — основные гормоны, вырабатываемые в период постменопаузы, — образуются в результате ароматизации из андростендиона (секреция которого в менопаузе осуществляется в большей степени надпочечниками и в меньшей — яичниками) [1, 6]. Фенолстероиды являются мощными агонистами эстрадиола, активность этих метаболитов превышает активность последнего в несколько раз (в частности 16-α-OHEI — в 8 раз), они образуют стойкие связи со специфическими рецепторами различных тканей [15].
Доказано, что превращение андростендиона в эстрон в процентном отношении коррелирует с массой тела женщины. Увеличение продукции постменопаузальных эстрогенов по мере увеличения массы тела связано с участием жировой ткани в процессе ароматизации андрогенов [6]. Поступление эстрогенов через ароматизацию андрогенов не ограничивается только жировой тканью. Этим свойством обладают почти все ткани [6]. РЭ (α и β) выявлены в мозге, кровеносных сосудах, сердце, костях, грудных железах, яичниках, матке [11]. Только РЭ-β — в легких, почках, мочевом пузыре, кишечнике. В матке и грудных железах доминируют РЭ-α. Внегонадное эстрогенообразование служит источником дополнительной эстрогенной стимуляции [6].
Оценка уровня гормонов в крови у женщин постменопаузального возраста, как показали исследования, не дает полной информации о возможных вариантах развития патологических процессов, так как для реализации гормонального эффекта необходимо наличие достаточного уровня цитоплазматических рецепторов в тканях [11, 29].
Среди возрастных эндокринно-обменных изменений у женщин, проявляющихся ожирением и инсулинорезистентностью, возникает компенсаторная гиперинсулинемия [15]. Инсулин опосредованно, через рецепторы инсулиноподобного фактора роста I, усиливает ферментативную активность биосинтеза андрогенов в яичниках, подобно ЛГ, что приводит к определенному повышению их функции [29].
Таким образом, в период постменопаузы наряду с выключением овуляторной функции яичников происходит мощное включение ряда компенсаторных механизмов, обеспечивающих достаточный уровень и разнообразный спектр биологически активных метаболитов.
По теории В.В. Фролькиса (1975) [40], старение — это следствие накопления случайных мутаций в хромосомах в результате изнашивания механизмов репарации ДНК, что приводит к ослаблению иммунологической реактивности организма.
С точки зрения В.М. Дильмана (1983, 1987) [16, 17], гормоны не являются канцерогенами, а выступают в роли промоторов, они не вызывают необратимых стойких изменений в генетическом аппарате, что необходимо для возникновения злокачественной трансформации клетки. Ученый выделил 2 типа гормонального канцерогенеза: промоторный (физиологический) и генетический. Первый тип ассоциируется с усиленной гормональной стимуляцией (гормон действует как фактор, создающий условия для увеличения числа опухолевых клеток). Для второго характерно повышение образования свободных радикалов в процессе метаболизма гормонов, что приводит к окислительному повреждению клеточных мембран и ослаблению репарации ДНК.
Проведены исследования [1, 78, 80, 81, 91], в которых изучали уровни РЭ в грудных железах, вульве, эндометрии в различные сроки постменопаузы. На основании полученных данных авторы показали, что с началом постменопаузы в клетках тканей-мишеней происходит достаточно интенсивное снижение концентрации РЭ, однако у части пациенток сохраняется наличие высоких концентраций РЭ вне зависимости от продолжительности постменопаузы.
Исследователи выделили 2 вида рецепторного статуса тканей-мишеней у пациенток в постменопаузе [1]:
- при первом происходит достаточно интенсивное снижение концентрации РЭ в течение первых 5–10 лет постменопаузы;
- при втором, вне зависимости от продолжительности постменопаузы, в тканях-мишенях сохраняется высокая концентрация РЭ.
Таким образом, основываясь на вышеизложенных данных, можно сделать вывод, что, несмотря на низкие уровни циркулирующих в крови стероидных гормонов у женщин в период постменопаузы, при определенных факторах имеются все необходимые условия для избыточной продукции эстрогенов и стимуляции ими органов-мишеней.
Изменения в яичниках в постменопаузальный период при эхографическом исследовании
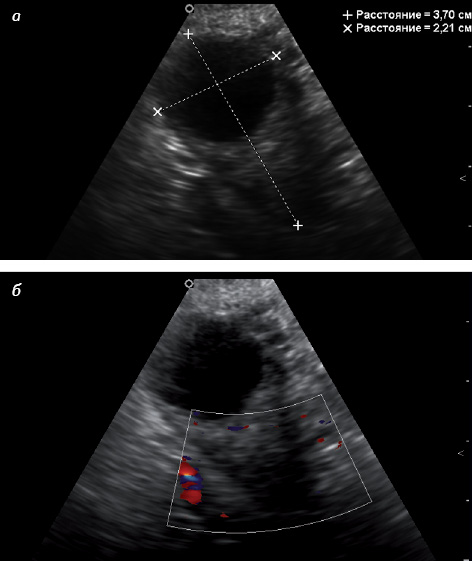
Существует 2 морфологических типа яичника в постменопаузе: атрофический и гиперпластический (стромальная гиперплазия) [11]. При атрофическом типе яичник значительно уменьшен в размере и объеме, снижена звукопроводимость, имеются гиперэхогенные участки, что соответствует превалированию соединительнотканного компонента (рис. 5 а). При допплеровском исследовании отсутствуют световые эхосигналы кровотока, нередко нет четкой визуализации яичника (рис. 5 б) [33].
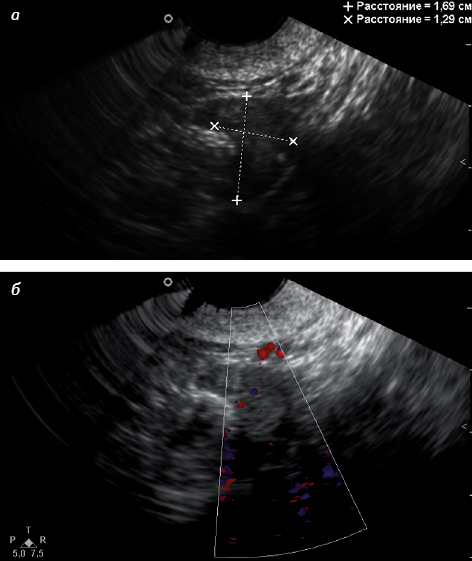
При гиперпластическом типе яичника уменьшение его размеров происходит медленно, характерен средний уровень звукопроводимости яичниковой ткани, возможно наличие мелких жидкостных включений (рис. 6 а). При небольшой длительности постменопаузы подобные включения обусловлены сохранением фолликулярного аппарата, через 5 лет после наступления менопаузы гистологическим методом в яичниках определяют только единичные фолликулы, что соответствует инклюзионным кистам. При гиперпластическом типе яичника возможна визуализация единичных цветовых эхосигналов кровотока, преимущественно в центральной его части (рис. 6 б) [33].
Особенностью заболеваний яичника в постменопаузе является их нередкое сочетание с патологией эндометрия — у каждой 3-й пациентки диагностируют ту или иную внутриматочную патологию. Чаще всего с ОЯ сочетаются железисто-фиброзные полипы на фоне атрофии эндометрия (49%), реже — железистая гиперплазия эндометрия (7,7%) и рак эндометрия (1,5%) [33]. Высокую частоту патологии эндометрия при ОЯ объясняют существованием так называемых ОЯ с функционирующей стромой, когда в строме опухоли выявляют гиперплазию тека-клеток, способных к гормонопродукции [29]. С этих позиций изменения эндометрия, с одной стороны, являются вторичным процессом, с другой, — при патологии яичника и эндометрия часто имеются общие факторы риска, что еще раз подтверждает гормонозависимый характер ОЯ и общий патогенез развития заболевания.
Изучение гормонального рецепторного статуса в опухолевой ткани яичника
О гормонозависимости РЯ свидетельствуют результаты различных исследований, в ходе которых установлено, что яичники не только продуцируют половые стероидные гормоны, но и выступают тканью-мишенью для них [62].
N. Ahmad, R. Kumar (2011), изучая наличие РСГ в опухолях яичника у крыс, показали, что экспериментальные модели РЯ являются гормонозависимыми [46].
Изучению гормонального рецепторного статуса ткани яичников посвящены работы многих отечественных и зарубежных ученых. Kauppila, Bergqvist и соавторы (1979), A. Vierikko (1981) показали в своих наблюдениях, что образцы тканей нормальных яичников, с доброкачественной и злокачественной опухолью содержали все рецепторы стероидных гормонов (РСГ) [4]. При этом процент РЭ+ в злокачественной ОЯ (ЗОЯ) оказался выше, чем в доброкачественной, и соответствовал уровню РЭ в нормальной ткани яичника, а для РП и рецепторов к тестостерону (РТ) отмечали обратное соотношение [4].
Этим данным противоречат результаты исследований M. Galli (1981) [4] и В.К. Кондратюка (2008) [24], в которых отмечено, что РЭ, РП, РТ одновременно присутствуют в 44% ЗОЯ и не выявлены ни в одном из образцов доброкачественной опухоли. Л.С. Бассалык (1987) [4], по данным своих исследований, отметил, что РЭ и РП с одинаковой частотой выявляли как в злокачественных, так и доброкачественных ОЯ, тогда как рецепторы к андрогенам в доброкачественных опухолях выявляли в 15 раз чаще, чем в злокачественных. M. Quinn и соавторы (1982) [4], А.С. Дудниченко и соавторы (2001) [18], Г.В. Бондарь и соавторы (2009) [7], A. García-Velasco и соавторы (2008) [69] в своих работах показали, что самым высоким уровнем РСГ обладают серозные эпителиальные ОЯ.
По данным S.-M. Ho (2003), опухолевая ткань яичника в 86% случаев окрашивалась позитивно для РЭ, 50% — для РП, 45% — положительно для обоих рецепторов. РЭ-α выявлены в 97% серозных карцином яичника, в 100% — эндометриоидных, в 70% — муцинозных [99]. При этом РЭ-α не найдены ни в одном из образцов ткани нормального яичника. Однако РЭ-β отмечены в 39% здоровой ткани яичника, в 41% — серозной аденокарциномы, в 30% — муцинозной, в 75% — эндометриоидной. В то время как РП в одинаковом соотношении выявлены как в нормальной, так и злокачественной ткани яичника. Ученый показал лучший прогноз у больных РЯ, получивших комбинацию платины с прогестероном в первой линии терапии [99].
Содержание РСГ в эпителиальном РЯ, по данным P. Schwarts и соавторов (1982), H. Cafflez (1983), не зависит от стадии заболевания, возраста больных и радикальности операции [4]. Эти данные подтверждают результаты исследований В.В. Баринова и Н.Е. Кушлинского (2006) [3], В.П. Козаченко и Е.Е. Маховой (2007) [23], N. Sharifi, Z. Yousefi и соавторов (2009) [87]: распределение и уровни РЭ, РП, РТ в ОЯ достоверно не различаются у больных репродуктивного возраста и в менопаузе.
С.М. Карташов (2003) [21] в своих наблюдениях показал, что процент РЭ+ РП+ ЗОЯ у женщин менопаузального периода составил 52,2%, тогда как в доброкачественных ОЯ — 28,6%. Для РЭ− РП+ опухолевых тканей отмечали обратную корреляцию — 29,2 и 37,5% соответственно. Аналогичную корреляцию регистрировали у женщин репродуктивного периода — процент РЭ+ РП+ ЗОЯ составил 27,5%, а доброкачественных ОЯ — 25,0%. Автор, исследуя рецепторный статус ОЯ в разные возрастные периоды больных, сделал вывод, что в менопаузе чаще встречаются рецепторположительные (РЭ+ РП+) как доброкачественные, так и злокачественные опухоли [21].
По данным исследований А.С Дудниченко и соавторов (2001) [18] отмечено, что РЭ+ и РП+ ОЯ более чувствительные к химиотерапии. Е.Е. Махова (2007) [23], Е.В. Новичков и А.А. Вотинцев (2006) [30], изучая рецепторный статус опухолевой ткани яичников, наблюдали более высокую эффективность химиотерапии у больных РЯ, опухоли которых имели высокий уровень РП и РТ.
Зависимость содержания РЭ и РП от степени дифференциации ОЯ изучали A. Vierikko и соавторы (1983) [4], L. Ayadia, S. Chaabounia, A. Khabira и соавторы (2010) [51], но они не нашли достоверной связи между гистологическим типом опухоли, степенью ее дифференциации и уровнем рецепторов гормонов.
Однако в исследованиях С.М. Карташова (2001) [18], Л.Г. Бучинской, Н.П. Юрченко (2009) [54] показана зависимость уровня РСГ от степени дифференциации опухолевой ткани яичника: высокодифференцированные опухоли обладают высоким уровнем РЭ и РП, что позволяет этот тип РЯ рассматривать как потенциально наиболее чувствительный к ГТ [7]. Низкодифференцированные ОЯ отличаются низким уровнем РЭ и РП. Однако частота рецепторположительных случаев ОЯ у больных этой группы может достоверно не отличаться от таковой у пациентов с высокой степенью дифференциации ОЯ. Авторы делают вывод, что если в процессе опухолевого роста злокачественные клетки имеют тенденцию к снижению степени дифференциации, то это проявляется не переходом опухолевых клеток из рецепторположительных в рецепторотрицательные, а снижением уровня экспрессии РСГ и, соответственно, снижением гормонозависимости. Исходя из полученных данных, исследователи предполагают, что и низкодифференцированные ОЯ могут обладать определенной чувствительностью к гормональному воздействию. Это согласуется с результатами исследований, в которых такие гормонозависимые опухоли, как рак грудной железы, в определенных ситуациях положительно реагируют на гормонотерапию при минимальном уровне РЭ и РП в опухолевых клетках [18].
Отечественные ученые установили, что гормональный рецепторный статус ОЯ изменяется при воздействии химиотерапии: в высокодифференцированных опухолях — понижается и наоборот — в умеренно- и низкодифференцированных имеет тенденцию к повышению (Т.П. Якимова, А.С. Дудниченко, 2001) [18].
Однако некоторые исследователи [30, 47, 59, 69, 87] утверждают, что выраженная экспрессия РЭ в ЗОЯ является фактором высокого риска развития рецидива заболевания, а выявление РП и РТ следует оценивать как фактор благоприятного прогноза у женщин с РЯ. Авторы показывают, что прогрессирование заболевания РЯ (до 6 мес) характерно для пациенток с гиперэстрогенией, в то время как развитие рецидива заболевания в более поздние сроки — на фоне подавления гормональной активности.
На основании полученных прогностических данных о рецепторном статусе ОЯ L. Ayadia, S. Chaabounia, A. Khabira (2010) [51] выдвигают 2 гипотезы зависимости прогноза заболевания от гормонального рецепторного статуса опухолевой ткани:
- чувствительные к эстрогенам опухолевые клетки эффективно восстанавливают ДНК и избегают апоптоз, индуцируя клональное деление и устойчивость к лекарственной терапии;
- прогестерон вызывает клеточную дифференциацию и апоптоз опухолевых клеток, ингибирует синтез ДНК и клеточное деление.
Совершенно иные результаты исследований отмечают A. Burges и соавторы (2010) [55]: лучший прогноз наблюдали у больных с РЭ+ серозным эпителиальным РЯ, и при снижении уровня РЭ в опухолевой ткани выживаемость больных снижалась. Эти данные подтверждаются исследованиями A. Halon и соавторов (2011) [73], в которых отмечены низкая выживаемость и короткий безрецидивный период у больных с опухолью низкого рецепторного статуса по РЭ-α, а также благоприятный прогноз — с РП+ ОЯ.
Интересные результаты получены при изучении гормонального рецепторного статуса ОЯ N. Liu, X. Wang, X. Sheng (2012) [84, 88]. Ученые выделили тип эпителиального РЯ, в котором отсутствовали РЭ, РП и HER2neu — «тройной отрицательный тип РЯ», показав, что этот эпителиальный РЯ имеет агрессивное течение и неблагоприятный прогноз, он подобен «тройному отрицательному» раку грудной железы, который плохо отвечает на лекарственную терапию.
По данным H. Arias-Pulido и соавторов (2009), 5-летняя выживаемость больных РЯ в зависимости от гормонального рецепторного статуса опухолевой ткани составила: 83% — при РЭ−/РП+, 79% — РЭ+/РП−, 61% — РЭ+/РП+ и 48% — РЭ−/РП− [49].
Результаты проведенных исследований в Национальном институте рака [37] продемонстрировали, что у больных РЯ до лечения и через 24 мес после его окончания отмечалась относительная и абсолютная гиперэстрогенемия и гиперандрогенемия на фоне выраженной абсолютной гипопрогестеронемии. В случаях с ранним рецидивом заболевания уровни эстрогенов и тестостерона в сыворотке крови повышались на фоне снижения уровня ФСГ и повышения уровня ЛГ. Исследователь показал, что такие изменения обусловлены не только наличием опухоли в яичниках (поскольку удаление последних не ликвидирует их), а имеют патогенетическое значение в развитии заболевания и его рецидивов.
Ю.С. Сидоренко и соавторы (2008) [35], изучая содержание половых гормонов в опухолевой ткани и крови больных РЯ І и ІІ стадии, сделали следующие выводы: у женщин репродуктивного возраста со ЗОЯ существовал дисбаланс в соотношении уровней прогестерона и эстрогенов в сторону относительной гиперэстрогенемии, несмотря на то, что злокачественный процесс в яичниках развивался как на фоне повышенной секреции половых гормонов, так и на фоне сниженной. А при распространенном РЯ уровень эстрадиола в крови оказался повышенным по сравнению с таковым у здоровых женщин, что исследователи связывают не только с гонадным синтезом эстрогенов, но и внегонадным.
Вопрос о применении гормональной терапии данного контингента больных на протяжении многих лет и сегодня остается дискутабельным.
В Украине, России и других странах проведен ряд нерандомизированных исследований, в ходе которых больным с прогрессирующим и химиорезистентным РЯ, а также ослабленным пациенткам с распространенным опухолевым процессом эмпирически назначали ГТ (тамоксифен, гозерилин, экземестан). Средняя продолжительность периода до прогрессирования заболевания составила 4–6 мес [7, 74, 83, 90, 105].
J.F. Smyth (2007) в своем нерандомизированном исследовании показал положительный лечебный эффект летрозола, который назначали больным с рецидивным РЯ с РЭ+ опухолью. Период до прогрессирования заболевания составил >8 мес, у некоторых пациентов общая выживаемость превысила 3 года [100].
А.Ф. Урманчеева (2008) [39] рекомендует назначать тамоксифен больным РЯ после проведенного стандартного лечения, у которых в дальнейшем отмечали повышенный уровень СА-125 как единственный признак заболевания.
Применение гормонотерапии (медроксипрогестерона и тамоксифена) в комплексном лечении больных эндометриоидным РЯ позволило повысить 2-летнюю выживаемость при I стадии на 12%, при II стадии — на 10,5%, при III–IV стадии — на 33,3% [38].
Отечественными учеными [9] экспериментально доказана выраженная противоопухолевая активность агонистов гонадотропин-рилизинг гормонов (аГнРГ) при лечении индуцированных ОЯ у крыс, а при комбинации данных препаратов с цитостатиками противоопухолевый эффект значительно повышался. Американские и британские ученые (2006, 2008, 2010) в своих исследованиях показали наличие антипролиферативного и апоптотического действия препаратов аГнРГ на клеточных линиях SKOV-3 и CaOV-3 РЯ [71, 76, 102]. Исследователи выявили в клеточных линиях РЯ два вида рецепторов к гонадотропин-рилизинг гормону: GnRH-I и GnRH‑IІ. При этом доказали, что связывание препаратов аГнРГ с GnRH-IІ имеет более мощный антипролиферативный и апоптотический эффект [102].
Национальными стандартами США, пересмотренными 02.2011 г., рекомендовано применение гормонотерапии препаратами, содержащими аГнР, и ингибиторами ароматазы у больных с химиорезистентными и рецидивными формами РЯ при отсутствии данных о гормональном рецепторном статусе опухолей, а также ослабленным пациенткам с распространенным опухолевым процессом [89].
Выводы
Таким образом, анализируя данные многочисленных исследований, установлено, что РЯ — гормонозависимая опухоль. В ЗОЯ выявлены все РСГ (РЭ, РП, РТ), что открывает возможность воздействия на опухолевые клетки гормональными препаратами. РЯ — хроническое заболевание, которое требует постоянного лечения. Для гормонотерапии не свойственна токсичность и, в отличие от химиотерапии, ее можно применять длительно и непрерывно.
Однако на сегодня не разработаны показания к назначению и критерии применения ГТ в комплексном лечении больных РЯ. А также остается открытым вопрос о достоверных факторах прогноза течения заболевания с учетом гормонального рецепторного статуса ОЯ, несмотря на то, что якобы определена корреляция степени дифференциации опухоли с уровнем содержания в ней РСГ.
Все вышесказанное свидетельствует о необходимости продолжения дальнейших исследований в этом направлении.
Список использованной литературы
1. Ашрафян Л.А., Киселев В.И. (2007) Опухоли репродуктивных органов (http://www.hpvinfo.ru/ cancer/Tumors-of-reproductive-bodies/glava-2.html).
2. Алов И.А. (1964) Очерки физиологии митотического деления клетки. Медицина, Москва, 302.
3. Баринов В.В., Кушлинский Н.Е., Кузнецов В.В. и др. (2006) Сопоставление рецепторного статуса тканей яичников и аденокарциномы эндометрия. Вестник РОНЦ им. Н.Н. Блохина РАМН, 17 (1): 15–18.
4. Бассалык Л.С. (1987) Рецепторы стероидных гормонов в опухоли человека. Медицина, Москва: 136–147.
5. Бахтин Ю.Б., Пинчук В.Г., Швембаргер и др. (1987) Клонально-селекционная концепция опухолевого роста. Наук. думка, Киев: 20.
6. Бернштейн Л.М. (1998) Внегонадная продукция эстрогенов. Наука, Санкт-Петербург: 13–19.
7. Бондарь Г.В., Лисовская Н.Ю., Кайряк О.В. и др. (2009) Химиогормонотерапия в комбинированном лечении распространенного рака яичников. Проблеми сучасної медичної науки та освіти, 2: 33–35.
8. Бохман Я.В. (2002) Руководство по онкогинекологии. Фолиант, Санкт-Петербург: 404–420.
9. Валуева И.М., Смирнова О.И., Буренин И.С. (1995) Лечение экспериментальных опухолей яичника аналогом люлиберина сурфагоном. Вестник РОНЦ им. Н.Н. Блохина РАМН, 3: 24–27.
10. Винокуров В.Л. (2004) Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. Фолиант, Санкт-Петербург: 5–7, 229–307.
11. Вихляева Е.М. (2002) Руководство по эндокринной гинекологии. МИА, Москва: 19–25.
12. Воробьева Л.И. (2012) Практическая онкогинекология, монография: 175–205.
13. Гранов А.М., Винокуров В.Л. (2002) Лучевая терапия в онкогинекологии и онкоурологии. Фолиант, Санкт-Петербург: 103–136.
14. Дильман В.М. (1982) Большие биологические часы. Знание, Москва: 35–51.
15. Дильман В.М. (1968) Старение, климакс и рак. Медицина, Ленинград: 378.
16. Дильман В.М. (1983) Эндокринологическая онкология. Медицина, Ленинград: 407–408.
17. Дильман В.М. (1987) Четыре модели медицины. Медицина, Ленинград: 81–94, 288–289.
18. Дудниченко А.С., Якимова Т.П., Карташов С.М. (2001) Рецепторный статус клеток яичников в зависимости от морфологических особенностей и химиотерапевтического воздействия. Онкология, 3(4): 271–274.
19. Епифанова О.И. (1965) Гормоны и размножение клеток. Наука, Москва: 243.
20. Имянитов Е.Н. (2010) Молекулярные механизмы опухолевого роста. Вопросы онкологии, 56 (2): 117–128.
21. Карташов С.М. (2000) Гормонально-метаболические особенности развития рака яичников у женщин группы риска. Медицина сегодня и завтра, 2: 103–105.
22. Кашулина А.П. (1983) Патофизиологические аспекты злокачественного роста. Медицина, Москва: 255.
23. Козаченко В.П., Махова Е.Е. (2007) Гормоны в онкогинекологии. (http://medinfa.ru/article/12/118816).
24. Кондратюк В.К. (2008) Імуногістохімічні особливості рецепторного апарата та регуляторів апоптозу пухлиноподібних уражень яєчників. Здоровье женщины, 2: 183–185.
25. Кузьмина С.В. (1983) Малигнизация нормальных клеток в условиях длительного культивирования in vitro. Наука, Москва: 229.
26. Лагучев С.С. (1970) Гормональная регуляция пролиферации эпителия матки, влагалища и молочных желез. Медицина, Москва: 160.
27. Матэ Ж. (1983) Досье рака. Мир, Москва: 253.
28. Максимов С.Я., Гусейнов К.Д. (2010) Таргетная терапия при раке яичников. Практическая онкология, 11 (3): 54–64.
29. Манухин И. Б., Тумилович Л. Г., Геворкян М. А. (2003) Клинические лекции по гинекологической эндокринологии. МИА, Москва: 6–25, 163–173, 200–207.
30. Новичков Е.В., Вотинцев А.А. (2006) Зависимость прогноза рака яичников от экспрессии рецепторов к половым гормонам и пролиферактивной активности опухолевых клеток. Архив патологии, 68 (2): 10–13.
31. Переводчикова Н.И. (2011) Руководство по химиотерапии опухолевых заболеваний. Практическая медицина, Москва: 196–207.
32. Рак в Україні, 2010–2011. (2012) Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень національного канцер-реєстру України: 52–53.
33. Савельева Г., Бреусенко В., Голова Ю. (2002) Период постменопаузы: климактерические расстройства, изменения в матке и яичниках. Врач, 8: 3–6.
34. Самунджан Е.М. (1973) Кора надпочечников и опухолевый процесс. Киев: Наук. думка: 202.
35. Сидоренко Ю.С. Франциянц Е.М., Громченко Н.В. и др. (2008) Содержание половых гормонов в ткани и крови женщин, больных раком яичников. Сибирский онкологический журнал, 1 (25): 29–33.
36. Свинцицкий В.С., Воробьева Л.И. (2010) Злоякісні пухлини яєчника: оптимізація комплексного лікування. Онкология, 12 (1): 52–56.
37. Свинцицкий В.С. (2004). Рак яєчників: динаміка деяких ендокринологічних показників під впливом комплексного лікування. Клінічна ендокринологія та ендокринна хірургія, 3: 25–30.
38. Симончук Е.В. (2006). Гормонотерапия при раке яичников. Здоровье женщины: 218–221.
39. Урманчеева А.Ф., Тюляндин С.А., Моисеенко В.М. (2008) Практическая онкогинекология: избранные лекции. Центр ТОММ, Санкт-Петербург: 368–375.
40. Фролькис В.В. (1975) Старение и биологические возможности организма. Наука, Москва: 265–268.
41. Хохлова С.В. (2008) Новые тенденции в лечении распространенного рака яичников. Опухоли женской репродуктивной сферы, 4: 64–73.
42. Черезов А.Е. (1997) Общая теория рака: тканевый подход. Изд-во МГУ, Москва: 101–113.
43. Чехун В.Ф. (2003) Злокачественные опухоли и беременность. Мед. газета «Здоров’я України», 73.
44. Шамрай Д.В., Мельник Н.А., Чайковский Ю.Б. (2010) Гормональный канцерогенез яичника и способы его моделирования. Клінічна анатомія та оперативна хірургія, 9 (2): 126–130.
45. Шапот В.С. (1973) Биохимические аспекты опухолевого роста. Медицина, Москва: 304.
46. Ahmad N., Kumar R. (2011) Steroid hormone receptors in cancer development: a target for cancer therapeutics. Cancer Lett., 300 (1): 1–9.
47. Alonso L., Gallego E., Jesús González F. et al. (2009) Gonadotropin and steroid receptors as prognostic factors in advanced ovarian cancer: aretrospective study. Clin. Transl. Oncol., 11: 748–752.
48. Altinoz M.A., Korkmaz R. (2004) NF-kappaB, macrophage migration inhibitory factor and cyclooxygenase inhibitions as likely mechanisms behind the acetaminophen- and NSAID-prevention of the ovarian cancer. Neoplasma, 51: 239–247.
49. Arias-Pulido H., Smith H.O., Joste N.E. et al. (2009) Estrogen and progesterone receptor status and outcome in epithelial ovarian cancers and low malignant potential tumors. Gynecol. Oncology, 114: 480–485.
50. Armstrong D.K, Bundy B., Wenzel L. et al. (2006) Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N. Engl. J. Med., 354: 34–43.
51. Ayadia L., Chaabounia S, Khabira A. et al. (2010) Correlation between immunohistochemical biomarkers expression and prognosis of ovarian carcinomas in tunisian patients. World J. Oncol., 1 (3): 118–128.
52. Bookman M.A., Brady M.F., McGuire W.P. et al. (2009) Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a phase III Trial of the Gynecologic Cancer Intergroup. J. Clin. Oncol., 27: 1419–25.
53. Brinton L.A., Lamb E.J., Moghissi K.S. et al. (2004) Ovarian cancer risk after the use of ovulation-stimulating drugs. Obstet. Gynecol., 103: 1194–1203.
54. Buchynska L.G., Lurchenko N.P., Grinkevych V.N. et al. (2009) Expression of the estrogen and progesterone receptors as prognostic factor in serous ovarian cancers. Exp. Oncol., 31 (1): 48–51.
55. Burges A., Brüning A., Dannenmann C. et al. (2010) Prognostic signi Wcance of estrogen receptor alpha and beta expression in human serous carcinomas of the ovary. Arch. Gynecol. Obstet., 281: 511–517.
56. Cancer Incidence in Five Continents Vol. IX, IARC 2007; 897 pages. (http://www.iarc.fr/en/ publications/pdfs-online/ epi/sp160/ index.php).
57. Capen C.C. (2004) Mechanisms of hormone-mediated carcinogenesis of the ovary. Toxicol. Pathol., 32: 1–5.
58. Landen C.N. Jr., Birrer M.J., Sood A.K. (2008) Early events in the pathogenesis of epithelial ovarian cancer. J. Clin. Oncol., 26: 995–1005.
59. Chakraborty A., Chatterjee S., Roy P. (2010) Progesterone receptor agonists and antagonists as anticancer agents. Mini Rev. Med. Chem., 10(6): 506–517.
60. Choi K.C., Kang S.K., Tai C.J. et al. (2002) Follicle-stimulating hormone activates mitogen-activated protein kinase in preneoplastic and neoplastic ovarian surface epithelial cells. J. Clin. Endocrinol. Metab., 87: 2245–2253.
61. Cui J., Miner B.M., Eldredge J.B. (2011) Regulation of gene expression in ovarian cancer cells by luteinizing hormone receptor expression and activation. BMC Cancer, 11: 280.
62. Cunat S., Hoffmann P. and Pujol P. (2004) Estrogens and epithelial ovarian cancer. Gynecol. Oncol., 94: 25–32.
63. Disaia P.J., Creasman W.T. (2012) Клиническая онкогинекология. Рид Элсивер, Москва: 44–137, 207–232.
64. du Bois A., Herrstedt J., Hardy-Bessard A.C. et al. (2010) Phase III trial of carboplatin plus paclitaxel with or without gemcitabine in first-line treatment of epithelial ovarian cancer. J. Clin. Oncol., 28: 4162–69.
65. Fathalla M.F. (1971) Incessant ovulation: a factor in ovarian neoplasia? Lancet, 2: 163.
66. Fleming JS., Beaugie CR., Haviv I. et al. (2006) Incessant ovulation, inflammation and epithelial ovarian carcinogenesis: Revisiting old hypotheses. Mol. Cell. Endocrinol., 247: 4–21.
67. Fredrickson T.N. (1987) Ovarian tumors of the hen. Environ Health Perspect, 73: 35–51.
68. Gadducci A., Cosio S., Gargini A. et al. (2004) Sex-steroid hormones, gonadotropin and ovarian carcinogenesis: A review of epidemiological and experimental data. Gynecol. Endocrinol., 19: 216–228.
69. García-Velasco A., Mendiola C., Sánchez-Muñoz A. et al (2008) Prognostic value of hormonal receptors, p53, ki67 and HER2/neuexpression in epithelial ovarian carcinoma. Clin. Transl. Oncol., 10: 367–371.
70. GLOBOCAN 2008. (http://globocan.iarc.fr/. Accessed March 8, 2011).
71. Guo, J., Schally A.V., Zarandi M. et al. (2010) Antiproliferative effect of growth hormone-releasing hormone (GHRH) antagonist on ovarian cancer cells through the EGFR-Akt pathway. Reprod. Biol. Endocrinol., 8: 54.
72. Gwinn M.L., Lee N.C., Rhodes P.H. et al. (1990) Pregnancy, breast feeding, and oral contraceptives and the risk of epithelial ovarian cancer. J. Clin. Epidemiol., 43: 559–568.
73. Halon A., Materna V., Drag-Zalesinska M. et al. (2011) Estrogen receptor alpha expression in ovarian cancer predicts longer overall survival. Pathol. Oncol. Res., 17(3): 511–518.
74. Hasan J., Ton N., Mullamitha S., et al. (2005) Phase II trial of tamoxifen and goserelin inrecurrent epithelial ovarian cancer. Br. J. Cancer, 93: 647–651.
75. Heintz A.P.M., Odicino F., Maisonneuve P. et al. (2006) Carcinoma of the fallopian tube. Int. J. Gynaecol. Obstet.; 95(1):161 — 169.
76. Imail А., Sugiyama M., Furui T., Tamaya T. (2006) Gi protein-mediated translocation of serine/threonine phosphatase to the plasma membrane and apoptosis of ovarian cancer cell in response togonadotropin-releasing hormone antagonist cetrorelix. J. Obstet. Gynaecol., 26(1): 37–41.
77. Ji Q., Liu P.I., Chen P.K. et al. (2004) Follicle stimulating hormone-induced growth promotion and gene expression profiles on ovarian surface epithelial cells. Int. J. Cancer, 112: 803–814.
78. Khan S.A., Rogers M.A.M., Khurana K.K. et al. (1998) Estrogen receptor expression in bening breast epithelium and breast cancer risk. J. Nat. Cancer Inst., 90: 37–42.
79. Land J.A. (1993) Ovulation, ovulation induction and ovarian carcinoma. Baillieres Clin. Obstet. Gynaecol., 7: 455–472.
80. Lange C.A., Richer J.K., Horwitz K.B. (1991) Hipothesis: progesterone primes breast cancer cells for cross-talk with proliferative or antiproliferative signals. MoI. Endocrinol.,13: 829–836.
81. Ling Poon S., Lau M.T., Hammond G.L., Leung P.C. (2011) Gonadotropin-releasing hormone-II increases membrane type I metalloproteinase production via beta-catenin signaling in ovarian cancer cells. Endocrinology, 152(3): 764–772.
82. MacNaughton J., Banah M., McCloud P. (1992) Age related changes in follicle simulating hormone, luteinizing, hormone, estradiol and immunoreactive inhibin in women of reproductive age. Clin. Endocrinol., 36: 339.
83. Makar A.P. (2000) Hormone therapy in epithelial ovarian cancer. Endocrine-Related Cancer, 7: 85–93.
84. Liu N., Wang X., Sheng X. (2012) The clinicopathological characteristics of triple-negative’ epithelial ovarian cancer. J. Clin. Pathol., 63: 240–243.
85. Nasca P.C., Greenwald P., Chorost S. et al. (1984) An epidemiologic case-control study of ovarian cancer and reproductive factors. Am. J. Epidemiol., 119: 705–713.
86. Ness RB., Cottreau C. (1999) Possible role of ovarian epithelial inflammation in ovarian cancer. J. Natl. Cancer Inst., 91: 1459–1467.
87. Sharifi N., Yousefi Z., Saeed S., Bahreini M. (2009) Prognostic Values of Estrogen and Progesterone Expression Receptors in Ovarian Papillary Serous Carcinoma. Ir. J. Pathology, 4(1): 9–12.
88. Nowsheen S., Aziz K., Panayiotidis M.I., Georgakilas A.G. (2011) Molecular markers for cancer prognosis and treatment. Cancer Letters. Journal homepage: (http://www.elsevier.com/locate/canlet)
89. NCCN Clinical Practice Guidelines in Oncology Ovarian (2.2011) Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer. Version 2.2011
90. Papadimitriou Christos A., Markaki S., Siapkaras J. et al. (2004) Hormonal Therapy with Letrozole for Relapsed Epithelial Ovarian Cancer. Oncology, 66: 112–117.
91. Pinzger G., Heim K. et al. (1991) Diagnosis and therapy of vulvar dystrophy. Gynacol. Rundsch., 31(2): 225–229.
92. Riman T., Dickman PW., Nilsson S. et al. (2002) Risk factors for invasive epithelial ovarian cancer: Results from a Swedish case-control study. Am. J. Epidemiol., 156: 363–373.
93. Risch H.A. (1998) Hormonal etiology of epithelial ovarian cancer, with a hypothesis concerning the role of androgens and progesterone. J. Natl. Cancer. Inst., 90: 1774–1786.
94. Risch H.A., Marrett L.D., Howe G.R. (1994) Parity, contraception, infertility, and the risk of epithelial ovarian cancer. Am. J. Epidemiol., 140: 585–597.
95. Rosenberg L., Palmer J.R., Zauber A.G. et al. (1994) A case-control study of oral contraceptive use and invasive epithelial ovarian cancer. Am. J. Epidemiol., 139: 654–661.
96. Schiffenbauer Y.S., Abramovitch R., Meir G. et al. (1997) Loss of ovarian function promotes angiogenesis in human ovarian carcinoma. Proc. Natl. Acad. Sc. USA, 94: 13203–13208.
97. Schiffenbauer Y.S., Meir G., Maoz M. et al. (2002) Gonadotropin stimulation of MLS human epithelial ovarian carcinoma cells augments cell adhesion mediated by CD44 and by alpha(v)-integrin. Gynecol. Oncol., 84: 296–302.
98. Schildkraut J.M., Schwingl P.J., Bastos E. et al. (1996) Epithelial ovarian cancer risk among women with polycystic ovary syndrome. Obstet. Gynecol., 88: 554–559.
99. Ho S.-M. (2003) Estrogen, Progesterone and Epithelial Ovarian Cancer. Reprod. Biol. and Endocrinol., 1: 73.
100. Smyth J.F. (2007) Hormone therapy effective in ovarian cancer. Clin. Cancer Res., 13: 3617 — 3622.
101. Tashiro H., Katabuchi H., Begum M. et al. (2003) Roles of luteinizing hormone/chorionic gonadotropin receptor in anchorage-dependent and -independent growth in human ovarian surface epithelial cell lines. Cancer Sc., 94: 953–959.
102. So W.-K., Cheng J.-C., Poon S.-L. and Leung P.C.K. (2008) Gonadotropin-releasing hormone and ovarian cancer: afunctional and mechanistic overview. FEBS J., 275: 5496–5511.
103. Wang J., Luo F., Lu J.J. et al. (2002) VEGF expression and enhanced production by gonadotropins in ovarian epithelial tumors. Int. J. Cancer, 97: 163–167.
104. Whittemore AS., Harris R., Itnyre J. (1992) Characteristics relating to ovarian cancer risk: Collaborative analysis of 12 US case-control studies. II. Invasive epithelial ovarian cancers in white women. Am. J. Epidemiol., 136: 1184–1203.
105. Williams C., Simera I., Bryant A. (2010) Tamoxifen for relapse of ovarian cancer. Cochrane Database Syst. Rev., 17(3): CD001034.
106. Zheng W., Lu JJ., Luo F. et al. (2000) Ovarian epithelial tumor growth promotion by follicle-stimulating hormone and inhibition of the effect by luteinizing hormone. Gynecol. Oncol., 76: 80–88.
Гормональний канцерогенез та обгрунтування застосування гормональної терапії в лікуванні хворих на рак яєчника (огляд літератури)
Резюме. Захворюваність і смертність хворих на рак яєчника в країнах СНД, Європи, США за останні 10 років підвищуються, незважаючи на удосконалення хірургічних методик лікування і використання сучасних хіміопрепаратів. Питання застосування гормонотерапії в лікуванні хворих на рак яєчника на сьогодні залишається відкритим. Дані зарубіжних і вітчизняних досліджень підтверджують гормонозалежність раку яєчника наявністю в пухлинній тканині рецепторів до всіх статевих стероїдних гормонів, проте відомості про фактори прогнозу перебігу захворювання з урахуванням гормонального рецепторного статусу і розподілу рецепторів стероїдних гормонів у пухлинній тканині залежно від її біологічних властивостей суперечливі. Мета роботи — показати на підставі літературних даних інтерес вчених до вивчення гормонального канцерогенезу, етіології та патогенезу раку яєчника, актуальність цього питання і необхідність подальших досліджень у цьому напрямку.
Ключові слова: рак яєчника, гормональний канцерогенез, гормональний статус, рецептори естрогенів, прогестерону і тестостерону, ступінь диференціювання пухлини, гормонотерапія.
Hormonal carcinogenesis and rationale for the use of hormone therapy in the treatment of patients with ovarian cancer (review)
Summary. The morbidity and mortality of patients with ovarian cancer in the CIS, Europe, the U.S. over the past 10 years are increasing, despite improvements in surgical-logical methods of treatment and the use of modern chemotherapy. The question on the application of hormonal therapy to date is still open. These foreign and domestic studies confirm the presence of hormone-dependent cancer of the ovary in a tumor cell receptor for all sex steroid hormones, but the data on the prognostic factors of the disease with the hormone receptor status and distribution of steroid hormone receptors in the tumor tissue, depending on its biological properties are contradictory. The purpose is to show on the basis of published data of interest to scientists studying the hormonal carcinogenesis, etiology and pathogenesis of ovarian cancer, the relevance of this issue and the need for further research in this direction.
Key words: ovarian cancer, hormonal carcinogenesis, hormonal status, estrogen, progesterone and testosterone, the degree of tumor differentiation, hormone therapy.














Leave a comment