Реконструкція нижньої щелепи у хворих зі злоякісними новоутвореннями орофарингеальної зони
Резюме. У статті представлено огляд літератури, присвячений проблемі реконструкції нижньої щелепи у хворих зі злоякісними новоутвореннями орофарингеальної зони. Досягнення мікрохірургії, розробка нових синтетичних імплантатів та технологій тканинної інженерії дозволили значно розширити можливості заміщення сегментарних дефектів нижньої щелепи, покращити функціональні та естетичні результати пластики. Розглянуто сучасні методики реконструкції нижньої щелепи, обговорено їх переваги та слабкі сторони.
Місцево-поширений рак слизової порожнини рота та ротоглотки, що розповсюджується на нижню щелепу (НЩ), первинні злоякісні новоутворення та остеорадіонекроз НЩ є основними показаннями до її сегментарної резекції. Оскільки НЩ формує контур нижньої зони обличчя, правильний прикус, підтримує дихальні шляхи, бере активну участь у функціях жування, ковтання та мовлення, порушення її неперервності призводить до значних функціональних та косметичних порушень [1, 2].
У зв’язку із цим метою оперативного втручання є не тільки радикальне видалення пухлини, а й відновлення неперервності та анатомічної форми НЩ. Незалежно від причини, більшість дефектів НЩ поєднуються з дефектами слизової (щоки, губи, ясен, дна порожнини рота, язика, ротоглотки) та м’яких тканин (м’язів, шкіри), що також потребують пластичного усунення [1, 3, 4].
Класифікація сегментарних дефектів НЩ. Для оцінки дефектів НЩ розроблено декілька класифікацій. D. David та співавтори у 1988 р. виділили 6 типів сегментарних мандибулярних дефектів залежно від їх локалізації (рис. 1).

Тип А — короткий однобічний дефект тіла НЩ;
Тип В — однобічний дефект НЩ від кута до симфізу;
Тип С — дефект НЩ між кутом однієї з них та тілом іншого боку;
Тип D — дефект НЩ від кута до кута;
Тип Е — дефект симфізу НЩ;
Тип F — половинний дефект НЩ, що включає суглобовий відросток.
D. Jewer та співавтори у 1989 р. розробили класифікацію, що враховує складність реконструкції НЩ (рис. 2). У даній класифікації виділено: C — центральні дефекти НЩ від ікла до ікла; L — латеральні дефекти, що поширюються від середньої лінії до суглобового відростка, не включаючи останній; Н — половинні дефекти НЩ, що включають L-дефекти та суглобовий відросток. Таким чином, можливі наступні варіанти дефектів НЩ — C, L, H, LC, HC, LHC, HCL, HH [5].
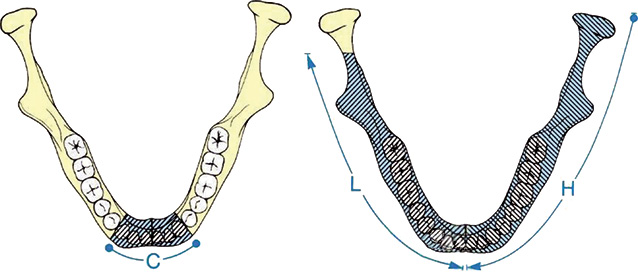
У 1993 р. J. Boyd та співавтори модифікували наведену класифікацію, урахувавши супутні дефекти язика «t», слизової «m» та шкіри «s» [6].
Методики реконструкції НЩ. На сьогодні для пластичного заміщення сегментарних дефектів НЩ застосовують:
- неваскуляризовані кісткові автотрансплантати;
- шкірно-м’язово-кісткові клапті на судинній ніжці;
- васкуляризовані кісткові автотрансплантати;
- реконструктивні пластини (РП)у комбінації зі шкірно-м’язовими клаптями;
- синтетичні імплантати;
- технології тканинної інженерії.
Неваскуляризовані кісткові автотрансплантати. Неваскуляризовані кісткові автотрансплантати використовуються для пластичного усунення невеликих (<6 см) L-дефектів НЩ. Не застосовують пересадку неваскуляризованої кістки в пацієнтів, яким проводили неоад’ювантну променеву терапію, та за наявності супутніх дефектів слизової або м’яких тканин [2, 7]. Для реконструкції НЩ використовують гребінь клубової кістки, фрагменти малогомілкової кістки, ребра та грудини.
Серед ускладнень у більшості випадків відзначають резорбцію пересадженого трансплантата без утворення кісткового регенерату та нагноєння автокістки, що супроводжується її некрозом і відторгненням. M. Rana та співавтори [8] визначили ступінь резорбції різних кісткових трансплантатів протягом 1-річного терміну спостереження (табл. 1). Частота ускладнень, за даними різних авторів, коливається від 7 до 31 %. У багатьох дослідженнях відзначають високий ризик розвитку остеорадіонекрозу пересадженої кістки після проведення ад’ювантної променевої терапії [7–12].
Таблиця 1. Резорбція неваскуляризованих кісткових трансплантатів при автотрансплантації
| Донорська зона (кількість трансплантатів, n) | Резорбція кісткових автотрансплантатів | ||||
|---|---|---|---|---|---|
| 7-й день спостереження, n | 1-й місяць спостереження, n | 6 міс спостереження, n | 1 рік спостереження, n | Усього, n (%) | |
| Гребінь клубової кістки (80) | 0 | 2 | 7 | 10 | 19 (23,7) |
| Ребро (39) | 0 | 3 | 6 | 16 | 25 (64,1) |
| Малогомілкова кістка (31) | 0 | 1 | 1 | 2 | 4 (12) |
| Грудина (16) | 0 | 1 | 1 | 2 | 4 (25) |
Шкірно–м’язово–кісткові клапті на судинній ніжці. У 1980 р. S. Ariyan та C. Cuono повідомили про використання для оромандибулярних реконструкцій шкірно-м’язового клаптя великого грудного м’яза з фрагментом V ребра [13].
У тому ж році W. Panje представив досвід застосування шкірно-м’язово-кісткового трапецієподібного клаптя у 27 хворих, при цьому у 87% випадків пересадки були успішними [14].
Також описано методики пластичного усунення сегментарних дефектів НЩ клаптем кивального м’яза з ключицею та найширшим м’язом спини з фрагментом ребра. Проте широкого застосування вказані клапті не отримали, оскільки вони мають наступні недоліки: складність виділення; обмежена дуга ротації трансплантата; недостатнє кровопостачання пересадженої кістки; обмежена рухомість шкірно-м’язової частини трансплантата відносно кісткової; недостатня товщина кістки для дентальної імплантації [1, 3].
Васкуляризовані кісткові автотрансплантати. Використання васкуляризованих кісткових автотрансплантатів дозволило значно покращити результати лікування пацієнтів зі значними дефектами НЩ та м’яких тканин, особливо після проведеної променевої терапії. На сьогодні найчастіше застосовують наступні автотрансплантати:
- малогомілковий;
- клубовий;
- лопатковий;
- променевий.
Дані клапті використовуються у вигляді кісткових, шкірно-фасціально-кісткових та шкірно-м’язово-кісткових автотрансплантатів. Фактори, які визначають вибір васкуляризованих кісткових автотрансплантатів, та їх характеристика наведені в табл. 2 [15, 16].
Табл. 2. Фактори, які визначають вибір васкуляризованих кісткових автотрансплантатів
| Фактор | Характеристика кісткових автотрансплантатів | |||
|---|---|---|---|---|
| Малогомілковий | Клубовий | Лопатковий | Променевий | |
| Довжина кісткового дефекту | 26–28 см | 12 см | 14 см | 12 см |
| Якість кістки | Бікортикальна | Монокортикальна | Монокортикальна | Монокортикальна |
| Необхідність остеотомії | Можливе проведення остеотомій з інтервалом 2 см | Високий ризик порушення кровопостачання після остеотомій | Можлива одна остеотомія | Неможливе проведення остеотомій |
| Остеоінтеграція дентальних імплантатів | Добра | Добра | Задовільна | Неможливе проведення дентальної імплантації |
| Якість м’якотканинного компонента | Рухомий шкірно-фасціальний фрагмент з надійним кровопостачанням | Масивний, немобільний шкірно-м’язовий компонент, непридатний для тривимірних реконструкцій | Можливий забір декількох рухомих шкірних фрагментів, при необхідності — м’язового | Рухомий шкірно-фасціальний фрагмент з надійним кровопостачанням; можливе закриття тривимірних дефектів |
| Довжина судинної ніжки | 6–7 см; можливе продовження до 15 см за рахунок підокісного виділення | 6 см | 4–6 см; можливе продовження до 20 см | 20 см |
| Оцінка донорської зони | Неможливий забір автотрансплантата при захворюваннях судин нижніх кінцівок | Неможливий забір автотрансплантата при попередніх операціях у даній зоні | Неможливий забір автотрансплантата при попередніх операціях у даній зоні | Неможливий забір автотрансплантата при попередніх переломах променевої кістки |
Малогомілковий клапоть (МК). МК вважається найкращим вибором для пластичного усунення сегментарних дефектів НЩ [1, 2, 15, 16]. Фрагмент бікортикальної кістки може бути викроєний довжиною 26–28 см, що дає можливість закрити більшість дефектів НЩ, включаючи С-дефекти. Судинною ніжкою МК є малогомілкова артерія з відповідними венами. Подвійне кровопостачання малогомілкової кістки дозволяє безпечно проводити необхідну кількість остеотомій для максимально точного відновлення форми НЩ [17–19].
F. Wei та співавтори, проаналізувавши кровопостачання шкіри латеральної поверхні гомілки, засвідчили, що шкірно-фасціальні гілки, які проходять через задню міжфасціальну перегородку, забезпечують адекватне кровопостачання шкірної частини клаптя. Це дозволило використати МК як шкірно-фасціально-кістковий трансплантат [20]. Надійний шкірний фрагмент МК може бути викроєний в нижній третині гомілки [21]. Крім того, для відновлення дефекту м’яких тканин в склад МК може бути включений довгий згинач великого пальця стопи [22] та фрагмент камбалоподібного м’яза [23]. Слід відзначити можливість одночасної роботи двох бригад хірургів, оскільки не потрібно змінювати положення тіла пацієнта при заборі МК [16, 24]. Важливим моментом подальшої реабілітації хворих є те, що пересаджена малогомілкова кістка придатна для дентальної імплантації [25]. Результати реконструкції НЩ з використанням МК представлено в табл. 3.
Таблиця 3. Результати реконструкції НЩ з використанням МК
| Автор | Кількість трансплантатів,n | Приживлення трансплантатів, % | Функціональний результат | Естетичний результат, % | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Харчування, % | Мовлення,% | |||||||||||
| Нормальна дієта | М’яка їжа | Рідка їжа | Зондове | Нормальне | Зрозуміле | Незрозуміле | Добрий | Задовільний | Поганий | |||
| T. Shptizer та співавтори (2000) | 14 | 100 | 50 | 35,7 | – | 14,3 | 92,9 | 7,1 | – | 78,6 | 14,3 | 7,1 |
| D. Hidalgo та співавтори (2002) | 20 | 100 | 70 | 30 | – | – | 85 | 15 | – | 55 | 20 | 25 |
| H. Vayada та співавтори (2006) | 11 | 100 | 100 | – | – | – | 100 | – | – | 82 | 18 | – |
| E. Virgin та співавтори (2010) | 117 | 96,6 | 22,6 | 50 | – | 27,4 | Даних немає | Даних немає | ||||
Роль передопераційної ангіографії дотепер не визначено. K. Blackwell рекомендує обов’язково проводити ангіографію у пацієнтів із захворюваннями периферичних судин, а також при попередніх травмах та операціях нижніх кінцівок [26]. Необхідність рутинної ангіографії перед забором МК дискутується [27, 28].
Ускладнення у донорській зоні після забору МК наступні: біль, нестабільність гомілкостопного суглоба, нестійкість ходи [29].
Клубовий клапоть (КК). КК є шкірно-м’язово-кістковим автотрансплантатом, що включає гребінь клубової кістки та внутрішній косий м’яз живота. Фрагмент монокортикальної кістки може бути узятий довжиною до 12 см. Судинною ніжкою КК є глибока артерія та вена, що огинають клубову кістку. Основною перевагою КК є достатній за висотою великий фрагмент кістки, який придатний для дентальної імплантації. Гребінь клубової кістки має природну кривизну, що дозволяє усувати L-дефекти НЩ без остеотомій [30, 31].
Недоліки КК наступні: шкірно-м’язовий компонент трансплантата достатньо масивний, немобільний та досить часто має недостатнє кровопостачання; пластичне усунення С-дефектів НЩ з використанням даного клаптя неможливе, оскільки проведення остеотомій призведе до порушення кровопостачання кістки; недостатня довжина судинної ніжки (до 6 см) [15, 32].
Ускладнення в донорській зоні після забору КК: біль, післяопераційна пахвинна грижа, порушення ходи та чутливості зовнішньої поверхні стегна [33].
Лопатковий клапоть (ЛК). ЛК може бути викроєний у вигляді шкірно-фасціально-кісткового автотрансплантата з одним або декількома шкірними фрагментами. При пластичному усуненні значних супутніх дефектів м’яких тканин у склад ЛК включають найширший м’яз спини [34, 35]. Фрагмент монокортикальної кістки може бути викроєний довжиною до 14 см. Судинною ніжкою є артерія та вена, що огинають лопатку. Перевагами ЛК є можливість включення достатньо мобільних шкірних фрагментів, порівняно довга судинна ніжка, мінімальні атеросклеротичні зміни судин, незначні порушення в донорській зоні [1, 34, 36, 37].
Недоліки ЛК наступні: неможливе проведення операції двома бригадами хірургів, що значно продовжує час оперативного втручання; недостатнє сегментарне кровопостачання латерального краю лопатки дозволяє провести лише одну остеотомію між артерією, що огинає лопатку та кутовою гілкою грудоспинної артерії [38]; товщина лопаткової кістки, як правило, недостатня для проведення дентальної імплантації [39].
Променевий клапоть (ПК). ПК може бути піднятий у вигляді шкірно-фасціально-кісткового автотрансплантата. Фрагмент монокортикальної кістки викроюють довжиною до 12 см. Основною перевагою ПК є тонкий, пластичний, з надійним кровопостачанням шкірно-фасціальний фрагмент, який ідеально підходить для відновлення м’яких тканин порожнини рота та ротоглотки [1, 40].
Застосування ПК для пластичного усунення сегментарних дефектів НЩ має наступні недоліки: неможливе проведення остеотомій та дентальної імплантації; високий ризик перелому променевої кіски в донорській зоні; необхідність іммобілізації передпліччя [41, 42].
Враховуючи переваги та недоліки ПК, C. Avery рекомендує використовувати його при невеликих L-дефектах НЩ, які поєднуються зі значними дефектами м’яких тканин [43].
РП у комбінації зі шкірно-м’язовими клаптями. У самостійному вигляді РП можуть бути використані для пластичного усунення сегментарних дефектів НЩ за умови відсутності значного супутнього дефекту м’яких тканин. B. Miles та співавтори відзначають, що основними ускладненнями при використанні РП є їх прорізування через слизову оболонку в порожнину рота або через шкіру назовні, перелом пластин та рухомість фіксуючих гвинтів [44].
T. Ettl та співавтори представили досвід лікування 334 пацієнтів з раком порожнини рота, яким проведено сегментарну резекцію НЩ із пластичним усуненням дефекту РП. У 136 хворих виявлено інфекційні ускладнення та прорізування пластини, у 7 — їх перелом. Таким чином, ускладнення зареєстровано у 42% випадків. Серед факторів, які сприяли розвитку ускладнень, автори відзначають паління, передопераційну променеву терапію та заміщення С-дефектів НЩ [45].
D. Coletti та співавтори, аналізуючи досвід застосування РП у 110 пацієнтів, відзначили 36% ускладнень [46]. P. Maurer та співавтори повідомляють про 37% ускладнень [47]. Раннє прорізування РП пов’язане з розвитком інфекційних ускладнень та некрозом м’яких тканин, пізнє — вважають наслідком тертя між пластиною та м’якими тканинами [48]. Перелом РП, за даними різних досліджень, становить від 3 до 16% [48, 49, 50]. Це є доказом того, що РП не замінює кістку, тому перелом може статися через втому металу, як наслідок проблеми відсутності кісткової регенерації [50]. Рухомість фіксуючих гвинтів пов’язана з тиском РП на кортикальну пластинку НЩ, що призводить до її розсмоктування та рухомості гвинтів [51].
При сегментарних дефектах НЩ, що поєднуються з дефектами слизової або м’яких тканин, застосовують РП у комбінації зі шкірно-м’язовими клаптями. Найчастіше використовують шкірно-м’язовий клапоть великого грудного м’яза [48, 52], рідше — вільний шкірно-м’язовий клапоть найширшого м’яза спини або прямих м’язів живота [53]. Шкірно-м’язовий клапоть не лише закриває дефект м’яких тканин, а й попереджує прорізування РП за рахунок того, що добре васкуляризований трансплантат покращує живлення тканин реципієнтної зони, чим підвищує вірогідність неускладненого перебігу післяопераційного періоду [54].
Крім того, S. Yokoo та співавтори вважають, що обгортання пластини м’язовими тканинами також попереджує її прорізування [55].
Частота та характеристика ускладнень, за даними різних досліджень, при пластичному усуненні комбінованих дефектів НЩ наведені в табл. 4 [48, 52, 53, 56].
Таблиця 4. Характеристика хірургічних ускладнень при застосуванні РП у комбінації з шкірно-м’язовими клаптями
| Автор | Кількість спостережень, n | Ускладнення | ||
|---|---|---|---|---|
| Прорізування пластини, n (%) | Перелом пластини, n (%) | Усього, % | ||
| T. Poli та співавтори (2003) | 25 | 4 (16) | 4 (16) | 32 |
| P. Salvatori та співавтори (2007) | 27 | 6 (22,2) | 0 (0) | 22,2 |
| M. El-Zohairy та співавтори (2009) | 33 | 3 (9,1) | 1 (3) | 12,1 |
| G. Harsha та співавтори (2012) | 36 | 9 (25) | 3 (8) | 33 |
РП у комбінації зі шкірно-м’язовими клаптями використовують у пацієнтів, які мають протипоказання до мікрохірургічної пересадки кісткових автотрансплантатів, та у хворих із високим ризиком рецидиву пухлини [52–54].
Деякі хірурги віддають перевагу первинному заміщенню сегментарних дефектів НЩ РП, а в подальшому, при відсутності рецидиву пухлини, проводять відстрочену кісткову пластику різними методами [50].
Синтетичні імплантати. На сьогодні пересадка васкуляризованих кісткових автотрансплантатів є золотим стандартом реконструктивно-відновного лікування пацієнтів із сегментарними дефектами НЩ [1, 2]. Проте, окрім переваг, застосування вільної кісткової пластики має суттєві недоліки:
- складність та дорожнечу методики;
- тривалість оперативного втручання;
- неможливість повного відновлення анатомічної форми НЩ та проведення артропластики;
- складність моделювання форми автотрансплантата;
- функціональні порушення в донорській зоні.
Тому нині продовжуються дослідження з розробки нових синтетичних матеріалів для реконструкції НЩ [1]. Слід відзначити вуглець-вуглецеві імплантати «Углекон-М» та «CarBulat» [57, 58]. Імплантати містять практично чистий вуглець — вуглецеве волокно, яке зв’язане піровуглецем. Матеріал біоінертний, забезпечує поєднання високої механічної міцності з низьким модулем пружності. Використання вуглець-вуглецевих імплантатів для пластичного усунення сегментарних дефектів НЩ має наступні переваги:
- відносну простоту та дешевизну методики;
- можливість повноцінного відновлення анатомічної форми НЩ та якісної ортопедичної реабілітації;
- відсутність необхідності проведення додаткових оперативних втручань із забору кісткових автотрансплантатів [57, 59, 60].
G. Szabo та співавтори проаналізували віддалені результати реконструкції НЩ з використанням вуглець-вуглецевих імплантатів «CarBulat» у 16 пацієнтів. У 5 з 16 хворих відзначено прорізування імплантата в порожнину рота. Переломів пластин, послаблення фіксуючих гвинтів та запалення навколо вуглець-вуглецевих імплантатів не виявляли. Автори відзначають хороші функціональні та косметичні результати пластики [58]. Також дослідження показало, що структура та морфологія імплантата в організмі людини не змінились через 8 років після імплантації [61].
Технології тканинної інженерії. У 1971 р. M. Urist запропонував термін «остеоіндукція». Він визначив остеоіндукцію як здатність викликати ектопічний остеогенез, тобто утворення кістки в м’якотканинних структурах. Ним доведено, що даний ефект мають кісткові морфогенетичні протеїни (bone morphogenetic proteins — BMP). Розвиток генної інженерії дозволив синтезувати рекомбінантні типи молекул різних фракцій BMP, зокрема — rhBMP-2, rhOP-1, використання яких дозволяє досягати стандартного процесу остеогенезу в експериментальних та клінічних умовах [62–64].
P. Warnke та співавтори для реконструкції НЩ застосували титанову сітку, заповнену блоками неорганічної кістки та просякнуту rhOP-1 й автологічними кістковомозковими клітинами. Дану конструкцію імплантовано під найширший м’яз спини. Через 7 тиж рефабрикований трансплантат разом із фрагментом найширшого м’яза спини перенесено в зону дефекту НЩ, реваскуляризовано та фіксовано титановими гвинтами. Проведена в післяопераційний період радіосцинтиграфія показала життєздатність пересадженої кісткової тканини [65].
A. Herford та співавтори представили досвід пластичного заміщення великих дефектів НЩ з використанням rhBMP-2 на колагеновому носієві та титанової сітки у 14 хворих. У всіх випадках досягнуто формування повноцінної кісткової тканини та високих показників функціональної реабілітації. Рентгенологічні ознаки новоутвореної кістки визначаються через 5–6 міс після реконструкції [65]. Автори вважають, що дана методика є альтернативою різним варіантам кісткової автопластики [66, 67].
У більшості відомих досліджень для реконструкції НЩ використовували rhBMP-2. C. Clokie та G. Sandor для заміщення сегментарних дефектів НЩ застосували rhBMP-7 [68].
У якості носія BMP використовують колагенову губку, яка повільно їх вивільняє протягом періоду остеогенезу. На жаль, колагенова губка легко деформується під тиском м’яких тканин, тому для захисту ложа, у якому формується кістка, слід застосовувати титанову сітку. Розробка нових носіїв з кращою структурною стабільністю дозволить вирішити зазначену проблему. Додавання наповнювачів — демінералізованого кісткового матриксу та автологічної кістки рекомендується для покращення остеокондуктивного ефекту [69, 70].
Характеристику досліджень, у яких вивчали застосування BMP для заміщення сегментарних дефектів НЩ, наведено в табл. 5 [64, 65, 67, 68, 70].
Таблиця 5. Характеристика досліджень, у яких вивчали застосування BMP для заміщення сегментарних дефектів НЩ
| Автор | Кількість спостережень, n | Етіологія дефекту | Тип ВМР | Носій ВМР | Наповнювач | Доза ВМР | Розмір дефекту | Тривалість спостереження | Дентальна імплантація | Ускладнення |
|---|---|---|---|---|---|---|---|---|---|---|
| C. Clokie та G. Sandor (2008) | 10 | Амелобластома, остеомієліт | rhВМР 7 | – | ДКМ | Даних немає | 3–9 см | 9–12 міс | Проведена у 4 хворих | – |
| A. Herford та P. Boyne (2008) | 14 | Злоякісні новоутворення, остеомієліт | rhВМР 2 | Колагенова губка | – | 6 мг | 4–8 см | 6 міс | – | – |
| T. Carter та співавтори (2008) | 5 | Кісти, травма | rhВМР 2 | Колагенова губка | ДКМ | 8,4–12 мг | 5 см | 8–22 міс | – | У 2 хворих |
| A. Herford (2009) | 2 | Амелобластома | rhВМР 2 | Колагенова губка | ДКМ | 12 мг | Даних немає | 8–9 міс | Проведена у 1 хворого | – |
| A. Herford та M. Cicciu (2010) | 1 | Остеобластома | rhВМР 2 | Колагенова губка | АК | 4,2 мг | Даних немає | 4 міс | – | – |
ДКМ – демінералізований кістковий матрикс; АК – автологічна кістка
На сьогодні опубліковано результати лікування 37 пацієнтів із сегментарними дефектами НЩ. У 32 (86,5%) хворих реконструкції були успішні, у 5 (13,5%) — досягнути формування адекватної кістки не вдалося. На основі невеликої кількості спостережень неможливо зробити висновок про те, чи BMP зможуть замінити кісткові автотрансплантати. Проведення в майбутньому клінічних досліджень дозволить визначити істинну ефективність цієї методики [70].
ВИСНОВКИ
Упроваджена в останні десятиріччя пересадка васкуляризованих кісткових автотрансплантатів дозволила значно покращити результати реконструктивного лікування хворих із сегментарними дефектами НЩ.
Застосування неваскуляризованої кістки, шкірно-м’язово-кісткових клаптів на судинній ніжці та РП у комбінації зі шкірно-м’язовими клаптями залишається методом вибору в певних клінічних ситуаціях.
Розробка нових синтетичних імплантатів та впровадження технологій тканинної інженерії в найближчому майбутньому дозволить розширити спектр методик із заміщення дефектів НЩ.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Cannon T.Y., Strub G.M., Yawn R.J. et al. (2012) Oromandibular Reconstruction. Clin. Anat., 25: 108–119.
2. Chim H., Salgano C.J., Mardini S. et al. (2010) Reconstruction of Mandibular Defects. Semin Plast. Surg., 24: 188–197.
3. Stosic S., Andelic G. (2011) Current «Cold Standart» and future procedures in manibular reconstruction. Med. Data, 3(2): 169–177.
4. Tacushima A., Harii K., Asato H. et al. (2001) Mandibular reconstruction using microvascular free flaps: a statistical analysis of 178 cases. Plast. Reconstr. Surg., 108: 1555–1563.
5. Jewer D.D., Boyd J.B., Manktelow R.T. et al. (1989) Orofacial and mandibular reconstruction with the iliac crest free flap: a review of 60 cases and a new method of classification. Plast. Reconstr. Surg., 84: 391–403.
6. Hidalgo D.A., Pusic A.L. (2002) Free-flap mandibular recons-truction: 10-year follow-up study. Plast. Reconstr. Surg., 110: 438–449.
7. Poqrel M.A., Podlesh S., Anthony J.P. et al. (1997) A comparison of vascularized and nonvascularized bone grafts for reconstruction of mandibular continuity defects. J. Oral Maxillofac. Surg., 55(11): 1200‒1206.
8. Rana M., Warraich R., Kokemüller H. et al. (2011) Reconstruction of mandibular defects-clinical retrospective research over a 10-year period. Head & Neck Oncol., 3: 23.
9. van Gemert J.T., van Es RJ., van Cann EM. et al. (2009) Nonvascularized bone grafts for segmental reconstruction of the mandible — a reappraisal. J. Oral Maxillofac. Surg., 67: 1446–1452.
10. Foster R.D., Anthony J.P., Sharma A. et al. (1999) Vascularized bone flaps versus nonvascularized bone grafts for mandibular reconstruction: an outcome analysis of primary bony union and endosseous implant success. Head Neck, 21: 66–71.
11. Szpindor E. (1995) Evaluation of the usefulness of autogenic bone grafts in reconstruction of the mandible. Ann. Acad. Med. Stetin, 41: 155–169.
12. Chiapasco M., Colletti G., Romeo E. et al. (2008) Long-term results of mandibular reconstruction with autogenous bone grafts and oral implants after tumor resection. Clin. Oral. Implants, 10: 1074–1080.
13. Ariyan S., Cuono C.B. (1980) Myocutaneous Flaps for Head and Neck Reconstruction. Head Neck Surg., 2(4): 321–345.
14. Panje W., Cutting C. (1980) Trapezius osteomyocutaneous island flap for reconstruction of the anterior floor of the mouth and the mandible. Head Neck Surg., 3(1) 66–71.
15. Goh B., Lee S., Tideman H. (2008) Mandibular reconstruction in adults: a review. J. Oral. Maxillofac. Surg., 37: 597–605.
16. Wehage I., Fansa H. (2011) Complex reconstruction in hed and neck cancer surgery: decision making. Head & Neck Oncology. 3: 1–14.
17. Hidalgo D.A. (1991) Aestethic improvements in free flap mandible reconstruction. Plast. and Reconstr. Surg., 4: 574–585.
18. Wei F.C., Seah C.S., Tsai Y.C. et al. (1994) Fibula osteoseptocutaneous flap for reconstruction of composite mandibular defects. Plast. Reconstr. Surg., 93: 294–304.
19. Bӓhr W. (1998) Blood supply of small fibula segments: and experimental study on human cadavers. J. Craniomaxillofac. Surg., 3: 148–152.
20. Wei F.C., Chen H.C., Chuang C.C. et al. (1996) Fibular osteoseptocutaneous flap: anatomic study and clinical application. Plast. Reconstr. Surg., 2: 191–200.
21. Yu P., Chang E.I., Hanasono M.M. (2011) Desing of a reliable skin paddle for the fibula osteocutaneous flap: perforator anatomy revisited. Plast. Reconstr. Surg., 128: 440–446.
22. Hidalgo D.A., Rekow A. (1995) A review of 60 consecutive fibula free flap mandible reconstructions. Plast. Reconstr. Surg., 96: 585–596.
23. Wong C.H., Ong Y.S., Chew K.Y. et al. (2009) The fibula osteosepotocutaneous flap incorporating flap incorporating the hemisoleus muscle for complex head and neck defects: anatomical study and clinical applications. Plast. Reconstr. Surg., 124: 1956–1964.
24. Mojallal A., Besse J.L., Breton P. (2004) Donor site morbidity after free fibula flap. Report of 42 consecutive cases. Ann. Chir. Plast. Esthet., 49: 3–10.
25. Chang Y.M., Chana J.S., Wei F.C. (2003) Osteotomy to treat malocclusion following reconstruction of the mandible with the free fibula flap. Plast. Reconstr. Surg., 1: 31–36.
26. Blackwell K.E. (1998) Donor site evaluation for fibula free flap transfer. Am. J. Otolaryngol., 19: 89–95.
27. Ahmad N., Kordestani R., Panchal J. et al. (2007) The role of donor site angiography before mandibular reconstruction utilizing free flap. J. Reconstr. Microsurg., 23: 199–204.
28. Kelly A.M., Cronin P., Hussain H.K. et al. (2007) Preoperative MR angiography in free fibula flap transfer for head and neck cancer: clinical application and influence on surgical decision making. AJR Am. J. Roentgenol., 188: 268–274.
29. Bodde E.W., Visser E., Duysens J.E. et al. (2003) Donorsite morbidity after free vascularized autogenous fibular transfer: subjective and quantitative analyses. Plast. Reconstr. Surg., 111: 2237–2242.
30. Boyd J.B. (1994) The place of iliac crest in vascularized oromandibular reconstruction. Microsurgery, 15: 250–256.
31. Takushima A., Harii K., Asato H. et al. (2005) Choice of osseous and osteocutaneous flaps for mandibular reconstruction. Int. J. Clin. Oncol., 10: 234–242.
32. Gabr E.M., Kobayashi M.R., Salibian A.H. et al. (2004) Oromandibular reconstruction with vascularized free flaps: A review of 50 cases. Microsurgery, 24: 374–377.
33. Forrest C., Boyd B., Manktelow R. et al. (1992) The free vascularized iliac crest tissue transfer: Donor site complications associated with eighty-two cases. Br. J. Plast. Surg., 45: 89–93.
34. Aviv J.E., Urken M.L., Vickery C. et al. (1991) The combined latissimus dorsi-scapular free flap in head and neck reconstruction. Arch. Otolaryngol. Head. Neck. Surg., 117: 1242–1250.
35. Valentini V., Gennaro P., Torroni A. et al. (2009) Scapula free flap for complex maxillofacial reconstruction. J. Craniofac. Surg., 20(4): 1125–1131.
36. Smith R.B., Henstrom D.K., Karnell L.H. et al. (2007) Scapula osteocutaneous free flap reconstruction of the head and neck: impact of flap choice on surgical and medical complications. Head. Neck., 29(5): 446–452.
37. Coleman S.C., Burkey B.B., Day T.A. et al. (2000) Increasing use of the scapula osteocutaneous free flap. Laryngoscope., 110: 1419–1424.
38. Coleman J.J., Sultan M.R. (1991) The bipedicled osteocutaneous scapula flap: a new subscapular system free flap. Plast. Reconstr. Surg., 87: 682–692.
39. Hanasono M., Skoracki R. (2010) The scapular tip osseous free flap as an alternative for anterior mandibular reconstruction. Plast. & Reconstr. Surg., 4: 164–166.
40. Villaret D.B., Futran N.A. (2003) The indications and outcomes in the use of osteocutaneous radial forearm free flap. Head Neck, 25: 475–481.
41. Mounsey R.A., Boyd J.B. (1994) Mandibular reconstruction with osseointegrated implants into the free vascularized radius. Plast. Reconstr. Surg., 94: 457–464.
42. Thoma A., Khadaroo R., Grigenas O. et al. (1999) Oromandibular reconstruction with the radial-forearm osteocutaneous flap: experience with 60 consecutive cases. Plast. Reconstr. Surg., 104: 368–378.
43. Avery C.M. (2010) Review of the radial free flap: still evolving or facing extinction? Part two: osteocutaneous radial free flap. Br. J. Oral. Maxillofac. Surg., 48(4): 253–260.
44. Miles B.A., Goldstein D.P., Gilbert R.W. et al. (2010) Mandible reconstruction. Curr. Opin. Otolaryngol. Head Neck Surg., 18: 317–322.
45. Ettl T., Driemel O., Dresp B.V. et al. (2010) Feasibility of alloplastic mandibular reconstruction in patients following removal of oral squamos cell carcinoma. J. Craniomax. Surg., 38: 350–354.
46. Coletti D.P., Ord R., Liu X. (2009) Mandibular reconstruction and second generation locking reconstruction plates: outcome of 110 patients. Int. J. Oral. Maxillofac. Surg., 38: 960–963.
47. Maurer P., Eckert A.W., Kriwalsky M.S. et al. (2010) Scope and limitations of methods of mandibular reconstruction: A long-term follow-up. Br. J. Oral. Maxillofac. Surg., 48: 100–104.
48. Salvatori P., Motto E., Paradisi S. et al. (2007) Oromandibular reconstruction using titanium plate and pectoralis major myocutaneous flap. Acta Otorhinolaryngologica Italica. 27: 227–232.
49. Shibahara T., Noma H., Furuya Y. et al. (2002) Fracture of mandibular reconstruction plates used after tumor resection. J. Oral. Maxillofac. Surg., 60: 182–185.
50. Gellrich N.C., Suarez-Cunqueiro M.M., Otero-Cepeda X.L. et al. (2004) Comparative study of locking plates in mandibular reconstruction after ablative tumour surgery: THORP Vs. UniLOCK system. J. Oral. Maxillofac. Surg., 62: 186–193.
51. Yi Z., Jian-Gou Z, Guang-Yan Y. et al. (1999) Reconstruction plates to bridge mandibular defects: a clinical and experimental investigation in biomechanical aspects. Int. J. Oral. Maxillofac. Surg., 28: 445–450.
52. El-Zohairy M., Mostafa A., Amin A. et al. (2009) Mandibular reconstruction using pectoralis major myocutaneous flap and titanium plates after ablative surgery for locally advanced tumors of the oral cavity. J. of the Egyptian Nat. Canc. Inst., 21(4): 299–307.
53. Poli T., Ferrari S., Bianchi B. et al. (2003) Primary oromandibular reconstruction using free flaps and thorp plates in cancer patients: a 5-year experience. Head Neck. 25: 15–23.
54. Kiyokawa K., Tai Y., Inoue Y. et al. (2001) Reliable, minimally invasive oromandibular reconstruction using metal plate rolled with pectoralis major myocutaneous flap. J. Craniofac. Surg., 12: 326–336.
55. Yokoo S., Komori T., Furudoi S. et al. (2003) Indications for vascularized free rectus abdominis musculocutaneous flap in oromandibular region in terms of efficiency of anterior rectus sheath. Microsurgery, 23: 96–102.
56. Harsha G., Reddy S., Talasila S. et al. (2012) Mandibular reconstruction using AO/ASIF stainless steel reconstruction plate: a retrospective study of 36 cases. J. of Contemp. Dent. Pract., 13(1): 75–79.
57. Кислых Ф.И., Штраубе Г.И., Рапекта С.И. (2004) Пластика дефектов челюстей с применением имплантатов из углеродного композиционного материала «Углекон-М». Анналы пласт., рекон. и эстет. хир., 4: 88–89.
58. Szabό G., Brabás J., Németh Z. et al. (2012) Carbon/carbon implants in oral and maxillofacial surgery — Part 1. Orv. Hetil., 153(7): 257–262.
59. Кислых Ф.И., Рогожников Г.И., Оленëв Л.М. (2006) Использование современных конструкционных материалов при хирургическом и ортопедическом лечении больных с дефектами челюстей. Вестн. рос. акад. естествен. наук, 3: 37–41.
60. Анциферов В.Н., Рогожников Г.И., Кислых Ф.И. и др. (2009) Применение современных реконструкционных материалов при комплексном лечении больных с дефектами челюстно-лицевой области. Перспективные материалы, 3: 46–51.
61. Sebõk B., Kiss G., Szabό P.L. et al. (2012) Carbon/carbon implants in oral and maxillofacial surgery — Part 2. Orv. Hetil., 153(19): 744–750.
62. Seto I., Marukawa E., Asahina I. (2006) Mandibular reconstruction using a combination graft of rhBMP-2 with bone marrow cells expanded in vitro. Plast. Reconstr. Surg., 117: 902–908.
63. Wilmowsky C., Schwarz S., Kerl J.M. et al. (2010) Reconstruction of a mandibular defect with autogenous, autoclaved bone grafts and tissue engineering: an in vivo pilot study. J. Biomed. Mater. Rec., 93: 1510–1518.
64. Carter T., Brar P., Tolas A. et al. (2008) Off-label use of recombinant human bone morphogenetic protein-2 (rhBMP-2) for reconstruction of mandibular bone defects in humans. J. Oral. Maxillofac. Surg., 66: 1417–1425.
65. Warnke P.H., Springer I.N., Wiltfang J. et al. (2004) Growth and transplantation of a custom vascularised bone graft in a man. Lancet, 364: 766–770.
66. Herford A.S., Boyne P.J. (2008) Reconstruction of mandibular continuity defects with bone morphogenetic protein-2 (rhBMP-2). J. Oral. Maxillofac. Surg., 66: 616–624.
67. Herford A.S. (2009) RhBMP-2 as an option for reconstructing mandibular continuity defects. J. Oral. Maxillofac. Surg., 67(12): 2679–84.
68. Clokie C.M.L., Sandor G.K.B. (2008) Reconstruction of 10 major mandibular defects using bioimplants containing BMP-7. J. Canad. Dent. Associat., 74(1): 67–72.
69. Cicciù M., Herford A.S., Stoffella E. et al. (2012) Protein- signaled guided bone regeneration using titanium mesh and rh-BMP2 in Oral Surgery: a case report involving left mandibular reconstruction after tumor resection. J. Open Dentistry, 6: 51–55.
70. Herford A.S., Cicciù M. (2010) Recombinant human bone morphogenetic protein type 2 jaw reconstruction in patients affected by giant cell tumor. J. Craniofac. Surg., 21(6): 1970–75.
Реконструкция нижней челюсти у больных со злокачественными новообразованиями орофарингеальной зоны
Резюме. В статье представлен обзор литературы, посвященный проблеме реконструкции нижней челюсти у больных со злокачественными новообразованиями орофарингеальной зоны. Достижения микрохирургии, разработка новых синтетических имплантатов и технологий тканевой инженерии позволили значительно расширить возможности замещения сегментарных дефектов нижней челюсти, улучшить функциональные и эстетические результаты пластики. Рассмотрены современные методики реконструкции нижней челюсти, обсуждены их преимущества и слабые стороны.
нижняя челюсть, дефекты, реконструкция.














Leave a comment