Сучасні технології в онкохірургії сарком заочеревинного простору
Щепотин И.Б., Лукашенко А.В., Колесник Е.А., Васильев О.В., Разумей Д.А., Приймак В.В., Жуков Ю.А.
Резюме. Операції з приводу заочеревинних сарком є травматичними, тому що в більшості випадків для адекватного видалення пухлини необхідне виконання мультивісцеральної резекції. Супроводжуються високим ризиком місцевого рецидиву. Були впроваджені трансплантаційні технології для виконання органозберігаючих втручань в радикальному обсязі. На представлених клінічних прикладах розглянуті авторська методика «трансплантація у безпечну ділянку», а також метод екстракорпорального видалення пухлини з подальшою аутотрансплантацією здорового органу. Запропоновано спосіб підвищення радикальності операції — тотальне видалення заочеревинної клітковини з використанням принципів лімфодисекції.
Резюме. Операции по поводу забрюшинных сарком являются травматичными, так как в большинстве случаев для адекватного удаления опухоли необходимо выполнение мультивицеральной резекции, сопровождаются высоким риском местного рецидива. Были внедрены трансплантационные технологии для выполнения органосохраняющих вмешательств в радикальном объеме. На представленных клинических примерах рассмотрены авторская методика «трансплантация в безопасное место», а также метод экстракорпорального удаления опухоли с последующей аутотрансплантацией здорового органа. Предложен способ повышения радикальности операций — тотальное удаление забрюшинной клетчатки с использованием принципов лимфодиссекции.

Введение
Саркомы составляют 1% общего числа злокачественных новообразований, 15% сарком мягких тканей локализуются в забрюшинном пространстве. Среди всех забрюшинных сарком 41% составляют липосаркомы [1]. Медленный рост забрюшинных сарком, а также анатомические особенности забрюшинного пространства обусловливают первичное выявление опухолей значительных размеров (в 80% случаев >10 см), вовлекающих смежные органы [2, 3].
Хирургический метод лечения данной патологии является золотым стандартом. Применение предоперационной химиотерапии, лучевой терапии с целью уменьшения размера опухоли не привело к существенным результатам [4], таким образом, выполнение операции при забрюшинных саркомах больших размеров требует от хирурга особого мастерства. Адекватный объем операции предусматривает R0-резекцию [5]. По данным литературы, R0-резектабельность сарком размером >10 см составляет
Результаты лечения забрюшинных сарком в настоящее время следует признать неудовлетворительными, основной причиной смерти больных являются рецидивы, которые по данным различных клиник могут составлять 27–80% [9, 10, 11].
Материалы и методы исследования
Основываясь на опыте нашей клиники (более 700 операций по поводу забрюшинных сарком за последние 30 лет), сегодня мы выделяем ряд ключевых проблем:
- забрюшинные саркомы характеризуются высокой частотой местных рецидивов, что обусловлено мультифокальным ростом опухоли;
- мультивисцеральные резекции по поводу забрюшинных сарком в ряде случаев сопровождаются нефректомией при отсутствии поражения почечной паренхимы (например при вовлечении в опухоль мочеточника либо сосудистой ножки почки);
- при удалении опухолей больших размеров гистологическое исследование чистоты края в ряде случаев чрезвычайно сложно выполнить с учетом всех плоскостей резекции [7];
- удаление почки значительно повышает риск возникновения почечной недостаточности в случае развития рецидива опухоли;
- наибольший процент рецидивов отмечают в неспециализированных клиниках, что обусловлено нерадикальностью оперативных вмешательств [12].
Решение данных проблем, на наш взгляд, состоит в пересмотре принципов оперативного лечения пациентов с забрюшинными новообразованиями. Предложен следующий комплекс мероприятий, который может как повысить радикальность оперативного вмешательства, так и улучшить качество жизни пациентов:
- расширение показаний к мультивисцеральным резекциям;
- внедрение трансплантационных методик, в частности, аутотрансплантация органов, непосредственно не вовлеченных в опухолевый процесс (при невозможности безопасного выделения сосудов для протезирования, обширного вовлечения мочеточника и т.п.);
- тщательное тотальное удаление забрюшинной клетчатки на стороне опухолевого поражения с использованием принципов лимфодиссекции;
- лечение данной категории больных в высокоспециализированных центрах.
На следующих клинических примерах предлагается рассмотреть новый комплексный подход к лечению пациентов с обширными саркомами забрюшинного пространства.
Клинический пример 1
Пациентка М., 57 лет, поступила в стационар с диагнозом «липосаркома забрюшинного пространства». Больная предъявляла жалобы на деформацию брюшной стенки (рис. 1), дискомфорт в брюшной полости. Общее состояние пациентки по шкале ВОЗ=0. Нарушений со стороны сердечной и легочной систем не выявлено. При осмотре брюшной стенки — деформация, при пальпации в правом фланке — опухоль 25 см в диаметре, мягкой консистенции, умеренно смещаемая. При гинекологическом осмотре патологии не выявлено. Лабораторные показатели — в пределах нормы.
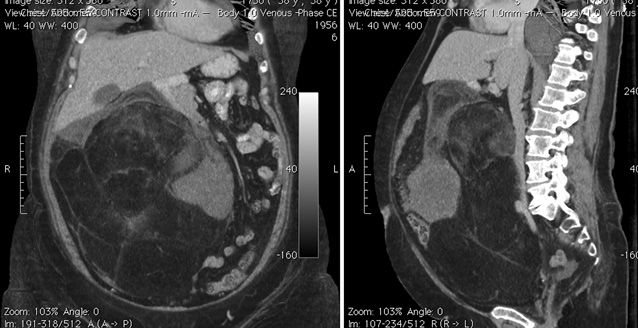
При УЗИ брюшной полости определена солидная опухоль (сонографические тени различной интенсивности), локализованная в забрюшинном пространстве справа. Экскреторная урография позволила выявить узурацию правого мочеточника в области средней трети. В результате проведения спиральной компьютерной томографии (КТ) с контрастированием выявлена опухоль, распространяющаяся из области правого забрюшиного пространства до малого таза со смещением желудка, тонкого и толстого кишечника в левую поддиафрагмальную область. Размеры опухоли составляли 233х149х265 мм, структура жировой плотности с центральным солидным компонентом — 149х91х95 мм, не было получено данных о вовлечении крупных сосудов (см. рис. 1). Путем пункционной биопсии под контролем спиральной КТ верифицирована умеренно-дифференцированная липосаркома.
Оперативное вмешательство

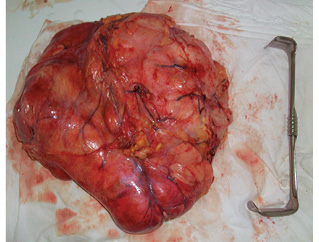
Лапаротомия — Т-образным доступом (рис. 2). Выполнен правый латеральный доступ к нижней полой вене: мобилизация восходящей ободочной кишки, мобилизация двенадцатиперстной кишки и головки поджелудочной железы по Кохеру. Опухоль удалена единым блоком с дистальными отделами правого мочеточника. Остаточный проксимальный участок мочеточника составил 6 см от лоханки. Вес опухоли — 7,7 г. (рис. 3). Далее впервые была использована авторская методика «пересадка в безопасную зону»: аутотрансплантация правой почки в левую подвздошную область. Выделены правая почечная вена с участком нижней полой вены и правая почечная артерия. Сосуды взяты на держалки (рис. 4). Наложены зажимы на правые почечные артерию и вену, почка отсечена, перенесена на «задний столик», начата инфузия почки охлажденным раствором «Кустодиол» (почка приобрела бело-серую мраморную равномерную окраску). Для повышения радикальности операции выполнено тщательное препарирование ворот почки — макроскопически удалена вся жировая клетчатка.
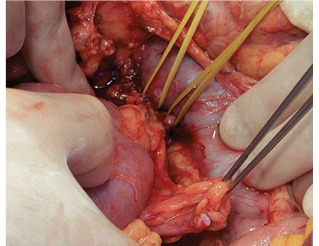
Проведена подготовка левой подвздошной области к аутотрансплантации. Мобилизована сигмовидная кишка. Выделены левая внутренняя подвздошная артерия до места деления на ветви первого порядка, наложен сосудистый зажим на ее проксимальную часть, левая внутренняя подвздошная артерия перевязана и отсечена. Наружная подвздошная вена выделена на протяжении и взята на держалки (рис. 5). Правая почка перенесена в рану и ориентирована в ней. Последовательно наложены анастомозы: почечная артерия с внутренней подвздошной артерией «конец в конец», почечная вена с наружной подвздошной веной «конец в бок» (рис. 6). Почка включена в кровоток, приобрела нормальную розовую равномерную окраску и тургор, спустя 3 мин из мочеточника появились броски мочи. Выполнена уретероцистонеостомия. Почка фиксирована забрюшинно в тазу слева путем укладки и фиксации сигмовидной кишкой (рис. 7).
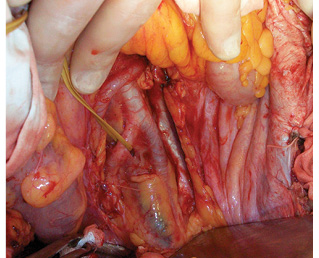
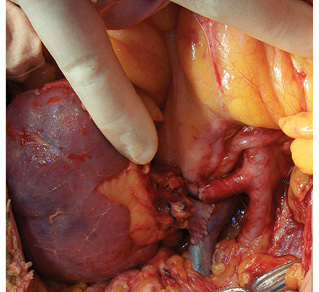
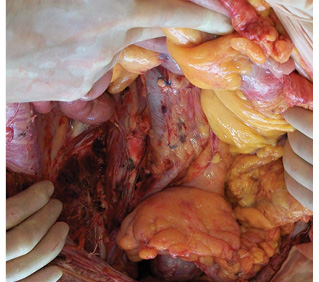
Согласно разработанным принципам произведено тщательное тотальное удаление клетчатки забрюшинного пространства из правой половины брюшной полости единым блоком с правосторонней эпинефрэктомией в пределах следующих границ: сверху — фасция диафрагмы, медиально — нижняя полая вена, снизу — правые общая и наружная подвздошные вены, латерально — фасция правой поперечной мышцы, сзади — фасции правых квадратной поясничной, большой и малой поясничных, подвздошной мышц. Выделены следующие структуры: нижняя полая вена на всем протяжении, правые общая подвздошная и наружная подвздошные вены, правая общая подвздошная и наружная подвздошные артерии, правые феморальный, генитофеморальный, обтураторный, подвздошно-паховый нервы (рис. 8). Кровопотеря составила 400 мл, общая продолжительность операции — 7 ч 40 мин.
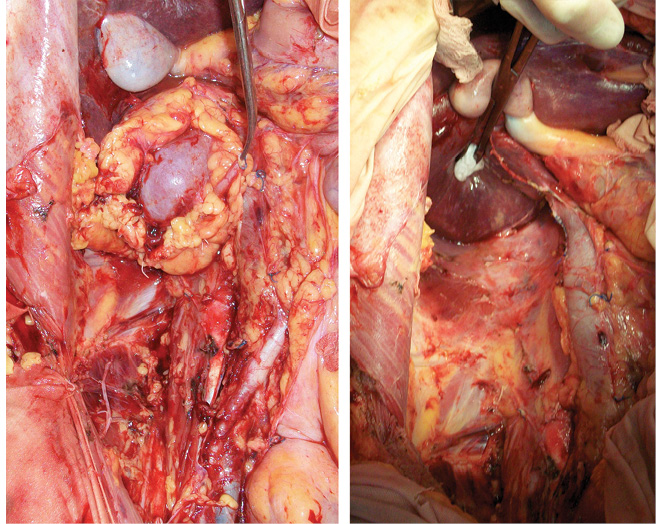
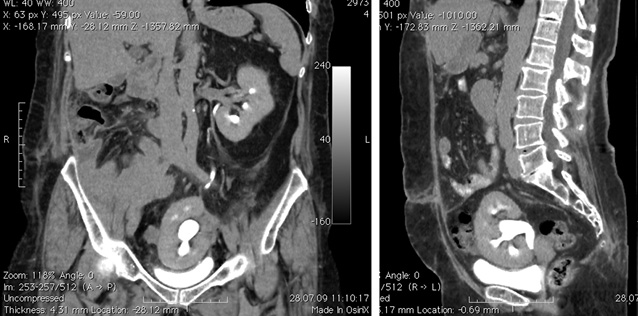
Послеоперационный период — без осложнений. Пациентка с 1-х суток принимала жидкую пищу, со 2-х суток самостоятельно обслуживала себя. Больная была выписана на 14-е сутки. Через 3 нед после выписки ей было успешно проведено оперативное вмешательство в плевральной полости — удаление кисты заднего средостения. Данные КТ через 3 нед представлены на рис. 9.
Клинический пример 2
Пациентка К., 49 лет, поступила в стационар с диагнозом «фиросаркома забрюшинного пространства». Больная предъявляла жалобы на периодическую боль, дискомфорт в брюшной полости. Общее состояние пациентки по шкале ВОЗ=0. Нарушений со стороны сердечной и легочной систем не выявлено. При пальпации в левой поддиафрагмальной области — опухоль 10 см в диаметре, умеренно смещаемая. При гинекологическом осмотре патологии не выявлено. Лабораторные показатели — в пределах нормы.
При УЗИ брюшной полости выявлена солидная опухоль (сонографические тени различной интенсивности), локализованная в забрюшинном пространстве слева в проекции левой почки. Экскреторная урография показала некоторую деформацию левого мочеточника в области верхней трети. Спиральная КТ с контрастированием позволила определить забрюшинную опухоль, распространяющуюся из области левого забрюшиного пространства, смещая тонкий и толстый кишечник вправо. Размеры опухоли 190х105х145 мм, структура неоднородной плотности, опухоль интимно прилежит к левой почке, деформирует ее сосудистую ножку. Была произведена пункционная биопсия под спиральным КТ контролем — верифицирована низкодифференцированная фибросаркома.
Оперативное вмешательство
Лапаротомия — Т-образным доступом. Выполнен левый латеральный доступ к брюшной аорте, нижней полой вене: мобилизация нисходящей ободочной кишки, двенадцатиперстной кишки, хвоста-тела поджелудочной железы. Опухоль удалена единым блоком с левой почкой согласно описанной ранее методике «пересадка в безопасную зону».
В данном случае на «задний столик» была перенесена почка вместе с опухолью (рис. 10) (единым блоком), начата инфузия почки охлажденным раствором «Кустодиол» (почка приобрела бело-серую мраморную равномерную окраску). Далее применена методика экстракорпорального удаления опухоли, препарат удален, выполнена ревизия на предмет отсутствия опухолевой инвазии как в паренхиму, так и в структуры ворот почки. (рис. 11). Почка аутотрансплантирована в правую подвздошную область согласно технологии, описанной выше. Кровопотеря составила 300 мл, общая продолжительность операции — 6 ч 30 мин. Послеоперационный период — без осложнений. В послеоперационный период у пациентки отмечено развитие гипопротеинэмии с 5-х суток после операции, что потребовало дополнительной коррекции путем комбинированного парентерального и энтерального питания. Больная была выписана на 21-е сутки в удовлетворительном состоянии.
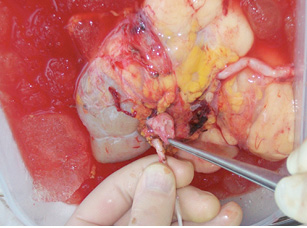
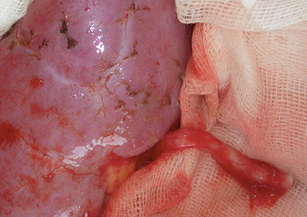
Обсуждение
Метод аутотрансплантации почек хорошо известен и достаточно широко используется при различных патологиях [13, 14, 15]. Однако данную методику ранее не применяли в онкохирургической практике. При удалении забрюшинной опухоли выполнение нефрэктомии для хирурга всегда проще, быстрее, не требует особых навыков и затрат.
На данных примерах впервые нами была успешно применена аутотрансплантация согласно разработанному принципу «пересадка в безопасное место», а также методики экстракорпорального удаления опухоли, что позволило выполнить радикальную обширную комбинированную операцию, сохранить орган, переместить его из зоны возможного рецидива (предупреждая развитие почечной недостаточности в будущем). В большинстве случаев нефрэктомия при удалении забрюшинной саркомы выполняется при поражении опухолью околопочечной клетчатки. Об этом свидетельствуют два морфологических исследования. На материале более чем 3000 мультивисцеральных резекций выявлено, что в 53% нефрэктомию выполняли при отсутствии опухолевой инвазии в ткань почки [5, 16].
Особо важным этапом в описанных клинических случаях было скрупулезное удаление всей забрюшинной клетчатки на стороне опухолевого поражения. Учитывая мультифокальный рост опухоли, данная методика направлена на предупреждение повторных операций по поводу новых очагов опухолевого роста, которые в литературе трактуются как рецидивы. Основной причиной плохих отдаленных результатов (5-летняя выживаемость после оперативного лечения составляет не более 15–30%) является нерадикальность выполняемых операций [17, 18, 19]. Stojadinovic и соавторы при исследовании гистопрепаратов у 2084 пациентов с забрюшинными саркомами установили, что при R0-резекции риск рецидива составляет 15%, при наличии микроскопически позитивных краев резекции (R1) — 28% [20]. Операция в объеме R1, помимо увеличения рецидивирования, повышает риск возникновения отдаленных метастазов в 1,6 раза.
Поиск методов улучшения результатов лечения путем применения комбинированных методик не принес успеха: при применении химиотерапии, в том числе препаратов последних поколений (месна, паклитаксел), не отмечено существенного влияния на снижение частоты рецидивов [4], при лучевой терапии предоперационно, послеоперационно и интраоперационно — не повысились показатели 5-летней выживаемости [7]. На наш взгляд, основным перспективным направлением в лечении забрюшинных сарком является совершенствование хирургических технологий, в том числе использование современных трасплантационных методик. Радикальные операции с мультивисцеральными резекциями сопряжены с приемлемым количеством послеоперационных осложнений при условии их выполнения в специализированных клиниках. В этом наша позиция совпадает с мнением зарубежных авторов [21].
Аутотрансплантация — перспективное направление хирургической онкологии, методика может быть усовершенствована и в последующем применена при опухолях других анатомических зон (например при инфильтрации основного ствола верхней брыжеечной артерии аутотрансплантация сосудов тонкой кишки в бассейн подвздошной области).
Заключение
Совершенствование методик трансплантации и их активное внедрение в лечение онкологических больных — перспективное направление развития хирургической онкологии, позволяющее выполнять радикальные органосохраняющие операции, повышая качество жизни больных.
Предложенный комплекс хирургических подходов «трансплантация в безопасное место» является перспективным вследствие повышения показаний к радикальному лечению больных забрюшинными саркомами. Методика требует дальнейшего изучения и оценки отдаленных результатов лечения.
литературА
- 1. Echenique-Elizondo M., Amodarain-Arratibel J.A. (2005) Liposarcoma retroperitoneal gigante. Cir. Esp., V. 77: 293–5.
- 2. Karakousis C.P., Gerstenbluth R., Kontzoglou K. et al. (1995) Retroperitoneal sarcomas and their management. Arch. Surg., V. 130, № 10: 1104–9.
- 3. Jaques D.P., Coit D.G., Hajdu S.I. et al. (1990) Management of primary and recurrent soft-tissue sarcoma of the retroperitoneum. Ann. Surg., V. 212: 51–9.
- 4. Yoshida Y., Inoue K., Ohsaco T. et al. (2007) Weekly paclitaxel therapy is curative for patients with retroperitoneal liposarcoma. Gan To Kagaku Ryoho., V. 34: 465–7.
- 5. Singer S., Antonescu C.R., Riedel E. et al. (2003) Histologic subtype and margin of resection predict pattern of recurrence and survival for retroperitoneal liposarcoma. Ann. Surg., V. 238, № 3: 358–70.
- 6. Hardwigsen J., Baque P., Crespy B. et al. (2001) Resection of the inferior vena cava for neoplasms with or without prosthetic replacement: A 14-patients series. Ann. Surg., V. 233: 242–9.
- 7. Hassan I., Park S.Z., Donohue J.H. et al. (2004) Operative management of primary retroperitoneal sarcomas. A reappraisal of an institute experience. Ann. Surg., V. 239: 244–50.
- 8. Stauffer J.A., Fakhre G.P., Dougherty M.K. et al. (2009) Pancreatic and multiorgan resection with inferior vena cava reconstruction for retroperitoneal leiomyosarcoma. World J. Surg. Oncol., V. 6, № 7: 3.
- 9. Nijhuis P.H., Sars P.R., Plaat B.E. et al. (2000) Clinico-pathological data and prognostic factors in completely resected AJCC stage I-III liposarcomas. Ann. Surg. Oncol., V. 7: 535–43.
- 10. McGrath P.C., Neifeld J.P., Lawrence W. et al. (1984) Improved survival following complete excision of retroperitoneal sarcomas. Ann. Surg., V. 200, № 2: 200–4.
- 11. Morandeira A., Prieto J., Poves I. et al. (2008) Giant retroperitoneal sarcoma. Can. J. Surg., V. 51, № 4: 79–80.
- 12. Hollenbeck S.T., Grobmyer S.R., Kent K.C. et al. (2003) Surgical treatment and outcomes of patients with primary inferior vena cava leiomyosarcoma. J. Am. Coll. Surg., V. 197: 575–579.
- 13. Bolling T., Janke K., Wolters H.H. et al. (2009) Kidney-autotransplantation before radiotherapy: a case report. Anticancer Res., V. 29, № 8: 3397–400.
- 14. Iida T., Kawa G., Matsuda T. (2009) A case of preserving renal function by renal autotransplantation for bilateral urothelial carcinoma of the ureter. Int. J. Urol., V.16, № 6: 587.
- 15. Lopez-Fando Lavalle L., Burgos Revilla J., Saenz Medina J. et al. (2007) Renal autotransplantation: a valid option in the resolution of complex cases. Arch. Esp. Urol., V. 60, № 3.P.255–65.
- 16. Russo P., Kim Y., Ravindran S., et al. (1997) Nephrectomy during operative management of retroperitoneal sarcoma. Ann. Surg. Oncol., V. 4, № 5: 421–4.
- 17. Glenn J., Sindelar W.F., Kinsella T. et al. (1985) Results of multimodality therapy of resectable soft tissue sarcomas of the retroperitoneum. Surgery., V. 97: 316–324.
- 18. Dalton R.R., Donohue J.H., Mucha P. et al. (1989) Management of retroperitoneal sarcomas. Surgery, V. 106: 725–733.
- 19. Herman K., Kusv T. (1999) Retroperitoneal sarcoma — the continued challenge for surgery and oncology. Surg. Oncol., V. 7: 77–81.
- 20. Stojadinovic A., Leung D.H., Hoos A. et al. (2002) Analysis of the prognostic significance of microscopic margins in 2,084 localized primary adult soft tissue sarcomas. Ann. Surg., V. 235: 424–34.
- 21. Teo M.C., Chow P.K., Soo K.C. (2005) Surgery for retroperitoneal sarcoma requiring major vascular resection and reconstruction. Asian. J. Surg., V. 28, № 4: 312–5.














Leave a comment