Опыт применения бисфосфонатов в лечении больных саркомами костей
Ковальчук П.А., Коровин С.И., Дедков А.Г., Волков И.Б., Бойчук С.И., Костюк В.Ю. , Тихонов В.Г.
Резюме. Проведен анализ эффективности применения комбинации химиотерапии и бисфосфонатов в комплексном лечении пациентов с саркомами костей. В работе представлены результаты собственных исследований влияния бисфосфонатов на лечебный патоморфоз злокачественных опухолей костей, стабильность и долговечность имплантов после хирургических резекций костей, доказана безопасность применения антирезорбтивных препаратов в сочетании с цитостатиками. Проведенный анализ свидетельствует, что бисфосфонаты способствуют повышению эффективности лечения больных саркомами костей, не повышая при этом токсичность лечения.
Введение
Исследованиями прошлых лет доказана эффективность ряда цитостатических средств в лечении пациентов с саркомами костей. На сегодня разработан четкий алгоритм лечения больных со злокачественными опухолями костей. Золотым стандартом являются неоадъювантная химиотерапия, радикальная хирургическая резекция и адъювантная химиотерапия. Список препаратов, входящий в этот алгоритм, давно известен, достаточно ограничен и включает в себя метотрексат, цисплатин, доксорубицин, ифосфамид, этопозид. Несмотря на бурное развитие фармакологической индустрии, количество препаратов первой линии в лечении сарком костей остается прежним. Попытки применения таргетных препаратов не привели к желаемым результатам [3, 19]. Также остается нерешенной проблема лечения пациентов с химиорезистентными формами злокачественных опухолей костей, которые требуют совершенного нового подхода к терапевтическому воздействию [15]. Именно существование этой группы пациентов наталкивает исследователей на поиск новых подходов и методов лечения.
Изучая свойства бисфосфонатов (БФ), которые эффективно применяли ранее в онкологической практике при лечении метастатического поражения скелета, мы предположили, что они могут влиять и на первичный злокачественный опухолевый процесс костей. Этот эффект подтверждают некоторые мировые исследования [22, 26].
БФ — это группа препаратов, которые ингибируют патологическую резорбцию костной ткани. Благодаря своим свойствам они нашли широкое применение в онкологической практике, поскольку оказывают антирезорбтивный, антиангиогенный и антинеопластический эффект [14]. Считалось, что механизм действия БФ был направлен исключительно на стабилизацию костной ткани. Позже выяснилось, что они напрямую влияют на опухолевые клетки у пациентов с миеломной болезнью [4, 8–10].
Многочисленные исследования подтверждают предположение, что БФ активно действуют против остеосаркомы, самостоятельно или в комбинации с химиотерапией [16, 17, 20]. Изучено влияние алендроновой кислоты, клодроната, ибандроновой, памидроновой и золедроновой кислоты на остеосаркому у животных, а также на культуры человеческих клеток остеосаркомы [2, 5, 9, 10–13, 21, 23, 24].
Известен также тот факт, что у большого количества пациентов с первичной саркомой кости, принимавших курс полихимиотерапии, регистрируют переломы во время лечения [26]. Для этих пациентов остается риск остеопороза и патологических переломов на протяжении всей их жизни. Связанная с лечением костная резорбция является общепризнанной проблемой для молодых пациентов, получающих химиотерапию. Для взрослых с остеопорозом лечение с применением БФ приводит к уменьшению количества переломов на 50% после 1 года лечения. У этих пациентов увеличение костной массы составило 2–4% в год в течение первых 4 лет лечения. Еще более опасными для этой группы пациентов являются патологические переломы в зоне опухоли, которые могут повлиять на выживаемость, и местные рецидивы. В различных научных обзорах утверждается, что в течение 5 лет выживаемость пациентов с остеосаркомой и патологическим переломом составляет 55%, а пациентов с остеосаркомой без перелома — 77%. Количество местных рецидивов также увеличивается в группе с патологическими переломами (25% по сравнению с 4%) [26].
Анализируя все предварительные данные, можно утверждать, что БФ — это совершенно новый подход в лечении злокачественных опухолей костей, но их применение не является альтернативой традиционному лечению как самостоятельный метод, а может использоваться только в сочетании с химиотерапией.
Цель нашего исследования — установить эффективность применения БФ в комбинации с химиотерапией в лечении пациентов с первично злокачественными опухолями костей, определить, приведет ли комбинирование химиотерапии и БФ к повышению токсичности или снижению эффективности воздействия на опухоль, изучить эффективность БФ для профилактики нестабильности эндопротезов [6, 7, 25, 27, 28].
Материалы и методы
В 2009 г. в Национальном институте рака и Институте патологии позвоночника и суставов им. М.И. Ситенко мы начали рандомизированное многоцентровое исследование по изучению влияния БФ в комбинации с химиотерапией в лечении первичных злокачественных опухолей костей.
Критерии включения в исследование:
- морфологически подтвержденный диагноз всех гистологических вариантов первичных злокачественных опухолей костей, которые ранее не подвергались лечению;
- пациенты только с локальными формами низкодифференцированных сарком (IIА, IIБ).
В исследование включено 47 пациентов с различными нозологическими формами сарком костей. Возраст пациентов — от 18 до 55 лет, среди них 22 женщины, 25 мужчин. Характеристика групп пациентов представлена в табл. 1, 2.
Таблица 1. Структура основной и контрольной групп пациентов
| Характеристика пациентов | Основная (n=18) | Контрольная (n=29) | |||
| n | % | n | % | ||
| Пол | Мужчины | 10 | 55,5 | 15 | 51,7 |
| Женщины | 8 | 44,5 | 14 | 48,3 | |
| Возраст, годы | 18-30 | 9 | 50,0 | 16 | 55,2 |
| 31-50 | 7 | 38,9 | 9 | 31,0 | |
| >50 | 2 | 11,1 | 4 | 13,8 | |
| Локализация опухоли | Конечности | 17 | 94,5 | 27 | 93,1 |
| Кости таза | 1 | 5,5 | 2 | 6,9 | |
Таблица 2. Распределение пациентов согласно морфологической форме и локализации опухоли
| Гистологический вариант | Локализация | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Бедренная кость | Большеберцовая кость | Плечевая кость | Кости таза | Всего | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| Остеосаркома | 22 | 46,8 | 3 | 6,4 | 1 | 2,1 | 1 | 2,1 | 27 | 57,5 |
| Фибросаркома | 4 | 8,5 | 1 | 2,1 | – | – | – | – | 5 | 10,6 |
| Злокачественная гигантоклеточная опухоль | 1 | 2,1 | 3 | 6,4 | – | – | – | – | 4 | 8,5 |
| Злокачественная фиброзная гистиоцитома | 2 | 4,2 | 3 | 8,5 | 1 | 2,1 | – | – | 6 | 12,8 |
| Ангиосаркома | 1 | 2,1 | – | – | – | – | 1 | 2,1 | 2 | 4,2 |
| Мезенхимальная хондросаркома | 1 | 2,1 | 1 | 2,1 | – | – | 1 | 2,1 | 3 | 6,4 |
| Всего | 31 | 66 | 11 | 23,4 | 2 | 4,2 | 3 | 6,4 | 47 | 100 |
Путем рандомизации все пациенты распределены на 2 группы в зависимости от приема БФ, сформированы основная и контрольная группа. В основную группу вошли 18 пациентов, которые проходили курс комбинированного лечения по общепринятой схеме (неоадъювантная химиотерапия, радикальная хирургическая резекция, адъювантная химиотерапия). Контрольную группу составили 29 пациентов, которые получали лечение согласно аналогичной схеме, но с ежемесячной инфузией БФ. Результат оценивали по следующим критериям: клинический ответ опухоли на терапевтическое лечение, сравнение лечебного патоморфоза, стабильность импланта и проявление токсичности.
Все пациенты проходили стандартный алгоритм лечения, включающий неоадъювантную химиотерапию, хирургическое лечение в объеме радикальной резекции кости с последующим замещением дефекта имплантом и адъювантную химиотерапию, которая зависит от ответа на дооперационное лечение. Предоперационную химиотерапию начинали с эндоартериального введения цисплатина в курсовой дозе 120 мг/м2 (2 введения по 60 мг/м2 в течение 2–3 ч) с пре- и постгидратацией. На 3–4‑й день пациент получал доксорубицин в курсовой дозе 75 мг/м2 (2 введения по 4 ч внутривенно). На 21-й день неоадъювантную химиотерапию продолжали 4-часовым внутривенным введением метотрексата в дозе 12 г/м2 на фоне инфузионной терапии с контролем уровня концентрации его в плазме крови по окончании введения, а затем каждые 24 ч (при необходимости чаще). Через сутки назначали кальция фолинат в дозе 15 мг/м2 каждые 6 ч до снижения уровня концентрации метотрексата в плазме крови до 0,2 мкмоль/л. Инфузионную терапию проводили из расчета 2000 мл/м2 жидкости в сутки (с учетом выпиваемой), назначали за 1 ч до введения метотрексата в течение 36 ч с поддержанием электролитного баланса и постоянным ощелачиванием мочи (уровень рН >7). Инфузионное обеспечение корригировали индивидуально в зависимости от проявлений токсичности и возникновения осложнений. Измерение концентрации метотрексата в плазме крови проводили на анализаторе TDx (Германия).
У каждого пациента проводили 3 блока химиотерапии с использованием 3 вышеназванных препаратов с интервалом 3 нед. После хирургического вмешательства, сохраняющего конечность, назначали адъювантную химиотерапию в режиме монохимиотерапии с чередованием метотрексата в той же дозе и следующим введением через 1 нед цисплатина в курсовой дозе 150 мг/м2 (48-часовое непрерывное введение), а также доксорубицина, применяемого через 21 день после цисплатина в дозе 90 мг/м2 (двукратное 4-часовое введение). Циклы повторяли через каждые 3 нед. Количество циклов определяли по степени лечебного патоморфоза с использованием методики Автандилова и градации степеней по Huvos [1, 18, 29]: 2 цикла — при I степени (100% некроза опухоли), 3–4 — при II (от 91 до 99,9% некроза). В случае плохого лечебного патоморфоза (90% и ниже — III–IV степень) в схему лечения включали также ифосфамид в дозе 12 г/м2 (3 курса).
В группе применения БФ все пациенты получали БФ по схеме ежемесячных внутривенных инфузий в стандартной дозе. Использовали преимущественно памидроновую (10) и ибандроновую (8) кислоту. Отсутствие разницы в результатах применения памидроновой и ибандроновой кислоты дало возможность объединить эти препараты в одну группу.
Памидроновую кислоту применяли в дозе 60 мг у пациентов с массой тела до 60 кг; и 90 мг у пациентов с массой тела свыше 60 кг. Ибандроновую кислоту применяли в дозе 6 мг. Время между применением БФ и цисплатина или метотрексата в высоких дозах должно составлять как минимум 24 ч. БФ назначали 1 раз в месяц, всего 12 доз. Первую дозу пациент получал во время первого цикла химиотерапии. Памидроновую кислоту назначали в виде 2-часовой инфузии, ибандроновую — 15-минутной.
Хирургическое лечение
В исследовании большую часть пациентов подвергали сохраняющему конечность хирургическому удалению опухоли с установкой эндопротеза.
В нашем исследовании радикальное оперативное вмешательство выполнено у 47 пациентов. Вид хирургической операции зависел от локализации и распространенности основного процесса, наличия метастатического поражения, будущего роста пациента. Выполнено 2 ампутации, 4 резекции с замещением дефекта аутотрансплантатом и 35 резекций с последующим эндопротезированием имплантом на цементной основе (табл. 3).
Выполнять движения в оперированном суставе при эндопротезировании мы рекомендовали на 2-е сутки после операции. Полная осевая нагрузка на конечность допускалась через 3 нед. В динамическом наблюдении оценивали повторные операции, связанные с фиксацией интрамедулярных ножек, выраженностью болевого синдрома, а также после появления рентгенологических признаков асептической нестабильности импланта.
Таблица 3. Распределение пациентов в зависимости от проведенного хирургического лечения
| Вид хирургического вмешательства | Количество пациентов, n |
|---|---|
| Резекция кости с опухолью + эндопротезирование коленного сустава | 35 |
| Резекция кости с опухолью + эндопротезирование голеностопного сустава | 1 |
| Резекция кости с опухолью + эндопротезирование тазобедренного сустава | 1 |
| Резекция кости с опухолью + эндопротезирование плечевого сустава | 4 |
| Резекция кости с опухолью + замещением дефекта аутотрансплантатом | 4 |
| Ампутация | 2 |
| Всего | 47 |
Результаты и их обсуждение
Мы не оценивали выживаемость пациентов из-за короткой продолжительности наблюдения. Основным критерием оценки противоопухолевой активности БФ стало сравнение объема жизнеспособных опухолевых клеток по критериям Huvos.
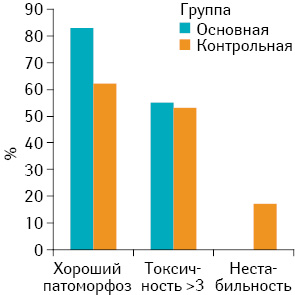
Эффект БФ также определяли по клиническим данным (боль), рентгенологической картине (восстановление кортикальной структуры кости, явления оссификации в зоне литической деструкции, стабилизация или заращение патологического перелома), а также в зависимости от проявлений токсичности по шкале ECOG (The Eastern Cooperative Oncology Group) в обеих группах. В группе пациентов, получающих БФ, выраженность болевого синдрома значительно уменьшалась в среднем через 24 ч после первого введения БФ, в контрольной группе этот эффект наступал позже (в среднем через 5 дней после начала терапии). Предварительные результаты представлены в табл. 4, а также на рис. 1.
Таблица 4. Распределение пациентов в зависимости от результатов лечения
| Основная (n=18) | Контрольная (n=29) | |||
|---|---|---|---|---|
| n | % | n | % | |
| Хороший патоморфоз | 15 | 83,3 | 18 | 62,1 |
| Токсичность по ECOG >3 | 10 | 55,6 | 11 | 38,0 |
| Нестабильность импланта | 0 | 0,0 | 5 | 17,3 |
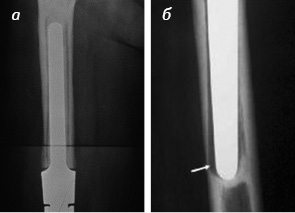
В контрольной группе болевой синдром был выражен у 7 пациентов, что связано с появлением рентгенопрозрачной линии как признака асептического расшатывания ножек эндопротеза (рис. 2), в основной группе таких проявлений не было. У пациентов, которые не получали БФ, выполнены 4 повторные ревизии с переустановкой ножек эндопротеза.
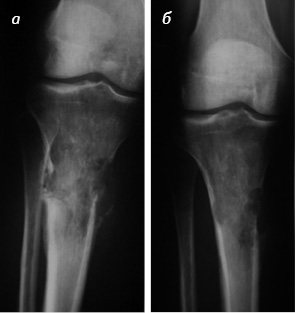
Также для оценки эффекта БФ использовали сравнение рентгенограмм пациентов в динамике в основной и контрольной группах. Оссификацию в зоне деструкции наблюдали у 100% пациентов в первой группе и у 40% — во второй (рис. 3).
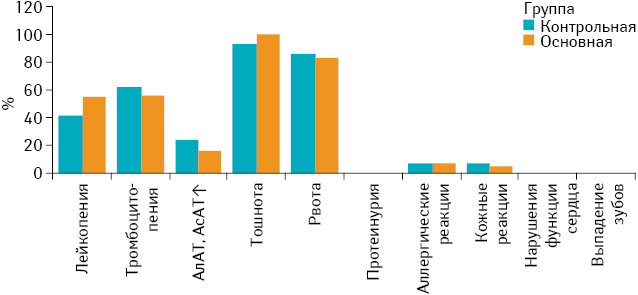
Одним из самых важных вопросов в нашем исследовании стало изучение безопасности применения БФ, так как при проведении полихимиотерапии применяли высокотоксичные препараты. Оценку токсичности проводили по шкале ECOG. Особое внимание уделяли проявлениям нефротоксичности, гепатотоксичности, гипокальциемии и возникновению остеонекроза нижней челюсти. Мы сравнили проявления и выраженность токсичности в контрольной и основной группе путем мониторинга основных лабораторных показателей (рис. 4). Имели значение следующие параметры: гипокальциемия, динамика гемоглобина, лейкоцитов, тромбоцитов, клиренс креатинина, динамика трансаминаз, билирубина. Оценивали также клинические проявления токсичности: тошноту, рвоту, диарею, стоматит, аллергические реакции (табл. 5).
Таблица 5. Сравнение токсичности проведенного лечения
| Критерии токсичности | Степень токсичности ≥3 | |||
|---|---|---|---|---|
| Контрольная группа, 29 | Основная группа, 18 | |||
| n | % | n | % | |
| Лейкопения | 12 | 41,4 | 10 | 55,6 |
| Нейтропения | 25 | 86,2 | 15 | 83,3 |
| Тромбоцитопения | 18 | 62,1 | 10 | 55,6 |
| Гипербилирубинемия | 5 | 17,3 | 2 | 11,1 |
| АсАТ, АлАТ ↑ | 7 | 24,1 | 3 | 16,7 |
| Диарея | 2 | 6,9 | 0 | 0,0 |
| Тошнота | 27 | 93,1 | 18 | 100,0 |
| Рвота | 25 | 86,2 | 15 | 83,3 |
| Стоматит | 16 | 55,2 | 12 | 66,7 |
| Протеинурия | 0 | 0,0 | 0 | 0,0 |
| Гематурия | 0 | 0,0 | 0 | 0,0 |
| Пульмонит | 0 | 0,0 | 0 | 0,0 |
| Гипертермия | 3 | 10,3 | 2 | 11,1 |
| Аллергические реакции | 2 | 6,9 | 1 | 5,6 |
| Кожные реакции | 2 | 6,9 | 1 | 5,6 |
| Инфекция | 5 | 17,2 | 3 | 16,7 |
| Нарушения функции сердца | 0 | 0,0 | 0 | 0,0 |
| Нейротоксичность | 0 | 0,0 | 0 | 0,0 |
| Боль | 20 | 68,9 | 10 | 55,6 |
| Выпадение зубов | 0 | 0,0 | 0 | 0,0 |
| Гипокальциемия | 0 | 0,0 | 4 | 22,2 |
Случаев остеонекроза челюсти не было ни во время проведения терапии, ни в течение периода наблюдения.
Сравнив результаты, мы убедились, что проявления токсичности химиотерапии не зависят от применения БФ. Наш опыт применения БФ и химиотерапии при лечении больных со злокачественными опухолями костей наводит на мысль, что врач-онколог в своей практике может безопасно и эффективно совмещать БФ с химиотерапией.
Большинство пациентов хорошо переносили БФ. Самыми частыми нежелательными явлениями были гриппоподобные симптомы (лихорадка, артралгии, миалгии и боли в костях), повышенная утомляемость, слабость, реакции со стороны желудочно-кишечной системы. Эти симптомы обычно слабо выражены, быстро купируются и не требуют медикаментозного лечения.
Терапия БФ может продлить срок службы протеза при помощи различных механизмов, включающих:
- улучшение плотности и прочности кости;
- стимулирование более надежного врастания в пористые поверхности безцементных протезов;
- стабилизацию соединения кость-протез или кость-цемент, замедляя остеокластическую резорбцию кости.
Собственный опыт применения БФ в комбинации с цитостатическими препаратами для лечения больных саркомами костей, а также анализ многочисленных исследований дают повод утверждать, что БФ можно безопасно применять в сочетании с химиотерапией, они являются новым эффективным терапевтическим методом воздействия на злокачественные опухоли костей. БФ дают возможность повысить стабильность и долговечность имплантов после хирургических резекций костей, что уменьшит число повторных оперативных вмешательств.
Несомненно, применение БФ в лечении сарком костей пребывает в стадии накопления опыта. Однако даже на этом этапе мы видим убедительные доказательства их действия, которое способствует повышению эффективности лечения пациентов онкологического профиля. Безопасность БФ доказана и подтверждена многоцентровыми исследованиями, что делает их доступными в клинической практике. Исследование показывает эффективность терапии в сравнении с предыдущим опытом и свидетельствует о том, что БФ могут повысить долговечность имплантов. Эти факты дают нам повод к дальнейшему их изучению и внедрению в лечение первичных злокачественных опухолей костей.
Список использованной литературы
1. Автандилов Г.Г. (1990) Медицинская морфометрия. Москва, 383 с.
2. Ashton J.A., Farese J.P., Milner R.J. et al. (2005) Investigation of the effect of pamidronate disodium on the in vitro viability of osteosarcoma cells from dogs. Am. J. Vet. Res. 66: 885–891.
3. Bond M., Bernstein M.L., Pappo A. et al. (2007) A phase II study of imatinib mesylate in children with refractory or relapsed solid tumors: A Children’s Oncology Group study. Pediatr. Blood Cancer, 29(1): 1–23.
4. Bloomfield D., Warr D., Whelan T. et al. (1999) Use of bisphosphonates in patients with bone metastases from breast cancer. Curr. Oncol., 6: 144–54
5. Benassi M.S., Chiechi A., Ponticelli F. et al. (2007) Growth inhibition and sensitization to cisplatin by zoledronic acid in osteosarcoma cells. Cancer Lett., 250: 194–205.
6. Вobyn J.D., Hacking S.A., Krygier J.J. (2005) Zoledronic acid causes enhancement of bоnе growth into porous implants. J. Воnе Joint Surg. Br., 87: 416–420.
7. Воbуn J.D., Hacking, Tanzer M. (2002) Marked enhancement of bonе growth into porous implants bу zoledronic acid. Trans. Orthop. Res. Soc., 27: 27.
8. Clark N.V., Holbrook I.B., McClure J. et al. (1991) Osteoclast inhibition by pamidronate in metastatic prostate cancer: a preliminary study. Br. J. Cancer, 63: 420–423.
9. Conte F.F., Mauriac L., Calabresi F. et al. (1996) Delay in progression of bone metastases treated with intravenous pamidronate: Results from a multicentre randomized controlled trial. J. Clin. Oncol., 14: 2552–59.
10. Conte P.F., Latreille J., Mauriac L. et al. (1996) Delay in progression of bone metastases in breast cancer patients treated with intravenous pamidronate: results from a multinational randomized controlled trial. The Aredia Multinational Cooperative Group. J. Clin. Oncol., 14: 2552–59.
11. Cheng Y.Y., Huang L., Lee K.M. (2004) Alendronate regulates cell invasion and MMP-2 secretion in human osteosarcoma cell lines. Pediatr. Blood Cancer, 42: 410–415.
12. Dass C.R., Choong P.F. (2007) Zoledronic acid inhibits osteosarcoma growth in an orthotopic model. Mol. Cancer Ther., 6: 3263–70.
13. Farese J.P., Ashton J., Milner R. et al. (2004) The effect of the bisphosphonate alendronate on viability of canine osteosarcoma cells in vitro. In Vitro Cell Dev. Biol. Anim., 40: 113–117.
14. Green J.R. (2003) Antitumor effects of bisphosphonates. Cancer, 97(3): 840–47.
15. Holmstrom T., Bohling T., Akerman M. et al. (1999) Diagnosis and tumor response in osteosarcoma and Ewing’s sarcoma, according to treatment protocols SSG II, SSG VIII, ISG/SSG I, SSG IV and SSG IX. Acta Orthop. Scand. Suppl., 285: 27–2.
16. Heymann D., Ory B., Blanchard F. et al. (2005) Enhanced tumor regression and tissue repair when zoledronic acid is combined with ifosfamide in rat osteosarcoma. Bone, 37: 74–86.
17. Horie N., Murata H., Kimura S. et al. (2007) Combined effects of a third-generation bisphosphonate, zoledronic acid with other anticancer agents against murine osteosarcoma. Br. J. Cancer, 96: 255–261.
18. Huvos A.G. (1991) Osteogenic sarcoma: pathologic assessment of preoperative (neoadjuvant) chemotherapy. In Bone Tumors: Diagnosis, Treatment, and Prognosis. Philadelphia: 122–128.
19. Kubo T., Piperdi S., Rosenblum J. et al. (2008) Platelet-derived growth factor receptor as a prognostic marker and a therapeutic target for imatinib mesylate therapy in osteosarcoma. Cancer, 112(10): 2119–29.
20. Kubista B., Trieb K., Sevelda F. et al. (2006) Anticancer effects of zoledronic acid against human osteosarcoma cells. J. Orthop. Res., 24: 1145–52.
21. Kubo T., Shimose S., Matsuo T. et al. (2006) Inhibitory effects of a new bisphosphonate, minodronate, on proliferation and invasion of a variety of malignant bone tumor cells. J. Orthop. Res., 24: 1138–1144.
22. Murayama T., Kawasoe Y., Yamashita Y. et al. (2008) Efficacy of the third-generation bisphosphonate risedronate alone and incombination with anticancer drugs against osteosarcoma cell lines. Anticancer Res. 28(4B): 2147–54.
23. Muraro M., Mereuta O.M., Carraro F. et al. (2007) Osteosarcoma cell line growth inhibition by zoledronatestimulated effector cells. Cell Immunol., 249: 63–72.
24. Murayama T., Kawasoe Y., Yamashita Y. et al. (2008) Efficacy of the third-generation bisphosphonate risedronate alone and in combination with anticancer drugs against osteosarcoma cell lines. Anticancer Res., 28: 2147–54.
25. Meraw S.J., С.М. Reeve, Wollan Р.С. (1999) Use of alendronate in peri-implant defect regeneration. J. Periodontol., 70: 15–8.
26. Meyers P.A., Healey J.H., Chou A.J. et al. (2010) Addition of pamidronate to chemotherapy for the treatment of osteosarcoma. DOI: 10.1002/cncr. 25744.
27. Peter B., Pioletti D.P., Laib S. et al. (2005) Calcium phosphate drug delivery system: influence of lосаl zoledronate release оf bоne imрlаnt osteointegration. Воnе, 36: 52–60.
28. Pataki A., Мuller К., Green J.R. et al. (1997) Effects of short-tеrm treatment with the bisphosphonates zоledronаte and раmidronаtе оn rat bone: а соmрагаtivе histomorphometric study оn the cancellous bоnе formed before, during, and after treatment. Anat. Rec., 249: 458–468.
29. Rosen G., Caparros B., Huvos A.G. et al. (1982) Preoperative chemotherapy for osteogenic sarcoma: selection of postoperative adjuvant chemotherapy based on the response of the primary tumor to preoperative chemotherapy. Cancer, 49: 1221–30.
Досвід застосування бісфосфонатів у лікуванні хворих на саркоми кісток
Резюме. Проведено аналіз ефективності застосування комбінації хіміотерапії та бісфосфонатів у комплексному лікуванні хворих на саркоми кісток. У роботі представлено результати власного дослідження впливу бісфосфонатів на лікувальний патоморфоз злоякісних пухлин кісток, стабільність та довговічність імплантів після хірургічних резекцій кісток, доведено безпечність антирезорбтивних препаратів у комбінації з цитостатиками. Проведений аналіз даних свідчить, що бісфосфонати сприяють підвищенню ефективності лікування хворих на саркоми кісток, не підвищуючи при цьому токсичність лікування.
Ключевые слова: бісфосфонати, первинні злоякісні пухлини кісток, стабільність ендопротезів.
Bisphosphonates in treatment of patients with bone sarcomas
Summary. The analysis of the effectiveness of the combination of chemotherapy and bisphosphonates in treatment of bone sarcomas was performed. This article presents the results of our research on the therapeutic effect of bisphosphonates. We have assessed the impact of bisphosphonates on pathomorphosis of malignant bone tumors, stability and durability of the reconstruction after surgical resection of bone. The safe use of antiresorptive treatment in combination with chemotherapy is proven. The data analysis suggests that bisphosphonates improve efficiency of treatment of bone sarcoma without increasing the toxicity of the treatment.
Key words: bisphosphonates, primary malignant bone tumors, stability of limb reconstruction.














Leave a comment