Молекулярно-біологічні особливості раку грудної залози
Шапочка Д.А., Залеток С.П. , Гнидюк Н.И.
Резюме. За допомогою імуногістохімічного методу проаналізовано рівень експресії субодиниць фактора транскрипції NF-κB (p50 та p65), рецепторів стероїдних гормонів (естрогенів — ER та прогестерону — PR), Her2/neu, Ki-67, p53, Bcl-2 та E-кадгерину в пухлинній тканині 132 хворих на рак грудної залози. Виявлено взаємозв’язок між ступенем диференціювання пухлини (Grade) та рівнем експресії рецепторів стероїдних гормонів (ER та PR), Bcl-2, Ki-67 та p65. Рівень проліферації в пухлині корелював з експресією ER, PR, Bcl-2, p53 та Her2/neu. Спостерігали також взаємозв’язки між рівнем експресії окремих маркерів. Так, високий рівень ядерної експресії NF-κB був асоційований з гіперекспресією Her2/neu та негативним статусом ER, PR і Bcl-2. Отримані дані можуть опосередковано свідчити про поганий прогноз та хіміорезистентність пухлин грудної залози з активованим NF-κB, однак це потребує подальших досліджень і ретроспективного аналізу великої вибірки пацієнтів.

ВСТУП
В Україні рак грудної залози (РГЗ) займає перше місце в структурі онкологічної захворюваності та смертності серед жінок. Суттєвий вплив на прогноз перебігу РГЗ має своєчасна діагностика та патогенетично адекватна терапія. Однак, незважаючи на постійне вдосконалення методів діагностики та лікування, загальна 5-річна виживаність хворих згідно з даними Національного канцер-реєстру України становить 56,2% [1].
Одним з найактуальніших завдань в онкології є вдосконалення терапевтичних схем та індивідуалізація лікування. За кілька останніх десятиріч розуміння біології пухлини значно поглиблено за рахунок молекулярно-біологічних досліджень, до клініко-морфологічних факторів прогнозу перебігу патологічного процесу додаються все нові молекулярні особливості пухлинних клітин.
Більшість молекулярно-біологічних маркерів, які сьогодні вивчають, залучені до патологічних процесів, в сукупності визначають здатність клітини до злоякісного росту [2]. Так, для вступу нормальної клітини в мітоз необхідний екзогенний ростовий сигнал. Разом з тим злоякісна трансформація клітин може супроводжуватися втратою залежності від даних сигналів. У пухлинах грудної залози часто має місце гіперекспресія Her2/neu, що є одним з рецепторів родини епідермального фактора росту. До неї входять чотирьох члени: EGFR/ErB1/HER1, c-erbB2/Her2/Neu, ErB3/HER3 та ErB4/HER4. Можна виділити 3 основні біологічні ефекти, які опосередковують епідермальні фактори росту: інгібування апоптозу, стимуляція проліферації та модифікація адгезивних молекул. Гіперекспресія Her2/neu може бути виявлена імуногістохімічним методом або методом імуноферментного аналізу в циркуляції. У пухлинах грудної залози вона часто асоційована з ампліфікацією гена, що можна виявити за допомогою Real-time PCR (polymerase chain reaction — полімеразної ланцюгової реакції) та флуоресцентної in situ (fluorescence in situ hybridization — FISH) або хромогенної in situ гібридизації (chromogenic in situ hybridization — CISH). Позитивний статус Her2/neu асоціюється з клініко-морфологічними параметрами пухлини, які мають поганий прогноз хвороби.
Іншим важливим процесом на шляху злоякісної трансформації клітини є блокування апоптозу. Найбільш розповсюдженою молекулярною подією, що призводить до такого наслідку, є інактивація білка p53. За різними даним, до 50% пухлин грудної залози мають мутації гена р53. Р53 є ключовим компонентом захисної системи, який блокує утворення атипових клітин. Білок р53 активується у відповідь на пошкодження ДНК, активацію онкогенів, гіпоксію, оксидативний стрес, вірусну інфекцію та інші аномальні процеси, які призводять до зупинки клітинного циклу і репарації пошкоджень або апоптозу. Мутації гена р53 забезпечують підвищення генетичної нестабільності, високий рівень проліферації та блокаду апоптозу. Є два основні методи визначення статусу р53 в пухлині: генетичний (наприклад сіквенс, або полімеразна ланцюгова реакція) та імуногістохімічний аналіз (який застосовували в даній роботі). За даними літератури, позитивна ядерна реакція на р53 в 90–100% випадків відповідає місенс-мутаціям гена р53, які й визначають мутантний імунофенотип [3]. Але негативна реакція з антитілами проти р53 лише у 80% випадків свідчить про відсутність мутації в гені, тоді як в 20% білок просто не експресується [3].
У пухлинах грудної залози, як і в новоутвореннях інших локалізацій, наявність мутантного р53 асоційована зі зниженням чутливості до терапії та агресивним перебігом хвороби.
Важливими регуляторами апоптозу є родина білків Bcl. Частина представників цієї родини є інгібіторами апоптозу (Bcl-2, Bcl-Xl), частина — індукторами (Bax, Bad). Найбільш важливе прогностичне значення для РГЗ серед представників даної родини має Bcl-2. Цей білок інгібує вивільнення з мітохондрій цитохрому с та фактора, який індукує апоптоз [4], а також ліпідні пероксидазні реакції на мітохондріальній мембрані [5], що призводить до гальмування апоптозу. Рівень Bcl-2 в клітині регулюється білком р53 за принципом оберненого зв’язку, отже, коекспресія цих факторів зустрічається дуже рідко [6]. Багатьма авторами підтверджено кореляцію гіперекспресії Bcl-2 з позитивним статусом рецепторів стероїдних гормонів; негативним р53 та Her2/neu; низьким рівнем проліферації [7, 8]. Крім цього, гіперекспресія Bcl-2 асоціюється з підвищенням загальної та безрецидивної виживаності пацієнток з РГЗ [7–9].
Важливим етапом злоякісної трансформації є набуття здатності до інвазії та метастазування. Це досягається пухлинною клітиною шляхом поступової реорганізації цитоскелету, делокалізації молекул клітинної адгезії, зменшенням сили міжклітинних зв’язків та деградації екстрацелюлярного матриксу. Вказані модифікації поступово змінюють епітеліальний фенотип клітини на мезенхімальний, що підвищує їх рухливість і здатність до інвазії та метастазування [10–13].
Найбільш вивченими та важливими для злоякісної трансформації є кадгерини. Центральною молекулою, яка зумовлює адгезію між епітеліальними клітинами, є Е-кадгерин. Зниження експресії Е-кадгерину, яке часто має місце в пухлинах грудної залози, з одного боку, спричиняє зменшення міжклітинної адгезії та сприяє інвазивному росту, а з іншого — призводить до вивільнення β-катеніну, транслокації його в ядро і стимуляції проліферації шляхом транскрипційної активності [14, 15]. На практиці — зниження експресії Е-кадгерину в протоковій аденокарциномі грудної залози корелює з низьким ступенем диференціювання, позитивним статусом лімфовузлів та Her2/neu і поганим прогнозом [16].
Сумарним показником блокади апоптозу та незалежності пухлини від ростових сигналів є рівень проліферації пухлинних клітин. На сьогодні найпоширенішим методом визначення проліферативної активності в пухлині є імуногістохімічне дослідження експресії Ki-67. Цей білок з’являється в клітині в пізній G1 фазі та залишається протягом подальших фаз клітинного циклу. Така властивість Ki-67 дозволяє визначати прихований проліферативний потенціал пухлини. Показано зниження загальної та безрецедивної виживаності хворих на РГЗ, рак яєчника, товстої кишки та інших локалізацій зі зростанням рівня проліферативної активності, що робить Ki-67 маркером поганого прогнозу.
Першими предиктивними молекулярно-біологічними маркерами для РГЗ стали рецептори естрогенів (estrogen receptors — ER) та прогестерону (progesterone receptors — PR). Вони являють собою протеїни, які специфічно зв’язують дані стероїдні гормони і після цього індукують транскрипцію генів, задіяних у процеси диференціювання, проліферації, адаптації та біосинтезу білка. Важливе прогностичне значення пов’язане, перш за все, з високою чутливістю ER- та PR-позитивних пухлин до гормональної терапії антиестрогеновими препаратами. Багатьма дослідженнями доведено, що зі зростанням рівня експресії ER та PR посилюється й ефект гормональної терапії. Так, наприклад ER+/PR−-пухлини чутливі до гормонотерапії в 55–60% випадків, а ER+/PR+-пухлини — у 80%.
Услід за рецепторами стероїдних гормонів у клінічну практику увійшов Her2/neu, позитивний статус якого у хворих на РГЗ корелює з високою чутливістю до таргетної терапії трастузумабом.
Перспективними потенційними мішенями для терапії можуть бути фактори транскрипції, адже, впливаючи на транскрипцію онкогенів та факторів апоптозу, вони відіграють важливу роль у формуванні хіміорезистентності. Одним із транскрипційних факторів, порушення функціонування якого часто має місце в злоякісних пухлинах, є NF-κB (nuclear factor kappa B).
Родина білків транскрипційного фактора NF-κB складається з поліпептидів c-rel, p50, p52, p65 (RelA), p68 (RelB), p100 та p105, які належать до так званої rel-родини білків, гомологічних онкогену v-rel. Найкраще з них досліджені р50 та р65, що формують класичний гетеродимер NF-κB. У більшості клітин NF-κB знаходиться в цитоплазмі в неактивному стані за рахунок зв’язування з ним інгібіторних білків класу I-κB. У ході активації NF-κB під дією різноманітних індукторів відбувається фосфорилювання I-κB, після чого він убіквітинізується і гідролізується протеїназним комплексом, а вільний NF-κB транслокується в ядро, де впливає на транскрипцію багатьох генів. Для багатьох пухлин характерна конститутивна активність NF-κB [17], яка, на думку M. Mayo та співавторів (1997) і D. Basseres та співавторів (2010), може залежати, наприклад, від наявності в клітинах онкогенних білків Ras, які активують фактор транскрипції NF-κB [18, 19].
Численні сучасні дані вказують на важливу роль NF-κB у підтриманні життєдіяльності пухлини. На сьогодні виявлено два важливі механізми впливу NF-κB на пухлинні процеси. Перший полягає в тому, що експресія багатьох онкогенів (наприклад c-myc), проапоптотичних білків (p53), онкогенних вірусів (SV-40, ретровіруси, аденовіруси) контролюється фактором NF-κB або активація NF-κB залежить від експресії певних білків, наприклад білків ras. Другим важливим моментом є вплив NF-κB на чутливість пухлини до хіміотерапії та імунні реакції організму [20]. Так, продемонстровано, що лише 20% хворих на РГЗ з активованим NF-κB відповідали на хіміотерапію, окрім цього в частині випадків рівень NF-κB у ядрах пухлинних клітин підвищувався після терапії, що, на думку C. Montagut та співавторів (2006), може бути причиною формування хіміорезистентності [21]. Ці результати можна пояснити тим, що хіміотерапія та імунні реакції часто направлені на індукцію апоптозу в пухлинних клітинах, але, у свою чергу, вони можуть активувати NF-κB і підвищувати експресію NF-κB-залежних антиапоптотичних генів, що й захищає клітину від загибелі [22, 23].
Окрім безпосереднього зв’язку між активацією NF-κB та хіміорезистентністю при РГЗ, вивчають взаємозв’язок експресії NF-κB з експресією інших маркерів. Існує багато протиріч у результатах таких досліджень, що пов’язано як з відсутністю стандартного методу визначення активації NF-κB, так і відмінностями в інтерпретації результатів, отриманих одним і тим самим методом. Однак більшість результатів свідчать, що NF-κB активується насамперед в ER-негативних та HER2-позитивних пухлинах [21, 24–26]. Такі пухлини грудної залози зазвичай мають низький ступінь диференціювання і високий проліферативний індекс та формують групу з найгіршим прогнозом і високою хіміорезистентністю. Усе вищезазначене вказує на те, що перспектива можливості безпосередньо регулювати активність NF-κB відкрила б нові патогенетично адекватні методи терапії пацієнтів зі злоякісними пухлинами [27].
ОБ’ЄКТ ТА МЕТОДИ ДОСЛІДЖЕННЯ
У дослідженні використано зразки пухлин 132 пацієнток, хворих на РГЗ. Усі вивчені пухлини за морфологічною будовою належали до інвазивних протокових карцином з різним ступенем диференціювання (G). Клінічні дані пацієнтів та характеристику пухлин наведено в табл. 1.
Рівень експресії маркерів визначали імуногістохімічним методом. Для дослідження брали зрізи фіксованої у формаліні, залитої в парафін тканини товщиною 4 мкм. Демаскування антигенів проводили за температури 98 °С протягом 30 хв. Для блокування ендогенної пероксидази зрізи 5 хв інкубували з 0,03% перекисом водню. Після промивання зрізи 30 хв інкубували з первинними антитілами: Estrogen Receptor α (Monoclonal Rabbit Anti-Human, RTU, clone SP1, «Dako»), Progesterone Receptor (Monoclonal Mouse Anti-Human, RTU, clone PgR 636, «Dako»), c-erbB2 (Polyclonal Rabbit Anti-Human, 1:1000, «Dako»), NF-κBp50 (NLS) (Polyclonal Rabbit Anti-Human, 1:200, sc114, «Santa Cruz Biotechnology»), p-NF-κBp65 (Ser 536) (Polyclonal Rabbit Anti-Human, 1:200 sc-33020, «Santa Cruz Biotechnology»), Ki-67 (Monoclonal Mouse Anti-Human, RTU, clone MIB-1, «Dako»), p53 (Polyclonal Rabbit Anti-Human, 1:100, RP 106, «Diagnostic BioSystems»), Bcl-2 (Monoclonal Mouse Anti-Human, RTU, clone 124, «Dako»), E-cadherin (Monoclonal Mouse Anti-Human, RTU, clone NCH-38, «Dako»). Після цього зрізи 20 хв інкубували з полімером HRP візуалізаційної системи FLEX («Dako»). Після чергового промивання на зрізи наносили на 3 хв DAB і контрастували ядра гематоксиліном Майера.
Таблиця 1. Клінічні дані пацієнтів та морфологічна характеристика пухлин
| Характеристика | Кількість пацієнтів | |
|---|---|---|
| n | % | |
| Загальна кількість пацієнтів | 132 | 100 |
| Вік, роки | ||
| Середній | 60 | |
| Діапазон | 28–81 | |
| Стадія | ||
| I | 17 | 13 |
| II | 87 | 66 |
| III | 28 | 21 |
| Наявність метастазів у лімфатичних вузлах | ||
| + | 82 | 62 |
| – | 50 | 38 |
| Ступінь диференціювання (Grade) | ||
| 1 | 17 | 13 |
| 2 | 84 | 64 |
| 3 | 31 | 23 |
Для інтерпретації імуногістохімічної реакції з антитілами проти ER, PR, p65 та p50 застосовували метод H-score. Рівень експресії визначали за формулою:
Н=3×% інтенсивне забарвлення+2× % помірне забарвлення+1×% слабке забарвлення
При значеннях Н>100 рівень експресії маркера вважали високим (3+), від 50 до 99 — середнім (2+) і при Н<50 – низьким (1+).
Визначення рівня експресії Her2/neu проводили за допомогою реакції з антитілами проти Her2/neu. Для інтерпретації застосовували такі критерії: 0 — відсутність забарвлення; 1+ — слабке неповне пофарбування мембрани пухлинних клітин; 2+ — середня інтенсивність пофарбування мембрани більше 10% пухлинних клітин; 3+ — інтенсивне пофарбування мембрани більше 10%. Пухлини з рівнем експресії 0 та 1+ вважали Her2/neu-негативними, а з 2+ та 3+ — позитивними.
Рівень проліферації оцінювали за допомогою реакції з антитілами проти Ki-67: 0 — відсутність ядерного забарвлення пухлинних клітин; 1 — 1–10% забарвлених ядер; 2 — 11–20%; 3 — 21–50%; 4 — >50%. У пухлинах з рівнем експресії Ki-67 «0» та «1» рівень проліферації вважали низьким; а з рівнем «2», «3» та «4» — високим.
Р53-статус пухлини визначали за рівнем його накопичення в ядрах пухлинних клітин. Негативний статус (0) — ядерне забарвлення відзначали в <10% пухлинних клітин; позитивний статус: 1 – 11-20%; 2 – 21-50%; 3 – 51-75%; 4 – >75%.
Експресію Bcl-2 та E-кадгерину оцінювали за допомогою реакції з відповідними антитілами. Рівень експресії вважали низьким (1) за наявності слабкого цитоплазматичного (для Bcl-2) та мембранного (для E-кадгерин) забарвлення більше 10% пухлинних клітин; помірним (2) — при забарвленні середньої інтенсивності більше 10%; високим (3) — при інтенсивному забарвленні більше 10% пухлинних клітин.
Дані щодо рівня експресії досліджуваних маркерів наведено в табл. 2.
Таблиця 2. Експресія молекулярних маркерів у пухлинах хворих на РГЗ
| Статус маркера | Кількість пацієнтів | ||
|---|---|---|---|
| n | % | ||
| ER | |||
| – | 36 | 27 | |
| + | 96 | 73 | |
| PR | |||
| – | 54 | 41 | |
| + | 78 | 59 | |
| Her2/neu | |||
| – | 92 | 70 | |
| + | 40 | 30 | |
| р65 | |||
| Низький (H<100) | |||
| Високий (H>100) | 23 | 17 | |
| р50 | |||
| Низький (H<100) | |||
| Високий (H>100) | 83 | 63 | |
| Ki-67 | |||
| Низький (<20%) | |||
| Високий (>20%) | 91 | 69 | |
| р53 | |||
| – | 80 | 61 | |
| + | 52 | 39 | |
| Bcl-2 | |||
| Низький | 83 | 63 | |
| Високий | 49 | 37 | |
| E-кадгерин | |||
| Низький | 54 | 41 | |
| Високий | 78 | 59 | |
Статистичний аналіз отриманих даних проводили за допомогою програми SPSS. Для виявлення кореляції визначали коефіцієнт кореляції Пірсона, а для перевірки його достовірності застосовували тести хі-квадрат (χ2).
РЕЗУЛЬТАТИ
У пухлинах хворих на РГЗ досліджено рівні експресії наступних молекулярно-біологічних маркерів: ER, PR, Her2/neu, субодиниць фактора транскрипції NF-κB (білків р50 і р65), Ki-67, p53, Bcl-2 та E-кадгерину (див. табл. 2). Виявлено, що у 47 (76%) пацієнток пухлини були естрогенчутливі (НER=10–300) і 15 (24%) – естрогеннечутливі (НERPR=10–300), а 20 (32%) — прогестероннечутливі (НPR<10). У пухлинах 25 (40%) пацієнток виявлено гіперекспресію Her2/neu (2+, 3+), тоді як у 37 (60%) пухлини мали негативний Her2/neu-статус (0, 1+). При дослідженні експресії субодиниць NF-κB (р50 та р65) високі рівні р50 та р65 в пухлинах виявлено у відповідно 39 (63%) та 7 (11%) пацієнток. Слід зазначити, що для всіх пухлин з високим рівнем експресії р65 характерним був високий рівень р50. Рівень проліферації (Кі-67) в 41 випадку (31%) був низьким, а в 91 (69%) —
високим. Рівень експресії Bcl-2 був низьким у 83 (63%) і високим у 49 (37%) пацієнток. У пухлинах 78 (59%) хворих виявлено високий рівень експресії Е-кадгерину, а в 54 (41%) експресія була знижена або втрачена.
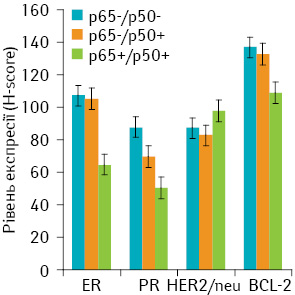
При вивченні взаємозв’язку між клініко-морфологічними характеристиками пухлин та експресією в них молекулярно-біологічних маркерів виявлено прямий кореляційний зв’язок між ступенем диференціювання пухлини (Grade) та наявністю метастазів у лімфатичні вузли (р=0,013), клінічною стадією захворювання (р=0,019), рівнем проліферації (Ki-67; p<0,01) і рівнем експресії p65-субодиниці NF-kB (p=0,022) (рис. 1). Також відзначали обернену кореляцію між ступенем диференціювання та рівнем експресії ER (p<0,01), PR (p<0,01) і Bcl-2 (p<0,01) (див. рис. 1).
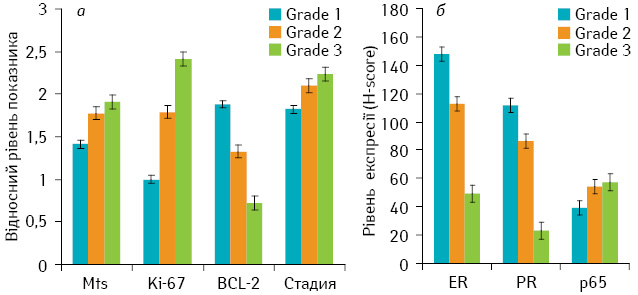
Суттєвої кореляції експресії досліджуваних маркерів з іншими клінічними характеристиками не виявлено.
Аналіз експресії молекулярних маркерів виявив взаємозв’язки між експресією багатьох з них. Так, встановлено існування прямої кореляції між експресією Her2/neu та рівнем проліферації (p=0,004), а також оберненої — між Her2/neu та експресією ER (р=0,003), PR (р=0,001) і Bcl-2 (р<0,001) (рис. 2).
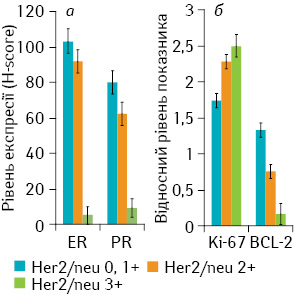
Окрім цього, рівень проліферації також обернено корелював з експресією рецепторів стероїдних гормонів (ER, PR; p<0,01) та Bcl-2 (p<0,01) і прямо — із накопиченням білка р53 (p<0,01) (рис. 3).
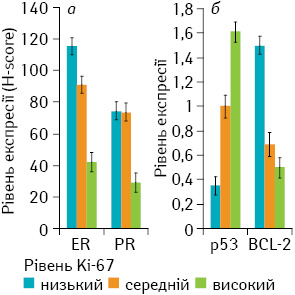
Виявлено існування прямого кореляційного зв’язку між рівнем експресії онкопротеїну Bcl-2 та експресією рецепторів стероїдних гормонів (ER, PR; p<0,01), Е-кадгерину (p<0,01), а також оберненого — між Bcl-2 та р65 (рис. 4).
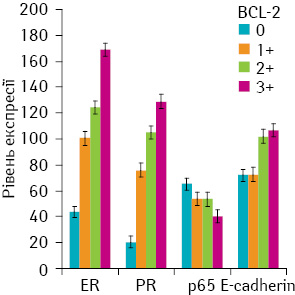
Для вивчення залежності експресії маркерів від профілю експресії NF-κB ми розділили пацієнток на 3 групи: І — з високим рівнем ядерної експресії p65 та p50; ІІ — з високим рівнем р50 та низьким р65; ІІІ — з низьким рівнем обох субодиниць NF-κB. У результаті показано, що підвищення рівня експресії субодиниць NF-κB корелює зі зниженням експресії ER (р=0,016), PR (р=0,056) і Bcl-2 (р=0,009) та підвищенням Her2/neu (р=0,011) (рис. 5).
ОБГОВОРЕННЯ
Отримані дані свідчать про розділення інвазивного протокового РГЗ за імунофенотипом на декілька груп. На основі цієї гетерогенності розроблено молекулярну класифікацію РГЗ [28]. Найбільшу групу формують пухлини з позитивним статусом рецепторів стероїдних гормонів, що відповідає люмінальним А та B підтипам. У нашому дослідженні такі пухлини мали зазвичай високий ступінь диференціювання (Grade); негативний статус Her2/neu та р53; низький рівень ядерної експресії субодиниць NF-κB та проліферації; високий рівень експресії Bcl-2 і E-кадгерину. Такий молекулярний профіль свідчить про збереження пухлинною клітиною адгезивних властивостей, здатності до апоптозу та чутливість до гормональної терапії, що асоціюється з менш агресивною поведінкою пухлини та узгоджується з даними літератури щодо сприятливого прогнозу перебігу захворювання у пацієнток з таким імунофенотипом [7–9, 16].
Іншу велику групу складають рецепторнегативні пухлини (ER-, PR-). Серед них одна частина є Her2/neu-ампліфікованими (Her2/neu-підтип), а інша — Her2/neu-негативними (базальний підтип), але вони часто мають спільні характеристики. Так, дані підтипи пухлин зазвичай низькодиференційовані, мають змістові мутації в гені р53, високий рівень проліферації, низький рівень експресії Bcl-2 та Е-кадгерину. Крім цього, виявлено, що такі пухлини часто характеризуються високим рівнем ядерної експресії обох субодиниць NF-κB, що призводить до його активації та впливу на транскрипцію генів-мішеней. Усі ці характеристики можуть пояснювати дані інших авторів щодо підвищеної злоякісності рецепторнегативних пухлин, їх резистентності до хіміотерапії та несприятливого прогнозу перебігу захворювання [7–9, 16].
Останню групу формують пухлини з позитивним статусом рецепторів стероїдних гормонів та Her2/neu, які за молекулярною класифікацією належать до гібридного підтипу. У нашому досліджені такі пухлини мали різний ступінь диференціювання, характеризувалися широкою варіабельністю рівня експресії всіх досліджуваних маркерів. У результаті ці пухлини можуть розцінюватися як помірно агресивні, що узгоджується з даними літератури щодо проміжного прогнозу перебігу захворювання у таких пацієнток [7–9, 16].
Таким чином, незважаючи на те що основою для вибору тактики лікування залишається визначення статусу рецепторів стероїдних гормонів та Her2/neu, доцільним є розширення спектра досліджуваних маркерів, оскільки вони дають додаткову інформацію про пухлину та сприяють індивідуалізації терапевтичних схем. Так, згідно з нашими результатами найвищий рівень NF-κB виявлено в рецепторнегативних (ER-, PR-) та Her2/neu-позитивних пухлинах, що пов’язано з поганим прогнозом. Ці дані можуть опосередковано свідчити про поганий прогноз та хіміорезистентність пухлин з активованим NF-κB, однак це твердження, на наш погляд, потребує подальших досліджень і ретроспективного аналізу великої вибірки пацієнтів.
ВИСНОВКИ
1. Виявлено, що ступінь диференціювання пухлини (Grade) перебував у прямому кореляційному зв’язку з рівнем експресії Кі-67 і р65, а в оберненому — з ER, PR та Bcl-2.
2. Рівень проліферації пухлини також характеризувався оберненим зв’язком з рівнем експресії ER, PR та Bcl-2 і прямим — зі статусом р53 та Her2/neu.
3. Між рівнем експресії Bcl-2 виявлено пряму кореляцію з експресією ER, PR та E-кадгерину і обернену — з р65-субодиницею NF-κB.
4. Встановлено, що найвищий рівень ядерної експресії субодиниць NF-κB (р50 та р65) має місце в пухлинах з низьким рівнем експресії Bcl-2, негативним статусом ER і PR та позитивним Her2/neu.
Список використаної літератури
1. Федоренко З.П., Гайсенко А.В., Гулак Л.О., та ін. (2010) Рак в Україні, 2008–2009. Бюл. Нац. канцер-реєстру, 11: 5.
2. Hanahan D., Weinberg R.A. (2000) The hallmarks of cancer. Cell, 100: 57–70.
3. Gazzeri S., Brambilla E., Caron de Fromentel C. et al. (1994) p53 genetic abnormalities and myc activation in human lung carcinoma. Int. J. Cancer, 58: 24–32.
4. Kluck R.M., Bossy-Wetzel E., Green D.R. et al. (1997) The release of cytochrome c from mitochondria: a primary site for Bcl-2 regulation of apoptosis. Science, 275: 1132–36.
5. HockenberyD., Nunez G., Milliman C. et al. (1990) Bcl-2 is an inner mitochondrial membrane protein that blocks programmed cell death. Nature: 1207–13.
6. Lee K.H., Im S.A., Oh D.Y. et al. (2007) Prognostic significance of bcl-2 expression in stage III breast cancer patients who had received doxorubicin and cyclophosphamide followed by paclitaxel as adjuvant chemotherapy. BMC Cancer, 7: 63.
7. Bozetty C., Nizzoli R., Naldi N. et al. (1999) Bcl-2 expression on fine needle aspirates from primary breast carcinoma: correlation with other biologic markers. Cancer, 87(4): 224–230.
8. Dema A., Dragan S., Lazar E. et al. (2008) Bcl-2 expression in breast carcinomas in postmenopausal women. TMJ, 58(3–4): 155–61.
9. Bererdo M.D., Elledge R.M., de Moor C. et al. (1998) Bcl-2 and apoptosis in lymph node positive breast carcinoma. Cancer, 82(7): 1296–1302.
10. Friedl P., Wolf K. (2010) Plasticity of cell migration: a multiscale tuning model. J. Exp. Med, 18: 11–9.
11. Поліщук Л.З., Рябцева О.Д., Лук’янова Н.Ю., Чехун В.Ф. (2011) Молекули адгезії та їх значення при розвитку злоякісних пухлин. Онкология, 13(1): 4–11.
12. Hugo H., Ackland M.L., Blick T. et al. (2007) Epithelial-mesenchymal and mesenchymal-epithelial transitions in carcinoma progression. J. Cell. Physiol., 213: 374–83.
13. Gos M., Miłoszewska J., Przybyszewska M. (2009) Epithelial-mesenchymal transition in cancer progression. Postepy Biochem., 55: 121–8.
14. Ino Y., Gotoh M., Sakamoto M. et al. (2002) Dysadherin, a cancer-associated cell membrane glycoprotein, down-regulates E-cadherin and promotes metastasis. Proc. Natl. Acad. Sci. USA, 99: 365–70.
15. Wadlow P.C. (2009) Systems level modeling of cancer-fibroblast interaction. PLoS One, 4: e6888.
16. El Moneim H.M.A., Zaghlou N.M. (2011) Expression of E-cadherin, N-cadherin and snail and their correlation with clinicopathological variants: an immunohistochemical study of 132 invasive ductal breast carcinomas in Egypt. Clinics, 66(10): 1765–71.
17. Meteoglu I.,Erdogdu I.H., Meydan N. et al. (2008) NF-kappa B expression correlates with apoptosis and angiogenesis in clear cell renal cell carcinoma tissues. J. Exp. Clin. Cancer Res., 27: 53.
18. Mayo M.W., Wang C.Y., Cogswell P.C. et al. (1997) Requirement of NF-kappa B activation to suppress p53-independent apoptosis induced by oncogenic. Ras. Science, 278: 1812–15.
19. Basseres D.S., Ebbs A., Levantini E. et al. (2010) Requirement of the NF-κB Subunit p65/RelA for K-Ras-Induced Lung Tumorigenesis. Cancer Res., 70(9): 3537–46.
20. Wang CY., Mayo MW., Baldwin AS. (1996) Tnf-α and cancer therapy-induced apoptosis: potentiation by inhibition of NF-kappa B. Science, 274: 784–787.
21. Montagut C., Tusquets I., Ferrer B. et al. (2006) Activation of nuclear factor-kB is linked to resistance to neoadjuvant chemotherapy in breast cancer patients. Endocrine-Related Cancer, 13(2): 606–616.
22. Beg A.A., Baltimore D. (1996) An essential role for NF-kappa B in preventing TNF-alpha-induced cell death. Science, 274: 782–784.
23. Van Antwerp D.J., Martin S.J., Kafri T. et al. (1996) Suppression of TNF-alpha-induced apoptosis by NF-κB. Science, 274: 787–789.
24. Zhou B.P., Hu M.C., Miller S.A. et al. (2000) HER-2/neu blocks tumor necrosis factor-induced apoptosis via the Akt/NF-κB pathway. J. Biol. Chem., 275(11): 8027–31.
25. Biswas D.K., Shi Q., Baily S. (2004) NF-κB activation in human breast cancer specimens and its role in cell proliferation and apoptosis. PNAS, 101(27): 10137–42.
26. Герштейн Е.С., Щербаков А.М., Платова А.М. (2010) Экспрессия и ДНК-связывающая активность транскрипционного фактора NF-κB в опухолях больных раком молочной железы. Бюл. экспериментальной биологии и медицины, 7: 80–84.
27. Baldwin A.S. (2001) Control of oncogenesis and cancer therapy resistance by the transcription factor NF-κB. J. Clin. Invest., 107(3): 241–246.
28. Dabbs DJ. (2010) Diagnostic immunohistochemistry: theranostic and genomic applications, 3rd ed. Philadelphia: Saunders (Elsevier Science), 941 p.
Молекулярно-биологические особенности рака грудной железы
2Ивано-Франковский областной онкологический диспансер
Резюме. При помощи иммуногистохимического метода проанализирован уровень экспрессии субъединиц фактора транскрипции NF-κB (p50 и p65), рецепторов стероидных гормонов (ER и PR), Her2/neu, Ki-67, p53, Bcl-2 и E-кадгерина в опухолевой ткани 132 пациенток с раком грудной железы. Выявлена взаимосвязь между степенью дифференциации опухоли (Grade) и уровнем экспрессии рецепторов стероидных гормонов (ER и PR), Bcl-2, Ki-67 и p65. Уровень пролиферации в опухоли коррелировал с экспрессией ER, PR, Bcl-2, p53 и Her2/neu. Отмечали также взаимосвязь между уровнем экспрессии отдельных маркеров. Так, высокий уровень ядерной экспрессии NF-κB ассоциировался с гиперэкспрессией Her2/neu и негативным статусом ER, PR и Bcl-2. Полученные данные могут опосредованно свидетельствовать о плохом прогнозе и химиорезистентности опухолей грудной железы с активированным NF-κB, однако это требует дальнейших исследований и ретроспективного анализа большой выборки пациентов.
Ключевые слова: рак грудной железы, рецепторы стероидных гормонов, Her2/neu, NF-κB, Ki-67, p53, Bcl-2, E-кадгерин.
Molecular and biological characteristics of breast cancer
2Ivano-Frankivsk Regional Oncology Dispensary
Summary. The expression of transcription factor NF-κB (p50 and p65), ER, PR, Her2/neu, Ki-67, p53, Bcl-2 and E-cadherin in tumor tissue of 132 patients with breast cancer was investigated by immunohistochemistry. As a result of researches the correlation between Grade and expression of ER, PR, Bcl-2, Ki-67 and p65-subunit of NF-κB was defined. The level of proliferation was correlated with ER, PR, Bcl-2, p53 and Her2/neu expression. Also the correlation between some of investigated markers was found. Thus, high level of NF-κB nuclear expression was associated with Her2/neu hyperexpression and negative status of ER, PR and Bcl-2. These data may indicate poor prognosis and resistance to chemotherapy in breast cancer patients with activated NF-κB, but it requires further research and retrospective analysis of large number of patients.
Key words: breast cancer, receptors of steroid hormones, Her2/neu, NF-κB, Ki-67, p53, Bcl-2, E-cadherin.














Leave a comment