Скринінг раку в Україні: коли теорія відповідає реальності. Соціально-економічне обґрунтування популяційного скринінгу раку шийки матки
Михайлович Ю.И., Журбенко А.В.
Резюме. У світі рак шийки матки залишається однією з найбільш поширених форм злоякісних новоутворень, займаючи 2-ге місце за частотою і 3-тє за смертністю серед усіх онкологічних захворювань у жінок. Найвища захворюваність характерна саме для країн, що розвиваються. На сьогодні скринінг в онкології є практично єдиним профілактичним методом, застосування якого сприяє зниженню рівня смертності від окремих видів злоякісних новоутворень. В Україні, державі з обмеженими фінансовими ресурсами, назріла потреба в соціально-економічному обґрунтуванні доцільності проведення популяційного скринінгу раку шийки матки з визначенням кількісної оцінки «затрати–ефективність» та якісної — «шкода–користь», а також в окресленні організаційних заходів для його впровадження. У роботі представлено аналіз фінансових параметрів з метою визначення сукупності показників, що характеризують економічний бік та ефективність процесу проведення популяційного скринінгу раку шийки матки.

Досвід розвинених в соціально-економічному відношенні країн (США, Західної Європи) показує, що систематична робота в напрямі первинної профілактики, дійсно, дозволяє реально знизити рівень онкологічної захворюваності та смертності. Найважливішу роль у цьому процесі відіграє цілеспрямована й наполеглива протиракова боротьба, одним з різновидів якої є первинна та вторинна профілактика. У кожній країні вибір пріоритетів медичних заходів має здійснюватися з урахуванням особливостей соціально-економічної, політичної, екологічної, онкоепідеміологічної та інших ситуацій. При цьому необхідно враховувати не лише потенційну ефективність профілактичних заходів, але й наявність умов, що дозволяють їх реалізувати.
У резолюції Всесвітньої організації охорони здоров’я (ВООЗ) щодо профілактики та контролю за онкологічними захворюваннями (WHO Global Action Plan Against Cancer), прийнятої у травні 2005 р., та в додатку до цієї резолюції «Національні програми боротьби проти раку: рекомендації щодо цілей, орієнтованих на кінцевий результат» представлено комплексну стратегію боротьби з онкологічними захворюваннями, яка складається з чотирьох основних компонентів: профілактика і діагностика, скринінг та лікування; догляд та надання паліативної допомоги; організаційні заходи [1, 2].
У сучасній Україні неможливо правильно вибрати пріоритетні напрями первинної профілактики, незважаючи на три найважливіші чинники онкологічного ризику, які впливають на захворюваність населення нашої країни: бідність, сильний хронічний стрес, а також практичну відсутність інформованості населення про причини виникнення, ранні ознаки та заходи профілактики раку. Враховуючи все вищесказане, а також досвід реальної роботи в галузі протиракової боротьби в нашій країні, можна виділити пріоритетні напрями первинної профілактики раку на сучасному етапі:
- створення нормативно-правової і методичної основи первинної профілактики раку;
- протиракова освітня робота серед населення;
- профілактика раку в групах підвищеного ризику;
- профілактика професійного раку;
- державні та регіональні профілактичні програми.
На перший погляд, вони істотно відрізняються від визнаних у світі пріоритетних напрямів. Однак ми повинні застосувати таку тактику, яка відповідає нинішній соціально-економічній ситуації й можливостям нашої країни. Стратегічною метою залишається єдине — зниження рівня онкологічної захворюваності та смертності населення.
У нашій державі основні показники ранньої діагностики та якості лікування раку в 2–2,5 раза нижчі, ніж у розвинених країнах. Зокрема, упродовж першого року після встановлення діагнозу в нас помирають удвічі більше пацієнтів, ніж у країнах Західної Європи [3].
На підставі аналізу основних тенденцій у лікуванні хворих онкологічного профілю стає очевидним той факт, що в ряді країн Західної Європи та Північної Америки системам охорони здоров’я вдалося досягти спочатку стабілізації, а потім і зниження смертності від найбільш поширених візуальних злоякісних пухлин. Це пов’язано, перш за все, з повномасштабним упровадженням національних програм скринінгу.
В Україні, з соціально-економічного погляду, організованому скринінгу з-поміж інших поширених злоякісних новоутворень (ЗН), рекомендованих ВООЗ, підлягає рак шийки матки (РШМ), оскільки це онкологічне захворювання спричинює негативний вплив на трудовий та демографічний потенціал нашої держави.
Проблема профілактики та ранньої діагностики РШМ на сьогодні є надзвичайно важливою та актуальною, оскільки рак вражає жінок як репродуктивного, так і працездатного віку. У світі РШМ залишається однією з найбільш поширених форм ЗН, займаючи 2-ге місце за частотою і 3-тє за смертністю серед усіх онкологічних захворювань у жінок. За результатами аналізу даних у 184 країнах світу за проектом GLOBOCAN-2008, проведеного Міжнародним агентством з дослідження раку (International Agency for Research on Cancer — IACR) відділу ВООЗ, найвищий рівень захворюваності на РШМ в Європі у 2008 р. зафіксовано в Румунії, захворюваність становила 34,9 на 100 тис. жіночого населення (0/0000), смертність від РШМ — 14,20/0000. Україна серед країн Європи перебуває на 11-му місці з показниками 19,2 і 7,80/0000, останнє місце займає Швейцарія — 4,2 і 1,60/0000 відповідно [4–7].
За інформаційними даними Європейської обсерваторії з дослідження раку (European Cancer Observatory), одержаними в ході реалізації програми EUCAN-2012 (European Concept for Accessibility Network), за поширеністю серед ЗН жіночого населення у країнах Європи РШМ займає 5-ту позицію. Захворюваність становить 13,40/0000, смертність — 4,90/0000, а питома вага РШМ серед інших ЗН репродуктивних органів у жінок — 3,6%, що залишає зазначену нозологічну форму на 3-му ранговому місці [8, 9].
Завдяки широкому розповсюдженню програм організованого скринінгу РШМ та його лікуванню смертність від РШМ значно зменшилася за останні 30 років. Протягом цього періоду рівень летальності істотно знизився у жінок віком 20–60 років (до 31%), 60–65 років (до 48%), а у осіб у віці понад 65 років він знижується значно повільніше (до 23%). Незважаючи на ці позитивні зрушення, сьогодні в Єврорегіоні 1 із 25 тис. жінок помирає від РШМ, за даними ВООЗ [10–12].
Прогноз для РШМ доволі сприятливий. Відносне 5-річне виживання на ранніх стадіях становить близько 90%. Кумулятивне 5-річне виживання у Європі — 67% [13].
В Україні, за даними Національного канцер-реєстру України, на основі стандартизованих показників (світовий стандарт), захворюваність на РШМ жіночого населення протягом 1998–2010 рр. зростала і досягла рівня 2010 р. 150/0000, смертність від РШМ за аналогічний період мала тенденцію до зниження і становила 5,60/0000. Найвищу питому вагу серед ЗН у 2011 р. мали хворі на РШМ в репродуктивному віці — 47,0%, працездатному — 60,8%. При аналізі ураження шийки матки за стадіями встановлено, що за період 2000–2010 рр. більш ніж 70% виявлених в Україні ЗН мали ранні стадії захворювання (І стадія — 35,9%, ІІ стадія — 40,3%), при цьому знижувався показник занедбаності (–25%), що має позитивний прогностичний характер. Аналіз показника виживання за стадією захворювання у хворих на РШМ, зареєстрованих за період 2003–2005 рр., дав можливість встановити наступне. Виживання при І стадії становило 86,1%; ІІ — 50,7%; ІІІ — 29,8%; ІV — 7,8%. Кумулятивне 5-річне виживання — 56,9%. Виявлено велику розбіжність даного показника у хворих з різними стадіями. Так, виживання при ІІ стадії РШМ є в 1,5 раза нижчим, ніж у групі хворих з І стадією, а виживання при ІІІ стадії — в 1,7 раза нижче, ніж при ІІ [3, 14].
За міжнародними даними, саме систематичний скринінг дозволяє запобігти до 80% випадків інвазивного РШМ. Аналіз ефективності проведених програм скринінгу РШМ за довготривалий період у країнах Західної Європи та Північної Америки засвідчив, що вдалося досягти високо рівня зниження смертності в Ісландії — на 80%, у Фінляндії — 50%, Швеції — 34% за 20 років проведення популяційного скринінгу, у Канаді (провінція Британська Колумбія) — на 75% за 30 років [15].
Ефективність проведених програм скринінгу ЗН у країнах Західної Європи та Північної Америки характеризує також показник виживання, який становить при дисплазії 100%, карциномі in situ — 99,3%, мікроінвазивному раку — 96,8%; при РШМ І, ІІ, ІІІ, ІV стадії — 78,1; 57; 31; 7,8% відповідно. На теперішній час ці програми проводяться в 11 країнах світу на 5 континентах, її виконують 38 інститутів. У Західній Європі систематичний скринінг виконують тільки в 9 країнах: Данії, Ісландії, Нідерландах, Норвегії, Словенії, Великобританії, Фінляндії, Швеції та частково Італії [16].
У міжнародній медичній спільноті існує 2 види цитологічного скринінгу РШМ: організований (систематичний), направлений на всю популяція жіночого населення, яка підлягає скринінгу, з визначенням його періодичності, та неорганізований (спорадичний), або рутинний — обстеженню підлягають лише ті жінки, які звернулися до лікувально-профілактичної установи з будь-якого приводу. Звичайно, найбільш ефективним є організований скринінг, саме через можливість охопити цитологічним дослідженням більшу кількість жіночого населення [17].
Ґрунтуючись на рекомендаціях ВООЗ та практичних настановах Міжнародного протиракового союзу (Union for International Cancer Control — UICC), з медико-біологічного погляду, проведенню популяційного скринінгу, що відповідає реаліям і можливостям нашої держави, підлягає РШМ. Це захворювання широко розповсюджене в Україні та є важливою проблемою охорони здоров’я, має надійно розпізнавану преклінічну фазу, тривалий період розвитку, можливості для подальшого удосконалення верифікації діагнозу та методів ефективного лікування, і, нарешті, існує надійний скринінг-тест — кольпоскопія з цитологічним дослідженням мазків, взятих із шийки матки і шийкового каналу [7, 18, 19].
За персоніфікованими даними Національного канцер-реєстру України, із застосуванням методів дескриптивної епідеміології, медичної та математичної статистики встановлено, що віковий пік при карциномі in situ шийки матки припадає на жінок віком 30–34 років (9,30/0000), а захворюваності на РШМ — 45–49 років (37,90/0000) (рисунок) [3].
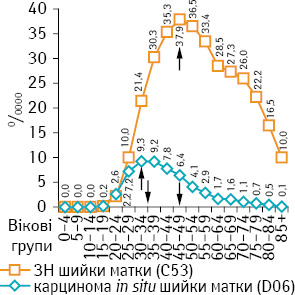
Ці дані є свідченням того, що розв’язання проблеми РШМ набуває державного характеру, оскільки рак вражає жінок репродуктивного і працездатного віку. Тому запровадження скринінгової програми РШМ в Україні є вкрай необхідним. Це повинно забезпечити зниження смертності від РШМ, знизити інвалідизацію, підвищити виживання та якість життя жінок, хворих на рак репродуктивної системи, і в майбутньому знизити захворюваність.
Необхідно зазначити, що на ефективність скринінгу РШМ з позицій доказової медицини впливає низка факторів:
- широта охоплення скринінгом жіночого населення;
- періодичність проведення скринінгу;
- чутливість тесту;
- якість забору матеріалу для дослідження;
- адекватне подальше обстеження та лікування хворих з виявленою патологією.
Проміжними ознаками ефективності програми зазвичай є підвищення частоти діагностованого передраку та раку в ранніх стадіях, що дозволяє забезпечити адекватне комплексне лікування хворих зазначеної нозології ЗН. Кінцевою метою скринінгу має бути зниження смертності на популяційному рівні.
Впровадження скринінгової програми складається з наступних кроків:
- формування бази даних;
- запрошення на обстеження;
- процес обстеження;
- лікування при виявленій патології;
- контроль за групою ризику;
- зворотній зв’язок з пацієнтами.
Організаційна методологія популяційного скринінгу РШМ передбачає вивчення чисельності населення в регіоні, його повікову характеристику, проведення заходів щодо поінформованості про рак, передракові захворювання та фактори ризику. Без налагодження такої роботи неможливо досягти потрібної ефективності скринінгу. Умовою належної організації скринінгу є одночасна участь у роботі різних ланок медичної служби (первинної, вторинної — спеціалізованої, третинної — високоспеціалізованої), ретельна підготовка фахівців, які проводять скринінг, тісна співпраця лікарів первинної ланки загальної лікувальної мережі та лікарів спеціалізованих лікувальних закладів.
Скринінгова програма має включати наступні етапи:
- комп’ютерний (формування бази даних усього жіночого населення, яке проживає в регіоні, районі, селі, її повікова та постатева характеристика; аналіз бази даних та відбір пацієнтів за віком та статтю, які підлягають скринінгу, визначення наявності чи відсутності факторів ризику, дата і результат останнього обстеження);
- клінічний (запрошення на обстеження, огляд онколога, взяття матеріалу для дослідження та направлення його до лабораторії);
- лабораторний (за результатами дослідження — встановлення наявності або відсутності патології, зазначення дати наступного запрошення на обстеження при виявлені патології та необхідності в дообстеженні);
- дообстеження (призначають додаткові методи обстеження для спростування або підтвердження виявленої патології, у разі підтвердження — пацієнта направляють на лікування);
- лікування (лікування проводять у загальнолікувальному закладі неонкологічного профілю або спеціалізованій онкологічній установі залежно від виявленої патології);
- облік та диспансерне спостереження (обов’язковий постійний моніторинг бази даних, її поновлення з урахуванням вікової категорії населення та результатів скринінгу; диспансерний нагляд за хворими, запрошення на повторне обстеження), включаючи фільтрацію, сортування, групування та архівацію даних за роками — організація збереження даних у зручній та легкодоступній формі;
- догляд та надання паліативної допомоги.
Проблему максимально повного охоплення населення державною програмою скринінгу необхідно здійснювати за допомогою широкомасштабної роз’яснювальної роботи, видання популярних друкованих матеріалів (брошур, пам’яток, листівок), через залучення засобів масової інформації та оприлюднення доповідей експертів, які можуть надавати інформацію неспеціалізованою мовою.
Важливим аспектом ефективності скринінгу є не тільки охоплення обстеженням визначеної категорії населення, а й ретельний облік пацієнтів з виявленими факторами ризику та подальша чітка організаційна робота з ними. Адже через безсимптомний перебіг передпухлинних захворювань або РШМ на ранніх стадіях більшість хворих не вбачають потреби в подальшому спостереженні, тому зв’язок з ними, як правило, втрачається. Отже, потрібна копітка роз’яснювальна робота, особливо серед осіб з факторами ризику, щодо необхідності диспансерного спостереження задля того, щоб зусилля, спрямовані на впровадження скринінгових програм, не виявилися марними, а державні кошти, виділені на їх реалізацію, не були б витрачені даремно.
Дослідження при скринінгу оцінюють за рівнем відтворюваності результатів і точності виявлення хвороби. Точність діагностування РШМ залежить від двох основних характеристик: чутливості та специфічності.
Відтворюваність — це вірогідність отримання однакових результатів дослідження при проведенні в інших умовах.
Чутливість — здатність дослідження точно виявляти осіб з патологією, у даному випадку з передраковими захворюваннями і РШМ. Чим вища чутливість, тим менше жінок з передраковими захворюваннями і РШМ будуть помилково визнані здоровими (хибнонегативний результат).
Специфічність — здатність дослідження точно виявляти здорових осіб. Чим вища специфічність, тим менше жінок з незміненою шийкою матки будуть помилково визнаними такими, що мають передракові захворювання і РШМ (хибнопозитивний результат) [18].
На сьогодні відомо понад 100 видів вірусу папіломи людини, але тільки 2 онкогенні типи високого ризику — HPV-16 і HPV-18 — спричинюють у 70% випадків рак. Преклінічна фаза триває близько 12–16 років, а весь період цервікального канцерогенезу до розвитку інвазивного РШМ — більше 20 років. Тобто, існує достатньо часу для проведення профілактичних заходів [16].
Аналіз чутливості математичної моделі показав, що вирішальним чинником, який впливає на витрати та ефективність скринінгу, є достовірність (чутливість і специфічність) діагностичних тестів. ПАП-тест — цитологічне дослідження препаратів, забарвлених за методом Папаніколау, — основний скринінговий метод виявлення передракових захворювань і РШМ. Він входить у систему скринінгу РШМ в усіх розвинених країнах світу. При визначенні чутливості за ПАП-тестом <80% і специфічності <86% впровадження скринінгу неефективне з клінічного та економічного погляду. Низька достовірність діагностичних тестів, які застосовують для скринінгу, призводить до великих витрат при вкрай низькому клінічному ефекті. Із 84 схем скринінгу згідно з міжнародними критеріями економічно ефективними є 12, з яких 7 дозволяють зберегти максимальну (2,45 року) тривалість життя при мінімальних витратах. Найменші витрати й максимальну кількість збережених років життя встановлено при використанні програм «Папаніколау — кольпоскопія» і «Папаніколау — вірус папіломи людини» за умови, що не менше 80% жінок буде охоплено скринінгом, при чутливості цитології ≥80% та специфічності ≥86% [20].
Необхідно зазначити, що на даний час для діагностики РШМ в системі охорони здоров’я України застосовують рутинну цитологію на атипові клітини (мазок на склі). Недоліками рутинної цитології є:
- відсутність стандартизованого забору матеріалу — неадекватно взятий матеріал з шийки матки призводить до хибнонегативних результатів (мала кількість клітин, надлишок клітин, клітини, що перекриваються, механічне ушкодження клітин, неправильна фіксація, присутність клітин крові);
- проблема хибнопозитивних цитологічних висновків (коли діагностують дисплазію там, де її немає) залежить від кваліфікації лікаря-лаборанта.
Більш ефективним та економічно вигідним нині було б застосування ПАП-тесту на основі новітньої технології — рідинної тонкошарової цитології. Вона усуває проблеми рутинного мазка, зберігає увесь зразок, отриманий з шийки матки, дозволяє виділити тонкий репрезентативний багатошаровий препарат; волога фіксація посилює чіткість клітинних структур і виключає появу артефактів при висушуванні на повітрі, дає можливість готувати додаткові препарати, які можуть бути використані для проведення допоміжних досліджень, таких як скринінг вірусу папіломи людини методом полімеразної ланцюгової реакції, імуногістоцитохімічне дослідження онкомаркера р16–18 [20–24].
Періодичність проведення скринінгу сьогодні є питанням дискусійним. У деяких країнах світу використовують різні міжскринінгові інтервали. Так, наприклад, у Нідерландах цитологічний скринінг проводять з 6-річним інтервалом, Фінляндії — 5-річним, Швеції — 4-річним, Данії — 3-річним, Ісландії та Китаї — кожні 2–3 роки. За даними ВООЗ, ідеальним вважається скринінг жінок віком 25–65 років: спочатку 2 роки поспіль з метою виключення хибнонегативного результату, оскільки чутливість цитологічного скринінгу становить від 60 до 83%, а в подальшому, за умови негативного результату тесту, — 1 раз на 3 роки [25].
Завдяки тривалому періоду розвитку інвазивного РШМ ефективність скринінгу більшою мірою залежить від широти охоплення жіночого населення цитологічним дослідженням, ніж від частоти його проведення. За результатами міжнародних досліджень, ефективність скринінгу майже однакова при інтервалах між дослідженнями 1 та 2 роки, а при порівнянні результатів скринінгу, який проводився щорічно та 1 раз на 3 роки в тій самій популяції жінок, виявлено різницю лише у 2%, хоч економічні витрати були втричі більшими [6, 11].
Враховуючи віковий пік карциноми in situ і РШМ (див. рисунок), середню тривалість життя жіночого населення в Україні (73 роки) та світовий досвід доказової медицини, скринінг РШМ в нашій державі доцільно проводити у жінок у віці 20–59 років протягом 2 років поспіль, а в подальшому — 1 раз на 3 роки [3, 17, 18, 23, 26].
З економічного погляду, кожен випадок хвороби, інвалідності та смерті від онкологічних захворювань призводить до певних грошових витрат, які припадають на частку держави і самих громадян. З метою соціально-економічного обґрунтування впровадження та проведення популяційного скринінгу РШМ в Україні нами проведено аналіз вартості цитологічного скринінгу та його економічної ефективності. Необхідно зазначити, що через існування розбіжностей в обчисленні прямих і непрямих витрат, пов’язаних з більшою кількістю діб госпіталізації, невизначену або низьку вартість додаткових методів діагностики та лікування, неврахування погодинної оплати праці медичного персоналу, відшкодування витрат, відсутність у вітчизняній системі охорони здоров’я деяких важливих економічних показників та автентичних коефіцієнтів [27] економічну ефективність проведення цитологічного скринінгу РШМ та витрати на нього розраховано авторами проекту без участі економістів, тому дані дослідження є орієнтовними.
У зв’язку з тим, що витрати на організаційно-методичні заходи можуть бути індивідуальними для кожної лікувальної установи в результаті різних обраних шляхів їх вирішення (поштові листівки, телефонний зв’язок, особистий візит сімейного лікаря, дільничного терапевта чи медичного реєстратора кабінету скринінгу тощо) і обчислити їх вартість у межах України неможливо, у вартість одного цитологічного дослідження включено лише витрати на:
- заробітну плату лікаря-гінеколога, який обстежує пацієнток та бере участь у заборі матеріалу для цитологічного дослідження;
- заробітну плату співробітників цитологічної лабораторії (лікарі, лаборанти, санітари — при двоступеневій системі мікроскопічного дослідження «лікар-лаборант»);
- витратні матеріали.
Відповідно до норм навантаження лікарів, лаборантів централізованої цитологічної лабораторії, на 50 тис. цитологічних досліджень на рік потрібно: 1 лікар, 3 лаборанти та 1 санітар. Кількість жіночого населення віком 20–59 років, за даними Державного комітету статистики України (далі — Держкомстату України), становить 13 848 861 (станом на 1 січня 2012 р.). Для охоплення даної категорії населення скринінгом необхідно 277 лікарів-гістологів, 831 лаборант, 277 санітарів.
За нормами навантаження лікарів консультативної поліклініки, на консультацію 1 хворого відводиться 12 хв. Лікар-гінеколог, який веде амбулаторний прийом, має 33 робочі години на тиждень при 5-денному робочому тижні. Таким чином, 1 лікар за 1 зміну може прийняти 33 пацієнтки або 7 260 осіб за рік (220 робочих днів, без вихідних, святкових днів та відпустки). Для обстеження категорії населення, яка підлягає скринінгу, необхідно 1 908 лікарів-гінекологів (табл. 1).
Таблиця 1. Кількість лікарів-гінекологів, необхідних для участі в програмі скринінгу РШМ
| Тривалість прийому 1 пацієнтки, хв | 12 |
| Тривалість робочого дня лікаря-гінеколога консультативної поліклініки, год | 6,6 |
| Кількість пацієнток на 1 лікаря за зміну, n | 33 |
| Кількість пацієнток на 1 лікаря в рік, n | 7 260 |
| Кількість пацієнток, які підлягають скринінгу, n | 13 848 861 |
| Необхідна кількість лікарів, n | 1 908 |
Середня заробітна плата лікаря в Україні становить 1 600 грн., лаборанта — 1 300 грн., санітара — 1 147 грн.* Річний фонд заробітної плати співробітників, які будуть залучені до цитологічного скринінгу РШМ, становить 4 894 019 грн. (табл. 2).
Таблиця 2. Річний фонд заробітної плати співробітників, залучених до скринінгу РШМ
| Штатні одиниці | Необхідна кількість штатних одиниць | Середня заробітна плата*, грн. | |
|---|---|---|---|
| на 1 посаду | Усього | ||
| Лікар-гінеколог | 1 908 | 1 600 | 3 052 800 |
| Лікар цитологічної лабораторії | 277 | 1 600 | 443 200 |
| Лаборант | 831 | 1 300 | 1 080 300 |
| Санітар | 277 | 1 147 | 317 719 |
| Усього на 1 дослідження | 0,35338 (≈ 0,35) | ||
| Усього на 1 рік | 3 293 | 5 647 | 4 894 019 |
*Станом на 1 січня 2013 р., за даними Держкомстату України (http://www.ukrstat.gov.ua).
Під час проведення цитологічного скринінгу РШМ будуть використані наступні витратні матеріали (табл. 3).
Таблиця 3. Кількість та вартість витратних матеріалів для скринінгу РШМ
| Витратні матеріали | Кількість | Вартість**, грн. | |||
|---|---|---|---|---|---|
| в упаковці | на 1 дослідження | упаковки | одиниці | на 1 дослідження | |
| Скло 24х24, шт. | 1000 | 1 | 100 | 0,10 | 0,10 |
| Скло 76х76, шт. | 72 | 1 | 13 | 0,18 | 0,18 |
| Забарвлення за методом Романовського, мл | 1000 | 2 | 60 | 0,06 | 0,12 |
| Рукавички латексні, шт. | 100 | 1 | 60 | 0,60 | 0,60 |
| Щіточка цервікальна, шт. | 100 | 1 | 64 | 0,64 | 0,64 |
| Усього на 1 дослідження | 1,64 | ||||
| Усього на 1 рік | 22 712 132 | ||||
**Станом на січень 2013 р., за даними ТОВ «ЕксімКаргоТрейд» (http://www.labprice.ua/company/eksimkargotrejd).
Загальні витрати на цитологічний скринінг осіб жіночої статті, що підлягають скринінгу, становили 27 612 984 грн. на рік, вартість одного цитологічного дослідження — 1,99 грн. (табл. 4).
Таблиця 4. Загальні витрати на цитологічний скринінг РШМ
| Витрати | На 1 рік, грн. | На 1 дослідження, грн. |
|---|---|---|
| Заробітна плата персоналу | 4 894 019 | 0,35 |
| Витратні матеріали | 22 712 132 | 1,64 |
| Усього | 27 606 151 | 1,99 |
Для розрахунку економічної ефективності проведення скринінгу застосовували формулу 1:
ЕЕф=ВС—(НП+ПІ+ВЛ), де (1)
ЕЕф — економічна ефективність проведення скринінгу;
ВС — витрати на скринінг;
НП — сума несплачених податків внаслідок смерті;
ПІ — виплата пенсій у зв’язку з інвалідністю внаслідок захворювання у працездатному віці;
ВЛ — витрати на лікування.
За даними Національного канцер-реєстру України, у 2010 р. від РШМ померли 2 170 жінок, із них 1 282 у віці 20–59 років, тобто особи працездатного віку, які в разі впровадження скринінгової програми могли б залишитися живими і, працюючи, сплачувати податки. Суму податків, несплачених державі внаслідок смерті від РШМ жінок працездатного віку, обчислювали за формулою 2:
НП=(СЗП • СЗП)/100 • КОПВ • 12, де (2)
НП — сума несплачених податків;
СЗП — середній розмір заробітної плати в державі;
ВСП — відсоток, який становлять податки від заробітної плати;
КОПВ — кількість осіб працездатного віку, які померли;
12 — кількість місяців у році.
На підставі даних Держкомстату України, середня заробітна плата в грудні 2012 р. становила 3 377 грн., податки — близько 21 %, отже, внаслідок смерті з причини РШМ держава не отримала податків на суму 10 909 871 грн. (табл. 5).
Таблиця 5. Сума несплачених податків
| Кількість жінок, що померли від РШМ, n | Усього несплачених податків внаслідок смерті від РШМ, грн. | |
|---|---|---|
| Усього | 2170 | 10 909 871 |
| Із них у працездатному віці | 1282 | |
Кількість жінок працездатного віку, в яких встановлено діагноз РШМ, та які потенційно можуть стати інвалідами й отримувати пенсію у зв’язку з інвалідністю, у 2010 р. становила 3 720 осіб. Мінімальний розмір пенсії в Україні станом на 1 січня 2013 р. — 884 грн./міс, отже, в рік держава може витратити 39 461 760 грн. на сплату пенсій у зв’язку з інвалідністю від РШМ, а загальні витрати, пов’язані зі смертністю та інвалідністю від РШМ, становитимуть 50 371 631 грн. в рік (табл. 6).
Таблиця 6. Загальні витрати, пов’язані зі смертністю та інвалідністю від РШМ
| Кількість жінок з діагностованим РШМ, які можуть отримувати пенсію у зв’язку з інвалідністю, n | 3 720 |
| Мінімальний розмір пенсії, грн. | 884 |
| Витрати на сплату пенсій у зв’язку з інвалідністю в рік, грн. | 39 461 760 |
| Усього несплачених податків внаслідок смерті від РШМ, грн. | 10 909 871 |
| Загальні витрати, пов’язані зі смертністю та інвалідністю від РШМ, грн. | 50 371 631 |
У вартість лікування хворих на РШМ включено лише хіміотерапевтичне лікування як найбільш високовартісне порівняно з хірургічним та променевим. Відповідно до наказу МОЗ України від 17.09.2007 № 554 «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія» хіміотерапевтичне лікування отримують хворі з ІІІ стадією — ад’ювантну хіміотерапію та IV стадією — паліативні курси поліхіміотерапії. Кількість таких жінок у 2011 р. становила 863 особи. Вони могли б отримувати лікування за наступними схемами [10]:
- монохіміотерапія: блеоміцин 300 мг сумарно;
- цисплатин 100 мг/м2; блеоміцин 40 мг/м2; етопозид 130 мг/м2 (3–4 курси);
- САР (цисплатин 100 мг/м2; доксорубіцин 50 мг/м2; циклофосфамід 1000 мг/м2 (3–4 курси));
- РС (цисплатин 100 мг/м2; циклофосфамід 1000 мг/м2 (3–4 курси)).
Дозу хіміотерапевтичного препарату розраховано на осіб з масою тіла 70 кг та зростом 170 см. Вартість препаратів, використаних при розрахунках, взято з Реєстру оптово-відпускних цін на лікарські засоби МОЗ України станом на 20 лютого 2013 р. (http://www.moz.gov.ua/ua/ portal/register_prices_drugs/) (табл. 7).
Таблиця 7. Вартість схем хіміотерапевтичного лікування
| Схема лікування | Вартість лікування, грн. | |||
|---|---|---|---|---|
| на 1 курс | на 4 курси | |||
| n=1 | n=863 | n=1 | n=863 | |
| Монохіміотерапія: блеоміцин 300 мг сумарно | 3 396,80 | 2 931 438,40 | ||
| Цисплатин + блеоміцин + етопозид | 1 760,41 | 7 041,64 | 1 518 795,49 | 6 075 181,95 |
| САР | 1 567,40 | 6 269,60 | 1 352 666,20 | 5 410 664,80 |
| РС | 1 162,02 | 4 648,08 | 1 002 823,26 | 4 011 293,04 |
Витрати на хіміотерапевтичне лікування хворих на РШМ становитимуть від 2 931 438,40 до 6 075 181,91 грн. залежно від схеми лікування.
Порівнюючи витрати держави на цитологічний скринінг і витрати на хіміотерапевтичне лікування, сплату пенсій у зв’язку з інвалідністю та недоотримані податки внаслідок смерті від РШМ жінок працездатного віку, держава матиме значну економію бюджетних коштів (табл. 8).
Таблиця 8. Витрати бюджетних коштів
| Вид витрат | Роки дії скринінгової програми | |
|---|---|---|
| Перші 2 роки, грн. | Починаючи з 3-го року, грн. | |
| На програму скринінгу | 27 606151,04 | 9 202 050,35 |
| Несплачені податки | 10 909 871,00 | |
| Пенсії у зв̓язку з інвалідністю | 39 461 760,00 | |
| Лікування: | ||
| найдешевша схема | 2 931 438,40 | |
| найдорожча схема | 6 075 181,95 | |
| Економія бюджетних коштів, враховуючи лікування за: | ||
| найдешевшою схемою | 25 696918,36 | 44 101019,05 |
| найдорожчою схемою | 28 840662,91 | 47 244763,61 |
Отже, протягом 1-го та 2-го років від моменту впровадження цитологічного скринінгу держава щорічно матиме економію бюджетних коштів від 25 696 918 до 28 840 662 грн. (за формулою 1). Починаючи з 3-го року дії скринінгової програми РШМ економія щорічно становитиме від 44 101 019 до 47 244 763 грн. за умови, що скринінгом буде охоплено все жіноче населення України віком 20–59 років.
Необхідно зазначити, що економічна ефективність роботи кабінету патології шийки матки Національного інституту раку в 2011 р. становила 531 092 грн. (64 610 дол. США); 8 566 грн. (1 071 дол.) на 1 хвору на РШМ.
Таким чином, на сьогодні організований цитологічний скринінг — це єдиний ефективний профілактичний спосіб протиракової боротьби з РШМ. Програма цитологічного організованого скринінгу має діяти постійно, адже лише за такої умови можливо досягти зниження захворюваності та смертності від РШМ, а з плином часу утримувати ці показники на низькому рівні. Для ефективної роботи популяційної скринінгової програми РШМ, у першу чергу, необхідно забезпечити найвищий відсоток охоплення скринінгом жіночого населення, ретельну підготовку кадрів, задіяних у реалізації даної програми, адекватне лікування та подальше динамічне спостереження пацієнтів з виявленими патологіями. Лише у випадку дотримання цих вимог будуть виконані всі завдання скринінгової програми, а кошти, виділені на її реалізацію, не будуть витрачені даремно.
Список використаної літератури
1. Le Gales-Camus C. (2005) The World Health Organization’s Fight Against Cancer: Strategies That Prevent, Cure and Care, WHO Press., Geneva, 25 p.
2. Danaei G., Vander Hoorn S., Lopez A.D. (2005) Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors. Lancet, 366(9499): 1784–1793.
3. Рак в Україні 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, Київ, 13, 124 с.
4. Jemal A., Bray F., Melissa M., Ferlay J. et al. (2011) Global cancer statistics. Cancer J. for Clinicians, 61(2): 69–90.
5. Ferlay J., Shin Hai-Rim, Bray F. et al. (2010) Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Intern. J. Cancer, 127(12): 2893–2917.
6. Arbyn M., Castellsagué X., de Sanjosé S. et al. (2011) Worldwide burden of cervical cancer in 2008. Ann. Oncol., 22(12): 2675–86.
7. World Health Organisation (2008) Programs and Projects, Cancer Screening and Early Detection of Cancer. J. Med. Screen, 12: 35–40.
8. Feral J., Steliarova-Foucher E., Lortet-Tieulent J. (2013) Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur. J. Cancer, 49(6):1374–1403.
9. Bray F., Ren J.S., Masuyer E. et al. (2013) Estimates of global cancer prevalence for 27 sites in the adult population in 2008. Int. J. Cancer, 132(5): 1133–1145.
10. Jemal A., Bray F., Melissa M. et al. (2011) Global cancer statistics. Cancer J. for Clinicians, 61(2): 69–90.
11. Sankaranarayanan R., Sauvaget C., Ramadas K. et al. (2011) Clinical trials of cancer screening in the developing world and their impact on cancer healthcare. Ann. Oncol., 22(7): vii20–vii28.
12. World Health Organization. World health statistics (2010). WHO Geneva:. http://www.who.int/whosis/whostat/2010/en/
13. Berrino F., De Angelis R., Sant M. et al. (2007) Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995–99: results of the EUROCARE-4 study. Lancet Oncol., 8(9): 773–783.
14. Федоренко З.П., Гайсенко А.В., Гулак Л.О. та ін. (2010) Рак в Україні, 2008–209. Захворюваність, смертність, показники діяльності онкологічної служби/гол. ред. І.Б. Щепотін. Бюл. Нац. канцер-реєстру України, Київ, 11, 107 с.
15. Homer M.J., Ries L.A.G., Krapcho M. et al. (2009) SEER Cancer Statistics Review 1975–2006, National Cancer Institute, Bethesda. http://seer.cancer.gov/ csr/1975_2006/.
16. Patnick J. (2011) NHS Cervical Screening Programme. Annual Review 2011, Eds: J. Patnick, NHSCSP, Hanover, 22 p.
17. Brawley O.W., Kramer B.S. (2004) Cancer screening in theory and in practice. J. Clin. Oncol., 23(2): 293–300.
18. World Health Organization, Department of Reproductive Health and Research and Department of Chronic Diseases and Health Promotion (2006) Comprehensive cervical cancer control. A guide to essential practice, Geneva, 284 р.
19. Mandel J.S., Smith R. (2008) Principles of Cancer Screening. Cancer. Principles & Practice of Oncology, eds: V.T. De Vita, Jr.S. Hellman, S.A. Rosenberg. Lippincott Williams & Wilkins, Philadelphia, Baltimore: 659–676.
20. Blanks R.G. (2010) Using a graph of abnormal predictive value versus the positive predictive value for the determination of outlier laboratories in the National Health Service cervical screening programme. Cytopathology, 21: 379–388.
21. Камышников В.С. (2007) Клинические лабораторные тесты от А до Я и их диагностические профили. МЕ Дпресс-информ, Москва, 313 с.
22. Arbyn M., Cuzick J. (2009) International agreement to join forces in synthesizing evidence on new methods for cervical cancer prevention. Review. Cancer Letters, 278(1): 1–2.
23. Arbyn M., Anttila A., Jordan J. et al. (2010) European Guidelines for Quality Assurance in Cervical Cancer Screening. Second edition — summary document. Ann. Oncol., 21(3): 448–458.
24. Belinson J.L., Hu S., Niyazi M. et al. (2010) Prevalence of type-specific human papillomavirus in endocervical, upper and lower vaginal, perineal and vaginal self-collected specimens: Implications for vaginal self-collection. Intern. J. Cancer, 127(5): 1151–57.
25. Daley E.M., Perrin K.M., McDermott R.J. et al. (2010) The psychosocial burden of HPV: a mixed-method study of knowledge, attitudes and behaviors among HPV+ women. J. Health Psychol., 15(2): 279–290.
26. Smith R.A., Cokkinides V., Brooks D. (2011) Cancer Screening in the United States, 2011. A Review of Current American Cancer Society Guidelines and Issues in Cancer Screening. CA Cancer J. Clin., 61(2): 8–30.
27. Levin C.E., Sellors J., Shi J.F. (2010) Cost-effectiveness analysis of cervical cancer prevention based on a rapid human papillomavirus screening test in a high-risk region of China. Int. J. Cancer, 127(5): 1404–11.
Скрининг рака в Украине: когда теория отвечает реальности. Социально-экономическое обоснование популяционного скрининга рака шейки матки
Резюме. В мире рак шейки матки остается одной из наиболее распространенных форм злокачественных новообразований, занимая 2-е место по частоте и 3-е по смертности среди всех онкологических заболеваний у женщин. Самая высокая заболеваемость характерна для развивающихся стран. На сегодня скрининг в онкологии является практически единственным профилактическим методом, применение которого способствует снижению уровня смертности от отдельных видов злокачественных новообразований. В Украине, государстве с ограниченными финансовыми ресурсами, возникла необходимость в социально-экономическом обосновании целесообразности проведения популяционного скрининга рака шейки матки с определением количественной оценки «затраты–эффективность» и качественной — «вред–польза», а также в создании организационных мероприятий по его внедрению. В работе представлен анализ финансовых параметров с целью определения совокупности показателей, которые характеризуют экономическую сторону и эффективность процесса проведения популяционного скрининга рака шейки матки.
Ключевые слова: скрининг, первичная профилактика, ранняя диагностика, рак шейки матки, алгоритм скрининговой программы, социально-экономическое обоснование скрининга.
Cancer screening in Ukraine: when a theory answers reality. Socioeconomic feasibility of population screening for cervical cance
Summary. Cervical cancer is a leading cause of disease in the world. Cervical cancer is the second most common cancer and third on a death rate among women worldwide. The great majority of the disease burden occurs in developing countries. At present, cancer screening in oncology it is the basic method of prophylaxis that reduces the level of death rate from malignant tumors. For Ukraine, as the states with the limited financial resources is a necessity socioeconomic feasibility of population screening for cervical cancer with definition of quantitative estimation «cost-effectiveness analysis» and qualitative estimation «disbenefit-benefits analysis». In addition, organizational events must be definition for his introduction. In this study, we carried out assessed of an analysis the parameters to measure aggregate criteria and indicators that characterize the economic side conducting of population screening for cervical cancer.
Key words: screening, primary prophylaxis, early cancer detection, cervical cancer, algorithm of the screening program, socioeconomic feasibility of cancer screening.














Leave a comment