Експериментальне обґрунтування застосування білків теплового шоку у вакцинотерапії хворих зі злоякісними новоутвореннями
Болюх І.А.1, Діденко Г.В. 2, Шпак Є.Г.1, Кузьменко О.П.2, Лісовенко Г.С.1, Потебня Г.П.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
Резюме. Значний терапевтичний потенціал у лікуванні пацієнтів зі злоякісними новоутвореннями становлять вакцини, виготовлені з використанням білків теплового шоку (БТШ). Одним із шляхів підвищення ефективності аутологічних БТШ-вакцин є модифікація пухлиноасоційованих антигенів цитотоксичними білоквмісними метаболітами Bacillus subtilis B-7025. У даній роботі проведено вивчення індукції та накопичення БТШ з молекулярною масою 70 кДа в пухлинних клітинах за рахунок гіпертермії, викликаної надвисокочастотним генератором, і досліджено протипухлинну ефективність вакцин, сконструйованих на основі пухлинних клітин, збагачених БТШ, і метаболітів Bacillus subtilis B-7025. Дані вакцини за рівнем гальмування росту пухлинного вузла та антиметастатичною дією виявилися більш ефективними, ніж вакцини, виготовлені за традиційною технологією.
Вступ
 Вакцинотерапія пухлин є самостійним перспективним напрямом лікування хворих зі злоякісними новоутвореннями, адже адекватний рівень імунного захисту здебільшого визначає успіх протипухлинної терапії. Протипухлинні вакцини (ПВ) застосовують для формування специфічної імунної відповіді на пухлинні антигени, що суттєво підвищує ефективність лікування пацієнтів онкологічного профілю [1–4]. Існує ціла низка вакцин, сконструйованих на основі пухлинного матеріалу пацієнтів, модифікованого різними методами, але на шляху їх використання виникає ряд перепон: імунологічна толерантність організму до пухлинних антигенів, можливість індукції аутоімунних процесів, досить низька експресія змінених антигенів на поверхні пухлинних клітин (ПК) [5–7].
Вакцинотерапія пухлин є самостійним перспективним напрямом лікування хворих зі злоякісними новоутвореннями, адже адекватний рівень імунного захисту здебільшого визначає успіх протипухлинної терапії. Протипухлинні вакцини (ПВ) застосовують для формування специфічної імунної відповіді на пухлинні антигени, що суттєво підвищує ефективність лікування пацієнтів онкологічного профілю [1–4]. Існує ціла низка вакцин, сконструйованих на основі пухлинного матеріалу пацієнтів, модифікованого різними методами, але на шляху їх використання виникає ряд перепон: імунологічна толерантність організму до пухлинних антигенів, можливість індукції аутоімунних процесів, досить низька експресія змінених антигенів на поверхні пухлинних клітин (ПК) [5–7].
Однією з успішних стратегій підвищення ефективності вакцинотерапії злоякісних пухлин є поєднане застосування в ПВ імунотропних речовин природного і синтетичного походження, серед яких особливе місце займають білки теплового шоку (БТШ) [8–10]. Відомо, що виділені з ПК БТШ знаходяться в комплексі з широким спектром клітинних пептидів і теоретично можуть нести на собі всі антигени, притаманні даній конкретній пухлині. Тому імуногенність БТШ є результатом двох різних особливостей: пептидзалежної здатності викликати адоптивну цитотоксичну Т-лімфоцитарну відповідь на антигенні пептиди і пептиднезалежної імуномодулюючої активності [11, 12]. Відповідно, стає вельми привабливим застосування аутологічних ПВ на основі виділених з пухлинної тканини комплексів БТШ з пухлиноасоційованими антигенами (БТШ-пептидні комплекси). Однак, незважаючи на успішні результати імунотерапії аутологічними БТШ-вакцинами, важливою проблемою залишається недостатня імуногенність пухлинних антигенів.
Одним із шляхів підвищення ефективності ПВ є посилення імунної відповіді на пухлиноасоційовані антигени за рахунок їх модифікації цитотоксичними білоквмісними метаболітами (БМ) Bacillus subtilis B-7025. Раніше було показано, що БМ В. subtilis B-7025 підвищують імуногенність таких слабких онкофетальних антигенів, як раково-ембріональний антиген та альфа-фетопротеїн, що проявляється у значному збільшенні титру антитіл до даних антигенів [13].
Ефективність вакцин, виготовлених з аутологічних (гомологічних) ПК шляхом їх обробки БМ В. subtilis B-7025, доведено в численних експериментальних та клінічних дослідженнях [14, 15]. Ці дані створили підґрунтя для конструювання та подальшого дослідження протипухлинної ефективності аутологічних ПВ на основі комплексу БТШ з пухлинними антигенами, до складу яких в якості ад’юванту входять цитотоксичні БМ B. subtilis B-7025.
Мета роботи: сконструювати протипухлинну аутовакцину, збагачену БТШ, та вивчити її терапевтичну ефективність.
Об’єкт та методи дослідження
Досліди проводили на мишах-самцях лінії С57В1/6 (віком 2 міс, масою тіла 18–20 г), одержаних з розплідника віварію Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, сертифікованого згідно з вимогами Міжнародної конвенції з правил гуманного поводження з дослідними тваринами. У якості моделі пухлинного росту використовували карциному легені Льюїс (КЛЛ) та рак Ерліха (РЕ). ПК перещеплювали в стегно миші з розрахунку 10клітин на тварину за стандартною
методикою.
Для індукції БТШ проводили прогрівання пухлини (розміром до 1 см в діаметрі) при температурі 43,0±0,3 °С протягом 1 год на експериментальному генераторі (частота 434 МГц, «Іstok», Росія). Білки з пухлинної тканини (РЕ, КЛЛ), яка зазнала впливу локальної гіпертермії (ГТ), одержували методом ЕДТА-екстракції (ЕДТА — етилендіамінтетраоцтова кислота, англ. EDTA – ethylenediaminetetraacetic acid). Розділення нативних білків та оцінку змін в білковому складі фіксували за допомогою SDS-електрофорезу (sodium dodecyl sulfate; метод Леммлі). Для підтвердження наявності та визначення рівня БТШ в екстрактах, отриманих з ПК, проводили імуноблот-тест, використовуючи моноклональні антитіла до БТШ-70 («ENZO», США).
За допомогою продуктів мікробного синтезу B. subtilis B-7025, які мають цитотоксичну дію відносно ПК в системі in vitro — БМ з молекулярною масою 70 та 18,5 кДа (БМ 70 кДа та БМ 8,5 кДа), та екстрактів, отриманих з пухлин (РЕ та КЛЛ), які зазнали впливу ГТ та без неї, сконструйовано декілька ПВ. Вакцини готували, виходячи з розрахунку білка (0,3 мг екстракту ПК та 0,3 мг відповідного БМ B. subtilis B-7025 на 1 мл вакцини). Імунізацію тварин починали на 2-гу добу після перещеплення пухлини, проводили чотирьохразово (2; 5; 12; 19-та доби), доза ПВ становила 0,2 мг на 1 ін’єкцію (0,8 мг на весь курс вакцинації).
Сформовані такі групи: 1-ша — контроль пухлинного росту; 2-га — вакцина на основі екстракту ПК (без попередньої ГТ) та БМ 70 кДа; 3-тя — вакцина на основі екстракту ПК (підданих ГТ) та БМ 70 кДа; 4-та — вакцина на основі екстракту ПК (без попередньої ГТ) та БМ 18,5 кДа; 5-та — вакцина на основі екстракту ПК (підданих ГТ) та БМ 18,5 кДа.
Умертвіння тварин та забір матеріалу проводили на 24-ту добу після перещеплення пухлини, з дотриманням умов, встановлених Міжнародною конвенцією з правил гуманного поводження з дослідними тваринами. Протипухлинний ефект лікування оцінювали за показниками виживаності тварин, індексом гальмування кількості та об’єму метастазів у легенях. Результати експериментальних досліджень опрацьовували з використанням загальноприйнятих методів варіаційної статистики із застосуванням пакетів комп’ютерних програм Origin 7.5 та Statistica 6.0 [16].
Результати та їх обговорення
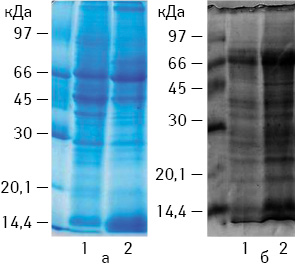
На першому етапі досліджено зміни в білковому спектрі екстрактів, отриманих з ПК, які піддавали локальній ГТ. Встановлено, що пік експресії БТШ припадає на 24-ту годину після нагріву незалежно від типу пухлини. Одержано зразки пухлинної тканини (РЕ та КЛЛ), які зазнали впливу локальної ГТ, для розробки оптимальної технології виготовлення з них ефективних ПВ. За допомогою методу SDS-електрофорезу показано, що існує різниця в білковому спектрі між екстрактами пухлин, які зазнали впливу локальної ГТ та без неї. Встановлено, що в пухлинах, підданих локальній ГТ, значно підвищена концентрація білків з молекулярною масою близько 70; 80 та 10 кДа (рис. 1). Особливо підвищеною є концентрація білків з молекулярною масою 70 кДа, ці показники є однаковими для обох модельних пухлин.
Використання БМ B. subtilis B-7025 (18,5 та 70,0 кДа) для виготовлення ПВ призводило до змін у білковому спектрі пухлин, імовірно, за рахунок часткового протеолізу білків пухлини (рис. 2).
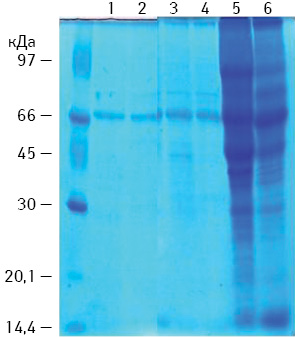
Крім того, відомо, що компонент 18 кДа має протеолітичні властивості, належить до класу серинових протеаз, оскільки його дію можна загальмувати відповідним блокатором (РМSF) [17].
Сконструйовані вакцини випробувано в експериментах in vivo у мишей з перещепленими експериментальними пухлинами (РЕ та КЛЛ). Одержані результати показали, що ефективність вакцин, виготовлених на основі пухлин, підданих локальній ГТ з метою збагачення БТШ, за низкою ознак перевершувала такі при використанні традиційної технології їх виготовлення. Кращі показники гальмування росту РЕ на термінальних його етапах (24-та доба після перещеплення пухлини) відзначали при введенні вакцини, виготовленої на основі ПК, підданих локальній ГТ, та БМ B. subtilis B-7025 з молекулярною масою 18 кДа (середній об’єм пухлини становив 9,35±0,86 см проти 12,36±1,82 сму контролі; індекс гальмування — 24,35%).
При оцінці динаміки росту КЛЛ вірогідних відмінностей між контрольною та дослідними групами не виявлено до 19-ї доби пухлинного росту (p>0,05), на 22-гу добу ця різниця стала помітною. Так, у мишей, які отримували ПВ на основі КЛЛ (ГТ) + БМ 18,5 кДа, об’єм пухлин був найменшим і становив 1,22±0,23 смпроти 1,75±0,19 см у контрольних тварин (p<0,05).
Затримку росту первинної пухлини відзначали також при використанні вакцин КЛЛ + БМ 18,5 кДа; КЛЛ + БМ 70 кДа та КЛЛ (ГТ) + БМ 70 кДа (1,48±0,28; 1,31±0,28 та 1,31±0,24 см відповідно). Слід підкреслити, що використання ЕДТА-екстрактів ПК без ад’ювантів не спричиняло протипухлинної дії, і розміри пухлин становили 2,11±0,34 та 1,80±0,41 см при введенні КЛЛ та КЛЛ (ГТ), що було наближеним до контрольного показника.
Метастазування КЛЛ в легені оцінювали на 24-ту добу експерименту (таблиця).
Таблиця Метастазування КЛЛ у мишей, що одержували вакцини на основі пухлинної тканини, підданої ГТ, та ад’ювантів мікробного походження
| Групи мишей | Середня кількість метастазів/тварину | Середній об’єм метастазів/тварину (мм) |
|---|---|---|
| Контроль | 17,17±1,62 | 28,76±5,09 |
| KЛЛ + БМ 18,5 кДа | 9,20±2,39* | 11,40±4,97 |
| KЛЛ (ГТ) + БМ 18,5 кДа | 1,57±1,11* | 2,02±1,44* |
| KЛЛ + БМ 70 кДа | 13,67±5,23 | 19,50±14,05 |
| KЛЛ (ГТ) + БМ 70 кДа | 15,29±3,87 | 17,42±4,63 |
*p<0,05
Виражений антиметастатичний ефект проявляли ПВ, виготовлені з використанням БМ B. subtilis B-7025 з молекулярною масою 18,5 кДа, при цьому саме вакцина на основі екстракту з клітин КЛЛ, підданої гіпертермії (КЛЛ (ГТ) + БМ 18,5 кДа), виявилася найбільш ефективною. Середня кількість метастазів на тварину становила лише 1,57±1,11 при 17,17±1,62 у контрольних тварин, а їх об’єм — 2,02±1,44 та 28,76±5,09 відповідно (p<0,05). Антиметастатична дія зазначеної ПВ суттєво перевищувала таку подібної вакцини, виготовленої з пухлини без попередньої ГТ, що дозволяє зробити припущення про збагачення БТШ, обробленої локальною ГТ пухлинної тканини.
У якості ПВ найбільш часто використовують БТШ 70 кДа, тому для з’ясування можливих механізмів протипухлинної дії розробленої вакцини проведено імуноблот-аналіз рівня БТШ 70 кДа (із застосуванням моноклональних антитіл до БТШ 70 кДа («ENZO», США)) як в ЕДТА-екстрактах, отриманих з ПК, підданих ГТ та без неї, так і у вакцинах, виготовлених з їх використанням [18, 19] (рис. 3).
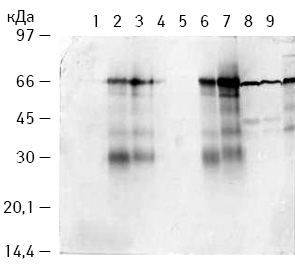
При аналізі рівня БТШ 70 кДа в ЕДТА-екстрактах, отриманих з клітин КЛЛ, продемонстровано, що ГТ пухлин призводила до значного підвищення рівня БТШ 70 кДа. Додавання до ЕДТА-екстрактів пухлин при виготовленні вакцини БМ B. subtilis B-7025 18,5 та 70 кДа призводило до зниження рівня БТШ 70 кДа, оскільки під впливом МБ відбувається його розщеплення до складових з молекулярною масою близько 28 кДа.
При аналізі методом імуноблотингу рівня БТШ 70 кДа в сироватках крові тварин, узятих через 24 год після прогрівання пухлин, різниці в кількості БТШ 70 кДа (порівняно з контрольною групою) не виявлено. Одержані результати насамперед свідчать про те, що на 2-гу добу після ГТ пухлини відбувається зростання рівня БТШ 70 кДа в пухлині, але цього не виявляють у сироватках крові тварин — носіїв даної пухлини. Це, ймовірніше, пов’язано з коагуляцією судин у пухлині під впливом ГТ, або максимальний синтез БТШ 70 кДа у периферичній крові відзначають на більш пізніх етапах.
Для підтвердження отриманих результатів проведено дослідження рівня БТШ 70 кДа в ЕДТА-екстрактах пухлин КЛЛ, підданих локальній ГТ, та вакцин, виготовлених на їх основі за допомогою БМ B. subtilis B-7025 з молекулярною масою 70 та 18,5 кДа (рис. 4).
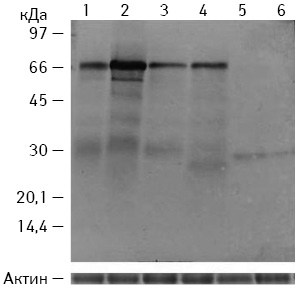
При аналізі результатів імуноблот-тесту підтверджено, що ГТ пухлини призводила до підвищення рівня БТШ 70 кДа в ЕДТА-екстракті пухлин КЛЛ. При цьому БМ 70 кДа B. subtilis B-7025 у готовій вакцині призводить до зменшення рівня БТШ 70 кДа, а використання БМ 18,5 кДа B. subtilis B-7025 сприяє розщепленню БТШ 70 кДа до складових з молекулярною масою близько 28 кДа, що скоріше за все підвищує їх імуногенність та призводить до більш вираженого протипухлинного ефекту.
У сироватках крові тварин контрольної групи та тварин, які отримували ЕДТА-екстракти КЛЛ (підданих локальній ГТ та без термічної обробки), рівень БТШ 70 кДа особливо не відрізнявся. Але у мишей, яким вводили вакцину на основі ЕДТА-екстракту з пухлин КЛЛ, підданих локальній ГТ, та БМ 18,5 B. subtilis B-7025, у яких зареєстровано виражений антиметастатичний ефект, БТШ 70 кДа в сироватках крові був практично відсутнім. Із цього можна зробити попереднє припущення, що рівень БТШ 70 кДа в сироватках крові може знижуватися при ефективній протипухлинній терапії.
ВИСНОВКИ
Таким чином, результати дослідження експресії БТШ у модельних пухлинах за умов локальної ГТ свідчать про суттєве зростання в них рівня БТШ 70 кДа. Попередні спроби створення ПВ на основі ЕДТА-екстрактів пухлинної тканини, збагаченої БТШ 70 кДа, за допомогою ад’ювантів мікробного походження мають позитивні результати, що виражається в кращій протипухлинній та антиметастатичній ефективності даних вакцин порівняно з вакцинами, виготовленими за традиційною технологією. Зниження рівня БТШ 70 кДа в сироватках крові вакцинованих мишей корелює з протипухлинним ефектом досліджуваних вакцин. Це свідчить про необхідність подальшої детальної розробки всіх етапів технології виготовлення ПВ, яка дозволить зберегти переваги збагачення БТШ і забезпечить максимальний позитивний ефект вакцинації.
Список ВИКОРИСТАНОЇ літератури
1. Srivastava P.K. (2006) Therapeutic cancer vaccines. Curr. Opin. Immunol., 18(2) : 201–5.
2. Itoh K., Yamada A., Mine T., Noguchi M. (2009) Recent advances in cancer vaccines: an overview. Jpn. J. Clin. Oncol., 39(2): 73–80.
3. Cebon J. (2010) Cancer vaccines: Where are we going? Asia Pac. J. Clin. Oncol., 6(l): 9–15.
4. Aurisicchio L., Ciliberto G. (2010) Patented cancer vaccines: the promising leads. Expert. Opin. Ther. Pat., 20(5): 647–60.
5. Chan A.D., Morton D.L. (1998) Active Immunotherapy with allergenic tumor vaccines: present status. Seminars in Oncol., 28(6): 611–622.
6. Moingeon P. (2001) Cancer Vaccines. Vaccine, 19: 1305–26.
7. Kochenderfer J.N., Gress R.E. (2007) A Comparison and Critical Analysis of Preclinical Anticancer Vaccination Strategies. Exp. Biol. Med., 232: 1130–41.
8. Higgins J.P., Bernstein M.B., Hodge J.W. (2009) Enhancing immune responses to tumor-associated antigens. Cancer Biol. Ther., 8(15): 1440–9.
9. Khranovska N., Orel V., Grinevich J. et al. (2012) Mechanical heterogenization of Lewis Lung carcinoma cells can improve antimetastatic effect of dendritic cells. J. Mech. Med. Biol., 12(1):1–22.
10. Dubensky T.W. Jr, Reed S.G. (2010) Adjuvants for cancer vaccines. Semin. Immunol., 22(3): 155–61.
11. Graner M.W., Katsanis E. (2004) Chaperone proteins. Heat shock proteins as anticancer vaccines. In: Handbook of Cancer Vaccine. Humana Press.: 297–316.
12. Srivastava P.K. (2000) Roles of heat shack proteins in innate and adoptive immunity. Nat. Rev. Immunol., 2: 185–94.
13. Потебня Г.П., Семерников В.А., Хуторной С.В. и др. (1999) Модуляция антигенных свойств опухолевых клеток с помощью продуктов метаболизма Bac. mesentericus АБ-56. Эксперим. онкология, 21(3–4): 223–227.
14. Потебня Г.П., Танасієнко О.А., Лісовенко Г.С., Савцова З.Д. (2003) Використання цитотоксичних лектинів бактеріального походження в імунотерапії експериментальних пухлин. В: Структура і біологічна активність бактеріальних біополімерів. Київський універс.: 235–304.
15. Потебня Г.П., Лісовенко Г.С., Чехун В.Ф. (2009) Впровадження протипухлинних вакцин серії ІЕПОР в клінічну практику онкологічних закладів України. Наука та інновації, 5(1): 62–79.
16. Гланц С. (1998) Медико-биологическая статистика. Пер. с англ. Практика, Москва, 459 с.
17. Діденко Г.В., Євтушенко О.І., Кузьменко А.П., Лісовенко Г.С., Потебня Г.П. (2010) Речовина з цитотоксичною дією. Патент на корисну модель № 52252 Україна. Бюл. № 16.
18. Аронов Д.А., Скрабелинская Е.И., Бойко А.А. и др. (2010) Иммунизация белком теплового шока 70 во время латентного периода ингибирует рост перевитой мышам карциномы молочной железы. Усп. совр. естествознания, 7: 17–8.
19. Никитин К.Д., Барышников А.Ю. (2007) Противоопухолевые вакцины на основе белков теплового шока. Рос. биотерап. журн., 6(2): 3–12.
Экспериментальное обоснование применения белков теплового шока при вакцинотерапии больных со злокачественными новообразованиями
Резюме. Значительный терапевтический потенциал в лечении пациентов со злокачественными новообразованиями представляют вакцины, изготовленные с использованием белков теплового шока (БТШ). Одним из путей повышения эффективности аутологичных БТШ-вакцин является модификация опухолеассоциированных антигенов цитотоксическими белоксодержащими метаболитами Bacillus subtilis B-7025. В данной работе проведено изучение индукции и накопления БТШ с молекулярной массой 70 кДа в опухолевых клетках за счет гипертермии, вызванной сверхвысокочастотным генератором, и исследована противоопухолевая эффективность вакцин, сконструированных на основе опухолевых клеток, обогащенных БТШ, и метаболитов Bacillus subtilis B-7025. Данные вакцины по уровню торможения роста опухолевого узла и антиметастатическому действию оказались более эффективными, чем вакцины, изготовленные по традиционной технологии.
белки теплового шока, противоопухолевые вакцины, белоксодержащие метаболиты, опухолевые антигены.














Leave a comment