Сравнительный анализ синхронных и этапных резекций печени у больных с метастатическим колоректальным раком
Щепотин И.Б., Колесник Е.А., Лукашенко А.В., Бурлака А.А., Приймак В.В., Лаврик Г.В., Халилеев А.А., Куценко Л.Б.
Резюме. Хирургическое лечение пациентов с синхронным метастатическим колоректальным раком (СМКРР) остается единственным методом, улучшающим общую 5-летнюю выживаемость. На сегодня актуальным является вопрос о целесообразности и эффективности применения синхронных оперативных вмешательств при метастатическом поражении печени у больных с СМКРР. Проанализированы результаты лечения 98 больных с МКРР с синхронным поражением печени, которые получали синхронные (группа А, n=40) и этапные резекции (группа Б, n=58) печени в научно-исследовательском отделении опухолей брюшной полости и забрюшинного пространства Национального института рака Министерства здравоохранения Украины в период с 2008 по 2012 г. Общая 3-летняя выживаемость в группе больных с синхронными резекциями (группа А) составила 42% и в группе Б — 55% (р=0,22). Суммарный уровень послеоперационных осложнений в группах А и Б после завершения хирургических этапов статистически не отличался, составив 30 и 35,7% в группах А (n=40) и Б (n=28) соответственно (р=0,83). Меньшая длительность оперативного вмешательства зарегистрирована в группе А — 316,3±10,3 мин, тогда как в группе Б составила 484,1±18,3 мин (р<0,001). Больные после этапных резекций дольше пребывали в стационаре — 23,3±0,8 койко-дня, тогда как после синхронных резекций — 10,2±0,4 койко-дня (р<0,001). Аанализ проведенных нами исследований указывает на необходимость разработки дифференцированного подхода в хирургическом лечении СМКРР. Последующие работы должны быть направлены на изучение факторов прогноза и критериев для отбора больных в группы хирургического лечения, оценки экономического эффекта, качества жизни пациентов.

Введение
Колоректальный рак (КРР) занимает четвертое место в структуре онкологической заболеваемости и второе среди причин летального исхода от злокачественных новообразований в мире [2]. У 40–50% пациентов с КРР диагностируют метастатическое поражение печени, у половины из них — синхронного характера [9, 12]. Метастатическое поражение печени при КРР является неблагоприятным прогностическим фактором, а медиана выживаемости таких больных не превышает 12 мес [23].
Хирургическое лечение является единственным методом, улучшающим общую 5-летнюю выживаемость, показатели которой, по данным разных авторов, достигают 25–58% [1, 9, 20]. Оптимальный подход к тактике хирургического лечения больных с синхронным метастатическим колоректальным раком (СМКРР) остается дискутабельным. Традиционно хирургическое лечение больных с СМКРР предполагает этапные резекции, когда первичную опухоль удаляют на начальном этапе, с последующей отсроченной резекцией опухоли печени [14, 24, 26]. За последние годы в некоторых исследовательских центрах отмечен позитивный сдвиг в сторону синхронных резекций первичной опухоли печени у больных с СМКРР [25]. Однако сравнительные результаты лечения больных после синхронных и этапных резекций представлены недостаточно, а показатели послеоперационных осложнений значительно варьируют, по данным разных исследователей [25].
Таким образом, на сегодня актуальным является вопрос о целесообразности и эффективности применения синхронных оперативных вмешательств при метастатическом поражении печени у больных СМКРР.
Цель исследования: провести сравнительный анализ непосредственных и отдаленных результатов синхронного и этапного хирургического лечения больных СМКРР.
Материал и методы
Проанализированы результаты лечения 98 больных МКРР с синхронным поражением печени, которые находились на лечении в отделении опухолей брюшной полости и забрюшинного пространства Национального института рака Министерства здравоохранения Украины в период с 2008 по 2012 г. Для проведения сравнительного анализа выделены группы пациентов: с СМКРР, которым выполнили синхронные резекции первичной опухоли толстой кишки и печени (группа А) — 40 больных (40,8%); с СМКРР, которым запланировали отсроченные резекции печени в течение 3–6 мес после резекции первичной опухоли (группа Б) — 58 больных (59,2%).
Все больные в группе А после одномоментных резекций получали 6 курсов полихимиотерапии (ПХТ) в адъювантном режиме по стандартным схемам — FOLFOX (XELOX)/FOLFIRI; в группе Б всем больным назначали аналогичные режимы ПХТ после первого (3–4 курса) и второго (3–4 курса) хирургического этапа. Характеристика пациентов обеих групп представлена в таблице.
Таблица. Клиническая характеристика пациентов с СМКРР, получавших синхронные и этапные резекции (n=98)
| Клиническая характеристика | Резекции печени | р | ||
|---|---|---|---|---|
| Синхронные (группа А) | Этапные (группа Б) | |||
| Количество больных, n | 40 | 58 | ||
| Средний возраст±стандартная ошибка, годы | 61,1±1,5 | 62,8±0,9 | 0,33 | |
| Пол (мужчины/женщины), % | 22 (55)/18 (45) | 26 (44,8)/32 (55,2) | 0,43 | |
| Степень метастатического поражения по Gennari на момент установления диагноза, n (%) | ||||
| І стадия | 13 (32,5) | 11 (18,9) | 0,84 | |
| ІІ стадия | 10 (25) | 19 (32,7) | 0,14 | |
| ІІІ стадия | 17 (42,5) | 28 (48,4) | 0,14 | |
| Тип резекции кишечника, n (%) | ||||
| толстая кишка | 11 (27,5) | 36 (62,1) | ||
| прямая кишка | 29 (72,5) | 22 (37,9) | 0,4 | |
| Тип резекции печени, n (%) | ||||
| ≤3 сегментов | 31 (77,5) | 23(39,6) | 0,34 | |
| >3 сегментов | 9 (22,5) | 5(8,6) | 0,42 | |
| Мультивисцеральные резекции | 2 (5) | – | ||
| при первом этапе резекции | – | 2 (3,4) | ||
| при втором этапе резекции | – | 6 (10,3) | ||
| Средняя длительность операций±стандартная ошибка, мин | 316,3±10,3 | 484,1±18,3 | ||
| Средняя продолжительность пребывания в стационаре±стандартная ошибка, сут | 10,2±0,4 | 23,3±0,8 | ||
| Локализация КРР, n (%) | ||||
| восходящая | 4 (10) | 14 (24,1) | 0,03 | |
| поперечно-ободочная | 1 (2,5) | 3 (5,2) | 0,62 | |
| нисходящая | 1 (2,5) | 6 (10,3) | 0,2 | |
| сигмовидная | 5 (12,5) | 13 (22,4) | 0,98 | |
| ректосигмоидная | 2 (5) | 1 (1,8) | 1,0 | |
| прямая | 27 (67,5) | 21 (36,2) | 0,47 | |
| Прогрессирование на фоне ПХТ за 1-й год лечения, n (%) | 12 (30) | 30 (57,1) | 0,008 | |
| Послеоперационные осложнения, n (%) | (n=40) | I этап* (n=58) | II этап** (n=30) | |
| несостоятельность анастомоза | 2 (5) | – | – | |
| истечение желчи | 1 (2,5) | – | 1 (3,6) | |
| инфекция раны | 3 (7,5) | 1 (1,7) | 4 (17,8) | |
| внутрибрюшной абсцесс | 2 (5) | – | 2 (7,2) | |
| печеночная недостаточность | 2 (5) | – | 2 (7,2) | |
| толстокишечный свищ | 1 (2,5) | – | – | |
| пневмония | – | 1 (1,7) | 1 (3,6) | |
| другие | 1 (2,5) | 1 (1,7) | – | *0,61 |
| Всего | 12 (30) | 3 (5,2) | 10 (35,7) | *0,66/**0,83 |
| Без осложнений | 28 (70) | 55 (94,8) | 18 (64,3) | |
| Послеоперационная летальность, n (%) | 2 (5) | – | 0,47 | |
*,** группа А против группы Б на І и ІІ этапе хирургического лечения соответственно.
Степень метастатического поражения определяли в соответствии с классификацией L. Gennari и соавторов (1982).
Объем предоперационной диагностики:
- ультразвуковое исследование;
- фиброгастроскопия;
- фиброколоноскопия;
- ирригоскопия;
- трансанальное ультразвуковое исследование;
- спиральная компьютерная томография (СКТ) с внутривенным усилением;
- электрокардиография;
- эхокардиография;
- вирусологическое исследование маркеров вирусных гепатитов;
- комплекс онкомаркеров;
- ультразвуковая допплер-флуориметрия;
- пункционная биопсия с целью цитологической верификации диагноза.
Сосудистую анатомию печени во всех случаях изучали по данным ангиореконструкции СКТ. Функциональные резервы печени оценивали в соответствии со шкалой Чайлд-Пью (Child-Pugh).
При планировании объема оперативного вмешательства на печени использовали международную классификацию резекций печени (Brisbane, 2000). Ответ очагов опухоли на ПХТ оценивали по критериям RECIST 1.1. (Response Evaluation Criteria In Solid Tumors). Статистический анализ полученных данных проводили с помощью программного обеспечения STATISTICA 6.0.
Непараметрические величины представлены медианой и межквартильным диапазоном, для сравнения использовали тест Манна — Уитни (Mann — Whitney).
Категориальные величины сравнивали, используя χ2-тест. Величины, представленные как Мean±SЕМ (р<0,05), считали статистически достоверными.
Хирургические аспекты
Принципиальным моментом в работе было соблюдение основных онкологических принципов: радикальность (обязательное выполнение операции в объеме R0-резекции) наряду с использованием органосохраняющих методик.
Планирование и подготовка к таким операциям были возможны благодаря точным данным СКТ по определению количества, размеров метастазов, а также расположения и взаимоотношения опухоли с основными сосудистыми структурами. Изучение сосудистой анатомии, а собственно полноценная визуализация правой печеночной вены, определение наличия или отсутствия дополнительных печеночных вен (задненижняя печеночная вена Makuuchi) позволили нам выполнить органосохраняющие операции в объеме мезогепатэктомии (Sg 4, 5, 8); резекции правой передней секции печени (Sg 5, 8). При таких операциях сохраняется правая задняя секция печени (Sg 6, 7) с единственным, как правило, венозным дренажом (правой печеночной веной).
Данные интраоперационного ультразвукового исследования позволили у пациента с 3 метастазами в Sg 4, 5, 8 выявить инвазию одного из метастазов в правую печеночную вену. Выполнена мезогепатэктомия (Sg 4, 5, 8) с сегментэктомией Sg 1, с пересечением правой печеночной вены и сохранением венозного оттока от правой задней секции (Sg 6, 7) по задненижней печеночной вене диаметром 1,2–1,3 см.
Транссекцию паренхимы во всех случаях производили через здоровые ткани (не менее 1,5–2 см от края опухоли). При гистологическом исследовании операционного материала микроскопических признаков злокачественного роста по краю резекции не выявлено.
Сегментэктомии, гемигепатэктомии и расширенные гемигепатэктомии (право- и левосторонние) выполняли по общепринятым методикам и с соблюдением следующего алгоритма действий (рис. 1):
- выполнение субкостального билатерального доступа, дополненного верхнесрединной лапаротомией (Calne);
- мобилизация печени;
- интраоперационное ультразвуковое исследование печени — уточнение количественных и качественных характеристик опухоли печени, ее интраорганная топография;
- выделение элементов печеночно-двенадцатиперстной связки — холецистэктомия, идентификация сосудов, ответственных за афферентное кровоснабжение остающейся и удаляемой части паренхимы печени;
- выделение печеночных вен в кавальных воротах;
- выбор плоскости и траектории резекции печени — прерывистое кратковременное пережатие афферентных сосудов артериальной и портальной системы. Определение границ резекции по линиям ишемии;
- перевязка артерии, портальной вены и печеночной вены удаляемой части печени;
- разделение паренхимы печени — метод монополярной или биполярной коагуляции, использование ультразвукового кавитатора-аспиратора, водоструйного диссектора, инструментальное «раздавливание» паренхимы.
- гемостаз раны печени (аргоновая коагуляция, гемостатические препараты);
- пневмогидропроба герметичности желчных протоков.
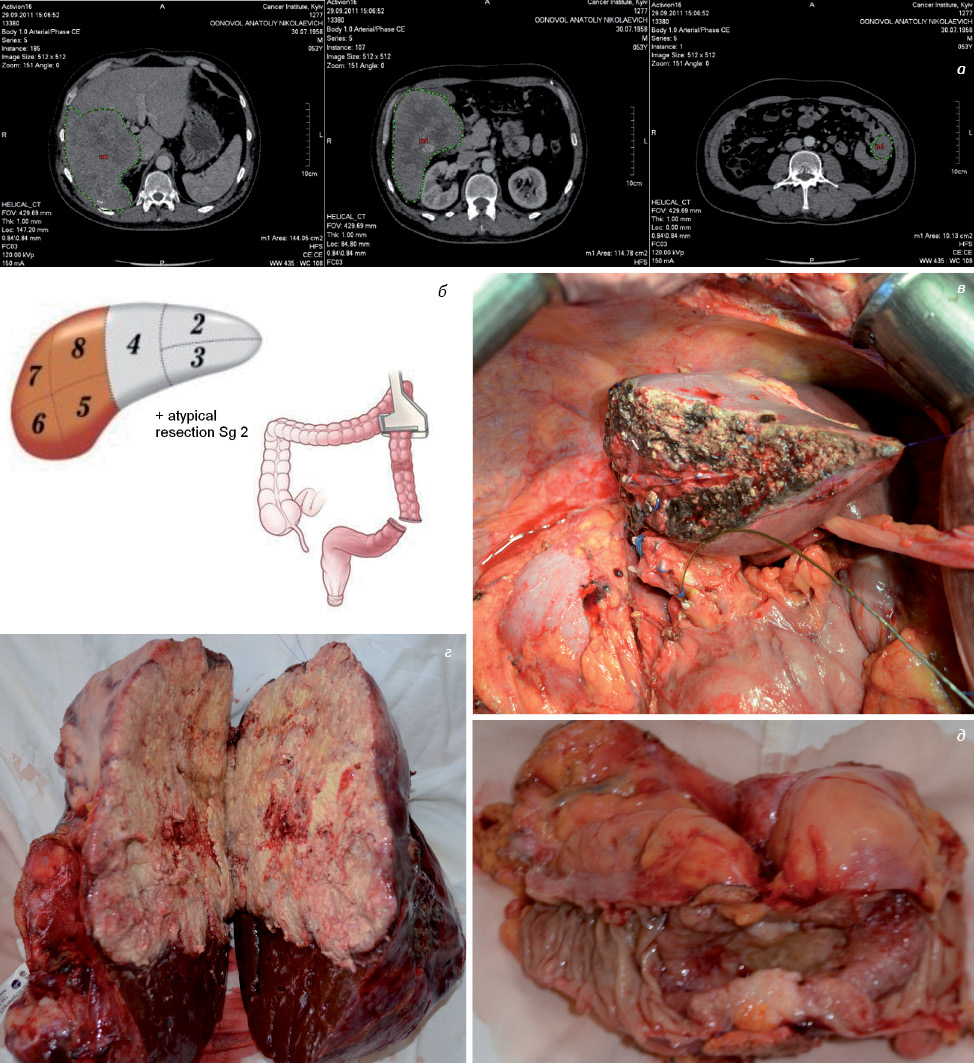
Лимфодиссекция во всех случаях предусматривает выделение элементов гепатодуоденальной связки с удалением клетчатки и лимфатических узлов группы № 12, а также при подозрении на их метастатическое поражение — лимфатических узлов № 8a, 8p и 13 (согласно Японской классификации карциномы желудка, 3-е издание).
По данным литературы, в настоящее время ведутся исследования по изучению эффективности выполнения парааортальной лимфодиссекции, а также зоны чревного ствола. В этой связи при явных признаках опухолевого поражения лимфатических узлов этой зоны мы выполняем лимфодиссекцию групп № 9 и 16. Комбинированные операции проводили стандартно — после определения резектабельности в первую очередь выполняли резекцию печени («чистый» этап), а затем резекцию толстой кишки. Атипичные резекции печени проводили при выявлении метастазов размерами до 3–3,5 см в диаметре, расположенных субкапсульно, или при «краевой» локализации — при отсутствии инвазии в крупные внутрипеченочные сосудистые структуры по данным интраоперационного ультразвукового исследования.
Результаты
За указанный период времени у всех пациентов группы А (n=40) провели радикальные синхронные резекции толстой кишки и резекции печени по поводу СМКРР. В группе Б (n=58) у всех больных на первом этапе выполнены паллиативные хирургические вмешательства по поводу первичной опухоли. Прогрессирование заболевания в течение первого года в группе А и Б зарегистрировано у 12 (30%) и 30 (57,1%) пациентов соответственно (р=0,008). Таким образом, только у 28 пациентов группы Б удалось выполнить изолированные резекции печени (таблица). По данным заключительного патогистологического исследования у всех больных подтверждена R0-резекция.
По результатам однофакторного анализа не выявлено достоверного различия в исследуемых группах, медиана общей выживаемости составила 30 мес в группе А и 36 мес — в группе Б, (р=0,22). Общая 3-летняя выживаемость (рис. 2) в группе больных с синхронными резекциями (группа А) составила 42% и в группе Б — 55% (р=0,22). При сравнении типа резекции первичной опухоли необходимо отметить, что в группе А большая часть (72,5%) пациентов оперированы по поводу рака прямой кишки, тогда как в группе Б этот показатель составил 27,5% (р<0,001). Статистически достоверного различия в объеме резекции печени не отмечали: ≤3 сегментов удалили в 77,5 и 39,6% (р=0,43) в группах А и Б соответственно.
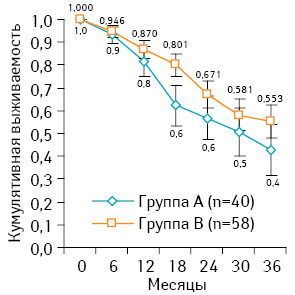
Больные после этапных резекций дольше пребывали в стационаре — 23,3±0,8 койко-дня, тогда как синхронные резекции обеспечили более короткие сроки восстановления в послеоперационный период — 10,2±0,4 койко-дня (р<0,001). Меньшая длительность оперативного вмешательства зарегистрирована в группе А — 316,3±10,3 мин, тогда как в группе Б — 484,1±18,3 мин (р<0,001).
Послеоперационная летальность (5%) выше в группе А. Причиной смерти стала прогрессирующая печеночная недостаточность. Послеоперационной летальности в группе Б не зарегистрировано. Суммарный уровень послеоперационных осложнений в группах А и Б после завершения хирургических этапов статистически не отличался, составив 30 и 35,7% в группах А (n=40) и Б (n=28) соответственно (р=0,83).
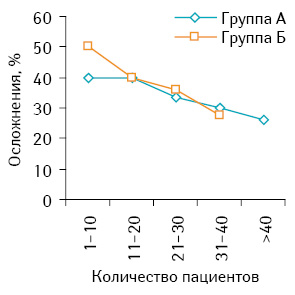
Следует отметить, что уровень послеоперационных осложнений за период исследования существенно снизился в обеих группах. Так, начиная с 2008 г. уровень послеоперационных осложнений составлял 50 и 40% для групп А и Б соответственно (по 10 пациентов в каждой группе). На момент проведения анализа в 2012 г. показатель составил 26 и 27,5%, что продемонстрировано графически на кривой обучения (рис. 3).
Обсуждение результатов лечения
На сегодня доказано, что радикальное хирургическое удаление всех опухолевых очагов достоверно улучшает продолжительность жизни больных с МКРР [6]. Стратегия лечения данной категории больных предполагает комплексный подход с учетом множества прогностических факторов, среди которых: клиническое проявление болезни, локализация первичной опухоли и метастазов в печени, наличие синхронных или метахронных метастазов; соматический статус пациента и наличие сопутствующих заболеваний; возможность проведения комбинированного лечения. Одной из основных задач, поставленных перед хирургом и анестезиологом, является обеспечение безопасности комбинированного оперативного вмешательства.
Уровень послеоперационных осложнений при синхронном подходе зависит от объема резекции толстой кишки и печени. Возможен рост этого показателя при выполнении синхронных резекций первичной опухоли толстой кишки и более 3 сегментов печени, на что указывают результаты метаанализа [19] и проведенные нами исследования.
В нескольких исследованиях показана возможность выполнения одномоментной гемигепатэктомии с резекцией толстой кишки по поводу СМКРР [4, 8, 13, 15, 21, 22]. Авторы также выявили корреляцию между повышением уровня послеоперационных осложнений и смертности. Частота возникновения осложнений при синхронных резекциях с право- или левосторонней гемигепатэктомией, по данным разных авторов, составляет 5–48%, тогда как после выполнения расширенных гемигепатэктомий — 33–55%. По этой причине большинство расширенных гемигепатэктомий по поводу СМКРР рекомендуют проводить отсрочено, что снижает риск развития осложнений до 16–47% [7, 10, 27].
В нашем исследовании в группе А выполнены одномоментные резекции кишки с гемигепатэктомией (n=6), и следует отметить, что основная масса послеоперационных осложнений была именно у этих пациентов.
Основной задачей этого исследования было изучение и анализ первичных клинических данных у больных МКРР с синхронными метастазами в печень с целью оптимизации хирургической стратегии их лечения. На данном этапе исследования анализ не показал статистически достоверного различия в уровнях поcлеоперационных осложнений в группах синхронного и этапного лечения.
Однако синхронные резекции обеспечили меньшую продолжительность пребывания пациентов в стационаре, а соответственно, и более низкие затраты на терапию таких больных. Все же полученные данные не продемонстрировали улучшения отдаленных результатов в группе больных с синхронными резекциями. Объяснением может быть вынужденная «селекция больных» в группе с этапным подходом (группа Б). Пациенты получали ПХТ после первого хирургического этапа, а в случае прогрессирования отсроченный этап резекции печени не проводили. При этом в группе А все больные подлежали синхронному хирургическому вмешательству без возможности оценки чувствительности к системной терапии и, соответственно, без возможности проведения отбора пациентов.
Так, R. Adam и соавторы в своем исследовании приходят к выводу, что различие в сроках назначения ПХТ до этапа резекции печени у больных с СМКРР может быть причиной более высокого показателя рецидивов заболевания в группе одномоментных резекций. За 3 года наблюдения пациентов с СМКРР после комбинированного лечения рецидивы заболевания развивались чаще в группе с синхронными резекциями, составив 85% от всех больных этой группы, в сравнении с 63,6% при этапных резекциях (р=0,002) [5, 8, 17].
C.Y. Hao и соавторы показали, что медиана выживаемости больных с СМКРР без хирургического лечения составляет от 6 до 12 мес, а при применении химиотерапии (фторпиримидины, оксалиплатин или иринотекан) этот показатель повышается до 19 мес [16].
За последние годы разработаны новые химиотерапевтические и биологические агенты, а также подходы к системной противоопухолевой терапии, однако анализ, проведенный J. Shindoh и соавторами, показал, что уровень объективного терапевтического эффекта не превышает 47% [18]. Последнее может служить объяснением разницы сроков прогрессирования в группах больных.
Основным преимуществом одномоментных хирургических вмешательств у больных с СМКРР является возможность удаления всех опухолевых очагов в один этап, что снижает риск развития диссеминации заболевания, дает возможность избежать повторной послеоперационной иммуносупрессии [3]. Кроме того, одна операция улучшает качество жизни больного и снижает стоимость лечения, что подтверждается и нашими данными.
Следует отметить, что радикальное удаление первичной опухоли и отдаленных метастазов обеспечивает лучшие условия для системной ПХТ у пациентов с КРР IV стадии. С другой стороны, на результаты лечения могут оказывать влияние микрометастазы опухоли, не выявленные доступными на сегодня методами исследования на этапе первичного хирургического вмешательства.
В настоящее время большинство исследовательских работ направлено на изучение возможности контроля прогрессирования заболевания, режимов и способов лекарственной терапии, контроля токсичности системной терапии с целью обеспечения безопасной резекции печени.
Выводы
Анализ проведенных нами исследований указывает на необходимость разработки дифференцированного подхода к хирургическому лечению СМКРР.
Синхронные резекции, выполненные опытными специалистами у больных с СМКРР, безопасны при резекции ≤3 сегментов печени, обеспечивают лучший экономический результат.
Анализ отдаленных результатов не показал преимущества в общей 3-летней выживаемости исследуемых групп больных. Последующие исследования должны быть направлены на изучение факторов прогноза и критериев для отбора больных в группы хирургического лечения, оценки экономического эффекта, качества жизни пациентов.
Список использованной литературы
1. Патютко Ю.И., Сагайдак И.В., Котельников А.Г. и др. (2007) Хирургическое и комбинированное лечение метастазов колоректального рака в печень. Практ. онкология, 8: 29−33.
2. Рак в Україні, 2010–2011. Захворюваність, смертність, показники діяльності онкологічної служби (2012) Бюл. Нац. канцер-реєстру України. Київ. 13: 124 с.
3. Bolton J.S., Fuhrman G.M. (2000) Survival after resection of multiplebilobar hepatic metastases from colorectal carcinoma. Ann. Surg., 231: 743–51.
4. Capussotti L., Ferrero A., Vigano L. et al. (2007) Major liver resections synchronous with colorectal surgery. Ann. Surg. Oncol., (14): 195–201.
5. Courtney L., Steven A., Francesco I. et al. (2003) Feasibility of adjuvan thepatic arterial infusion of chemotherapy after radiofrequency ablation with or without resection in patients with hepatic metastases from colorectal cancer. Ann. Surg. Oncol., 10(4): 348–354.
6. Fahy B.N., D’Angelica M., DeMatteo R.P. et al. (2009) Synchronous hepatic metastases from colon cancer: changing treatment strategies and results of surgical intervention. Ann. Surg. Oncol., 16: 361–370.
7. Fahy B.N., Fischer C.P. (2012) Synchronous resection of colorectal primary and hepatic metastasis. J. Gastrointest. Oncol., 3: 48–58.
8. de Haas R.J., Adam R. (2010) Comparison of simultaneous or delayed liver surgery for limited synchronous colorectal metastases. British J. Surgery, 97: 1279–89.
9. Haddad A.J., Hani M.B., Pawlik T.M., Cunningham S.C. (2011) Colorectal liver metastases. Int. J. Surg. Oncol. (http://dx.doi.org/10.1155/2011/285840).
10. Martin 2nd R.C., Augenstein V., Reuter N.P. et al. (2009) Simultaneous versus staged resection for synchronous colorectal cancer liver metastases. J. Am. Coll. Surg., 208: 842–850.
11. Minagawa M., Yamamoto J., Miwa S. et al. (2006) Selection criteria for simultaneous resection in patients with synchronous liver metastasis. Arch. Surg., 141(10): 1006–12.
12. National Comprehensive Cancer Network, 2013.
13. Nordlinger B., Benoist S. (2003) Surgical resection including peri-operative chemotherapy (adjuvant and neoadjuvant). EJC, 1 (suppl. 6): 181–87.
14. Nordlinger B., Benoist S. (2008) Liver metastases from colorectal cancer: a multidisciplinary approach is necessary. Bull. Acad. Natl. Med., 192(1): 33−43.
15. Nordlinger B., Jaeck D., Guiguet M. et al. (1992) Résection chirurgicale des métastases hépatiques. Enquète de l’Association Française de Chirurgie. Métastases Hépatiques des Cancers Colorectaux. B. Nordlinger, D. Jaeck (eds). Springer, Paris: 141–159.
16. Reinacher-Schick A.C., Bechstein W.O. (2007) Colorectal liver metastases. Neoadjuvant chemotherapy: aspects of medical and surgical oncology. Internist (Berl.), 48(1): 51–58.
17. Rene A. (2003) Surgery in liver metastases: new perspectives. Ann. Oncol., 14 (suppl. 3): iii4.
18. Shindoh J., Loyer E.M., Kopetz S. et al. (2012) Optimal Morphologic Response to Preoperative Chemotherapy: An Alternate Outcome End Point Before Resection of Hepatic Colorectal Metastases. J.Clin. Oncol., 30: 4566–72.
19. Slesser A.A.P., Simillis C., Goldin R. et al. (2012)A meta-analysis comparing simultaneous versus delayed resections in patients with synchronous colorectal liver metastases. Surg. Oncol., 14: S0960–7404.
20. Tan E.K., Ooi L.L. (2010) Colorectal cancer liver metastases — understanding the differences in the management of synchronous and metachronous disease. Ann. Acad. Med. Singap., 39(9): 719–815.
21. Tanaka K., Shimada H., Matsuo K. et al. (2004) Outcome after simultaneous colorectal and hepatic resection for colorectal cancer with synchronous metastases. Surgery, 136: 650–59.
22. Thelen A., Jonas S., Benckert C. et al. (2007) Simultaneous versus staged liver resection of synchronous liver metastases from colorectal cancer. Int. J. Colorectal. Dis., 22: 1269–76.
23. Thomas P., Forse R.A., Bajenova O. (2011) Carcinoembryonic antigen (CEA) and its receptor RNPM are mediators of metastasis and the inflammatory response in the liver. Clin. Exp. Metastasis, 28(8): 923–932.
24. Vassiliou I., Arkadopoulos N., Theodosopoulos T. et al. (2007) Surgical approaches of resectable synchronous colorectal liver metastases: timing considerations. World J. Gastroenterol., 13(9): 1431–34.
25. Viganò L. (2012) Treatment strategy for colorectal cancer with resectable synchronous liver metastases: Is any evidence–based strategy possible? World J. Hepatol., 4 (8): 237–241.
26. Wagman L.D. (2008) Expanded criteria for surgery for liver metastases: thoughtful science or diamond mining? J. Clin. Oncol., 26(22): 3672−80.
27. Welsh F.K., Tekkis P.P., John T.G., Rees M. (2008) Predictive models in colorectal liver metastases — can we personalize treatment and outcome? Dig. Surg., 25(6): 406–412.
Порівняльний аналіз синхронних та етапних резекцій печінки у хворих на метастатичний колоректальний рак
Резюме. Хірургічне лікування пацієнтів з синхронним метастатичним колоректальним раком (СМКРР) залишається єдиним методом, який поліпшує загальну 5-річну виживаність. На сьогодні залишається актуальним питанням доцільності та ефективності застосування синхронних оперативних втручань при метастатичному ураженні печінки у хворих на СМКРР. Проаналізовано результати лікування 98 хворих на МКРР із синхронним ураженням печінки, які одержували синхронні (група А, n=40) та етапні (група Б, n=58) резекції печінки у науково-дослідному відділенні пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку Міністерства охорони здоров’я України в період з 2008 по 2012 р. Загальна 3-річна виживаність у групі хворих із синхронними резекціями (група А) становила 42% та в групі Б — 55% (р=0,22). Сумарний рівень післяопераційних ускладнень в групах А та Б після завершення хірургічних етапів статистично не відрізнявся, становивши 30 та 35,7% в групах А (n=40) та Б (n=28) відповідно (р=0,83). Менша тривалість оперативного втручання зареєстрована в групі А — 316,3±10,3 хв, тоді як в групі Б — 484,1±18,3 хв (р довше перебували в стаціонарі — 23,3±0,8 ліжко-дня, тоді як після синхронних резекцій — 10,2±0,4 ліжко-дня (р ведених нами досліджень вказує на необхідність розробки диференційного підходу в хірургічному лікуванні СМКРР. Подальші роботи мають бути спрямовані на вивчення факторів прогнозу та критеріїв для відбору хворих у групи хірургічного лікування, оцінки економічного ефекту, якості життя хворих.
Ключевые слова: синхронний метастатичний колоректальний рак, синхронні та етапні резекції печінки.
Comparative analysis of synchronous and staged resections in patients with metastatic colorectal cancer
Summary. Surgical treatment of synchronous metastatic colorectal cancer (SMCLC) remains the only method that improves overall 5-year survival. For the moment the issue of feasibility and effectiveness of synchronous operative interventions application in metastatic liver lesion in patients with SMCLC remains challenging. Results of 98 MCLC patients treatment with synchronous liver lesion that received synchronous (group A, n=40) and staged (group B, n=58) liver resections in the Department of Abdominal and Retroperitoneum Tumorsofthe National Cancer Institute of the Ministry of Health Care of Ukraine in the period from 2008 till 2012. Overall 3-year survival in the group of patients with synchronous resections (group А) was 42% and in the group B was 55% (р=0,22). Overall level of post-operative complications in the groups A and B after surgical stages finishing did not differstatistically, being 30 and 35,7% in the groups А (n=40) and B (n=28), respectively (p=0,83).
Shorter operative intervention duration was registered in the group A – 316,3±10,3 min, whereas in the group B it was 484,1±18,3 min (р for alon gertime– 23,3±0,8 bed-days, when synchronous resections provided with shorter recovery terms in post-operative period — 10,2±0,4 bed-days (p necessity of the development of differentiated approachin SMCLC surgical treatment. Subsequent research should be directed towards study of prognosis factors and criteria for patients’ selection for surgical treatment groups, assessment of economic effect, and patients’ life quality.
Key words: synchronous metastatic colorectal cancer, synchronous and staged resections.














Leave a comment